Цитоплазматические антитела против нейтрофилов - Anti-neutrophil cytoplasmic antibody


Антинейтрофильные цитоплазматические антитела (АНКА) являются группой аутоантитела, в основном из IgG типа, против антигены в цитоплазма из нейтрофильные гранулоциты (самый распространенный вид лейкоцит ) и моноциты. Они обнаруживаются как анализ крови в ряде аутоиммунные расстройства, но особенно связаны с системными васкулит, так называемые ANCA-ассоциированные васкулиты (AAV).
Шаблоны ANCA IF
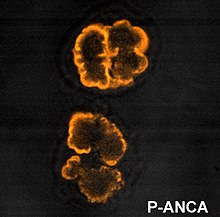
Иммунофлуоресценция (IF) на нейтрофилах, фиксированных этанолом, используется для обнаружения ANCA, хотя нейтрофилы, фиксированные формалином, могут использоваться, чтобы помочь дифференцировать паттерны ANCA. ANCA можно разделить на четыре модели при визуализации с помощью IF; цитоплазматический ANCA (c-ANCA), C-ANCA (атипичный), перинуклеарный ANCA (p-ANCA) и атипичный ANCA (a-ANCA), также известный как x-ANCA. c-ANCA демонстрирует цитоплазматическую гранулярную флуоресценцию с центральным межлобулярным усилением. C-ANCA (атипичный) показывает окрашивание цитоплазмы, которое обычно однородно и не имеет межлобулярного акцентирования. p-ANCA имеет три подтипа: классический p-ANCA, p-ANCA без ядерного удлинения и антинуклеарное антитело, специфичное для гранулоцитов (GS-ANA). Классический p-ANCA показывает перинуклеарное окрашивание с расширением ядра, p-ANCA без расширения ядра имеет перинуклеарное окрашивание без расширения ядра, а GS-ANA показывает окрашивание ядра только на гранулоцитах. a-ANCA часто показывает комбинации как цитоплазматического, так и околоядерного окрашивания.[1]
Антигены ANCA
Антиген c-ANCA специфически протеиназа 3 (PR3). p-ANCA антигены включают миелопероксидаза (МПО) и фактор увеличения бактериальной проницаемости Бактерицидный протеин, повышающий проницаемость (БПИ). Существуют и другие антигены c-ANCA (атипичные), но многие из них пока неизвестны. Классический p-ANCA встречается с антителами, направленными на MPO. p-ANCA без удлинения ядра встречается с антителами к BPI, катепсин G, эластаза, лактоферрин и лизоцим. GS-ANA - это антитела, направленные против ядерных антигенов, специфичных для гранулоцитов. Считается, что атипичные ANCA являются антигенами, аналогичными антигенам p-ANCA, однако могут возникать из-за различий в процессинге нейтрофилов.[1]
Другие менее распространенные антигены включают: HMG1 (паттерн p-ANCA), HMG2 (паттерн p-ANCA), альфа-энолаза (паттерн p и c-ANCA), каталаза (паттерн p и c-ANCA), бета-глюкуронидаза (паттерн p-ANCA), азуроцидин (паттерн p и c-ANCA), актин (p и a-ANCA) и h-лампа-2 (c-ANCA).[1]
ELISA
Иммуноферментный анализ (ELISA) используется в диагностических лабораториях для обнаружения ANCA. Хотя IF может использоваться для скрининга многих ANCA, ELISA используется для обнаружения антител к отдельным антигенам. Наиболее распространенные антигены, используемые в ELISA микротитровальный планшет являются MPO и PR3, которые обычно проверяются после положительного теста IF.[2]
Разработка
Непонятно, как развиваются ANCA, хотя было высказано несколько гипотез. Вероятно, существует генетический вклад, особенно в генах, контролирующих уровень иммунного ответа - хотя генетическая восприимчивость, вероятно, связана с фактором окружающей среды, некоторыми возможными факторами, включая вакцинацию или воздействие силикатов. Постулируются два возможных механизма развития ANCA, хотя ни одна из этих теорий не отвечает на вопрос о том, как развиваются различные особенности ANCA, и по разработке ANCA все еще проводится много исследований.[3]
Теория молекулярной мимикрии
Микробный суперантигены представляют собой молекулы, экспрессируемые бактериями и другими микроорганизмами, которые способны стимулировать сильный иммунный ответ путем активации Т-клетки. Эти молекулы обычно имеют области, похожие на аутоантигены, которые способствуют остаточному аутоиммунному ответу - это теория молекулярной мимикрии. Стафилококковый и стрептококковый суперантигены были охарактеризованы при аутоиммунных заболеваниях - классический пример для стрептококков пост-группы А. ревмокардит, где есть сходство между М белки из Streptococcus pyogenes сердечный миозин и ламинин. Также было показано, что до 70% пациентов с гранулематоз Вегенера хронические носовые носители Золотистый стафилококк, у носителей в восемь раз повышенный риск рецидив.[3] Поэтому это будет считаться гиперчувствительность II типа реакция.
Теория дефектного апоптоза
Нейтрофил апоптоз или запрограммированная гибель клеток, жизненно важны для контроля продолжительности ранней воспалительной реакции, тем самым ограничивая повреждение тканей нейтрофилами. ANCA может развиваться либо в результате неэффективного апоптоза, либо в результате неэффективного удаления фрагментов апоптозных клеток, что приводит к воздействию на иммунную систему молекул, обычно секвестрируемых внутри клеток. Эта теория разрешает парадокс того, как могут возникать антитела против внутриклеточных антигенных мишеней ANCA.[3]
Роль в болезни
Ассоциации болезней
ANCA связаны с малым судном васкулиты включая гранулематоз Вегенера, микроскопический полиангиит, первичный паучиммунный некротический серповидный гломерулонефрит (тип почечно-ограниченного микроскопического полиангиита), эозинофильный гранулематоз с полиангиитом и лекарственные васкулиты. PR3-направленный c-ANCA присутствует в 80–90% случаев гранулематоза с полиангиитом, в 20–40% случаев микроскопического полиангиита, в 20–40% случаев слабоиммунного серповидного гломерулонефрита и в 35% случаев эозинофильного гранулематоза с полиангиитом. c-ANCA (атипичный) присутствует в 80% случаев муковисцидоза (с BPI в качестве антигена-мишени), а также в воспалительное заболевание кишечника, первичный склерозирующий холангит и ревматоидный артрит (с антителами к нескольким антигенным мишеням). p-ANCA со специфичностью к МПО обнаруживается в 50% случаев микроскопического полиангиита, в 50% случаев первичного паучиммунно-некротического серповидного гломерулонефрита и в 35% случаев эозинофильного гранулематоза с полиангиитом. p-ANCA со специфичностью к другим антигенам связаны с воспалительными заболеваниями кишечника, ревматоидным артритом, лекарственным васкулитом, аутоиммунное заболевание печени, лекарственные синдромы и паразитарные инфекции. Атипичный ANCA связан с лекарственным системным васкулитом, воспалительным заболеванием кишечника и ревматоидным артритом.[2][4] Показатель ANCA-положительных результатов намного выше у пациентов с сахарным диабетом 1 типа, чем у здоровых людей.[5]
Левамизол, который часто является примесью кокаин, может вызвать ANCA-положительный васкулит.[6]
Наличие или отсутствие ANCA не может указывать на наличие или отсутствие заболевания, и результаты коррелируют с клиническими особенностями. Ассоциация ANCA и активности заболевания остается спорным; однако повторное появление ANCA после лечения может указывать на рецидив.[7][8]
Патогенез
Хотя патогенная роль ANCA остается спорная, in vitro а модели на животных подтверждают идею о том, что антитела играют непосредственную патологическую роль в образовании васкулитов мелких сосудов. ANCA, специфичный для MPO и PR3, может активировать нейтрофилы и моноциты через их Fc и рецепторы Fab'2, которые могут быть усилены цитокины которые заставляют нейтрофилы отображать МПО и PR3 на своей поверхности. Аберрантное гликозилирование ANCA, специфичного для MPO и PR3, усиливает их способность взаимодействовать с активирующими рецепторами Fc на нейтрофилах.[9] Активированные нейтрофилы могут прилипнуть к эндотелиальные клетки где происходит дегрануляция. Это высвобождает свободные радикалы кислорода и литические ферменты, что приводит к повреждению эндотелия за счет индукции некроз и апоптоз. Кроме того, нейтрофилы выделяют хемоаттрактивные сигнальные молекулы, которые привлекают больше нейтрофилов к эндотелию, действуя как петля положительной обратной связи. Модели на животных показали, что антитела к МПО могут вызывать некротический серповидный гломерулонефрит и системный васкулит мелких сосудов. В этих моделях на животных образование гломерулонефрита и васкулита может происходить в отсутствие Т-клеток, однако нейтрофилы должны присутствовать.[10][11][12][13] Хотя было отмечено, что титры ANCA имеют ограниченную корреляцию с активностью заболевания, за исключением заболевания почек, и с риском рецидива, это объясняется различиями в эпитопы и сродство ANCA.[14] ANCA вызывают избыточную активацию нейтрофилы, что приводит к образованию внеклеточных ловушек нейтрофилов (NET), которые вызывают повреждение мелких кровеносных сосудов.[14] Кроме того, у пациентов с активным заболеванием, получавших Ритуксимаб, анти-CD20 антитела, которые удаляют циркулирующие B-клетки, клиническая ремиссия больше коррелирует с уменьшением количества циркулирующих B-клеток, чем со снижением титра ANCA, который у некоторых пациентов не изменяется во время лечения. То же исследование показало, что клинический рецидив у некоторых пациентов был связан с возвращением циркулирующих В-клеток.[15] На основании вышеприведенных наблюдений и того, что реактивная В-клетки могут быть обнаружены в обращении у пациентов с AAV, была предложена альтернативная гипотеза, приписывающая прямую патогенную роль этих клеток, при которой активированные нейтрофилы и ANCA-реактивные B-клетки участвуют в межклеточном перекрестном взаимодействии, что приводит не только к дегрануляции нейтрофилов и воспаление, но также к пролиферации и дифференцировке ANCA-реактивных B-клеток.[16] Однако эту гипотезу еще предстоит проверить.
История
ANCA были первоначально описаны в Дэвисе. и другие. в 1982 г. в сегментарный некротизирующий гломерулонефрит.[14][17] Второй международный семинар ANCA, состоявшийся в Нидерландах в мае 1989 г., определил номенклатуру перинуклеарных и цитоплазматических паттернов, а антигены MPO и PR3 были обнаружены в 1988 и 1989 годах соответственно.[18] Международные семинары ANCA проводятся каждые два года.
Рекомендации
- ^ а б c Мид, А. Брэдуэлл, Р.П. Стокс, Г.П. (1999). Расширенный атлас паттернов аутоантител. Бирмингем: обязательный сайт. ISBN 978-0704485105.
- ^ а б Савиг, Дж; Дэвис, Д.; Фальк, Р.Дж.; Jennette, JC; Wiik, A (март 2000 г.). «Антинейтрофильные цитоплазматические антитела и ассоциированные заболевания: обзор клинических и лабораторных особенностей». Kidney International. 57 (3): 846–62. Дои:10.1046 / j.1523-1755.2000.057003846.x. PMID 10720938.
- ^ а б c Reumaux D, Duthilleul P, Roos D (2004). «Патогенез заболеваний, связанных с аутоантителами цитоплазмы антинейтрофилов». Hum Immunol. 65 (1): 1–12. Дои:10.1016 / j.humimm.2003.09.013. PMID 14700590.
- ^ Боссайт, X (февраль 2006 г.). «Серологические маркеры воспалительного заболевания кишечника». Клиническая химия. 52 (2): 171–81. Дои:10.1373 / Clinchem.2005.058560. PMID 16339302.
- ^ Омура, Т. (сентябрь 2019 г.). «Самый старый пациент с сахарным диабетом 1 типа, получающий лечение с помощью инсулиновой помпы с положительным осложнением цитоплазматических антител миелопероксидазы и антинейтрофилов: отчет о болезни». Гериатр Геронтол Инт. 19 (9): 957–58. Дои:10.1111 / ggi.13683. PMID 31490005.
- ^ Тран, Н; Тан, Д; Марнейон, Т.П. (февраль 2013 г.). «Кожная васкулопатия, связанная с кокаином, фальсифицированным левамизолом». Клиническая медицина и исследования. 11 (1): 26–30. Дои:10,3121 / см. 2012,1085. ЧВК 3573092. PMID 22723468.
- ^ Sinclair, D; Стивенс, Дж. М. (сентябрь 2007 г.). «Роль антинейтрофильных цитоплазматических антител и антител к базальной мембране клубочков в диагностике и мониторинге системных васкулитов». Анналы клинической биохимии. 44 (Pt 5): 432–42. Дои:10.1258/000456307781646049. PMID 17761028.
- ^ Стегеман, Калифорния (ноябрь 2005 г.). «Прогностическое значение антинейтрофильных цитоплазматических антител при васкулите мелких сосудов: стакан наполовину полон или наполовину пуст?». Журнал ревматологии. 32 (11): 2075–7. PMID 16265681.
- ^ Маверакис Э., Ким К., Шимода М., Гершвин М., Патель Ф., Уилкен Р., Райчаудхури С., Рухак Л. Р., Лебрилла CB (2015). "Гликаны в иммунной системе и измененная теория аутоиммунитета гликанов". J Аутоиммунный. 57 (6): 1–13. Дои:10.1016 / j.jaut.2014.12.002. ЧВК 4340844. PMID 25578468.
- ^ Фальк, Р.Дж.; Дженнетт, JC (май 2010 г.). «Заболевание ANCA: куда идет эта область?». Журнал Американского общества нефрологов. 21 (5): 745–52. Дои:10.1681 / ASN.2009121238. PMID 20395376.
- ^ Seo, P; Stone, JH (1 июля 2004 г.). «Васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами». Американский журнал медицины. 117 (1): 39–50. Дои:10.1016 / j.amjmed.2004.02.030. PMID 15210387.
- ^ Jennette, JC; Сяо, H; Фальк, Р.Дж. (май 2006 г.). «Патогенез воспаления сосудов антинейтрофильными цитоплазматическими антителами». Журнал Американского общества нефрологов. 17 (5): 1235–42. Дои:10.1681 / ASN.2005101048. PMID 16624929.
- ^ Falk RJ, Террелл Р.С., Чарльз Л.А., Дженнетт Дж. (1990). «Антинейтрофильные цитоплазматические аутоантитела индуцируют дегрануляцию нейтрофилов и выработку кислородных радикалов in vitro». Proc Natl Acad Sci U S A. 87 (11): 4115–4119. Bibcode:1990PNAS ... 87.4115F. Дои:10.1073 / pnas.87.11.4115. ЧВК 54058. PMID 2161532.CS1 maint: использует параметр авторов (связь)
- ^ а б c Накадзава, Д; Масуда, S; Томару, Ю; Ишизу, А (февраль 2019 г.). «Патогенез и терапевтические вмешательства при ANCA-ассоциированном васкулите» (PDF). Nature Reviews Ревматология. 15 (2): 91–101. Дои:10.1038 / с41584-018-0145-у. HDL:2115/74654. PMID 30542206. S2CID 54474335.
- ^ Джейн Д.Р., Джонс РБ; Ферраро Эй Джей; Чаудри А.Н.; Brogan P; Салама А.Д .; Smith KG; Savage CO (01.07.2009). «Многоцентровое исследование терапии ритуксимабом при рефрактерном васкулите, ассоциированном с антинейтрофильными цитоплазматическими антителами». Ревматоидный артрит. 60 (7): 2156–68. Дои:10.1002 / арт.24637. PMID 19565480.
- ^ Уртадо, Плинио; Nitschke, J .; Hurtado-Perez, E .; Пех, К.А. (Апрель 2013). «ANCA-реактивные В-клетки и нейтрофилы перекрестно взаимодействуют в патогенезе AAV: модельное предложение». La Presse Médicale. 42 (№ 4P2): 720. Дои:10.1016 / j.lpm.2013.02.256.
- ^ Дэвис, диджей; Moran, JE; Niall, JF; Райан, Великобритания (28 августа - 4 сентября 1982 г.). «Сегментарный некротизирующий гломерулонефрит с антинейтрофильными антителами: возможная арбовирусная этиология?». Британский медицинский журнал (под ред. Клинических исследований). 285 (6342): 606. Дои:10.1136 / bmj.285.6342.606. ЧВК 1499415. PMID 6297657.
- ^ Jennette, JC; Хойдаль, младший; Фальк, RJ (1 июня 1990 г.). «Специфичность антинейтрофильных цитоплазматических аутоантител к протеиназе 3». Кровь. 75 (11): 2263–4. Дои:10.1182 / blood.V75.11.2263.2263. PMID 2189509.
1
внешняя ссылка
- изображения pANCA и CANCA
- флуоресцентные изображения ANCA
- Антинейтрофилы + цитоплазматические + антитела в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
