Чашечка Хельда - Calyx of Held

В Чашечка Хельда особенно большой синапс в млекопитающее слуховой Центральная нервная система, названный так Гансом Хельдом в своей статье 1893 г. Die centrale Gehörleitung[1] из-за его сходства с чашечка цветка.[2] Шаровидные кустистые клетки в передне-вентральное кохлеарное ядро (AVCN)[3] Отправить аксоны к контралатеральному медиальному ядру трапециевидное тело (MNTB), где они синапсируют через эти чашечки на основных клетках MNTB.[4][5][6] Эти основные клетки затем проецируются на ипсилатеральную боковая верхняя олива (LSO),[7] где они подавляют постсинаптические нейроны и обеспечивают основу для обнаружение межурального уровня (ILD), необходим для локализации высокочастотного звука.[8] Этот синапс был описан как самый большой в мозге.[9]
Связанные конец лампы Held также представляет собой большой синапс меньшего размера на конце аксона (15-30 мкм в диаметре), обнаруженный в других структурах слухового ствола мозга, а именно в ядре улитки.[10] Как и чашечки, эти синапсы способствуют быстрой и эффективной передаче информации.
Чашечка Хельда содержит пузырьки, содержащие глутамат на пресинаптическом окончании пузырьки высвобождаются при стимуляции (происходящие из слуховой системы). Затем глутамат связывается с двумя известными рецепторами глутамата, AMPA- и Рецепторы NMDA.[11]
Чашечка Хельда, обычно используемая в исследованиях из-за ее большого размера, использовалась для понимания множества механизмов, связанных с развитием и везикул освобождение синапса.
Функция
Чашечка Хельда входит в состав слуховая система, соединяющие глобулярные кустистые клетки (GBC) антеровентрального кохлеарное ядро к основным нейронам медиального ядра трапециевидного тела (MNTB). Функция чашечки Held как синапса - передавать сигнал от GBC к основным нейронам. Основные нейроны MNTB являются глицинергическими, поэтому гиперполяризующий то высший оливарный комплекс (SOC) ядра в соседних клетках и производящие тонотопный тормозящие эффекты.[11] В результате его роли в стимуляции основных нейронов, основная функция чашечки Held заключается в том, чтобы позволить дифференцировать временную активацию волосковых клеток улитки, которые важны для звуковая локализация (обнаружение межурального уровня).[12]
Обнаружение межврального уровня возможно через систему чашечки из-за большого относительного размера GBC, чашечки Held и основных нейронов. Нейроны в Lateral Superior Olive особенно важны для распознавания этих межуральных изменений уровня. Большой диаметр аксонов пушистых клеток позволяет тормозному сигналу, производимому нейронами MNTB, достигать SOC примерно через 0,2 мс после первоначального кохлеарный возбуждение. Это измерение времени ~ 0,2 секунды важно для сравнения контралатеральной (противоположной стороны) и ипсилатеральной (одна и той же стороны) стимуляции, необходимой для локализации звука в горизонтальной плоскости, и является ключевым моментом в определении местоположения низкочастотных звуков.[11]
Структура

Для каждого основного нейрона существует одна чашечка, а для большинства аксонов GBC существует только одна чашечка, хотя есть исключения из этой пары.[1] Это в целом создает соотношение один к одному между GBC, чашечками Held и основными нейронами. Чашечка Held включает в себя главный нейрон с отличной морфологией: разветвление чашечки позволяет создавать сети второго и третьего порядка. Каждая ветвь устанавливает связь с главным нейроном, создавая большое количество активных зон. Это необычно для синаптических окончаний в головном мозге, так как большинство из них создают единую активную зону.[13] Каждая чашечка содержит от 300 до 700 активных зон, и в каждой из активных зон имеется около 100 везикул, содержащих глутамат, с примерно 3 пристыкованными везикулами одновременно. Эти везикулы большие, что согласуется с данными о квантовом размере в других синапсах взрослых. Везикулы с плотным ядром, обычно содержащие нейропептиды, также присутствуют, но необходимы дальнейшие исследования для определения их содержания и функции.[14]
Для поддержания структуры синапса, как и в случае с другими синапсами, существует множество микротрубочки. Чашечка имеет большое количество микротрубочек у основания терминала. Эти микротрубочки выполняют множество функций, таких как обеспечение стабильности синапса, ограничение распределения синаптических пузырьков и локализация митохондрии. Митохондрии выполняют три важные функции на синаптическом окончании: позволяют синапсу удовлетворять метаболические потребности (особенно для удаления кальция после деполяризация ), буферизация кальций, позволяя ему поглощать митохондрии и обеспечивая энергию для синтеза глутамата.[11]
Разные глиальные клетки также связаны с чашечкой Held. Чашечку окружают два типа глиальных клеток: астроциты и NG2 глиальные клетки. Астроциты экспрессируют транспортеры глутамата для удаления глутамата из синапса. Это единственный известный механизм удаления глутамата из синапса. НГ2 глиальные клетки экспрессируют рецепторы AMPA.[11]
Разработка
Общее развитие
На второй постнатальный день (P2) формируется незрелая чашечка Held, которую легко отличить по характерной запечатанной ложке. морфология.[11] Первичные синаптические контакты, которые образуют чашечку, собираются между нейронами MNTB (медиальное ядро трапециевидного тела) и VCN (вентральный кохлеарный нерв), в конечном итоге соединяясь друг с другом, выступая по средней линии двух областей. Эти ассоциации начинают появляться сразу после генерации нейронов VCN; наиболее раннее образование этих контактов можно наблюдать примерно на 17-й день эмбриона (E17). Эти нейронные связи, составляющие важную область улитки, образуют ответвления друг с другом, которые заканчиваются в чашечке Held. В течение следующих двух-трех недель нейронные контакты, которые сначала сформировали эмбриональную чашечку, развиваются по форме и функциям, достигая кульминации в зрелой чашечке, которая способствует последовательному и быстрому распространению сигналов в области MNTB-VCN.[13]
Несколько избранных процессов происходят на раннем этапе развития нейронов, чтобы обеспечить правильное формирование чашечки, в частности, за счет влияния Фактор фибробластного роста (FGF), фактор транскрипции Math5, молекула распознавания нервных клеток NB-2 и эфрин (Eph) белки в клетках. Math1 / Math5 и FGF - два регулятора, необходимые для соответствующего роста и развития комплекс кохлеарного ядра, который включает как вентральное ядро улитки (VCN), так и дорсальное ядро улитки (DCN). Достаточные уровни FGF обеспечивают правильную морфологию ядер улитки, в то время как Math5 обеспечивает правильный размер и обработку ядра улитки. Math1, еще один фактор транскрипции, необходим для появления нейронов VCN в экстрамуральном потоке улитки, а также нейронов высший оливарный комплекс. NB-2 также способствует формированию чашечки Held, а также способствует поддержанию контралатерального MNTB. Комбинированное действие этих трех молекул друг на друга иллюстрирует тот факт, что существует множество семейств белков, участвующих в правильной передаче сигналов и формировании чашечки.[13]
| Миелиновой оболочки |
|---|
Кроме того, белки Eph являются неотъемлемой частью дальнейшего развития системы слуховых цепей после образования эмбриональной чашечки. Одной из характеристик, которая отличает белки Eph и их рецепторы от других сигнальных систем, является их способность передавать информацию двунаправленно. Прямая и обратная передача сигналов в клетках VCN и MNTB важна для правильного количества и формирования выступов VCN и ипсилатеральных MNTB в чашечке. Белки Eph также гарантируют, что пока аксоны проходят через ипсилатеральный MNTB, ветвление и окончательное завершение этих выступов происходит только в контралатеральном MNTB, возможно потому, что белки нацелены только на определенные области на аксонах.[13]
Всего есть два ультраструктурный изменения, происходящие в чашечке Хельда. Во-первых, на второй неделе разработки миелинизация аксонов VCN в MNTB увеличивается. Этот заметный рост миелина соответствует хронологическому развитию сигнальной цепи и адаптации чашечки. Второе ультраструктурное изменение касается основных нейронов MNTB, чьи клеточные тела и ядра увеличиваются в площади поверхности из-за увеличения. Это прямой результат того, что отдельные большие постсинаптические плотности распадаются на более мелкие, множественные плотности.[13]
Развитие калиевых каналов

Калиевые каналы жизненно важны для проведения пресинаптического потенциал действия. Чашечка содержит несколько типов калиевых каналов, каждый из которых отличается расположением и чувствительностью. Оба низкопороговых K+ каналы и высокопороговая задержка выпрямительный типа К+ каналы присутствуют в пресинаптических нейронах.[14] Имеется четыре низкопороговых K+ количество каналов: Kv1,1, Кv1,2, Кv1,3, а Kv7.5. Kv1.1 и Kv1.2 расположены в переходной зоне между аксоном и терминалом, а Kv1,3 тыс.v7,5 расположены в чашечке.[14] Существует кальций-активированный калиевый канал экспрессируется в чашечке, однако этот тип канала не способствует высвобождению нейромедиаторов.[11]
В течение одной недели испытуемые мыши (от P7 до P14) показали, что плотность Kv1 и Kv3 каналов с низким порогом увеличивается, что, в свою очередь, влияет на кинетика каналов.[14]
Развитие натриевого канала
Изменения в натриевые каналы во время созревания позволяют увеличить скорость пресинаптического потенциала действия. Здесь потенциалы действия становятся быстрее из-за способности натриевых каналов быстрее восстанавливаться после проводимость. Данные показывают, что экспрессия в альфа-субъединице NaV1.6, особый тип натриевого канала, отвечает за повышенную скорость передачи. NaV1.2, другой натриевой канал, экспрессируемый в аксонах и узлах, как известно, демонстрирует более медленную кинетику.[13]
Чтобы компенсировать миелинизацию (повышенная емкость ), ведущий к чашечке в последнем узле (область между миелиновой оболочкой) перед окончанием аксона, содержащим высокую плотность Na+ каналов, чтобы позволить большому притоку (входящему потоку) натрия вызвать потенциалзависимые кальциевые каналы открываться в пресинаптическом терминале, вызывая приток кальция.
Развитие кальциевых каналов
В незрелых чашечках Held кальций (Ca2+) ионы попадают в нейроны МНТБ через N-, P / Q-, и R-тип Ca2+ каналы, а в зрелых чашечках Ca2+ приток происходит в основном через каналы P / Q-типа.[13] N- и R- тип Ca2+ рецепторы менее склонны запускать высвобождение везикул, поскольку эти типы рецепторов находятся дальше от мест высвобождения. Следовательно, ионы кальция, попадающие в каналы N- и R-типа, увеличивают концентрацию ионов кальция в областях, менее важных для функции чашечки.
Блокировка Са2+ каналы могут возникать за счет использования G-белковые рецепторы, активируемые следующими нейротрансмиттерами:[11]
- Норадреналин (норэпинефрин)
- Серотонин
- γ-аминомасляная кислота (ГАМК)
- Глутамат (глютаминовая кислота)
- Аденозин
В ионных каналах происходят изменения, способствующие более быстрой передаче:[11]
- Na+ и K+ каналы меняются, чтобы позволить пре- и постсинаптическому потенциалу действия быть быстрее
- Kv3 канала также активируются намного быстрее.
- Размер пресинаптического Са2+ токи увеличивается.
- Механика стробирования глутаматных рецепторов становится быстрее
 Норадреналин | 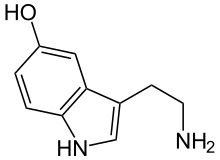 Серотонин |  ГАМК | 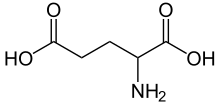 Глютаминовая кислота |  Аденозин |
Развитие лиганд-закрытого канала
Помимо рецептора глутамата, только несколько других лиганд-закрытые каналы были найдены в незрелых чашечках Хельда: ионотропная ГАМКА и рецептор глицина. Эти рецепторы позволяют хлориду (Cl−) протекать через мембрану, и из-за высокой концентрации хлорида в терминале эти рецепторы деполяризуются.[11]
Фенестрация
Между второй и третьей неделями после рождения, примерно во время появления слуха, чашечка Хельда приобретает характерные особенности: оконный (много открытий) внешний вид.[13] Фенестрация приводит к тому, что мембрана редуцируется до множества небольших отделений, которые увеличивают площадь поверхности пресинаптической щели. По мере того, как мембрана все больше защемляется в этих луковидных структурах, синаптические везикулы группируются в эти пространства, что приводит к увеличению числа пристыкованных пузырьков.[11]
Чтобы компенсировать доступные пространства в чашечке, глиальные клетки с рецепторами и транспортом глутамата используются для заполнения открытых пространств, обеспечивая эффективное поглощение глутамата синапсом. Это физическое изменение чашечки не только характерно, но и прагматично с точки зрения слухового хронологического развития.
Механизм

Как синапс, чашечка Held следует механизму, аналогичному другим синапсам. Подробное описание можно найти в разделе нейротрансмиссия.
Приток кальция
Приток кальция в незрелую чашечку Хельда опосредуется N-, п /Q-, и Кальциевые каналы R-типа; однако по мере созревания только кальциевые каналы P / Q-типа становятся доминирующими.[13] При поступлении кальция незрелая чашечка Held очень реактивна из-за ее небольшой кальциевый буфер способность - это вызывает высвобождение глутамат даже при низком уровне притока кальция. В терминале, как и в других синапсах, два иона кальция связываются с синаптотагмин чтобы вызвать высвобождение пузырьков - для чашечек Held глутамат высвобождается в пузырьках. Помимо высвобождения пузырьков, ионы кальция сигнализируют о возвращении конца чашечки в неактивное состояние. При поступлении кальция белок, связывающий элемент цАМФ-ответа (CREB) - это фосфорилированный, изменяя концентрацию калия в ячейке, чтобы вернуть терминал в неактивное состояние.[13] Удаление кальция осуществляется различными способами, в том числе: удаление из терминала, попадание в митохондрии или связывание с кальций-связывающими белками, такими как парвальбумин и кальретинин.[11]
Пресинаптическое торможение
Ретроградная сигнализация необходим в чашечке Held для регулирования уровней кальция в пресинаптическом окончании. Активация метаботропные рецепторы глутамата (mGluRs) активирует вторичный мессенджер G-белка, который взаимодействует с кальциевыми каналами P / Q-типа для снижения проводимости. Кроме того, размер пула везикул увеличивается и вероятность высвобождения снижается. Другие методы пресинаптического ингибирования включают норадреналин, серотонин и аденозин - эти методы наблюдаются только в незрелых чашечках Held.[13]
Постсинаптические рецепторы глутамата
Рецепторы глутамата присутствуют на постсинаптическом окончании - два типа включают ионотропные. AMPA- и Рецепторы NMDA. Как возбуждающий нейротрансмиттер, глутамат почти всегда вызывает активацию потенциала действия на постсинаптической стороне, что дополнительно стимулируется низким внутренним натрием основных нейронов.[11] В зрелой чашечке рецепторы AMPA сосредоточены на главном нейроне, чтобы локализовать передачу для большей вероятности потенциала действия. Также обратите внимание, что вклад рецепторов глутамата NMDA-типа уменьшается после появления слуха.[11]
Пресинаптический эндоцитоз пузырьков
Механизм эндоцитоза синаптических пузырьков изменяется по мере того, как чашечка становится более зрелой. Кальмодулин и кальциневрин в своей активной форме необходимы для эндоцитоза везикул в незрелой чашечке; однако в зрелой чашечке кальмодулин и кальциневрин не нужны. Скорее, этот процесс опосредуется энергией, создаваемой гидролизом GTP.[13] Для загрузки глутамата в пузырьки на конце используются два белка: везикулярный переносчик глутамата 1 (VGLUT1) и VGLUT2.
Ответ
Высокопороговые калиевые каналы в постсинаптической мембране позволяют быстро реполяризация целевого нейрона. Низкопороговые калиевые каналы постсинаптического нейрона снижают возбудимость нейрона, чтобы ограничить его активацию только самым большим синаптическим входом (ами).[11]
Важность исследования
Чашечка Хельда стала популярной модельная система в области нейробиологии. Присутствие этого синапса в нервной системе млекопитающих позволило провести прямые исследования на модели млекопитающих, а большой размер увеличивает легкость исследования. электрофизиологический запись. По этим причинам он стал популярным в понимании выпуска передатчиков.
В частности, чашечка Хельда используется из-за:[11]
- легкость пресинаптического патч-зажим записи.
- возможность контролировать высвобождение передатчика при измерении пре- и постсинаптических эффектов.
- простота визуализации и измерения емкости.
- использование вирусы наблюдать чашечку Хельда как экзогенный система экспрессии.
- возможность проводить эксперименты in vivo.
Рекомендации
- ^ а б Held, H. "Die centrale Gehörleitung" Arch. Анат. Physiol. Анат. Абт, 1893 г.
- ^ Sätzler, K .; Söhl, L. F .; Bollmann, J. H .; Borst, J. G .; Frotscher, M .; Sakmann, B .; Любке, Дж. Х. (2002). «Трехмерная реконструкция чашечки Held и его постсинаптического главного нейрона в медиальном ядре трапециевидного тела». Журнал неврологии. 22 (24): 10567–10579. PMID 12486149.
- ^ Ян, H .; Сюй-Фридман, М.А. (2013). «Стохастические свойства высвобождения нейротрансмиттера расширяют динамический диапазон синапсов». Журнал неврологии. 33 (36): 14406–14416. Дои:10.1523 / JNEUROSCI.2487-13.2013. ЧВК 3761050. PMID 24005293.
- ^ Smith, P.H .; Joris, P. X .; Карни, Л. Х .; Инь, Т.С.Т. (1991). «Проекции физиологически охарактеризованных аксонов шаровидных пушистых клеток из ядра улитки кошки». Журнал сравнительной неврологии. 304 (3): 387–407. Дои:10.1002 / cne.903040305. PMID 2022755.
- ^ Smith, P.H .; Joris, P. X .; Инь, Т. С. (1998). «Анатомия и физиология основных клеток медиального ядра трапециевидного тела (MNTB) кошки». Журнал нейрофизиологии. 79 (6): 3127–3142. Дои:10.1152 / ян.1998.79.6.3127. PMID 9636113.
- ^ Borst, J.G.G .; Сория Ван Хов, Дж. (2012). «Чашечка удерживаемого синапса: от модельного синапса к слуховой реле». Ежегодный обзор физиологии. 74: 199–224. Дои:10.1146 / аннурев-физиол-020911-153236. PMID 22035348.
- ^ Спенглер, К. М .; Warr, W. B .; Хенкель, К. К. (1985). «Проекции главных клеток медиального ядра трапециевидного тела у кошки». Журнал сравнительной неврологии. 238 (3): 249–262. Дои:10.1002 / cne.902380302. PMID 4044914.
- ^ Цучитани, К. (1997). «Вход от медиального ядра трапециевидного тела на детектор межурального уровня». Слуховые исследования. 105 (1–2): 211–224. Дои:10.1016 / S0378-5955 (96) 00212-2. PMID 9083818.
- ^ Морест, Д. К. (1968). «Коллатеральная система медиального ядра трапециевидного тела кошки, ее нейрональная архитектура и связь с оливокохлеарным пучком». Brain Res. 9 (2): 288–311. Дои:10.1016/0006-8993(68)90235-7. PMID 5679830.
- ^ Рюго Д.К., Монтей К.Л., Ригт А.Л., Беннетт М.Л., Понгстапорн Т. (2006). «Постнатальное развитие терминала большого слухового нерва: концевой луковицы Held у кошек». Слуховые исследования. 216–217: 100–115. Дои:10.1016 / j.heares.2006.01.007. PMID 16497457.
- ^ а б c d е ж грамм час я j k л м п о п Borst, J.G.G .; Русу, С.И. (2012). Трассел, Лоуренс; Поппер, Артур; Фэй, Ричард (ред.). Глава 5: Чашечка удерживаемого синапса. Нью-Йорк: Springer-Verlag. С. 95–134. ISBN 978-1-4419-9516-2.
- ^ Цучитани, Чиеко (март 1997 г.). «Вход от медиального ядра трапециевидного тела на детектор межурального уровня». Слуховые исследования. 105 (1–2): 211–224. Дои:10.1016 / S0378-5955 (96) 00212-2. PMID 9083818.
- ^ а б c d е ж грамм час я j k л Накамура, Пол А .; Крамер, Карина С. (июнь 2011 г.). «Формирование и созревание чашечки Хельда». Слуховые исследования. 276 (1–2): 70–78. Дои:10.1016 / j.heares.2010.11.004. ЧВК 3109188. PMID 21093567.
- ^ а б c d Borst, G .; Сория ван Хов, Джон; Джерард, Дж. (17 марта 2012 г.). «Чашечка удерживаемого синапса: от модельного синапса к слуховой реле». Ежегодный обзор физиологии. 74 (1): 199–224. Дои:10.1146 / аннурев-физиол-020911-153236. PMID 22035348.

