Хемостат - Chemostat
| Хемостат | |
|---|---|
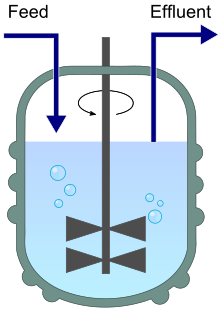 Схема хемостата, показывающая приток (питание) и отток (стоки). | |
| Промышленность | Биологическая инженерия |
| Заявление | Исследование и Промышленность |

А хемостат (из химиясреда статic) является биореактор в которую постоянно добавляется свежая среда, в то время как культуральная жидкость, содержащая оставшиеся питательные вещества, конечные продукты метаболизма и микроорганизмы, непрерывно удаляется с той же скоростью, чтобы поддерживать постоянный объем культуры.[2][3] Изменяя скорость добавления среды в биореактор, удельная скорость роста из микроорганизм можно легко контролировать в определенных пределах.
Операция
Устойчивое состояние
Одной из наиболее важных особенностей хемостатов является то, что микроорганизмы можно выращивать в физиологических условиях. устойчивое состояние в постоянных условиях окружающей среды. В этом устойчивом состоянии рост происходит при постоянном удельная скорость роста и все параметры культуры остаются постоянными (объем культуры, концентрация растворенного кислорода, концентрации питательных веществ и продуктов, pH, плотность клеток и т. д.). Кроме того, экспериментатор может контролировать условия окружающей среды.[4] Микроорганизмы, растущие в хемостатах, обычно достигают устойчивого состояния из-за отрицательной обратной связи между скоростью роста и потреблением питательных веществ: если в биореакторе присутствует небольшое количество клеток, клетки могут расти со скоростью выше, чем скорость разведения, поскольку они потребляют мало питательных веществ. поэтому рост меньше ограничивается добавлением ограничение питательных веществ с втекающей свежей средой. Ограничивающее питательное вещество - это питательное вещество, необходимое для роста, присутствующее в среде в предельной концентрации (все другие питательные вещества обычно поставляются в избытке). Однако чем больше становится количество клеток, тем больше питательного вещества потребляется, что снижает концентрацию ограничивающего питательного вещества. В свою очередь, это снизит удельную скорость роста клеток, что приведет к уменьшению количества клеток, поскольку они продолжают удаляться из системы с оттоком. Это приводит к устойчивому состоянию. Благодаря саморегулированию устойчивое состояние является стабильным. Это позволяет экспериментатору контролировать конкретную скорость роста микроорганизмов, изменяя скорость насоса, подающего свежую среду в сосуд.
Хорошо перемешанный
Другой важной особенностью хемостатов и других систем непрерывного культивирования является то, что они хорошо перемешаны, так что условия окружающей среды являются однородными или однородными, а микроорганизмы беспорядочно рассредоточены и случайно встречаются друг с другом. Следовательно, конкуренция и другие взаимодействия в хемостате глобальны, в отличие от биопленки.
Скорость разведения
Скорость обмена питательных веществ выражается как степень разбавления.D. В устойчивом состоянии удельная скорость роста μ микроорганизма равна степени разведенияD. Скорость разбавления определяется как расход среды в единицу времени, F, по объемуV культуры в биореакторе
Максимальная скорость роста и критическая скорость разбавления
Удельная скорость ростаμ обратно пропорционально времени удвоения биомассы, которое называется временем удвоения.тd, к:
Следовательно, время удвоения тd становится функцией степени разбавленияD в устойчивом состоянии:
Каждый микроорганизм, растущий на определенном субстрате, имеет максимальную удельную скорость роста. μМаксимум (скорость роста, наблюдаемая, если рост ограничивается внутренними ограничениями, а не внешними питательными веществами). Если выбран коэффициент разбавления выше, чем μМаксимум, клетки не могут расти со скоростью, с которой они удаляются, поэтому культура не сможет поддерживать себя в биореакторе и вымывается.
Однако, поскольку концентрация ограничивающего питательного вещества в хемостате не может превышать концентрацию в корме, удельная скорость роста, которой могут достичь клетки в хемостате, обычно немного ниже максимальной удельной скорости роста, поскольку удельная скорость роста обычно увеличивается с питательным веществом. концентрации, как описано кинетикой Уравнение Моно.[нужна цитата ] Наибольшие удельные темпы роста (μМаксимум) клеток равняется критической скорости разбавления (D 'c):
куда S это концентрация субстрата или питательного вещества в хемостате и KS - константа полунасыщения (это уравнение предполагает кинетику Моно).
Приложения
Исследование
Хемостаты в исследованиях используются для исследований в области клеточной биологии как источник больших объемов однородных клеток или белка. Хемостат часто используется для сбора устойчивых данных об организме с целью создания математической модели, относящейся к его метаболическим процессам. Хемостаты также используются как микрокосмы в экологии[5][6] и эволюционная биология.[7][8][9][10] В одном случае мутация / отбор доставляет неудобства, в другом - исследуемый желаемый процесс. Хемостаты также можно использовать для обогащать для определенных типов бактериальных мутантов в культуре, таких как ауксотрофы или те, которые устойчивы к антибиотики или же бактериофаги для дальнейшего научного изучения.[11] Вариации скорости разведения позволяют изучать метаболические стратегии, проводимые организмами при разной скорости роста.[12][13]
Конкуренция за один или несколько ресурсов, эволюция путей приобретения и использования ресурсов, перекрестное кормление / симбиоз,[14][15] антагонизм, хищничество и конкуренция между хищниками были изучены в экология и эволюционная биология с помощью хемостатов.[16][17][18]
Промышленность
Хемостаты часто используются в промышленном производстве этиловый спирт. В этом случае последовательно используют несколько хемостатов, каждый из которых поддерживает понижающуюся концентрацию сахара.[нужна цитата ] Хемостат также служит экспериментальной моделью непрерывных культур клеток в биотехнологической промышленности.[13]
Технические проблемы
- Вспенивание приводит к переполнению, при этом объем жидкости не совсем постоянный.
- Некоторые очень хрупкие клетки разрываются во время волнение и аэрация.
- Клетки могут расти на стенках или прилипать к другим поверхностям.[19] которое можно преодолеть, обработав стеклянные стенки сосуда силан сделать их гидрофобными. Однако ячейки будут выбраны для прикрепления к стенам, поскольку те, которые есть, не будут удалены из системы. Те бактерии, которые прочно прилипают к стенкам, образуя биопленка трудно изучать в условиях хемостата.
- Смешивание может быть неоднородным, что нарушает «статичность» хемостата.
- Капание среды в камеру на самом деле приводит к небольшим импульсам питательных веществ и, следовательно, к колебаниям концентраций, снова нарушая «статические» свойства хемостата.
- Бактерии довольно легко перемещаются вверх по течению. Они быстро достигнут резервуара со стерильной средой, если путь жидкости не прерван воздушным разрывом, в котором среда каплями падает через воздух.
Постоянные усилия по исправлению каждого дефекта довольно часто приводят к изменению базового хемостата. Примеры в литературе многочисленны.
- Пеногасители используются для подавления пенообразования.
- Перемешивание и аэрация можно проводить осторожно.
- Было принято множество подходов к уменьшению роста стен[20][21]
- В различных приложениях для смешивания используются лопасти, барботаж или другие механизмы.[22]
- Капание можно сделать менее сильным с помощью более мелких капель и большего объема емкости
- Многие улучшения нацелены на угрозу заражения
Соображения экспериментального дизайна
Выбор и настройка параметров
- Установившаяся концентрация ограничивающего субстрата в хемостате не зависит от концентрации притока. Концентрация притока будет влиять на концентрацию клеток и, следовательно, на ОП в установившемся состоянии.
- Несмотря на то, что предельная концентрация субстрата в хемостате обычно очень низкая и поддерживается дискретными высококонцентрированными импульсами притока, на практике временное изменение концентрации внутри хемостата невелико (несколько процентов или меньше) и, таким образом, может рассматриваться как квазистационарное состояние.
- Время, необходимое для того, чтобы плотность клеток (OD) приблизилась к установившемуся значению (превышение / недостижение), часто будет долгим (многократные обороты хемостата), особенно, когда начальный посевной материал большой. Но время можно минимизировать при правильном выборе параметров.
Устойчивый рост состояния
- Может показаться, что хемостат находится в устойчивом состоянии, но поглощения мутантных штаммов могут происходить непрерывно, даже если они не обнаруживаются путем мониторинга параметров макроуровня, таких как OD или концентрации продукта.
- Лимитирующий субстрат обычно находится в таких низких концентрациях, что его невозможно обнаружить. В результате концентрация ограничивающего субстрата может сильно варьироваться во времени (в процентном отношении), поскольку разные штаммы захватывают популяцию, даже если результирующие изменения OD слишком малы для обнаружения.
- «Импульсный» хемостат (с очень большими импульсами притока) имеет существенно более низкую избирательную способность, чем стандартный квазинепрерывный хемостат, для мутантного штамма с повышенной приспособленностью к ограничивающим условиям.
- Путем резкого снижения концентрации субстрата, ограничивающего приток, можно временно подвергнуть клетки относительно более жестким условиям, пока хемостат не стабилизируется обратно в устойчивое состояние (во временном порядке степени разбавления D).
Мутация
- Некоторые типы мутантных штаммов появятся быстро:
- Если есть SNP который может улучшить физическую форму, он должен появиться в популяции всего после нескольких удвоений хемостата, для характерно больших хемостатов (например, 10 ^ 11 Кишечная палочка ячеек).
- Штамм, для которого требуются два конкретных SNP, где только их комбинация дает преимущество пригодности (тогда как каждый из них по отдельности является нейтральным), вероятно, появится только в том случае, если целевой размер (количество различных местоположений SNP, вызывающих полезную мутацию) для каждого SNP очень большой.
- Маловероятно появление других типов мутантных штаммов (например, двух SNP с малым размером мишени, большего количества SNP или хемостатов меньшего размера).
- Эти другие мутации ожидаются только в результате последовательного охвата мутантов с преимуществом приспособленности. Можно ожидать появления нескольких мутантов только в том случае, если каждая мутация является независимой, а не в тех случаях, когда мутации индивидуально нейтральны, но вместе полезны. Последовательные поглощения - единственный надежный способ эволюции в хемостате.
- Казалось бы, крайний сценарий, когда мы требуем, чтобы каждый возможный SNP хотя бы один раз сосуществовал в хемостате, на самом деле весьма вероятен. Большой хемостат, скорее всего, достигнет этого состояния.
- Для большого хемостата ожидаемое время до благоприятного мутация примерно соответствует времени оборота хемостата. Обратите внимание, что это обычно значительно меньше времени, в течение которого полезный штамм захватывает популяцию хемостата. Это не обязательно так в маленьком хемостате.
- Ожидается, что приведенные выше пункты будут одинаковыми для разных бесполых репродуктивных видов (Кишечная палочка, С. cerevisiae, так далее.).
- Более того, время до появления мутации не зависит от размера генома, но зависит от скорости мутации на BP.
- Для характерно больших хемостатов гипермутантный штамм не дает достаточно преимуществ, чтобы их можно было использовать. Кроме того, у него недостаточно избирательного преимущества, чтобы можно было ожидать, что он всегда будет проявляться в результате случайной мутации и захватить хемостат.
Единое поглощение
- Время перехода предсказуемо с учетом соответствующих параметров деформации.
- Разные степени разбавления выборочно способствуют тому, что разные мутантные штаммы захватывают популяцию хемостата, если такой штамм существует. Например:
- Высокая скорость разведения создает давление отбора для мутантного штамма с повышенной максимальной скоростью роста;
- Средняя степень разбавления создает давление отбора для мутантного штамма с более высоким сродством к ограничивающему субстрату;
- Низкая скорость разведения создает давление отбора для мутантного штамма, который может расти в среде без ограничивающего субстрата (предположительно, за счет потребления другого субстрата, присутствующего в среде);
- Время захвата превосходящего мутанта будет довольно постоянным во всем диапазоне рабочих параметров. Для характерных рабочих значений время принятия составляет от дней до недель.
Последовательные поглощения
- При подходящих условиях (достаточно большая популяция и несколько мишеней в геноме для простых полезных мутаций) ожидается, что несколько штаммов будут последовательно захватывать популяцию, и делать это будет относительно синхронизировано и темпами. Время зависит от типа мутации.
- В последовательности заимствования, даже если избирательное улучшение каждого из штаммов остается постоянным (например, каждый новый штамм лучше предыдущего на постоянный коэффициент), скорость заимствования не остается постоянной, а скорее уменьшается от штамма к штамму.
- Бывают случаи, когда последовательные поглощения происходят так быстро, что очень трудно различать штаммы даже при изучении частоты аллелей. Таким образом, линия множественного поглощения последовательных штаммов может проявиться как поглощение одного штамма с когортой мутаций.
Вариации
Установки ферментации, тесно связанные с хемостатами, являются турбидостат, то ауксостат и ретентостат. В ретентостатах культуральная жидкость также удаляется из биореактора, но фильтр задерживает биомассу. В этом случае концентрация биомассы увеличивается до тех пор, пока потребность в питательных веществах для поддержания биомассы не сравняется с количеством ограничивающего питательного вещества, которое может быть потреблено.
Смотрите также
- Бактериальный рост
- Биохимическая инженерия
- Реактор непрерывного действия с мешалкой (CSTR)
- E. coli эксперимент долгосрочной эволюции
- Fed-партия
Рекомендации
- ^ Мэдиган, Майкл (2015). Биология микроорганизмов Брока. Пирсон. С. 152–153. ISBN 978-0-321-89739-8.
- ^ Новик А., Сцилард Л. (1950). «Описание хемостата». Наука. 112 (2920): 715–6. Bibcode:1950Sci ... 112..715N. Дои:10.1126 / science.112.2920.715. PMID 14787503.
- ^ Джеймс ТВ (1961). «Непрерывное культивирование микроорганизмов». Ежегодный обзор микробиологии. 15: 27–46. Дои:10.1146 / annurev.mi.15.100161.000331.
- ^ D Herbert; Р. Элсворт; RC Теллинг (1956). «Непрерывное культивирование бактерий; теоретические и экспериментальные исследования». J. Gen. Microbiol. 14 (3): 601–622. Дои:10.1099/00221287-14-3-601. PMID 13346021.
- ^ Бекс Л., Хилкер Ф.М., Мальхов Х., Юргенс К., Арндт Х. (2005). «Экспериментальная демонстрация хаоса в микробной пищевой сети». Природа. 435 (7046): 1226–9. Bibcode:2005Натура 435.1226Б. Дои:10.1038 / природа03627. PMID 15988524.
- ^ Павлоу С, Кеврекидис И.Г. (1992). «Микробное хищничество в периодически работающем хемостате: глобальное исследование взаимодействия между естественными и внешними частотами». Math Biosci. 108 (1): 1–55. Дои:10.1016 / 0025-5564 (92) 90002-Е. PMID 1550993.
- ^ Вичман HA, Millstein J, Bull JJ (2005). «Адаптивная молекулярная эволюция для 13 000 поколений фагов: возможная гонка вооружений». Генетика. 170 (1): 19–31. Дои:10.1534 / генетика.104.034488. ЧВК 1449705. PMID 15687276.
- ^ Дыхуизен Д.Е., Декан А.М. (2004). «Эволюция специалистов в экспериментальном микромире». Генетика. 167 (4): 2015–26. Дои:10.1534 / генетика.103.025205. ЧВК 1470984. PMID 15342537.
- ^ Вик Л.М., Вайленманн Х., Эгли Т. (2002). «Явная часовая эволюция Escherichia coli в хемостатах с ограничением глюкозы воспроизводима в целом, но не при малых размерах популяции, и может быть объяснена с помощью кинетики Монода». Микробиология. 148 (Pt 9): 2889–902. Дои:10.1099/00221287-148-9-2889. PMID 12213934.
- ^ Джонс Л. Е., Элнер СП (2007). «Влияние быстрой эволюции добычи на циклы хищник-жертва». J Math Biol. 55 (4): 541–73. arXiv:q-bio / 0609032. Дои:10.1007 / s00285-007-0094-6. PMID 17483952.
- ^ Шлегель Х.Г., Яннаш Х.В. (1967). «Обогащение культур». Анну. Rev. Microbiol. 21: 49–70. Дои:10.1146 / annurev.mi.21.100167.000405. PMID 4860267.
- ^ Варма, А .; Палссон, Б. О. (1994-10-01). «Модели стехиометрического баланса потока позволяют количественно прогнозировать рост и секрецию побочных продуктов метаболизма у Escherichia coli W3110 дикого типа». Прикладная и экологическая микробиология. 60 (10): 3724–3731. ISSN 0099-2240. ЧВК 201879. PMID 7986045.
- ^ а б Фернандес-де-Коссио-Диас, Хорхе; Леон, Калет; Мулет, Роберто (2017-11-13). «Описание устойчивых состояний метаболических сетей в масштабе генома в непрерывных культурах клеток». PLOS вычислительная биология. 13 (11): e1005835. arXiv:1705.09708. Bibcode:2017PLSCB..13E5835F. Дои:10.1371 / journal.pcbi.1005835. ISSN 1553-7358. ЧВК 5703580. PMID 29131817.
- ^ Доутон CG, Шей Д.П. (1977). «Утилизация паратиона бактериальными симбионтами в хемостате». Appl. Environ. Микробиол. 34 (2): 175–84. ЧВК 242618. PMID 410368.
- ^ Пфайффер Т., Бонхёффер С. (2004). «Эволюция перекрестного кормления в микробных популяциях». Являюсь. Нат. 163 (6): E126–35. Дои:10.1086/383593. PMID 15266392.
- ^ Дж. Дж. Батлер; Г. С. К. Волкович (Июль 1986 г.). «Опосредованная хищниками конкуренция в хемостате». J Math Biol. 24 (2): 67–191. Дои:10.1007 / BF00275997.
- ^ Dykhuizen DE, Hartl DL (июнь 1983 г.). «Отбор в хемостатах». Microbiol. Rev. 47 (2): 150–68. ЧВК 281569. PMID 6308409.
- ^ Dykhuizen DE, Hartl DL (май 1981). «Эволюция конкурентоспособности Escherichia coli». Эволюция. 35 (3): 581–94. Дои:10.2307/2408204. JSTOR 2408204.
- ^ Бономи А., Фредриксон А.Г. (1976). «Питание простейших и рост бактериальной стенки». Biotechnol. Bioeng. 18 (2): 239–52. Дои:10.1002 / бит. 260180209. PMID 1267931.
- ^ де Креси Э., Мецгар Д., Аллен С., Пенико М., Лион Б., Хансен С.Дж., де Креси-Лагар В. (2007). «Разработка нового устройства непрерывного культивирования для экспериментальной эволюции бактериальных популяций». Appl. Microbiol. Biotechnol. 77 (2): 489–96. Дои:10.1007 / s00253-007-1168-5. PMID 17896105.
- ^ Чжан З., Бокацци П., Чой Х.Г., Пероцциелло Дж., Сински А.Дж., Дженсен К.Ф. (2006). «Микрохемостат-микробная непрерывная культура в инструментальном микробиореакторе на полимерной основе». Лабораторный чип. 6 (7): 906–13. Дои:10.1039 / b518396k. PMID 16804595.
- ^ Ван Хулле С.В., Ван ден Брок С., Мартенс Дж., Виллез К., Шелстраете Г., Фольке Е.И., Ванроллегхем ПА (2003). «Практический опыт запуска и эксплуатации лабораторного реактора SHARON с непрерывной аэрацией». Commun. Agric. Appl. Биол. Sci. 68 (2 Pt A): 77–84. PMID 15296140.
- ^ а б c d е Широкий А., Майло Р. (2018). «Понимание динамики и оптимизация производительности экспериментов по выбору хемостата». arXiv:1806.00272 [q-bio.PE ].
внешняя ссылка
- http://www.pererikstrandberg.se/examensarbete/chemostat.pdf
- https://web.archive.org/web/20060504172359/http://www.rpi.edu/dept/chem-eng/Biotech-Environ/Contin/chemosta.htm
- Заключительная диссертация, включающая математические модели хемостата и других биореакторов.
- Страница об одной конструкции лабораторного хемостата
- Подробное руководство по хемостату (лаборатория Данхэма). Процедуры и принципы являются общими.




