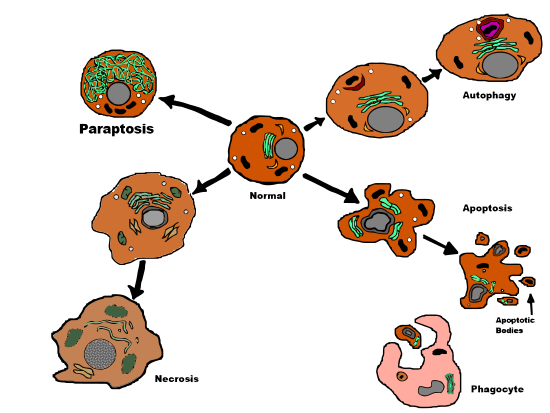
Параптоз - Paraptosis

Параптоз (от Греческий παρά параграф, "связанные с" и апоптоз ) является разновидностью запрограммированная гибель клеток, морфологически в отличие от апоптоз и некроз. Определяющими признаками параптоза являются: цитоплазматический вакуолизация, независим от каспаза активация и торможение, а также отсутствие апоптотической морфологии. Параптозу не хватает некоторых отличительных характеристик апоптоза, таких как мембрана пузыри, хроматин конденсация и ядерная фрагментация. Подобно апоптозу и другим типам запрограммированной гибели клеток, клетка вызывает свою собственную смерть и экспрессия гена требуется. Это контрастирует с некрозом, который представляет собой незапрограммированную гибель клеток, возникающую в результате травма, повреждение в камеру.
Параптоз был обнаружен в некоторых случаях развития и нейродегенеративный гибель клеток, а также вызванная несколькими рак наркотики.
История
Первое упоминание об использовании термина «параптоз» было сделано Сабиной Сперандио. и другие. в 2000 году. Группа использовала человека рецептор инсулиноподобного фактора роста 1 (IGF-1R) стимулировать гибель клеток в 293T клетки и мыши эмбриональные фибробласты, наблюдая явные отличия от других форм гибели клеток. Они придумали термин «параптоз», образованный от греческого предлога параграф, что означает рядом с ним или имеет отношение к нему, и апоптоз.[1][2]
Хотя Сперандио был первым, кто опубликовал термин «параптоз», это был не первый случай, когда наблюдалась гибель клеток со свойствами параптоза. Такие термины, как «цитоплазматическая» и «гибель клеток типа 3» ранее использовались для описания этих форм гибели клеток. Эти формы очень похожи на параптоз морфологически, и возможно, что некоторые случаи гибели клеток, первоначально описанные как одна из этих форм, являются проявлениями параптоза.[1][3]
Морфология
Параптоз - это форма запрограммированной гибели клеток III типа с уникальным сочетанием определенных апоптотических и некротических характеристик. Параптоз делает не продемонстрировать ядерная фрагментация, образование апоптотических телец или окончательная демонстрация конденсации хроматина - все это наблюдается при апоптозе. Вместо этого параптоз показывает несколько примитивный путь гибели клеток,[4] сравнимо с некрозом, включая характерное образование цитоплазматической вакуоли и позднее набухание митохондрий[1] и комкование.[5] Количество и размер вакуолей со временем увеличивается. В конце концов, размеры вакуолей достигают точки невозврата, и клетка не может восстановиться.[5]
Подобно апоптозу, методы окрашивания могут использоваться для идентификации параптотических клеток путем выделения транслокации фосфатидилсерина из цитоплазматического (внутреннего) листка плазматической мембраны на поверхность клетки или внешний листок.[6]
Изменения морфологии параптоза аналогичны морфологическим изменениям, произошедшим во время развитие нервной системы.[1]
Крупная структурная перестройка
Почти сразу основные структурные перестройки, такие как округлые клетки, реорганизация цитоплазмы и вакуолизация клеток, подвергающихся параптозу, можно увидеть с помощью световой микроскопии.[7] Наблюдается физическое увеличение митохондрий и эндоплазматического ретикулума. Этот опухший вид можно объяснить дисбалансом внутриклеточных ионов и, в конечном итоге, осмотический лизис. После разрыва высвобождаются частицы и вещества, в том числе: (1) группа B-1 с высокой подвижностью (HMGB1 )[8] (2) белки теплового шока[9] и (3) различные другие протеазы. Эти вещества являются «сигналами опасности» и вызывают воспаление.[10]
Путь
Хотя известно, что определенные шаблоны запрограммированной гибели клеток полагаются на de novo синтез белка, параптотическая гибель клеток, индуцированная IGFIR-IC в клетках 293T, сдерживается актиномицин D и циклогексимид, тем самым демонстрируя зависимость от транскрипции и трансляции.[1]
Установлено, что индукция параптоза опосредуется двумя путями передачи положительного сигнала: MAPK и JNK, используя IGF-IR на уровне рецепторов. Таким образом, параптоз можно предотвратить путем ингибирования определенных протеинкиназы этих путей.[3]
AIP1 взаимодействие (через его карбоксильный терминал ) с эндофилинами может вызывать образование внутриклеточных вакуолей.[11] Было установлено, что AIP1 / Alix является «первым специфическим ингибитором» параптоза.[3]
Фенотип, подобный параптозу, также был описан в клетках колоректального рака человека после сверхактивации нерецепторной тирозинкиназы. c-Src предполагая возможное участие передачи сигналов Src в параптозе.[12]
Отличия от других путей гибели клеток
Гибель клеток, индуцированная IGFIR-IC в клетках 293T, демонстрировала гибель клеток без ассоциированной активности каспаз. Это по сравнению с апоптозом, при котором проапоптотический белок Bax индуцированная активация каспаз и гибель клеток. Кроме того, исследования показали, что ингибиторы каспаз (zVAD.fmk, p53, BAF), ингибитор x-хромосомы (xiap ), и Bcl-xL (из семейства Bcl-2) не предотвращал гибель клеток в клетках 293T при индукции IGFIR-IC. Таким образом, был сделан вывод, что параптоз отличается от апоптоза (типа гибели клеток 1) тем, что на него не влияют ингибиторы апоптоза.[1]
При апоптозе HMGB1 белок хроматина задерживается в ядре, что приводит к образованию апоптотических телец, в то время как при параптозе высвобождается HMGB1.[13]
Наиболее существенная разница, наблюдаемая (по состоянию на апрель 2014 г.) между параптозом и аутофагический гибель клеток (тип смерти клеток 2) - это отсутствие в параптозе характерных аутофагических вакуолей, наблюдаемых в аутофагический гибель клеток.[1] Как и ожидалось, ингибиторы гибели аутофагических клеток (например, 3-метиладенин) неэффективны при подавлении параптоза.[7]
Сравнение типов гибели клеток
| Параптоз | Апоптоз | Некроз | |
|---|---|---|---|
| Морфология | |||
| Цитоплазматическая вакуолизация | да | Нет | да |
| Конденсация хроматина | Нет | да | Нет |
| Ядерная фрагментация | Нет | да | Нет |
| Апоптотические тела | Нет | да | Нет |
| Митохондриальный отек | да | Иногда | да |
| Мембранные пузыри | Нет | да | Да поздно |
| Запрограммированная гибель клеток | да | да | Нет |
| Активность каспазы | Нет | да | Иногда |
| Ингибиторы | |||
| Актиномицин D, циклогексимид | да | Иногда | Нет |
| AIP1 / Аликс | да | Нет | Нет |
| Ингибиторы каспаз (zVAD.fmk, p53, BAF) | Нет | да | Нет |
| Xiap | Нет | да | Нет |
| Bcl-XL | Нет | да | Обычно нет |
Профиль протеома
Клетки испытывают как морфологические, так и протеом изменяется при параптозе. Изменения структурных, сигнальных и митохондриальных белков наблюдались во время параптоза.[7]
Структурные белки
В клетках, подвергающихся параптозу:
- α-тубулин больше сосредоточено в эндосомы и Гольджи (светлая мембрана) и реже встречается в цитозоле и темной мембране (состоит из митохондрий и лизосомы ).[7]
- Тропомиозин, подобно α-тубулину, демонстрирует более высокое присутствие в эндосомах и гольджи, имея меньшее содержание в цитозоле и темной мембране.[7]
Белки сигнальной трансдукции
PEBP, или Раф киназа белок-ингибитор (RKIP) снижается в параптотических клетках, поэтому результирующая понижающая регуляция PEBP и / или других ингибиторов киназ, по-видимому, указывает на участие в MAPK и JNK путей, поскольку уменьшение PEBP позволит уровням MAPK и JNK накапливаться в достаточном количестве, чтобы вызвать гибель клеток.[7]
Белки митохондрии
АТФ-синтаза состоит из нескольких субъединиц и находится в митохондриях. При параптозе большее количество ß-субъединицы АТФ-синтазы было продемонстрировано в P20.[7]
Окрашивание митохондрий показывает, что параптотические клетки округлой формы с повышенным уровнем запретить похоже, претерпевает реорганизацию митохондриальной сети.[7]
В паратотических клетках уровень запретитина увеличился в 3,4 раза. Повышенные уровни запрета в сочетании с паратотическим стимулом могут привести к гибели клеток, которая не может быть подавлена ингибиторами каспаз.[7]
Возможное медицинское значение
Рак
Было показано, что многие противораковые вещества вызывают параптоз в большом количестве раковых клеток человека. Это включает несколько соединений, полученных из природных источников.[14][15] а также металлокомплексы.[16][17] Использование соединений природного происхождения для лечения рака может дать способ избежать многих вредных побочных эффектов традиционных химиотерапия. Параптоз также представляет интерес для исследований рака как способ лечения устойчивых к апоптозу форм рака.[14][18]
Паклитаксел, обычно распространяемый под торговой маркой Taxol, представляет собой противораковое лекарственное средство, используемое для лечения рака груди и яичников. Одно исследование показало, что при высоких концентрациях (70 мкМ) он вызывает параптозную гибель клеток и может быть важным механизмом для лечения устойчивых к апоптозу форм рака.[18]
Исследователи сообщили, что обнаружили, что γ-токотриенол, форма витамина Е, полученная из пальмового масла, вызвала параптозную гибель клеток в рак толстой кишки клетки. Помимо индукции параптоза, γ-токотриенол также подавлял Сигнальный путь Wnt, который играет роль в развитии опухоли. Комбинация этих двух функций может обеспечить новый механизм лечения рака толстой кишки.[15]
Приготовленный на пару Американский женьшень Сообщалось, что экстракт «сильно убивает клетки колоректального рака».[19] В частности, производные от протопанаксадиол Rg3 и Rh2 - ключевые гинсенозиды, содержащиеся в экстракте.[19] В клеточных линиях колоректального рака HCT116 цитозольная вакуолизация была вызвана Rh2.[20] Более того, Rh2-индуцированная вакуолизация ингибировалась специфическим ингибитором MEK1 / 2. U0126, циклогексимид,[20] тем самым подтверждая два характерных свойства параптоза, передачу сигналов через MAP киназа и необходимая трансляция белка.[3] Rh2 также вызывает увеличение ROS уровни, которые активируют NF-κB сигнальный путь, при блокировании ROS с участием НАК или каталаза предотвращает активацию NF-κB передачи сигналов и дополнительно усиливает гибель клеток, вызванную Rh2. Это предполагает усиленный антиоксидантами противораковый эффект Rh2.[20]
Хонокиол, соединение, полученное из Магнолия лекарственная, может вызывать параптоз у человека лейкемия клетки. В клеточной линии NB4 параптоз был основным методом гибели клеток. В К562 клетки, апоптоз был первичным механизмом, иногда обнаруживался параптоз.[14] Исследователи заявили, что это говорит о том, что смерть лейкозных клеток может быть вызвана несколькими путями.[14]
В одном эксперименте комплекс фосфин-медь (I) вызывал параптоз в раковых клетках толстой кишки, вызывая эндоплазматический ретикулум стресс.[16] Другой комплекс меди, комплекс тиоксотриазола меди (II) A0, также вызывает параптоз в HT1080. фибросаркома клетки посредством стресса эндоплазматического ретикулума и вакуолизации цитоплазмы. Вместе с цитотоксический такие эффекты, как увеличение окисленных глутатион и предотвращение протеасома активности, A0 предотвращает активность каспазы-3, которая может ингибировать апоптоз и вызывать гибель клеток через параптоз.[17]
Нейродегенеративная гибель клеток
Активность супрессора опухолей млекопитающих p53 зависит от уровня изоформа р53, р44. В эксперименте с трансгенными мышами, у которых была повышенная экспрессия p44, гиперактивация IGF-1R произошло, что в свою очередь привело к ускоренному старению и смерти. Мыши также испытали гибель нейронов в областях мозга, связанных с формированием и восстановлением памяти. Эта индуцированная IGF-1R нейродегенерация была вызвана как параптозом, так и гибелью аутофагических клеток.[21] IGF-1R является важной областью исследований нейродегенеративных заболеваний, поскольку дефекты передачи IGF-1R, включая повышенные уровни IGF-1R, были обнаружены в мозге Болезнь Альцгеймера пациенты.[22]
Другие примеры
Запрограммированная гибель клеток, подобная параптозу, наблюдалась как у растений, так и у растений. протисты. Апоптотическая смерть, подобная той, что наблюдается у животных, не происходит у растений из-за клеточная стенка клеток растений, предотвращающих фагоцитоз. В эксперименте с табаком блеомицин был использован для введения двухцепочечных разрывов в ДНК клеток. Затем это заставляло клетки претерпевать запрограммированную гибель клеток со значительной вакуолизацией и отсутствием фрагментации ДНК и ингибирования каспаз, подобно параптозу.[23] Исследование с водорослями Дуналиелла виридис продемонстрировали способность протистов претерпевать запрограммированную гибель клеток через несколько типов, включая параптоз и апоптоз, в зависимости от различных стимулов окружающей среды.[24] Сочетание этих факторов привело к предположению, что параптоз может быть наследственной формой запрограммированной гибели клеток, сохраняющейся в разных формах жизни.[23]
Смотрите также
использованная литература
- ^ а б c d е ж г час Сперандио, S; де Белль, я; Бредесен, Делавэр (19 декабря 2000 г.). «Альтернативная, неапоптотическая форма запрограммированной гибели клеток». Труды Национальной академии наук Соединенных Штатов Америки. 97 (26): 14376–81. Bibcode:2000PNAS ... 9714376S. Дои:10.1073 / pnas.97.26.14376. ЧВК 18926. PMID 11121041.
- ^ «Параптоз - Оксфордские словари».
- ^ а б c d е Sperandio S, Poksay K, de Belle I, Lafuente MJ, Liu B, Nasir J, Bredesen DE (октябрь 2004 г.). «Параптоз: опосредование MAP-киназами и ингибирование AIP-1 / Alix». Гибель клеток и дифференциация. 11 (10): 1066–75. Дои:10.1038 / sj.cdd.4401465. PMID 15195070.
- ^ «Параптоз - новый путь к запрограммированной гибели клеток». Биологические исследования онлайн (предмет новостей). 19 декабря 2000 г.
- ^ а б Cagle, Philip T .; Аллен, Тимоти Крейг (10.06.2009). Основные понятия молекулярной патологии. Springer. п. 30. ISBN 9780387896267. Получено 19 апреля 2014.
- ^ Ван, Y; Ли, Х; Ван, Л; Дин, П; Zhang, Y; Хан, Вт; Ма, Д. (15 марта 2004 г.). «Альтернативная форма параптозоподобной гибели клеток, запускаемая TAJ / TROY и усиленная сверхэкспрессией PDCD5». Журнал клеточной науки. 117 (Pt 8): 1525–32. Дои:10.1242 / jcs.00994. PMID 15020679.
- ^ а б c d е ж г час я j Сперандио, S; Поксай, КС; Шиллинг, B; Криппен, Д.; Гибсон, Б.В.; Бредесен, Делавэр (15 декабря 2010 г.). «Идентификация новых модуляторов и белковых изменений в неапоптотической программируемой гибели клеток». Журнал клеточной биохимии. 111 (6): 1401–12. Дои:10.1002 / jcb.22870. ЧВК 5668132. PMID 20830744.
- ^ Ян, H; Wang, H; Czura, CJ; Трейси, KJ (июль 2005 г.). «Цитокиновая активность HMGB1». Журнал биологии лейкоцитов. 78 (1): 1–8. Дои:10.1189 / jlb.1104648. PMID 15734795.
- ^ Мельчер, А; Тодрик, С; Hardwick, N; Форд, М; Якобсон, М; Вайл, Р.Г. (май 1998 г.). «Иммуногенность опухоли определяется механизмом гибели клеток через индукцию экспрессии белка теплового шока». Природа Медицина. 4 (5): 581–7. Дои:10,1038 / нм0598-581. PMID 9585232.
- ^ Галлуччи, S; Матцингер, П. (февраль 2001 г.). «Сигналы опасности: SOS для иммунной системы». Текущее мнение в иммунологии. 13 (1): 114–9. Дои:10.1016 / s0952-7915 (00) 00191-6. PMID 11154927.
- ^ Chatellard-Causse, C; Блот, В; Кристина, N; Факел, S; Missotten, M; Садул, Р. (9 августа 2002 г.). «Аликс (белок X, взаимодействующий с ALG-2), белок, участвующий в апоптозе, связывается с эндофилинами и вызывает вакуолизацию цитоплазмы». Журнал биологической химии. 277 (32): 29108–15. Дои:10.1074 / jbc.M204019200. PMID 12034747.
- ^ Велман А., Которн С., Понсе-Перес Л. и др. (2006). «Повышение уровня экспрессии и активности c-Src не способствует росту клеток колоректальной карциномы человека in vitro и in vivo». Неоплазия. 8 (11): 905–16. Дои:10.1593 / neo.06475. ЧВК 1716016. PMID 17132222.
- ^ Коэн, Дж. Дж. (Март 1993 г.). «Апоптоз». Иммунология сегодня. 14 (3): 126–30. Дои:10.1016/0167-5699(93)90214-6. PMID 8466628.
- ^ а б c d Ван, Y; Чжу, X; Ян, Z; Чжао, X (18 января, 2013). «Хонокиол вызывает каспазно-независимый параптоз за счет продукции активных форм кислорода, что сопровождается апоптозом лейкозных клеток». Сообщения о биохимических и биофизических исследованиях. 430 (3): 876–82. Дои:10.1016 / j.bbrc.2012.12.063. PMID 23262230.
- ^ а б Zhang, JS; Ли, DM; Может; Курицы; Гу, Q; Wang, FS; Цзян, SQ; Чен, BQ; Лю, младший (2013). «γ-Токотриенол вызывает смерть клеток, подобных параптозу, в клетках карциномы толстой кишки человека SW620». PLoS ONE. 8 (2): e57779. Bibcode:2013PLoSO ... 857779Z. Дои:10.1371 / journal.pone.0057779. ЧВК 3585143. PMID 23469066.
- ^ а б Гандин, В; Пеллей, М; Tisato, F; Порчия, М; Сантини, C; Марцано, К. (январь 2012 г.). «Новый комплекс меди индуцирует параптоз в раковых клетках толстой кишки через активацию передачи сигналов стресса ER». Журнал клеточной и молекулярной медицины. 16 (1): 142–51. Дои:10.1111 / j.1582-4934.2011.01292.x. ЧВК 3823100. PMID 21388518.
- ^ а б Тардито, S; Изелла, С; Medico, E; Marchiò, L; Bevilacqua, E; Hatzoglou, M; Буссолати, О; Франки-Газзола, Р. (4 сентября 2009 г.). «Комплекс тиоксотриазола меди (II) A0 вызывает стресс эндоплазматического ретикулума и параптотическую смерть раковых клеток человека». Журнал биологической химии. 284 (36): 24306–19. Дои:10.1074 / jbc.M109.026583. ЧВК 2782024. PMID 19561079.
- ^ а б Guo, WJ; Чен, ТС; Ван, XP; Чен, Р. (2010). «Таксол вызывает зависимую от концентрации апоптотическую и параптозоподобную гибель клеток в клетках аденокарциномы легких человека (ASTC-a-1)». Журнал рентгеновской науки и техники. 18 (3): 293–308. Дои:10.3233 / XST-2010-0261. PMID 20714087.
- ^ а б Ли, Б; Ван, Чехия; Он, ТС; Юань, CS; Du, W (1 марта 2010 г.). «Антиоксиданты усиливают индуцированное американским женьшенем уничтожение клеток колоректального рака». Письма о раке. 289 (1): 62–70. Дои:10.1016 / j.canlet.2009.08.002. ЧВК 2824022. PMID 19716228.
- ^ а б c Ли, Б; Чжао, Дж; Ван, Чехия; Сирл, Дж; Он, ТС; Юань, CS; Du, W (28 февраля 2011 г.). «Гинзенозид Rh2 вызывает апоптоз и параптозоподобную гибель клеток в клетках колоректального рака посредством активации p53». Письма о раке. 301 (2): 185–92. Дои:10.1016 / j.canlet.2010.11.015. ЧВК 3022099. PMID 21194832.
- ^ Пехар М., О'Риордан К.Дж., Бернс-Кусато М., Анджеевски М.Э., дель Алькасар К.Г., Бургер С., Скрэбл Х., Пульелли Л. (апрель 2010 г.). «Измененная активность p53: p44, обеспечивающая долголетие, у мышей вызывает потерю памяти, нейродегенерацию и преждевременную смерть». Ячейка старения. 9 (2): 174–90. Дои:10.1111 / j.1474-9726.2010.00547.x. ЧВК 2848983. PMID 20409077.
- ^ Молони, AM; Гриффин, RJ; Тиммонс, S; О'Коннор, Р. Равид, Р; О'Нил, К. (февраль 2010 г.). «Дефекты рецептора IGF-1, рецептора инсулина и IRS-1/2 при болезни Альцгеймера указывают на возможную устойчивость к IGF-1 и передаче сигналов инсулина». Нейробиология старения. 31 (2): 224–43. Дои:10.1016 / j.neurobiolaging.2008.04.002. PMID 18479783.
- ^ а б Сметана, О; Широки, Дж; Houlné, G; Opatrný, Z; Шабуте, Мэн (апрель 2012 г.). «Неапоптотическая запрограммированная гибель клеток с параптотическими особенностями в обработанных блеомицином растительных клетках подавляется посредством ингибирования путей ATM / ATR или сверхэкспрессии NtE2F». Журнал экспериментальной ботаники. 63 (7): 2631–44. Дои:10.1093 / jxb / err439. PMID 22268149.
- ^ Хименес, C; Капассо, Дж. М.; Эдельштейн, CL; Ривард, CJ; Люсия, S; Breusegem, S; Берл, Т; Сеговия, М. (2009). «Различные способы смерти: способы гибели клеток одноклеточного хлорофита Dunaliella viridis, подвергающегося различным стрессам окружающей среды, опосредованы каспазоподобной активностью DEVDase». Журнал экспериментальной ботаники. 60 (3): 815–28. Дои:10.1093 / jxb / ern330. ЧВК 2652065. PMID 19251986.