Брахитерапия простаты - Prostate brachytherapy
| Брахитерапия простаты | |
|---|---|
 Рисунок 1. Одноцепочечные семена для брахитерапии, показывающие относительные размеры семян и игл, используемых для введения. | |
| МКБ-9-СМ | 92.27 |
| MedlinePlus | 007385 |
Брахитерапия это тип лучевая терапия или лучевая терапия, предлагаемая некоторым онкологическим больным. Существует два типа брахитерапии - высокая мощность дозы (HDR) и низкая мощность дозы (LDR). Брахитерапия LDR - это тип, который чаще всего используется для лечения рак простаты; иногда это называют «имплантацией семян» или «хирургией точечного отверстия».[1]
В брахитерапии LDR крошечные радиоактивные частицы размером с рисовое зерно (см. Рисунок 1 ) имплантируются прямо в место опухоль. Эти частицы известны как «семена», и они могут быть вставлены связанными вместе, как нити, или по отдельности. Поскольку семена вставляются или имплантируются непосредственно в опухоль или очень близко к ней, они доставляют высокие дозы радиации в опухоль, не затрагивая нормальные здоровые ткани вокруг нее. Это означает, что процедура менее разрушительна, чем обычная лучевая терапия, когда радиоактивный луч доставляется извне тела и должен пройти через другие ткани, прежде чем достигнет опухоли.[2]
Помимо семян доступен новый инкапсулированный в полимер источник LDR. Исходные особенности 103Pd по всей длине устройства, содержащий полимеры с низким Z. Полимерная конструкция и линейное радиоактивное распределение этого источника создают очень однородное распределение дозы.[3]
Брахитерапия простаты LDR (имплантация семенного или линейного источника) - это проверенный метод лечения локализованного рака простаты от низкого до высокого риска (когда рак находится внутри простаты).[4][5] Под общим наркозом радиоактивные семена вводятся через тонкие иглы непосредственно в предстательная железа, так что лучевая терапия может уничтожить раковые клетки. Семена постоянно имплантируются, поэтому они остаются на месте, но постепенно становятся неактивными по мере естественного и безопасного спада радиоактивности с течением времени.[6] В отличие от традиционной хирургии, брахитерапия LDR не требует разрезов и обычно проводится как дневной случай процедура. Иногда требуется госпитализация на одну ночь. Пациенты обычно быстро восстанавливаются после брахитерапии LDR, что означает, что большинство мужчин могут вернуться к работе или нормальной повседневной деятельности в течение нескольких дней. Как описано ниже, брахитерапия LDR имеет хороший профиль побочных эффектов с меньшим риском недержание мочи или же бессилие чем другие варианты лечения,[7] и становится все более популярной альтернативой серьезному хирургическому вмешательству (традиционной радикальной простатэктомии или лапароскопической (хирургия замочной скважины) радикальной простатэктомии).
Используемые изотопы включают йод 125 (период полураспада 59,4 дней) палладий 103 (период полураспада 17 дней) и цезий-131 (период полураспада 9,7 суток).[8]
Процедура



Когда проводится брахитерапия простаты LDR (имплантация семян или полимерных источников), УЗИ зонд вставляется в задний проход (прямая кишка ), а изображения с этого зонда используются для оценки размера и формы простата. Это делается для того, чтобы врач мог определить, как лучше всего ввести правильную дозу облучения для каждого пациента. Затем семена вставляются в точные места, указанные в начале процедуры. Обычно это занимает 1-2 часа.[9] Хирургический разрез не требуется; вместо этого радиоактивные семена вводятся в предстательную железу с помощью игл, которые проходят через кожу между мошонка и прямая кишка ( промежность ), а ультразвуковой датчик используется для точного определения их окончательного положения. Иглы помещаются в целевые положения, и от 70 до 150 семян помещается в простату. Затем иглы удаляются. фигура 2 показано устройство в виде сетки, используемое для ввода игл в область промежности; координаты или «привязки карты» на этой сетке или шаблоне используются для определения точных позиций в простате, где должны быть помещены семена. Рисунок 3 показывает, как семена расположены для нацеливания на опухоль. Врач использует ультразвук и рентгеновские снимки, чтобы убедиться, что семена находятся в нужном месте. Специальная компьютерная программа используется, чтобы убедиться, что предстательная железа полностью покрыта нужной дозой радиации (см. Рисунок 4 ), чтобы убедиться, что все раковые клетки, присутствующие в простате, полностью вылечены.
Оказавшись на месте, семена или источники медленно начинают испускать излучение. Пока источники активны, пациент должен соблюдать некоторые основные меры предосторожности. Путешествие и общение со взрослыми - это нормально; однако в течение первых двух месяцев после имплантации семян маленькие дети и беременные женщины не должны находиться в прямом контакте с пациентом в течение продолжительного времени - например, дети не должны сидеть на коленях пациента в течение длительного времени. Половой акт можно возобновить через несколько недель. В очень редких случаях при эякуляции семя может быть выброшено из семени; если это действительно происходит, то обычно это происходит в первые несколько эякуляций, поэтому рекомендуется использовать презерватив в первые два или три раза после брахитерапии LDR.[10]
Обычно пациенты могут вернуться к нормальной деятельности и работать в течение нескольких дней. Они должны ожидать, что их будут осматривать через четыре-шесть недель, затем каждые три месяца в течение года, от шести месяцев до пяти лет, а затем ежегодно.[9][10]
Показания
Брахитерапия простаты LDR (имплантация семян или источника полимера) рекомендуется в качестве лечения для пациентов, у которых рак находится на ранней стадии (стадии рака от T1 до T2) и который не распространился за пределы простаты (локализованное заболевание).[10][11] Врачи используют комбинацию таких факторов, как стадия и степень рака, уровень ПСА, оценка Глисона и тесты потока мочи / опорожнения мочевого пузыря, чтобы помочь им решить, подходит ли пациент для брахитерапии LDR. Пациенты должны спросить своих врачей о результатах этих различных тестов и о том, как они влияют на тип лечения, которое им может быть предложено.[10][11] Брахитерапия LDR в сочетании с дистанционной лучевой терапией также может быть рекомендована пациентам с более поздними стадиями рака и более высоким уровнем ПСА и баллом Глисона.[10]
Риски и преимущества
С момента своего появления в середине 1980-х годов брахитерапия простаты (имплантация семян или полимерных источников) стала хорошо зарекомендовавшим себя вариантом лечения пациентов с ранними локализованными заболеваниями. Только в США этим методом лечатся более 50 000 подходящих пациентов с раком простаты в год.[12] Осведомленность об этом выборе метода лечения теперь распространилась на другие части мира, и этот метод широко используется и быстро растет. В Великобритании брахитерапия простаты проводится в большинстве онкологических центров, и тысячи пациентов прошли лечение.[13]
Клинические преимущества
Было показано, что брахитерапия простаты LDR (имплантация семян или источника полимера) сама по себе очень эффективна для лечения рака простаты на ранних стадиях.[14] Показатель выживаемости без повышения среднего уровня ПСА после брахитерапии LDR аналогичен показателю, достигнутому при дистанционной лучевой терапии и радикальной простатэктомии.[4] Однако брахитерапия LDR имеет более низкий риск некоторых осложнений, связанных с этими другими вариантами лечения.[7]
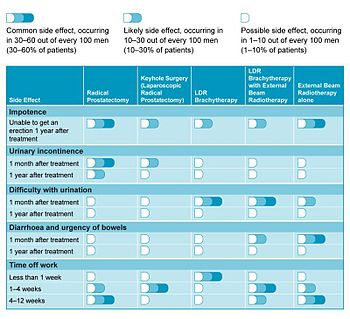
Побочные эффекты
Брахитерапия простаты LDR (имплантация семян или источников полимера) - очень эффективное лечение локализованного рака от низкого до высокого риска, при котором пациенты быстро возвращаются к нормальной деятельности.[15] Несмотря на то, что пациенты могут испытывать проблемы с мочеиспусканием в течение первых 6 месяцев или около того после имплантации, они обычно проходят, и длительные проблемы возникают редко и возникают только у 1-2% пациентов.[16] Эти осложнения включают:
- Проблемы с мочеиспусканием могут включать: недержание мочи, в основном стрессовое недержание мочи или же позывное недержание мочи, трудности с мочеиспускание, и задержка мочи. Согласно обзору, опубликованному в 2002 г. [17], в долгосрочной перспективе - значительные обструктивные симптомы или стойкая задержка мочи, требующие ТУРП встречались у 0-8,7% пациентов. Недержание мочи было обнаружено почти у 19% пациентов, которым имплантировали ранее имплантат. ТУРП Однако у тех, кто это сделал, процент был намного выше (до 86%). Стрессовое недержание мочи можно рассматривать как результат прямого повреждения наружный сфинктер уретры что является результатом излучения. Лечение может включать изменение образа жизни, тренировку мочевого пузыря и использование прокладок при недержании. Хирургическое лечение у тех, у кого начальная терапия неэффективна, может включать в себя использование уретральный слинг или искусственный мочевой сфинктер.
- Проблемы с кишечником. Некоторые пациенты (менее 10%) сообщают об увеличении проблем с кишечником (диарея или позывы к дефекации), но, опять же, это обычно проходит без дальнейшего лечения.[18] Лучевой проктит может быть обнаружен у 0,5 - 21,4% пациентов, получавших брахитерапию простаты из-за близости простаты и толстой кишки со значительным повреждением (свищ ) встречается у 1–2,4% пациентов.
- Эректильная дисфункция (трудности с достижением и / или сохранением эрекции; импотенция) - еще один побочный эффект, связанный с некоторыми хирургическими и нехирургическими методами лечения рака простаты. Проблема составляет от 25 до 50% мужчин, получающих брахитерапию простаты, что меньше, чем у мужчин, получающих стандартную терапию. внешнее лучевое излучение [19]. В течение 3 лет не у многих мужчин наблюдается значительное улучшение потенции, а иногда цифры могут ухудшаться. [20]. Варианты лечения включают использование лекарств (например, виагра и Сиалис ), внутрикавернозные инъекции, вакуумное сужающее устройство, или имплантаты полового члена [19].
В исследовании 2006 года, посвященном качеству жизни пациентов, брахитерапия LDR выгодно отличалась от других вариантов лечения.[18] Таблица 1 суммирует наиболее распространенные побочные эффекты, связанные с каждой формой лечения, и то, как они могут повлиять на выздоровление пациента.
Смотрите также
Рекомендации
- ^ Сковронек, Януш (2013). «Брахитерапия с низкой или высокой мощностью дозы в лечении рака простаты - между вариантами». Журнал современной брахитерапии. 5 (1): 33–41. Дои:10.5114 / jcb.2013.34342. ЧВК 3635047. PMID 23634153.
- ^ Ван Лимберген, Эрик; Столяр, Майкл; Ван дер Когель, Альберт; Дёрр, Вольфганг. «Радиобиология брахитерапии LDR, HDR, PDR и VLDR». В Ван Лимбергене, Эрик; Пёттер, Ричард; Хоскин, Питер; Балтас, Димос (ред.). Справочник GEC-ESTRO по брахитерапии. Брюссель: ESTRO.
- ^ Ривард, Марк Дж .; Рид, Джошуа Л .; ДеВерд, Ларри А. (01.01.2014). «Струны 103Pd: оценка Монте-Карло нового подхода к проектированию источников для брахитерапии». Медицинская физика. 41 (1): 011716. Bibcode:2014MedPh..41a1716R. Дои:10.1118/1.4856015. ISSN 0094-2405. PMID 24387508.
- ^ а б Купелян П.А., Поттерс Л., Хунтия Д. и др. (2004). «Радикальная простатэктомия, дистанционная лучевая терапия менее 72 Гр, дистанционная лучевая терапия ≥72 Гр, постоянная имплантация семян или комбинированная лучевая терапия семенами / дистанционным лучевым излучением для рака простаты стадии T1-T2». Международный журнал радиационной онкологии, биологии, физики. 58 (1): 25–33. Дои:10.1016 / S0360-3016 (03) 00784-3. PMID 14697417.
- ^ Поттерс Л., Моргенштерн С., Калугару Е. и др. (2005). «12-летние результаты постоянной брахитерапии простаты у пациентов с клинически локализованным раком простаты». Журнал урологии. 173 (5): 1562–1566. Дои:10.1097 / 01.ju.0000154633.73092.8e. PMID 15821486.
- ^ Американское общество брахитерапии: www.americanbrachytherapy.org
- ^ а б Франк С.Дж., Пистерс Л.Л., Дэвис Дж. И др. (2007). «Оценка качества жизни после радикальной простатэктомии, дистанционной лучевой терапии высокой дозой и имплантации йода для брахитерапии в качестве монотерапии локализованного рака простаты». Журнал урологии. 177 (6): 2151–2156. Дои:10.1016 / j.juro.2007.01.134. PMID 17509305.
- ^ Лемуан, Ив; Канер, Алессандра (11 сентября 2009 г.). Лучевая терапия и брахитерапия. ISBN 9789048130955.
- ^ а б Салембье С., Лаваньини П., Никерс П. и др. (2007). «Опухоль и целевые объемы в постоянной брахитерапии простаты: дополнение к рекомендациям ESTRO / EAU / EORTC по брахитерапии простаты». Лучевая терапия и онкология. 83 (1): 3–10. Дои:10.1016 / j.radonc.2007.01.014. PMID 17321620.
- ^ а б c d е Эш Д., Флинн А., Баттерман Дж. И др. (2000). «Рекомендации ESTRO / EAU / EORTC по постоянной имплантации семян при локализованном раке простаты». Лучевая терапия и онкология. 57 (3): 315–321. Дои:10.1016 / s0167-8140 (00) 00306-6. PMID 11104892.
- ^ а б Национальный институт клинического совершенства. Диагностика и лечение рака простаты (2008 г.). Клинические рекомендации NICE 58. Лондон: Национальный институт клинического совершенства.
- ^ а б Консультативная группа по брахитерапии простаты: www.prostatebrachytherapyinfo.net
- ^ Стюарт, A.J .; Дринкуотер, К.Дж .; Laing, R.W .; Nobes, J.P .; Локк, И. (июнь 2015 г.). "Аудит брахитерапии простаты Королевским колледжем радиологов в 2012 году". Клиническая онкология. 27 (6): 330–336. Дои:10.1016 / j.clon.2015.02.005. PMID 25727645.
- ^ Khaksar SJ, Laing RW, Henderson A, et al. (2006). «Биохимические (простатоспецифический антиген) безрецидивная выживаемость и токсичность после 125I Брахитерапия простаты с низкой мощностью дозы ". BJU International. 98 (6): 1210–1215. Дои:10.1111 / j.1464-410x.2006.06520.x. PMID 17034501.
- ^ Langley SE, Laing R. Брахитерапия простаты достигла совершеннолетия: обзор техники и результатов. BJU International 2002; 89: 241–249.
- ^ Crook J, Fleshner N, Roberts C, Pond G. Долгосрочные мочевые последствия после брахитерапии простаты 125 йодом. Журнал урологии 2008; 179: 141–146.
- ^ Stone, N. N .; Сток, Р. Г. (2002-04-01). «Осложнения после постоянной брахитерапии простаты». Европейская урология. 41 (4): 427–433. Дои:10.1016 / S0302-2838 (02) 00019-2. ISSN 0302-2838.
- ^ а б Бурон, Екатерина; Ле Вю, Беатрис; Коссе, Жан-Марк; Помье, Паскаль; Пайфферт, Дидье; Деланнес, Мартина; Флам, Тьерри; Гериф, Стефан; Салем, Наджи; Шовейн, Лоран; Ливартовский, Ален (март 2007 г.). «Брахитерапия в сравнении с простатэктомией при локализованном раке простаты: результаты французского многоцентрового проспективного медико-экономического исследования». Международный журнал радиационной онкологии * Биология * Физика. 67 (3): 812–822. Дои:10.1016 / j.ijrobp.2006.10.011. PMID 17293235.
- ^ а б «Эректильная дисфункция после рака простаты». www.hopkinsmedicine.org. Получено 2020-04-01.
- ^ «Эректильная дисфункция после рака простаты». www.hopkinsmedicine.org. Получено 2020-04-01.
внешняя ссылка
- Американское общество брахитерапии (США)
- Канадская сеть рака простаты (Канада)
- Национальная коалиция рака простаты (США)
- Консультативная группа по брахитерапии простаты (Великобритания)
- Благотворительная организация по борьбе с раком простаты (Великобритания)
- Фонд рака простаты (США)
- Институт рака простаты (США)
- Простата Великобритания (Великобритания)
