Термодинамическая температура - Thermodynamic temperature
| Термодинамика | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Классический Тепловой двигатель Карно | ||||||||||||
| ||||||||||||
| ||||||||||||
Эта статья должна быть обновлено. Причина такова: он должен отражать 2019 новое определение базовых единиц СИ, который вступил в силу 20 мая 2019 г. (Январь 2020) |
Термодинамическая температура абсолютная мера температура и является одним из основных параметров термодинамика.
Термодинамическая температура определяется третий закон термодинамики в котором теоретически самая низкая температура является нулевой или нулевой точкой. На этой точке, абсолютный ноль, частицы, составляющие иметь значение имеют минимальное движение и не могут стать холоднее.[1][2] в квантово-механический описание, материя при абсолютном нуле находится в своем основное состояние, что является его самым низким энергия. Термодинамическую температуру также часто называют абсолютная температурапо двум причинам: первая, предложенная Кельвин, что это не зависит от свойств конкретного материала; во-вторых, он относится к абсолютному нулю согласно свойствам идеального газа.
В Международная система единиц указывает конкретную шкалу термодинамической температуры. Он использует кельвин шкалу для измерения и выбирает тройная точка воды при 273,16 К в качестве основной точки крепления. Другие весы использовались исторически. В Шкала Ренкина, используя степень Фаренгейт как единичный интервал, все еще используется как часть Английские инженерные подразделения в США в некоторых инженерных областях. ИТС-90 дает практические средства оценки термодинамической температуры с очень высокой степенью точности.
Грубо говоря, температура тела в состоянии покоя является мерой среднего значения энергии поступательных, колебательных и вращательных движений составляющих материальных частиц, таких как молекулы, атомы, и субатомные частицы. Полное разнообразие этих кинетических движений вместе с потенциальными энергиями частиц, а также иногда с некоторыми другими типами энергии частиц, находящихся в равновесии с ними, составляет общую внутренняя энергия вещества. Внутреннюю энергию в общих чертах называют высокая температура энергия или тепловая энергия в условиях, когда нет работай воздействует на субстанцию своим окружением или субстанцию с окружением. Внутренняя энергия может храниться в веществе различными способами, каждый из которых представляет собой «степень свободы». В состоянии равновесия каждая степень свободы будет иметь в среднем одинаковую энергию: куда это Постоянная Больцмана, если эта степень свободы не находится в квантовом режиме. Внутренние степени свободы (вращение, вибрация и т. Д.) Могут находиться в квантовом режиме при комнатной температуре, но поступательные степени свободы будут в классическом режиме, за исключением чрезвычайно низких температур (доли Кельвина), и можно сказать что для большинства ситуаций термодинамическая температура определяется средней поступательной кинетической энергией частиц.
Обзор
Температура является мерой случайных субмикроскопических движений и колебаний частиц, составляющих иметь значение. Эти предложения составляют внутренняя энергия вещества. В частности, термодинамическая температура любого объемного количества вещества является мерой средней кинетической энергии на классическую (то есть неквантовую) степень свободы составляющих ее частиц. «Поступательные движения» почти всегда в классическом режиме. Поступательные движения - это обычные движения всего тела в трехмерное пространство в котором частицы движутся и обмениваются энергией при столкновениях. Рисунок 1 ниже показано поступательное движение в газах; Рисунок 4 ниже показано поступательное движение в твердых телах. Термодинамические температуры ноль точка, абсолютный ноль, - это температура, при которой частицы, составляющие материю, максимально близки к полному покою; то есть у них есть минимальный движение, сохраняя только квантово-механический движение.[3] Нулевая кинетическая энергия остается в веществе при абсолютном нуле (см. Тепловая энергия при абсолютном нуле, ниже).
Во всем научном мире, где измерения проводятся в SI единиц, термодинамическая температура измеряется в кельвины (символ: K). Однако во многих областях инженерии в США термодинамическая температура измеряется с помощью Шкала Ренкина.
К международное соглашение, Единица кельвин и его масштаб определяются двумя точками: абсолютным нулем и тройная точка из Венская стандартная средняя океанская вода (вода с указанной смесью изотопов водорода и кислорода). Абсолютный ноль, минимально возможная температура, определяется как равная 0 К. и −273.15 ° C. В тройная точка воды определяется как 273,16 K и 0,01 ° С. Это определение делает три вещи:
- Он фиксирует величину единицы кельвина как равную 1 части на 273,16 частей разницы между абсолютным нулем и тройной точкой воды;
- Он устанавливает, что один кельвин имеет ту же величину, что и приращение на один градус Цельсия шкала; и
- Он устанавливает, что разница между нулевыми точками двух шкал составляет ровно 273,15 кельвина (0 K = -273,15 ° C и 273,16 K = 0,01 ° C).
Температуры, выраженные в кельвинах, переводятся в градусы Ренкина путем умножения на 1,8 (Т/ ° R = 1,8 К / ° R ×Т/ К). Температуры, выраженные в градусах Ренкина, переводятся в градусы Кельвина путем деления на 1,8 (Т/ K =Т/ ° R ÷ 1,8 K / ° R).
Практическая реализация
Хотя шкала Кельвина и Цельсия определяется с использованием абсолютного нуля (0 K) и тройной точки воды (273,16 K и 0,01 ° C), непрактично использовать это определение при температурах, которые сильно отличаются от тройной точки воды. ИТС-90 затем разрабатывается так, чтобы максимально точно представить термодинамическую температуру во всем ее диапазоне. Требуется много различных конструкций термометров, чтобы охватить весь диапазон. К ним относятся термометры давления паров гелия, термометры газообразного гелия, стандартные платиновые термометры сопротивления (известные как SPRT, PRT или Platinum RTD) и термометры монохроматического излучения.
Для некоторых типов термометров связь между наблюдаемым свойством (например, длиной ртутного столба) и температурой близка к линейной, поэтому для большинства целей достаточно линейной шкалы без калибровки по точкам. Для других требуется калибровочная кривая или уравнение. Ртутный термометр, изобретенный до понимания термодинамической температуры, первоначально определенный шкала температур; из-за его линейности показания хорошо коррелировали с истинной температурой, то есть "ртутная" шкала температур была близка к истинной шкале.
Взаимосвязь температуры, движения, теплопроводности и тепловой энергии

Природа кинетической энергии, поступательного движения и температуры
Термодинамическая температура - это мера средней энергии поступательного, колебательного и вращательного движений иметь значение составляющие частицы (молекулы, атомы, и субатомные частицы ). Полное разнообразие этих кинетических движений вместе с потенциальными энергиями частиц, а также иногда с некоторыми другими типами энергии частиц, находящимися в равновесии с ними, вносят свой вклад в общую внутренняя энергия (свободно, тепловая энергия ) вещества. Таким образом, внутренняя энергия может храниться в веществе различными способами (степенями свободы). Когда степени свободы находятся в классическом режиме («разморожены»), температура очень просто связана со средней энергией этих степеней свободы в состоянии равновесия. Три поступательные степени свободы размораживаются, за исключением самых низких температур, и их кинетическая энергия просто связана с термодинамической температурой в самом широком диапазоне. В теплоемкость, который связывает подвод тепла и изменение температуры, обсуждается ниже.
Связь кинетической энергии, массы и скорости определяется формулой Ek = 1/2мв2.[4] Соответственно, частицы с одной единицей массы, движущиеся с одной единицей скорости, имеют точно такую же кинетическую энергию и точно такую же температуру, что и частицы с четырехкратной массой, но с половиной скорости.
За исключением квантового режима при крайне низких температурах, термодинамическая температура любого оптовое количество вещества (статистически значимое количество частиц) прямо пропорционально средней кинетической энергии определенного вида движения частицы, известного как поступательное движение. Эти простые движения в трех Икс-, у-, и z-осевое измерение пространства означает, что частицы движутся в трех пространственных степени свободы. Температуру, полученную из этой поступательной кинетической энергии, иногда называют кинетическая температура и равна термодинамической температуре в очень широком диапазоне температур. Поскольку есть три переводной степеней свободы (например, движение по Икс-, у-, и z-axes) поступательная кинетическая энергия связана с кинетической температурой следующим образом:
куда:
- средняя кинетическая энергия в джоули (J)
- kB = 1.380649×10−23 Дж / К это Постоянная Больцмана
- кинетическая температура в кельвинах (K)
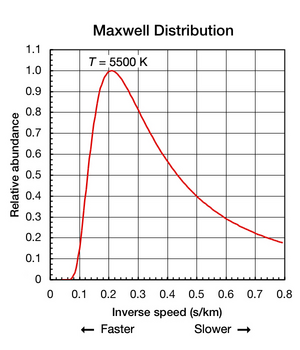
Хотя постоянная Больцмана полезна для определения средней кинетической энергии частицы, важно отметить, что даже когда вещество изолировано и находится в термодинамическое равновесие (все части имеют одинаковую температуру, и тепло не поступает внутрь и не выходит), поступательные движения отдельных атомов и молекул происходят в широком диапазоне скоростей (см. анимацию в Рисунок 1 над). В любой момент доля частиц, движущихся с заданной скоростью в этом диапазоне, определяется вероятностью, как описано Распределение Максвелла – Больцмана. График, показанный здесь в Рис. 2 показывает распределение по скоростям атомов гелия 5500 К. У них есть наиболее вероятно скорость 4,780 км / с. Однако определенная часть атомов в любой данный момент движется быстрее, тогда как другие движутся относительно медленно; некоторые на мгновение фактически остановились (вне Икс-ось вправо). Этот график использует обратная скорость для своего Икс-оси, так что форму кривой можно легко сравнить с кривыми на Рисунок 5 ниже. На обоих графиках ноль на Икс-ось представляет бесконечную температуру. Кроме того, Икс- и у-оси на обоих графиках масштабируются пропорционально.
Высокие скорости поступательного движения
Хотя для непосредственного обнаружения поступательных движений требуется очень специализированное лабораторное оборудование, возникающие в результате столкновения атомов или молекул с небольшими частицами, взвешенными в жидкость производит Броуновское движение что можно увидеть в обычный микроскоп. Поступательные движения элементарных частиц равны очень быстрый[5] и температуры, близкие к абсолютному нулю, необходимы для их непосредственного наблюдения. Например, когда ученые NIST достигли рекордной температуры холода в 700 нК (миллиардных долей кельвина) в 1994 году, они использовали оптическая решетка лазерное оборудование для адиабатически прохладно цезий атомы. Затем они выключили улавливающие лазеры и непосредственно измерили скорость атомов 7 мм в секунду, чтобы вычислить их температуру.[6] Формулы для расчета скорости и скорости поступательного движения приведены в следующей сноске.[7]
Благодаря своей внутренней структуре и гибкости молекулы могут накапливать кинетическую энергию в внутренние степени свободы которые способствуют теплоемкость.
Помимо кинетической энергии поступательного движения, существуют и другие формы внутренней энергии. Как видно на анимации справа, молекулы сложные объекты; они представляют собой совокупность атомов, и тепловое возбуждение может вызвать напряжение их внутренних химические связи тремя различными способами: вращением, длиной связки и перемещениями связующего угла. Это все виды внутренние степени свободы. Это отличает молекулы от одноатомный вещества (состоящие из отдельных атомов), такие как благородные газы гелий и аргон, которые имеют только три поступательные степени свободы. Кинетическая энергия хранится во внутренних степенях свободы молекул, что дает им внутренняя температура. Хотя эти движения называются внутренний, внешние части молекул все еще движутся - скорее, как покачивание неподвижного водный шар. Это допускает двусторонний обмен кинетической энергией между внутренними движениями и поступательными движениями при каждом столкновении молекул. Соответственно, когда у молекул отводится энергия, их кинетическая температура (температура, полученная из кинетической энергии поступательного движения) и их внутренняя температура одновременно уменьшаются в равных пропорциях. Это явление описывается теорема о равнораспределении, который утверждает, что для любого объемного количества вещества, находящегося в равновесии, кинетическая энергия движения частицы равномерно распределяется между всеми активными (т. е. незамороженными) степенями свободы, доступными частицам. Поскольку внутренняя температура молекул обычно равна их кинетической температуре, различие обычно представляет интерес только при детальном изучении непогоды.локальное термодинамическое равновесие (LTE) такие явления, как горение, то сублимация твердых тел и распространение горячих газов в частичном вакууме.
Кинетическая энергия, хранящаяся внутри молекул, заставляет вещества содержать больше внутренней энергии при любой заданной температуре и поглощать дополнительную внутреннюю энергию при заданном повышении температуры. Это связано с тем, что любая кинетическая энергия, которая в данный момент связана во внутреннем движении, в этот же момент не вносит вклад в поступательное движение молекул.[8] Эта дополнительная тепловая энергия просто увеличивает количество энергии, поглощаемой веществом при заданном повышении температуры. Это свойство известно как свойство вещества. удельная теплоемкость.
Различные молекулы поглощают разное количество тепловой энергии для каждого постепенного повышения температуры; то есть они имеют разные удельные теплоемкости. Отчасти высокая удельная теплоемкость возникает из-за того, что молекулы одних веществ обладают большим числом внутренних степеней свободы, чем другие. Например, азот, который является двухатомный молекулярный газ при стандартной температуре и давлении, имеет пять активные степени свободы при комнатной температуре: три включают поступательное движение плюс две внутренние степени свободы вращения. Поскольку две внутренние степени свободы по существу не заморожены, в соответствии с теоремой о равнораспределении азот имеет пять третей удельной теплоемкости на единицу крот (определенное количество молекул), как и одноатомные газы.[9] Другой пример бензин (видеть стол показывающий его удельную теплоемкость). Бензин может поглощать большое количество тепловой энергии на моль при небольшом изменении температуры, потому что каждая молекула состоит в среднем из 21 атома и, следовательно, имеет множество внутренних степеней свободы. Даже более крупные и сложные молекулы могут иметь десятки внутренних степеней свободы.
Распространение тепловой энергии: энтропия, фононы и подвижные электроны проводимости

Теплопроводность это диффузия тепловой энергии от горячих частей системы к холодным частям. Система может быть либо одной совокупностью, либо множеством дискретных совокупных объектов. Период, термин масса в данном контексте означает статистически значимое количество частиц (которое может быть микроскопическим). Всякий раз, когда тепловая энергия распространяется в изолированной системе, разница температур внутри системы уменьшается (и энтропия увеличивается).
Один конкретный механизм теплопроводности возникает, когда поступательное движение, движение частицы, лежащее в основе температуры, передает импульс от частицы к частице в столкновениях. В газах эти поступательные движения имеют характер, показанный на рисунке выше. рисунок 1. Как видно из этой анимации, не только импульс (тепло) распространяется по всему объему газа посредством последовательных столкновений, но и целые молекулы или атомы могут двигаться вперед на новую территорию, неся с собой свою кинетическую энергию. Следовательно, разница температур в газах очень быстро выравнивается, особенно для легких атомов или молекул; конвекция еще больше ускоряет этот процесс.[10]
Поступательное движение в твердые вещества, однако принимает форму фононы (видеть Рис. 4 справа). Фононы - это ограниченные квантованные волновые пакеты, которые распространяются со скоростью звука данного вещества. Способ взаимодействия фононов внутри твердого тела определяет множество его свойств, включая теплопроводность. В электрически изолирующих твердых телах теплопроводность на основе фононов обычно неэффективный[11] и такие твердые тела считаются теплоизоляторы (например, стекло, пластик, резина, керамика и камень). Это связано с тем, что в твердых телах атомы и молекулы заблокированы на месте относительно своих соседей и не могут свободно перемещаться.
Металлы однако, не ограничиваются только теплопроводностью на основе фононов. Тепловая энергия проходит через металлы необычайно быстро, потому что вместо прямых столкновений молекул большая часть тепловой энергии передается через очень легкие, мобильные проводимость электроны. Вот почему существует почти идеальная корреляция между металлами. теплопроводность и их электрическая проводимость.[12] Электроны проводимости наделяют металлы своей необычайной проводимостью, потому что они делокализованный (т.е.не привязаны к конкретному атому) и ведут себя скорее как своего рода квантовый газ из-за эффектов энергия нулевой точки (подробнее о ZPE см. Примечание 1 ниже). Кроме того, электроны относительно легкие и имеют только массу покоя.1⁄1836 что из протон. Это примерно такое же соотношение, как у .22 Короткий пуля (29 зерна или 1,88грамм ) по сравнению с винтовкой, которая стреляет в нее. В качестве Исаак Ньютон написал со своим третий закон движения,
Закон № 3: Все силы действуют парами, и эти две силы равны по величине и противоположны по направлению.
Однако пуля ускоряется быстрее, чем винтовка при равной силе. Поскольку кинетическая энергия увеличивается пропорционально квадрату скорости, почти вся кинетическая энергия идет в пулю, а не в винтовку, даже если обе испытывают одинаковую силу от расширяющихся пороховых газов. Таким же образом, поскольку они намного менее массивны, тепловая энергия легко переносится подвижными электронами проводимости. Кроме того, поскольку они делокализованы и очень быстрая кинетическая тепловая энергия чрезвычайно быстро проходит через металлы с большим количеством электронов проводимости.
Распространение тепловой энергии: излучение черного тела.

Тепловое излучение является побочным продуктом столкновений, возникающих при различных колебательных движениях атомов. Эти столкновения заставляют электроны атомов излучать тепловую энергию. фотоны (известный как черное тело радиация). Фотоны испускаются всякий раз, когда электрический заряд ускоряется (как это происходит при столкновении электронных облаков двух атомов). Четное отдельные молекулы с внутренней температурой выше абсолютного нуля также испускают излучение черного тела от своих атомов. В любом объеме вещества, находящегося в равновесии, фотоны черного тела излучаются в диапазоне длины волн в спектре, который имеет форму колоколообразной кривой, называемой Кривая Планка (см. график в Рис. 5 справа). Вершина кривой Планка (максимальная длина волны излучения ) находится в определенной части электромагнитный спектр в зависимости от температуры черного тела. Вещества в экстремальных условиях криогенный температуры излучают в длинных радиоволнах, тогда как чрезвычайно высокие температуры производят короткие гамма излучение (видеть Таблица общих температур ).
Излучение черного тела распространяет тепловую энергию по всему веществу, поскольку фотоны поглощаются соседними атомами, передавая при этом импульс. Фотоны черного тела также легко выходят из вещества и могут поглощаться окружающей средой; кинетическая энергия теряется в процессе.
Как установлено Закон Стефана – Больцмана, интенсивность излучения черного тела увеличивается в четвертой степени абсолютной температуры. Таким образом, черное тело при 824 К (чуть меньше светящегося тускло-красного) излучает 60 раз сияющий мощность как это происходит при 296 К (комнатная температура). Вот почему так легко можно почувствовать лучистое тепло от горячих предметов на расстоянии. При более высоких температурах, например, в лампа накаливания, излучение черного тела может быть основным механизмом, посредством которого тепловая энергия покидает систему.
Таблица термодинамических температур
Полный диапазон термодинамической шкалы температур от абсолютного нуля до абсолютно горячий, и некоторые примечательные моменты между ними показаны в таблице ниже.
| кельвин | Пиковая эмиссия длина волны[13] из фотоны черного тела | |
| Абсолютный ноль (именно по определению) | 0 К | ∞ [3] |
| Самый холодный измеренный температура [14] | 450 pK | 6,400 км |
| Один милликельвин (именно по определению) | 0,001 К | 2.897 77 м (Радио, FM диапазон )[15] |
| Космическое микроволновое фоновое излучение | 2,725 48 (57) К | 1.063 мм (пиковая длина волны) |
| Вода с тройная точка (именно по определению) | 273,16 К | 10,608.3 нм (Длинноволновый I.R. ) |
| Лампа накаливания[A] | 2500 К[B] | 1160 нм (Возле инфракрасный )[C] |
| солнце Видимая поверхность[C][16] | 5778 К | 501,5 нм (Зеленый свет ) |
| Молнии канал | 28000 К | 100 нм (Далеко Ультрафиолетовый свет) |
| Ядро Солнца | 16 МК | 0,18 нм (Рентгеновские лучи ) |
| Термоядерный взрыв (пиковая температура)[17] | 350 мк | 8.3 × 10−3 нм (Гамма излучение ) |
| Sandia National Labs ’ Z машина[D][18] | 2 GK | 1.4 × 10−3 нм (Гамма излучение) |
| Ядро массовый звезда в свой последний день[19] | 3 ГК | 1 × 10−3 нм (Гамма излучение) |
| Слияние двоичных файлов нейтрон звезда система[20] | 350 ГК | 8 × 10−6 нм (Гамма излучение) |
| Гамма-всплеск прародители[21] | 1 ТЗ | 3 × 10−6 нм (Гамма излучение) |
| Релятивистский пулеметчик Ионный коллайдер[22] | 1 ТЗ | 3 × 10−6 нм (Гамма излучение) |
| ЦЕРН Протон vs. столкновения ядер[23] | 10 тк | 3 × 10−7 нм (Гамма излучение) |
| Вселенная 5.391 × 10−44 s после Большой взрыв | 1.417 × 1032 K | 1.616 × 10−26 нм (Планковская частота)[24] |
- ^ Для истинного черного тела (которым не являются вольфрамовые нити). Излучательная способность вольфрамовых нитей выше при более коротких длинах волн, что делает их более белыми.
- ^ Значение 2500 K является приблизительным.
- ^ а б Эффективная температура фотосферы.
- ^ Для истинного черного тела (которым не было плазмы). Доминирующее излучение Z-машины происходило от 40 МК электронов (мягкое рентгеновское излучение) в плазме.
Тепло фазовых переходов

Кинетическая энергия движения частицы составляет лишь один вклад в общую тепловую энергию вещества; другой фазовые переходы, которые являются потенциальная энергия молекулярных связей, которые могут образовываться в веществе при его охлаждении (например, во время уплотнение и замораживание ). Тепловая энергия, необходимая для фазового перехода, называется скрытая теплота. Это явление легче понять, если рассмотреть его в обратном направлении: скрытая теплота - это энергия, необходимая для перемена химические связи (например, во время испарение и таяние ). Практически каждый знаком с эффектами фазовых переходов; например, пар при 100 ° C может вызвать серьезные ожоги намного быстрее, чем при 100 ° C воздух из фен. Это происходит потому, что при конденсации пара на коже в жидкую воду выделяется большое количество скрытой теплоты.
Несмотря на то, что тепловая энергия выделяется или поглощается во время фазовых переходов, чистая химические элементы, соединения, и эвтектика сплавы не проявлять никаких изменений температуры пока они им подвергаются (см. Рис.7, внизу справа). Рассмотрим один конкретный тип фазового перехода: плавление. Когда тает твердое тело, кристаллическая решетка химические связи разваливаются на части; вещество переходит из так называемого более упорядоченное состояние к менее упорядоченное состояние. В Рис.7, таяние льда показано в левом нижнем поле заголовком от синего до зеленого.

В одной конкретной термодинамической точке температура плавления (что составляет 0 ° C в широком диапазоне давлений в случае воды), все атомы или молекулы в среднем находятся на максимальном энергетическом пороге, которому их химические связи могут выдерживать, не разрываясь от решетки. Химические связи - это силы, действующие по принципу «все или ничего»: они либо держатся, либо рвутся; промежуточного состояния нет. Следовательно, когда вещество находится в точке плавления, каждый джоуль добавленной тепловой энергии разрывает связи только определенного количества его атомов или молекул,[25] превращение их в жидкость точно такой же температуры; кинетическая энергия не добавляется к поступательному движению (что и определяет температуру веществ). Эффект скорее похож на Попкорн: при определенной температуре дополнительная тепловая энергия не может сделать ядра более горячими до тех пор, пока переход (лопание) не завершится. Если процесс обратный (как при замерзании жидкости), тепловая энергия должна быть удалена из вещества.
Как указано выше, тепловая энергия, необходимая для фазового перехода, называется скрытая теплота. В конкретных случаях плавления и замораживания это называется энтальпия плавления или же теплота плавления. Если молекулярные связи в кристаллической решетке сильны, теплота плавления может быть относительно большой, обычно в диапазоне от 6 до 30 кДж на моль для воды и большинства металлических элементов.[26] Если вещество является одним из одноатомных газов (которые имеют небольшую тенденцию к образованию молекулярных связей), теплота плавления будет более скромной и составляет от 0,021 до 2,3 кДж на моль.[27] Условно говоря, фазовые переходы могут быть действительно энергетическими событиями. Чтобы полностью растопить лед при 0 ° C в воду при 0 ° C, нужно добавить примерно в 80 раз больше тепловой энергии, чем требуется для повышения температуры той же массы жидкой воды на один градус Цельсия. Соотношение металлов еще больше, обычно в пределах от 400 до 1200 раз.[28] И фазовый переход кипячение намного энергичнее, чем замораживание. Например, энергия, необходимая для полного кипения или испарения воды (то, что известно как энтальпия испарения ) примерно 540 раз что требовалось для увеличения на один градус.[29]
Значительная энтальпия испарения воды является причиной того, что кожа может обгореть так быстро, когда на ней конденсируется пар (цвет от красного к зеленому в Рис. 7над). В противоположном направлении, поэтому кожа ощущается прохладной, когда жидкая вода на ней испаряется (процесс, который происходит при температуре ниже окружающей среды). температура по влажному термометру это зависит от относительная влажность ). Высокоэнергетическая энтальпия испарения воды также является важным фактором, объясняющим, почему солнечные покрытия для бассейнов (плавающие утепленные одеяла, закрывающие бассейны когда они не используются) так эффективно сокращают расходы на отопление: они предотвращают испарение. Например, испарение всего 20 мм воды из бассейна глубиной 1,29 метра охлаждает его воду на 8,4 градуса по Цельсию (15,1 ° F).
Внутренняя энергия
Полная энергия поступательного и внутреннего движения всех частиц, включая энергию электронов проводимости, плюс потенциальная энергия фазовых переходов, плюс энергия нулевой точки[3] составляют внутренняя энергия вещества.

Внутренняя энергия при абсолютном нуле
По мере охлаждения вещества различные формы внутренней энергии и связанные с ними эффекты одновременно уменьшаются по величине: скрытая теплота доступных фазовых переходов высвобождается, когда вещество переходит из менее упорядоченного состояния в более упорядоченное состояние; уменьшаются поступательные движения атомов и молекул (уменьшается их кинетическая температура); уменьшаются внутренние движения молекул (уменьшается их внутренняя температура); электроны проводимости (если вещество является электрическим проводником) перемещаются в некотором роде помедленнее;[30] и максимальная длина волны излучения черного тела увеличивается (энергия фотонов уменьшается). Когда частицы вещества максимально близки к полному покою и сохраняют только квантово-механическое движение, вызванное ZPE, вещество имеет температуру абсолютного нуля (Т = 0).
Обратите внимание, что в то время как абсолютный ноль - это точка нулевой термодинамической температуры, а также точка, в которой частицы, составляющие материю, имеют минимальное движение, абсолютный ноль не обязательно является точкой, в которой вещество содержит нулевую тепловую энергию; нужно быть очень точным в том, что подразумевается под внутренняя энергия. Часто меняется вся фаза, может происходят в веществе, буду произошли к моменту достижения абсолютного нуля. Тем не менее, это не всегда так. В частности, Т = 0 гелий остается жидким при комнатном давлении и должно находиться под давлением не менее 25бар (2.5 МПа ) кристаллизоваться. Это связано с тем, что теплота плавления гелия (энергия, необходимая для плавления гелиевого льда) настолько мала (всего 21 джоуль на моль), что вызывающего движение эффекта нулевой энергии достаточно, чтобы предотвратить его замерзание при более низких давлениях. Только при давлении ниже 25 бар (2,5 МПа) эта скрытая тепловая энергия будет высвобождаться, когда гелий замерзает, приближаясь к абсолютному нулю. Еще одна сложность заключается в том, что многие твердые тела меняют свою кристаллическую структуру на более компактные при чрезвычайно высоких давлениях (до миллионов бар или сотен гигапаскалей). Они известны как фазовые переходы твердое тело - твердое тело при этом скрытая теплота выделяется при изменении кристаллической решетки на более термодинамически благоприятную, компактную.
Вышеупомянутые сложности делают довольно громоздкие общие утверждения относительно внутренней энергии в Т = 0 веществ. Независимо от давления, что может Можно сказать, что при абсолютном нуле все твердые тела с кристаллической решеткой с наименьшей энергией, например, с наиболее плотная упаковка (видеть Рис. 8, вверху слева) содержат минимальную внутреннюю энергию, сохраняя только то, что из-за вездесущего фона нулевой энергии.[3] [31] Можно также сказать, что для данного вещества при постоянном давлении абсолютный ноль является точкой наименьшего энтальпия (мера рабочего потенциала, учитывающая внутреннюю энергию, давление и объем).[32] Наконец, всегда верно сказать, что все Т = 0 вещества содержат нулевую кинетическую тепловую энергию.[3] [7]
Практическое применение термодинамической температуры

Термодинамическая температура полезна не только для ученых, она также может быть полезна для непрофессионалов во многих областях, связанных с газами. Выражая переменные в абсолютном выражении и применяя Закон Гей-Люссака пропорциональность температуры / давления позволяет легко решать повседневные проблемы; например, расчет того, как изменение температуры влияет на давление внутри автомобильной шины. Если шина имеет холодное манометрическое давление 200кПа, то его абсолютное давление составляет 300 кПа.[33][34][35] Комнатная температура («холодная» в терминах шин) составляет 296 K. Если температура шины на 20 ° C выше (20 кельвинов), решение рассчитывается как 316 К/296 К = На 6,8% выше термодинамическая температура и абсолютное давление; то есть абсолютное давление 320 кПа, что соответствует манометрическому давлению 220 кПа.
Определение термодинамической температуры
Термодинамическая температура определяется закон идеального газа и его последствия. Это можно связать также со вторым началом термодинамики. Можно показать, что термодинамическая температура обладает особыми свойствами и, в частности, может быть определена однозначно (с точностью до некоторого постоянного мультипликативного множителя) при рассмотрении эффективность идеализированных тепловые двигатели. Таким образом соотношение Т2/Т1 двух температурТ1 иТ2 одинаково для всех абсолютных шкал.
Строго говоря, температура системы хорошо определена, только если она равна тепловое равновесие. С микроскопической точки зрения материал находится в тепловом равновесии, если количество тепла между его отдельными частицами сокращается. Существует множество возможных шкал температуры, полученных из различных наблюдений за физическими явлениями.
Грубо говоря, разница температур определяет направление тепла между двумя системами, так что их суммарная энергия максимально распределяется между их самыми низкими возможными состояниями. Мы называем это распределение "энтропия ". Чтобы лучше понять взаимосвязь между температурой и энтропией, рассмотрим взаимосвязь между теплотой, работай и температура, показанная на Тепловой двигатель Карно. Двигатель преобразует тепло в работу, направляя температурный градиент между источником тепла с более высокой температурой, ТЧАС, и радиатор с более низкой температурой, ТCчерез газовый поршень. Работа, выполненная за цикл, равна разнице между теплом, подводимым к двигателю. ТЧАС, qЧАС, а тепло, подводимое к ТC двигателем, qC. В эффективность двигателя - это работа, разделенная на тепло, подаваемое в систему или
куда шСай это работа, выполненная за цикл. Таким образом, эффективность зависит только от qC/qЧАС.
Теорема Карно утверждает, что все реверсивные двигатели, работающие между одними и теми же тепловыми резервуарами, одинаково эффективны. Таким образом, любой реверсивный тепловой двигатель, работающий между температурами Т1 и Т2 должен иметь такую же эффективность, то есть эффективность зависит только от температуры
In addition, a reversible heat engine operating between temperatures Т1 и Т3 must have the same efficiency as one consisting of two cycles, one between Т1 and another (intermediate) temperature Т2, and the second between Т2 иТ3. If this were not the case, then energy (in the form of Q) will be wasted or gained, resulting in different overall efficiencies every time a cycle is split into component cycles; clearly a cycle can be composed of any number of smaller cycles.
With this understanding of Q1, Q2 и Q3, mathematically,
But the first function is НЕТ функция Т2, therefore the product of the final two functions ДОЛЖЕН result in the removal of Т2 as a variable. The only way is therefore to define the function f as follows:
и
так что
i.e. The ratio of heat exchanged is a function of the respective temperatures at which they occur. We can choose any monotonic function for our ; it is a matter of convenience and convention that we choose . Choosing then один fixed reference temperature (i.e. triple point of water), we establish the thermodynamic temperature scale.
Such a definition coincides with that of the ideal gas derivation; also it is this определение of the thermodynamic temperature that enables us to represent the Carnot efficiency in terms of ТЧАС и ТC, and hence derive that the (complete) Carnot cycle is isentropic:
Substituting this back into our first formula for efficiency yields a relationship in terms of temperature:
Notice that for ТC=0 the efficiency is 100% and that efficiency becomes greater than 100% for ТC<0, which cases are unrealistic. Subtracting the right hand side of Equation 4 from the middle portion and rearranging gives
where the negative sign indicates heat ejected from the system. The generalization of this equation is Теорема Клаузиуса, which suggests the existence of a state function S (i.e., a function which depends only on the state of the system, not on how it reached that state) defined (up to an additive constant) by
where the subscript indicates heat transfer in a reversible process. Функция S соответствует энтропия of the system, mentioned previously, and the change of S around any cycle is zero (as is necessary for any state function). Equation 5 can be rearranged to get an alternative definition for temperature in terms of entropy and heat (to avoid logic loop, we should first define энтропия through statistical mechanics):
For a system in which the entropy S это функция S(E) of its energy E, the thermodynamic temperature Т is therefore given by
so that the reciprocal of the thermodynamic temperature is the rate of increase of entropy with energy.
История
- Ca. 485 BC: Парменид in his treatise "On Nature" postulated the existence of primum frigidum, a hypothetical elementary substance source of all cooling or cold in the world.[36]
- 1702–1703: Guillaume Amontons (1663–1705) published two papers that may be used to credit him as being the first researcher to deduce the existence of a fundamental (thermodynamic) temperature scale featuring an absolute zero. He made the discovery while endeavoring to improve upon the air thermometers in use at the time. His J-tube thermometers comprised a mercury column that was supported by a fixed mass of air entrapped within the sensing portion of the thermometer. In thermodynamic terms, his thermometers relied upon the volume / temperature relationship of gas under constant pressure. His measurements of the boiling point of water and the melting point of ice showed that regardless of the mass of air trapped inside his thermometers or the weight of mercury the air was supporting, the reduction in air volume at the ice point was always the same ratio. This observation led him to posit that a sufficient reduction in temperature would reduce the air volume to zero. In fact, his calculations projected that absolute zero was equivalent to −240 °C—only 33.15 degrees short of the true value of −273.15 °C.
- 1742: Андерс Цельсий (1701–1744) created a "backwards" version of the modern Celsius temperature scale. In Celsius's original scale, zero represented the boiling point of water and 100 represented the melting point of ice. In his paper Observations of two persistent degrees on a thermometer, he recounted his experiments showing that ice's melting point was effectively unaffected by pressure. He also determined with remarkable precision how water's boiling point varied as a function of atmospheric pressure. He proposed that zero on his temperature scale (water's boiling point) would be calibrated at the mean barometric pressure at mean sea level.
- 1744: Coincident with the death of Anders Celsius, the famous botanist Карл Линней (1707–1778) effectively reversed[37] Celsius's scale upon receipt of his first thermometer featuring a scale where zero represented the melting point of ice and 100 represented water's boiling point. The custom-made linnaeus-thermometer, for use in his greenhouses, was made by Daniel Ekström, Sweden's leading maker of scientific instruments at the time. For the next 204 years, the scientific and thermometry communities worldwide referred to this scale as the шкала Цельсия. Temperatures on the centigrade scale were often reported simply as градусы or, when greater specificity was desired, degrees centigrade. The symbol for temperature values on this scale was °C (in several formats over the years). Потому что срок по Цельсию was also the French-language name for a unit of angular measurement (one-hundredth of a right angle) and had a similar connotation in other languages, the term "сотая степень " was used when very precise, unambiguous language was required by international standards bodies such as the Международное бюро мер и весов (Bureau international des poids et mesures) (BIPM). The 9th CGPM (Генеральная конференция по мерам и весам (Conférence générale des poids et mesures) and the CIPM (Международный комитет мер и весов (Comité international des poids et mesures) formally adopted[38] градус Цельсия (symbol: °C) in 1948.[39]
- 1777: В его книге Pyrometrie (Berlin: Haude & Spener, 1779) completed four months before his death, Иоганн Генрих Ламберт (1728–1777), sometimes incorrectly referred to as Joseph Lambert, proposed an absolute temperature scale based on the pressure/temperature relationship of a fixed volume of gas. This is distinct from the volume/temperature relationship of gas under constant pressure that Guillaume Amontons discovered 75 years earlier. Lambert stated that absolute zero was the point where a simple straight-line extrapolation reached zero gas pressure and was equal to −270 °C.
- Circa 1787: Notwithstanding the work of Guillaume Amontons 85 years earlier, Жак Александр Сезар Шарль (1746–1823) is often credited with discovering, but not publishing, that the volume of a gas under constant pressure is proportional to its absolute temperature. Созданная им формула была V1/Т1 = V2/Т2.
- 1802: Жозеф Луи Гей-Люссак (1778–1850) published work (acknowledging the unpublished lab notes of Jacques Charles fifteen years earlier) describing how the volume of gas under constant pressure changes linearly with its absolute (thermodynamic) temperature. Такое поведение называется Закон Чарльза и является одним из газовые законы. His are the first known formulas to use the number 273 for the expansion coefficient of gas relative to the melting point of ice (indicating that absolute zero was equivalent to −273 °C).
- 1848: Уильям Томсон, (1824–1907) also known as Lord Kelvin, wrote in his paper, On an Absolute Thermometric Scale, of the need for a scale whereby infinite cold (absolute zero) was the scale's null point, and which used the degree Celsius for its unit increment. Like Gay-Lussac, Thomson calculated that absolute zero was equivalent to −273 °C on the air thermometers of the time. This absolute scale is known today as the kelvin thermodynamic temperature scale. It's noteworthy that Thomson's value of −273 was actually derived from 0.00366, which was the accepted expansion coefficient of gas per degree Celsius relative to the ice point. The inverse of −0.00366 expressed to five significant digits is −273.22 °C which is remarkably close to the true value of −273.15 °C.
- 1859: Маккорн Ренкин (1820–1872) proposed a thermodynamic temperature scale similar to William Thomson's but which used the degree Фаренгейт for its unit increment. This absolute scale is known today as the Ренкин thermodynamic temperature scale.
- 1877–1884: Людвиг Больцманн (1844–1906) made major contributions to thermodynamics through an understanding of the role that particle kinetics and black body radiation played. His name is now attached to several of the formulas used today in thermodynamics.
- Circa 1930s: Gas thermometry experiments carefully calibrated to the melting point of ice and boiling point of water showed that absolute zero was equivalent to −273.15 °C.
- 1948: Resolution 3 of the 9th CGPM (Conférence Générale des Poids et Mesures, also known as the Генеральная конференция по мерам и весам ) fixed the triple point of water at precisely 0.01 °C. At this time, the triple point still had no formal definition for its equivalent kelvin value, which the resolution declared "will be fixed at a later date". The implication is that если the value of absolute zero measured in the 1930s was truly −273.15 °C, then the triple point of water (0.01 °C) was equivalent to 273.16 K. Additionally, both the CIPM (Comité international des poids et mesures, also known as the International Committee for Weights and Measures) and the CGPM formally adopted название Цельсия для градус Цельсия и Шкала температуры Цельсия. [39]
- 1954: Resolution 3 of the 10th CGPM gave the kelvin scale its modern definition by choosing the triple point of water as its second defining point[требуется разъяснение ] and assigned it a temperature of precisely 273.16 kelvins (what was actually written 273.16 градусы Кельвина в то время). This, in combination with Resolution 3 of the 9th CGPM, had the effect of defining absolute zero as being precisely zero kelvins and −273.15 °C.
- 1967/1968: Resolution 3 of the 13th CGPM renamed the unit increment of thermodynamic temperature кельвин, symbol K, replacing degree absolute, symbol °K. Further, feeling it useful to more explicitly define the magnitude of the unit increment, the 13th CGPM also decided in Resolution 4 that "The kelvin, unit of thermodynamic temperature, is the fraction 1/273.16 of the thermodynamic temperature of the triple point of water".
- 2005: The CIPM (Comité International des Poids et Mesures, also known as the Международный комитет мер и весов ) affirmed that for the purposes of delineating the temperature of the triple point of water, the definition of the kelvin thermodynamic temperature scale would refer to water having an isotopic composition defined as being precisely equal to the nominal specification of Венская стандартная средняя океанская вода.
- 2019: In November 2018, the 26th General Conference on Weights and Measures (CGPM) changed the definition of the Kelvin by fixing the Boltzmann constant to 1.380649×10−23 when expressed in the unit J/K. This change (and other changes in the definition of SI units) was made effective on the 144th anniversary of the Metre Convention, 20 May 2019.
Смотрите также
- Absolute hot
- Абсолютный ноль
- Планковская температура
- Hagedorn temperature
- Адиабатический процесс
- Black-body
- Кипячение
- Постоянная Больцмана
- Броуновское движение
- Тепловой двигатель Карно
- Химическая связь
- Конденсация
- Конвекция
- Степени свободы
- Делокализованный электрон
- Распространение
- Упругое столкновение
- Электрон
- Энергия
- Эффективность преобразования энергии
- Энтальпия
- Энтропия
- Equipartition theorem
- Испарение
- Фаренгейт
- Первый закон термодинамики
- Замораживание
- Газовые законы
- Высокая температура
- Теплопроводность
- Heat engine
- Тепловая смерть вселенной
- Внутренняя энергия
- International System of Quantities
- ITS-90
- Закон идеального газа
- Джоуль
- Кельвин
- Кинетическая энергия
- Скрытая теплота
- Законы термодинамики
- Распределение Максвелла – Больцмана
- Melting
- Крот
- Молекула
- По порядку величины (температура)
- Фаза перехода
- Фонон
- Planck's law of black-body radiation
- Потенциальная энергия
- Quantum mechanics:
- Шкала Ренкина
- Удельная теплоемкость
- Стандартное изменение энтальпии плавления
- Стандартное изменение энтальпии испарения
- Закон Стефана – Больцмана
- Сублимация
- Температура
- Формулы преобразования температуры
- Теплопроводность
- Тепловое излучение
- Термодинамическая бета
- Thermodynamic equations
- Термодинамическое равновесие
- Термодинамика
- Thermodynamics Category (list of articles)
- Хронология технологии тепловых двигателей
- Хронология технологий измерения температуры и давления
- Тройная точка
- Универсальная газовая постоянная
- Венская стандартная средняя океанская вода (VSMOW)
- Wien's displacement law
- Work (Mechanical)
- Работа (термодинамика)
- Нулевая энергия
Примечания
- In the following notes, wherever numeric equalities are shown in concise form, Такие как 1.85487(14)×1043, the two digits between the parentheses denotes the неуверенность at 1-σ (1 стандартное отклонение, 68% confidence level) in the two least significant digits of the значимое.
- ^ Rankine, W. J. M., "A manual of the steam engine and other prime movers", Richard Griffin and Co., London (1859), p. 306–307.
- ^ Уильям Томсон, первый барон Кельвин, "Heat", Adam and Charles Black, Edinburgh (1880), p. 39.
- ^ а б c d е While scientists are achieving temperatures ever closer to абсолютный ноль, they can not fully achieve a state of нуль температура. However, even if scientists could remove все kinetic thermal energy from matter, quantum mechanical zero-point energy (ZPE) causes particle motion that can never be eliminated. Энциклопедия Britannica Online defines zero-point energy as the "vibrational energy that molecules retain even at the absolute zero of temperature". ZPE is the result of all-pervasive energy fields in the vacuum between the fundamental particles of nature; it is responsible for the Эффект Казимира and other phenomena. Видеть Zero Point Energy and Zero Point Field. Смотрите также Solid Helium В архиве 2008-02-12 в Wayback Machine by the University of Alberta's Department of Physics to learn more about ZPE's effect on Bose–Einstein condensates гелия.
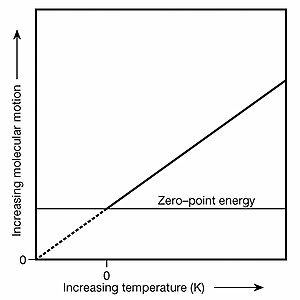 Absolute zero's relationship to zero-point energy
Absolute zero's relationship to zero-point energyAlthough absolute zero (Т=0) is not a state of zero molecular motion, it являетсяthe point of zero temperature and, in accordance with the Boltzmann constant, is also the point of zero particle kinetic energy and zero kinetic velocity. To understand how atoms can have zero kinetic velocity and simultaneously be vibrating due to ZPE, consider the following thought experiment: two Т=0 helium atoms in zero gravity are carefully positioned and observed to have an average separation of 620 вечера between them (a gap of ten atomic diameters). It's an "average" separation because ZPE causes them to jostle about their fixed positions. Then one atom is given a kinetic kick of precisely 83 yoctokelvins (1 yK = 1×10−24 K). This is done in a way that directs this atom's velocity vector at the other atom. With 83 yK of kinetic energy between them, the 620 pm gap through their common барицентр would close at a rate of 719 pm/s and they would collide after 0.862 second. This is the same speed as shown in the рисунок 1 animation above. Before being given the kinetic kick, both Т=0 atoms had zero kinetic energy and zero kinetic velocity because they could persist indefinitely in that state and relative orientation even though both were being jostled by ZPE. В Т=0, no kinetic energy is available for transfer to other systems. The Boltzmann constant and its related formulas describe the realm of particle kinetics and velocity vectors whereas ZPE is an energy field that jostles particles in ways described by the mathematics of quantum mechanics. In atomic and molecular collisions in gases, ZPE introduces a degree of хаос, i.e., unpredictability, to rebound kinetics; it is as likely that there will be меньше ZPE-induced particle motion after a given collision as более. This random nature of ZPE is why it has no net effect upon either the pressure or volume of any bulk quantity (a statistically significant quantity of particles) of Т>0 K gases. Однако в Т=0 конденсированное вещество; e.g., solids and liquids, ZPE causes inter-atomic jostling where atoms would otherwise be perfectly stationary. Inasmuch as the real-world effects that ZPE has on substances can vary as one alters a thermodynamic system (for example, due to ZPE, helium won't freeze unless under a pressure of at least 25бар or 2.5 МПа ), ZPE is very much a form of thermal energy and may properly be included when tallying a substance's internal energy.
Note too that absolute zero serves as the baseline atop which термодинамика и это уравнения are founded because they deal with the exchange of thermal energy between "systems" (a plurality of particles and fields modeled as an average). Accordingly, one may examine ZPE-induced particle motion в a system that is at absolute zero but there can never be a net outflow of thermal energy from such a system. Also, the peak emittance wavelength of black-body radiation shifts to infinity at absolute zero; indeed, a peak no longer exists and black-body photons can no longer escape. Because of ZPE, however, виртуальный photons are still emitted at Т= 0. Such photons are called "virtual" because they can't be intercepted and observed. Furthermore, this zero-point radiation имеет уникальный zero-point spectrum. However, even though a Т=0 system emits zero-point radiation, no net heat flow Q out of such a system can occur because if the surrounding environment is at a temperature greater than Т=0, heat will flow inward, and if the surrounding environment is at Т=0, there will be an equal flux of ZP radiation both inward and outward. A similar Q equilibrium exists at Т=0 with the ZPE-induced spontaneous emission of photons (which is more properly called a стимулированный emission in this context). The graph at upper right illustrates the relationship of absolute zero to zero-point energy. The graph also helps in the understanding of how zero-point energy got its name: it is the vibrational energy matter retains at the zero-kelvin point. Derivation of the classical electromagnetic zero-point radiation spectrum via a classical thermodynamic operation involving van der Waals forces, Daniel C. Cole, Physical Review A, 42 (1990) 1847.
- ^ At non-релятивистский temperatures of less than about 30 GK, классическая механика are sufficient to calculate the velocity of particles. At 30 GK, individual neutrons (the constituent of neutron stars and one of the few materials in the universe with temperatures in this range) have a 1.0042 γ (gamma or Фактор Лоренца ). Thus, the classic Newtonian formula for kinetic energy is in error less than half a percent for temperatures less than 30 GK.
- ^ Even room–temperature air has an average molecular translational скорость (not vector-isolated velocity) of 1822 km/hour. This is relatively fast for something the size of a molecule considering there are roughly 2.42×1016 of them crowded into a single cubic millimeter. Assumptions: Average molecular weight of wet air = 28.838 g/mol and Т = 296.15 K. Assumption's primary variables: An altitude of 194 meters above mean sea level (the world–wide median altitude of human habitation), an indoor temperature of 23 °C, a dewpoint of 9 °C (40.85% relative humidity), and 760мм рт. ст. (101.325 kPa) sea level–corrected barometric pressure.
- ^ Adiabatic Cooling of Cesium to 700 nK in an Optical Lattice, A. Kastberg и другие., Physical Review Letters 74 (1995) 1542 Дои:10.1103/PhysRevLett.74.1542. It's noteworthy that a record cold temperature of 450pK in a Bose–Einstein condensate of sodium atoms (achieved by A. E. Leanhardt и другие.. из Массачусетский технологический институт ) equates to an average vector-isolated atom velocity of 0.4 mm/s and an average atom speed of 0.7 mm/s.
- ^ а б The rate of translational motion of atoms and molecules is calculated based on thermodynamic temperature as follows:
- is the vector-isolated mean velocity of translational particle motion in m/s
- kB это Постоянная Больцмана = 1.3806504(24)×10−23 Дж / К
- Т is the thermodynamic temperature in kelvins
- м is the molecular mass of substance in kilograms
- is the mean speed of translational particle motion in m/s
- ^ The internal degrees of freedom of molecules cause their external surfaces to vibrate and can also produce overall spinning motions (what can be likened to the jiggling and spinning of an otherwise stationary water balloon). If one examines a Один molecule as it impacts a containers' wall, some of the kinetic energy borne in the molecule's internal degrees of freedom can constructively add to its translational motion during the instant of the collision and extra kinetic energy will be transferred into the container's wall. This would induce an extra, localized, impulse-like contribution to the average pressure on the container. However, since the internal motions of molecules are random, they have an equal probability of destructively interfering with translational motion during a collision with a container's walls or another molecule. Averaged across any bulk quantity of a gas, the internal thermal motions of molecules have zero net effect upon the temperature, pressure, or volume of a gas. Molecules' internal degrees of freedom simply provide additional locations where internal energy is stored. This is precisely why molecular-based gases have greater specific heat capacity than monatomic gases (where additional thermal energy must be added to achieve a given temperature rise).
- ^ When measured at constant-volume since different amounts of work must be performed if measured at constant-pressure. Nitrogen's CvЧАС (100 kPa, 20 °C) equals 20.8 J mol−1 K−1 vs. the monatomic gases, which equal 12.4717 J mol−1 K−1. Цитаты: W.H. Freeman's Физическая химия, Part 3: Change (422 kB PDF, here В архиве 2007-09-27 в Архив-Это ), Exercise 21.20b, p. 787. Also Университет штата Джорджия Molar Specific Heats of Gases.
- ^ В скорость at which thermal energy equalizes throughout the volume of a gas is very rapid. However, since gases have extremely low density relative to solids, the высокая температура поток (the thermal power passing per area) through gases is comparatively low. This is why the dead-air spaces in multi-pane windows have insulating qualities.
- ^ Алмаз is a notable exception. Highly quantized modes of phonon vibration occur in its rigid crystal lattice. Therefore, not only does diamond have exceptionally бедные удельная теплоемкость, it also has exceptionally высоко теплопроводность.
- ^ Correlation is 752 (W⋅m−1⋅K−1)/(MS⋅cm), σ = 81, through a 7:1 range in conductivity. Value and standard deviation based on data for Ag, Cu, Au, Al, Ca, Be, Mg, Rh, Ir, Zn, Co, Ni, Os, Fe, Pa, Pt, and Sn. Citation: Data from CRC Справочник по химии и физике, 1st Student Edition and эта ссылка to Web Elements' home page.
- ^ В cited emission wavelengths are for true black bodies in equilibrium. In this table, only the sun so qualifies. CODATA 2006 recommended value of 2.897 7685(51) × 10−3 m K used for Wien displacement law constant б.
- ^ А record cold temperature of 450 ±80 pK in a Bose–Einstein condensate (BEC) of sodium atoms was achieved in 2003 by researchers at Массачусетский технологический институт. Цитата: Cooling Bose–Einstein Condensates Below 500 Picokelvin, A. E. Leanhardt и другие., Science 301, 12 Sept. 2003, Pg. 1515. It’s noteworthy that this record’s peak emittance black-body wavelength of 6,400 kilometers is roughly the radius of Earth.
- ^ В peak emittance wavelength of 2.897 77 m is a frequency of 103.456 MHz
- ^ Измерение was made in 2002 and has an uncertainty of ±3 kelvins. А 1989 measurement produced a value of 5777 ±2.5 K. Citation: Overview of the Sun (Chapter 1 lecture notes on Solar Physics by Division of Theoretical Physics, Dept. of Physical Sciences, University of Helsinki). Download paper (252 kB PDF В архиве 2014-08-23 at the Wayback Machine )
- ^ В 350 MK value is the maximum peak fusion fuel temperature in a thermonuclear weapon of the Teller–Ulam configuration (commonly known as a “hydrogen bomb”). Peak temperatures in Gadget-style fission bomb cores (commonly known as an “atomic bomb”) are in the range of 50 to 100 MK. Цитата: Nuclear Weapons Frequently Asked Questions, 3.2.5 Matter At High Temperatures. Link to relevant Web page. All referenced data was compiled from publicly available sources.
- ^ Вершина горы temperature for a bulk quantity of matter was achieved by a pulsed-power machine used in fusion physics experiments. The term “bulk quantity” draws a distinction from collisions in particle accelerators wherein high “temperature” applies only to the debris from two subatomic particles or nuclei at any given instant. The >2 GK temperature was achieved over a period of about ten nanoseconds during “shot Z1137.” In fact, the iron and manganese ions in the plasma averaged 3.58 ±0.41 GK (309 ±35 keV) for 3 ns (ns 112 through 115). Цитата: Ion Viscous Heating in a Magnetohydrodynamically Unstable Z Pinch at Over 2 × 109 Кельвин, M. G. Haines и другие., Physical Review Letters 96, Issue 7, id. 075003. Link to Sandia’s news release. В архиве 2006-07-02 at the Wayback Machine
- ^ Основной temperature of a high–mass (>8–11 solar masses) star after it leaves the главная последовательность на Диаграмма Герцшпрунга – Рассела and begins the альфа-процесс (which lasts one day) of fusing silicon–28 into heavier elements in the following steps: sulfur–32 → argon–36 → calcium–40 → titanium–44 → chromium–48 → iron–52 → nickel–56. Within minutes of finishing the sequence, the star explodes as a Type II сверхновая звезда. Цитата: Stellar Evolution: The Life and Death of Our Luminous Neighbors (by Arthur Holland and Mark Williams of the University of Michigan). Link to Web site. More informative links can be found здесь, и здесь В архиве 2011-08-14 на Wayback Machine, and a concise treatise on stars by NASA is здесь. В архиве July 20, 2015, at the Wayback Machine
- ^ Основан on a computer model that predicted a peak internal temperature of 30 MeV (350 GK) during the merger of a binary neutron star system (which produces a gamma–ray burst). Нейтронные звезды в модели имели массу 1,2 и 1,6 солнечных соответственно, были примерно 20 км в диаметре и вращались вокруг своего барицентра (общего центра масс) с частотой около 390 Гц в течение последних нескольких миллисекунд, прежде чем полностью слились. Участок 350 GK представлял собой небольшой объем, расположенный в развивающемся общем ядре пары, и варьировался от примерно 1 до 7 км в поперечнике в течение примерно 5 мс. Представьте себе два объекта размером с город невообразимой плотности, вращающиеся вокруг друг друга с той же частотой, что и музыкальная нота G4 (28-я белая клавиша на фортепиано). Также примечательно, что при 350 ГК средний нейтрон имеет колебательную скорость 30% скорости света и релятивистскую массу (м) На 5% больше его массы покоя (м0). Цитата: Oechslin, R .; Янка, Х.-Т. (2006). «Образование тора при слиянии нейтронных звезд и хорошо локализованных коротких гамма-всплесках». Ежемесячные уведомления Королевского астрономического общества. 368 (4): 1489–1499. arXiv:Astro-ph / 0507099v2. Bibcode:2006МНРАС.368.1489О. Дои:10.1111 / j.1365-2966.2006.10238.x. Чтобы просмотреть сводку исследования в браузере, кликните сюда.
- ^ Новый ученый: Восемь крайностей: самая горячая вещь во вселенной, 7 марта 2011 г., в котором говорилось: «Хотя детали этого процесса в настоящее время неизвестны, он должен включать в себя огненный шар из релятивистских частиц, нагретых до температуры порядка триллиона кельвинов [с]»
- ^ Полученные результаты исследования Стефана Бате с использованием ФЕНИКС детектор на Релятивистский коллайдер тяжелых ионов в Брукхейвенская национальная лаборатория в Аптоне, Нью-Йорк, США. Бат изучал столкновения золота с золотом, дейтрон-золото и протон-протон, чтобы проверить теорию квантовой хромодинамики, теорию сильного взаимодействия, которое удерживает атомные ядра вместе. Ссылка на пресс-релиз.
- ^ Цитата: Как физики изучают частицы? В архиве 2007-10-11 на Wayback Machine к ЦЕРН.
- ^ В Планковская частота равна 1,854 87 (14) × 1043 Гц (что является обратной величиной планковского времени). Фотоны на планковской частоте имеют длину волны, равную одной планковской длине. Планковская температура 1,416 79 (11) × 1032 K соответствует расчетному б/Т = λМаксимум длина волны 2,045 31 (16) × 10−26 нм. Однако фактическая длина волны пикового излучения квантуется до планковской длины 1,616 24 (12) × 10−26 нм.
- ^ Энтальпия плавления воды (0 ° C, 101,325 кПа) равна 0.062284 эВ на молекулу, поэтому добавление одного джоуля тепловой энергии к водяному льду 0 ° C вызывает 1.0021×1020 молекулы воды оторваться от кристаллической решетки и стать жидкостью.
- ^ Энтальпия плавления воды составляет 6,0095 кДж моль.−1 K−1 (0 ° C, 101,325 кПа). Цитата: Структура воды и наука, свойства воды, энтальпия плавления, (0 ° C, 101,325 кПа) (Лондонский университет Южного берега). Ссылка на веб-сайт. Единственные металлы с энтальпиями плавления нет в диапазоне 6–30 Дж моль−1 K−1 являются (на высокой стороне): Ta, W и Re; и (со стороны низкого уровня) большинство металлов группы 1 (щелочные) плюс Ga, In, Hg, Tl, Pb и Np. Цитата: Эта ссылка на главную страницу Web Elements.
- ^ Цитирование значения ксенона: Эта ссылка к данным по ксенону WebElements (доступные значения находятся в диапазоне от 2,3 до 3,1 кДж / моль). Также следует отметить, что теплота плавления гелия, составляющая всего 0,021 кДж / моль, настолько слаба для силы связи, что энергия нулевой точки предотвращает замерзание гелия, если он не находится под давлением не менее 25 атмосфер.
- ^ CRC Справочник по химии и физике, 1-е студенческое издание и Веб-элементы.
- ^ ЧАС2Удельная теплоемкость, Cп = 0,075327 кДж моль−1 K−1 (25 ° С); Энтальпия плавления = 6,0095 кДж / моль (0 ° C, 101,325 кПа); Энтальпия испарения (жидкость) = 40,657 кДж / моль (100 ° C). Цитата: Структура воды и наука, свойства воды (Лондонский университет Южного берега). Ссылка на веб-сайт.
- ^ Подвижные электроны проводимости делокализованный, то есть не привязаны к конкретному атому и ведут себя скорее как своего рода квантовый газ из-за эффектов нулевой энергии. Следовательно, даже при абсолютном нуле электроны проводимости все еще перемещаются между атомами на Скорость Ферми около 1.6×106 РС. Кинетическая тепловая энергия увеличивает эту скорость, а также заставляет делокализованные электроны улетать дальше от ядер.
- ^ Нет другого Кристальная структура может превышать 74,048% плотности упаковки плотнейшая упаковка. Обнаруженные в природе две регулярные кристаллические решетки с такой плотностью: гексагональный плотно упакованный (HCP) и гранецентрированная кубическая (FCC). Эти регулярные решетки находятся в самом низком энергетическом состоянии. Алмаз представляет собой наиболее плотноупакованную структуру с ГЦК кристаллической решеткой. Также обратите внимание, что подходящий кристаллический химический соединенияХотя обычно они состоят из атомов разного размера, их можно рассматривать как структуры с плотнейшей упаковкой, если рассматривать их на молекулярном уровне. Одним из таких соединений является обычный минеральная известный как магний алюминий шпинель (MgAl2О4). Он имеет гранецентрированную кубическую кристаллическую решетку, и никакое изменение давления не может создать решетку с более низким энергетическим состоянием.
- ^ Почти половина из 92 природных химических элементов, которые могут замерзнуть в вакууме, также имеют плотноупакованную кристаллическую решетку. В этот набор входят бериллий, осмий, неон, и иридий (но не включает гелий) и, следовательно, имеют нулевую скрытую теплоту фазовых переходов для вклада во внутреннюю энергию (символ: U). При расчете энтальпии (формула: ЧАС = U + pV )внутренняя энергия может исключать различные источники тепловой энергии (особенно ZPE) в зависимости от характера анализа. Соответственно, все Т = 0 плотноупакованная материя в идеальном вакууме имеет минимальную или нулевую энтальпию, в зависимости от характера анализа. Использование преобразований Лежандра в химической термодинамике, Роберт А. Олберти, Pure Appl.Chem., 73 (2001) 1349.
- ^ Давление также должно быть абсолютным. Воздух все еще в шине избыточное давление 0 кПа также расширяется при нагревании. Инженеры нередко упускают из виду, что при компенсации температуры необходимо работать с абсолютным давлением. Например, ведущий производитель авиационных шин опубликовал документ о температурной компенсации давления в шинах, в формуле которого использовалось избыточное давление. Однако высокое избыточное давление (180 фунтов на кв. Дюйм; 12,4 бар; 1,24 МПа) означает, что ошибка будет довольно небольшой. В автомобильных шинах низкого давления, где манометрическое давление обычно составляет около 2 бар (200 кПа), неспособность приспособиться к абсолютному давлению приводит к значительной ошибке. Ссылочный документ: Рейтинги авиационных шин (155 кБ PDF, здесь ).
- ^ Что касается написания «манометр» по сравнению с «манометром» в контексте давления, измеряемого относительно атмосферного давления, предпочтительное написание варьируется в зависимости от страны и даже отрасли. Кроме того, часто используются оба написания в конкретная отрасль или страна. Предприятия в британских англоязычных странах обычно используют написание «манометрическое давление», чтобы отличить его от прибора для измерения давления, который в Великобритании пишется манометр. По той же причине многие крупнейшие американские производители датчиков давления и приборов используют написание избыточное давление (используемое здесь соглашение) в их официальной документации, чтобы отличить его от инструмента, который пишется манометр. (видеть Honeywell-Sensotec's Страница часто задаваемых вопросов и Fluke Corporation страница поиска продукта ).
- ^ Здесь используется разница в 100 кПа вместо значения 101,325 кПа. стандартная атмосфера. В 1982 г. Международный союз теоретической и прикладной химии (ИЮПАК) рекомендовал, чтобы для целей определения физических свойств веществ, стандартное давление (атмосферное давление) должно быть точно определено как 100 кПа (≈ 750,062 торр). Помимо того, что это круглое число, это имело очень практический эффект: относительно немного людей живут и работают именно на уровне моря; 100 кПа соответствует среднему давлению на высоте около 112 метров, что ближе к 194-метровой всемирной медианной высоте проживания людей. Для работы с особенно низким давлением или высокой точностью необходимо измерить истинное атмосферное давление. Цитирование: IUPAC.org, Золотая книга, Стандартное давление
- ^ Абсолютный ноль и покорение холода , Шахтман, Том., Mariner Books, 1999.
- ^ Краткая история измерения температуры и; Уппсальский университет (Швеция), Термометр Линнея
- ^ bipm.org
- ^ а б В соответствии с Оксфордский словарь английского языка (OED) термин «термометр Цельсия» использовался по крайней мере еще в 1797 году. Кроме того, термин «термометр Цельсия или Цельсия» снова использовался в отношении определенного типа термометра, по крайней мере, еще в 1850 году. OED также цитирует отчет 1928 года о температуре: «Моя высота была около 5800 метров, температура была 28 ° по Цельсию». Однако словари стремятся найти наиболее раннее употребление слова или термина и не являются полезным ресурсом в отношении терминологии, используемой на протяжении всей истории науки. Согласно нескольким записям д-ра Терри Куинна CBE FRS, директора BIPM (1988–2004), в том числе Температурные шкалы с первых дней термометрии до 21 века (148 КБ PDF, здесь ) а также Температура (2nd Edition / 1990 / Academic Press / 0125696817), термин Цельсия в связи со шкалой Цельсия вообще не использовалась научным сообществом или термометрией до тех пор, пока CIPM и CGPM не приняли этот термин в 1948 году. BIPM даже не знал, что градус Цельсия до этого времени использовался не в научных целях. Также примечательно, что в двенадцатитомном издании OED 1933 года даже не было упоминания слова Цельсия (но есть списки для обоих по Цельсию и сотый в контексте измерения температуры). Принятие в 1948 г. Цельсия выполнил три задачи:
- Все общие температурные шкалы будут иметь свои единицы, названные в честь кого-то, кто с ними тесно связан; а именно Кельвина, Цельсия, Фаренгейта, Реомюра и Ренкина.
- Несмотря на важный вклад Линнея, который придал шкале Цельсия ее современную форму, имя Цельсия было очевидным выбором, потому что оно начиналось с буквы C. Таким образом, символ ° C, который на протяжении веков использовался в сочетании с именем по Цельсию можно продолжать использовать и одновременно унаследовать интуитивную ассоциацию с новым именем.
- Новое название устранило двусмысленность термина по Цельсию, позволяя ссылаться исключительно на французское название единицы измерения угла.
внешняя ссылка
- Кинетическая молекулярная теория газов. Объяснение (с интерактивной анимацией) кинетического движения молекул и того, как оно влияет на материю. Дэвид Н. Блауч, Кафедра химии, Дэвидсон колледж.
- Энергия нулевой точки и поле нулевой точки. Веб-сайт с подробным объяснением множества квантовых эффектов. Бернард Хейш, из Институт Кальфизики.


















































