Электрофильные ароматические направляющие группы - Electrophilic aromatic directing groups
В электрофильное ароматическое замещение реакция, существующие заместитель группы на ароматическое кольцо повлиять на общий скорость реакции или иметь руководство влияет на позиционный изомер из товары которые сформированы. An электронодонорная группа (EDG) или же группа высвобождения электронов (ЭРГ, Z в структурных формулах) является атомом или функциональная группа который жертвует часть своего электронная плотность в сопряженная π система через резонанс (мезомерия) или индуктивные эффекты (или индукция) - называется + M или же + Я эффекты, соответственно, делая систему π более нуклеофильный.[1][2] В результате этих электронные эффекты, ароматическое кольцо к которой присоединена такая группа, с большей вероятностью будет участвовать в реакции электрофильного замещения. Поэтому EDG часто называют активация групп, хотя стерические эффекты может помешать реакции.
An электроноакцепторная группа (EWG) будет иметь противоположный эффект на нуклеофильность кольца. EWG удаляет электронную плотность из π-системы, делая ее менее реактивной в этом типе реакции,[2][3] и поэтому назвал деактивация групп.
EDG и EWG также определяют положения (относительно самих себя) в ароматическом кольце, где реакции замещения наиболее вероятны; это свойство поэтому важно в процессах органический синтез.
Группы доноров электронов обычно орто / пара директора за электрофильные ароматические замещения, в то время как электроноакцепторные группы обычно мета-директора за исключением галогены которые также орто/параграф директора, как они есть одинокие пары электронов, которые делятся с ароматическим кольцом.
Категории
Группы, отводящие электроны, обычно делятся на три уровня активирующей способности («экстремальная» категория может рассматриваться как «сильная»). Группы отвода электронов относятся к аналогичным группам. Активирующие заместители способствуют электрофильному замещению орто и параграф позиции. Слабо деактивирующие группы прямого электрофилы атаковать молекулу бензола на орто- и пара- позиции, при этом сильно и умеренно дезактивирующие группы направляют атаки на мета- позиция.[4] Речь идет не о предпочтении метапозиции, такой как пара- и ортонаправляющие функциональные группы, а скорее о нежелании орто- и параграф-позиции больше, чем они неблагоприятны мета- позиция.
Активация групп
Активирующие группы в основном являются донорами резонанса (+ M). Хотя многие из этих групп также индуктивно выводятся (–I), что является дезактивирующим эффектом, резонансный (или мезомерный) эффект почти всегда сильнее, за исключением Cl, Br и I.
| Величина активация | Имя заместителя (в приблизительном порядке активации силы) | Структура | Тип электронного эффекта | Режущий эффект |
|---|---|---|---|---|
| Экстремальный | оксидогруппа | -O− | + I, + M | орто, параграф |
| Сильный | (заменено) аминогруппы | -NH2, -NHR, -NR2 | –I, + M | |
| гидрокси и алкоксигруппы | -ОЙ, -ИЛИ ЖЕ | |||
| Умеренный | ациламидные группы | -NHCOR | ||
| ацилокси группы | -OCOR | |||
| (ди) алкилфосфино, алкилтио, и сульфгидрильные группы[5] | -PR2, -SR, -SH | + M (слабый) | ||
| Слабый | фенильная (или арильная) группа | -C6ЧАС5 | –I, + M;[6] хотя могут быть задействованы и другие взаимодействия[7] | |
| виниловая группа | -CH = CH2 | |||
| алкильные группы (например, -CH3, -C2ЧАС5) | -Р | + Я | ||
| карбоксилатная группа[8] | -CO2− | |||
| группа фтор (параграф позиция) | -F | –I, + M | параграф |
В целом резонансный эффект элементов в третий период и за его пределами относительно слаба. Это в основном из-за относительно плохого орбитальное перекрытие 3p (или более высокой) орбитали заместителя с 2p-орбиталью углерода.
Из-за более сильного резонансного и индуктивного эффекта, чем у более тяжелых галогенов, фтор является аномальным. Фактор частичной скорости электрофильного ароматического замещения на фторбензол часто больше единицы на параграф положение, что делает его активирующей группой.[9] Напротив, он умеренно деактивирован в орто и мета положений, из-за близости этих положений к электроотрицательному заместителю фтора.
Деактивация групп
В то время как все дезактивирующие группы выводятся индуктивно (–I), большинство из них также выводятся через резонанс (–M). Исключение составляют галогеновые заместители: они являются резонансными донорами (+ M). За исключением галогенидов, они мета руководящие группы.
Галогениды находятся орто, параграф руководящие группы, но в отличие от большинства орто, параграф директора, галогениды мягко деактивируют арен. Такое необычное поведение можно объяснить двумя свойствами:
- Поскольку галогены очень электроотрицательны, они вызывают индуктивное удаление (отвод электронов от атома углерода бензола).
- Поскольку галогены имеют несвязывающие электроны они могут отдавать электронную плотность через пи-связь (резонансное пожертвование).
Индуктивные и резонансные свойства конкурируют друг с другом, но резонансный эффект доминирует в целях управления участками реактивности. Например, при нитровании фтор сильно направлен на параграф позиция, потому что орто положение отключено индуктивно (86% параграф, 13% орто, 0.6% мета). С другой стороны, йод направляет орто и параграф позиции сравнительно (54% параграф и 45% орто, 1.3% мета).[10]
| Величина деактивация | Имя заместителя (в приблизительном порядке дезактивирующей силы) | Структура | Тип электронного эффекта | Режущий эффект |
|---|---|---|---|---|
| Сильный | трифторметилсульфонильная группа[11] | -ТАК2CF3 | -Я | мета |
| (заменено) группы аммония[12] | -NR3+ (R = алкил или H) | -Я | ||
| нитрогруппа | -НЕТ2 | -Я | ||
| сульфоновые кислоты и сульфонильные группы | -ТАК3ЧАС, -ТАК2р | |||
| циано группа | -C≡N | |||
| тригалогенметильные группы (самый сильный для -CF3 группа ) | -CX3 (X = F, Cl, Br, I) | -Я | ||
| Умеренный | галоформильные группы | -COX (X = Cl, Br, I) | -Я | |
| формил и ацильные группы | -CHO, -COR | |||
| карбоксил и алкоксикарбонильные группы | -CO2ЧАС, -CO2р | |||
| (заменено) аминокарбонильные группы | -CONH2, -CONHR, -CONR2 | |||
| Слабый | группа фтор (орто, мета позиции) | -F | –I, + M (орто) | орто, параграф |
| нитрозогруппа | -N = O | –I, + M (димер) или –M (мономер) | ||
| гало-группы | -Cl, -Br, -I | –I, + M (слабый) |
Воздействие различных групп на бензол
Карбонилы, сульфоновые кислоты и нитро
Из-за полного или частичного положительного заряда на элементе, непосредственно присоединенном к кольцу для каждой из этих групп, все они обладают индуктивным эффектом от умеренного до сильного электроноакцепторного действия (известный как эффект -I). Они также проявляют эффект электроноакцепторного резонанса (известный как -M эффект):

Таким образом, эти группы делают ароматическое кольцо очень бедным электронами (δ +) по сравнению с бензолом, и, следовательно, они сильно дезактивируют кольцо (т.е. реакции протекают намного медленнее в кольцах, содержащих эти группы, по сравнению с реакциями в бензоле).
Анилины, Фенолы и Эфиры (Такие как анизол )
Из-за разницы в электроотрицательности углерода и кислорода / азота будет наблюдаться небольшой эффект удаления электронов через индуктивный эффект (известный как эффект –I). Однако другой эффект, называемый резонансом, увеличивает плотность электронов в кольце (известный как эффект + M) и преобладает над индуктивным эффектом. Следовательно, в результате они являются EDG и орто/параграф директора.
Фенол является орто / пара-директором, но в присутствии основания реакция идет быстрее. Это связано с более высокой реакционной способностью фенолят-анион. Отрицательный кислород был «вынужден» придать атомам углерода электронную плотность (поскольку он имеет отрицательный заряд, он имеет дополнительный эффект + I). Даже в холодном состоянии и с нейтральными (и относительно слабыми) электрофилами реакция все равно происходит быстро.

Алкильные группы
Алкильные группы электронодонорные группы. Углерод на этом зр3 гибридизированный и менее электроотрицательны, чем те, которые зр2 гибридизированный. Они пересекаются углерод-водородные связи (или же углерод-углеродные связи в таких соединениях, как терт-бутилбензол) с кольцом p-орбитали. Следовательно, они более реактивны, чем бензол, и орто/параграф директора.
Карбоксилат
Индуктивно отрицательно заряженный карбоксилат-ион умеренно отталкивает электроны в связи, прикрепляющей ее к кольцу. Таким образом, возникает слабый электронодонорный + I эффект. Эффект -M практически равен нулю, поскольку электроноакцепторная резонансная способность карбонильной группы эффективно устраняется делокализацией отрицательного заряда аниона на кислороде. Таким образом, в целом карбоксилатная группа (в отличие от карбоксил группа) оказывает активирующее влияние.[8]

Алкиламмоний и трифторметильная группа
Эти группы обладают сильным электроноакцепторным индуктивным эффектом (-I) либо в силу их положительного заряда, либо из-за сильной электроотрицательности галогенов. Эффект резонанса отсутствует, потому что нет орбиталей или электронных пар, которые могут перекрываться с таковыми в кольце. Индуктивный эффект действует так же, как и для карбоксилат-аниона, но в противоположном направлении (т.е. он производит небольшие положительные заряды на орто и параграф позиции, но не на мета положение и это дестабилизирует Веланд промежуточный.) Следовательно, эти группы деактивируются и мета режиссура:

Галиды конкурирующие эффекты
Индукция против резонанса
Фтор в данном случае является чем-то вроде аномалии. Выше она описана как слабая электроноакцепторная группа, но это верно лишь отчасти. Верно, что фтор обладает эффектом -I, который приводит к индуктивному отводу электронов. Однако другой эффект, который играет роль, - это эффект + M, который добавляет электронную плотность обратно в бензольное кольцо (таким образом, имеет эффект, противоположный эффекту -I, но по другому механизму). Это называется мезомерный эффект (следовательно, + M), а результат для фтора таков, что эффект + M приблизительно нейтрализует эффект -I. Эффект этого для фторбензол на параграф позиция - это реактивность, которая сравнима (или даже выше) с реактивностью бензол. Поскольку индукционные эффекты сильно зависят от близости, мета и орто позиции фторбензола значительно менее реактивны, чем бензол. Таким образом, электрофильное ароматическое замещение фторбензола сильно параграф селективный.
Этот эффект -I и + M справедлив для всех галогенидов - каждый из них имеет некоторый характер отдачи и отдачи электронов. Чтобы понять, почему происходят изменения реактивности, нам необходимо рассмотреть орбитальные перекрытия происходит в каждом. В валентные орбитали фтора - это 2p-орбитали, которые одинаковы для углерода, поэтому они будут очень близки по энергии и орбитальное перекрытие будет благоприятным. Хлор имеет 3p валентные орбитали, следовательно, орбитальные энергии будут дальше друг от друга, а геометрия будет менее благоприятной, что приведет к меньшему пожертвованию для стабилизации карбокатионного промежуточного соединения, следовательно хлорбензол менее реактивен, чем фторбензол. Тем не мение, бромбензол и йодобензол примерно такие же или немного более реактивные, чем хлорбензол, потому что, хотя резонансное пожертвование еще хуже, индуктивный эффект также ослаблен из-за их более низкой электроотрицательности. Таким образом, общий порядок реакционной способности имеет U-образную форму с минимумом для хлорбензола / бромбензола (относительная скорость нитрования по сравнению с бензолом = 1 в скобках): PhF (0.18) > PhCl (0.064) ~ PhBr (0.060) < PhI (0.12).[10] Но все же все галобензолы реагирует медленнее, чем сам бензол.
Обратите внимание, что йодбензол все еще менее реактивен, чем фторбензол, потому что поляризуемость тоже играет роль. Это также может объяснить, почему фосфор в фосфанах не может передавать электронную плотность углероду через индукция (т.е. эффект + I), хотя он менее электроотрицателен, чем углерод (2,19 против 2,55, см. список электроотрицательности ) и почему йодистоводородная кислота (pKa = -10) намного кислотнее, чем плавиковая кислота (pKa = 3). (Это 1013 раз более кислый, чем плавиковая кислота)
Режущий эффект
Из-за неподеленной пары электронов галогенные группы доступны для передачи электронов. Следовательно, они поэтому орто / параграф директора.
Группа Нитрозо
Индукция
Из-за разницы в электроотрицательности углерода и азота нитрозогруппа имеет относительно сильный эффект -I, но не такой сильный, как нитрогруппа. (Положительно заряженные атомы азота на катионах алкиламмония и на нитрогруппах имеют гораздо более сильный эффект -I)
Резонанс
Нитрозогруппа имеет как + M, так и -M эффект, но -M эффект более благоприятен.
Азот имеет неподеленную пару электронов. Однако неподеленная пара его мономерной формы неблагоприятна для передачи через резонанс. Для эффекта + M доступна только димерная форма. Однако димерная форма менее устойчива в растворе. Следовательно, нитрозогруппа менее доступна для передачи электронов.
Напротив, удаляющая электронная плотность более предпочтительна: (см. Рисунок справа).

В результате нитрозогруппа является дезактиватором. Однако он может передавать бензольному кольцу электронную плотность во время Веланд промежуточный, что делает его по-прежнему орто / параграф директор.
Стерические эффекты
Есть 2 орто позиции, 2 мета позиции и 1 параграф положение на бензоле, когда к нему присоединена группа. Когда группа орто / пара директор с орто и параграф позиций, реагирующих с одним и тем же коэффициентом частичной ставки, мы ожидаем в два раза больше орто продукт как параграф продукт из-за этого статистического эффекта. Однако коэффициенты частичной ставки на орто и параграф позиции обычно не равны. В случае фторсодержащего заместителя, например, орто коэффициент частичной ставки намного меньше, чем параграф, из-за более сильного индуктивного эффекта вывода на орто позиция. Помимо этих эффектов, часто бывает стерический эффект, из-за повышенных стерических затруднений в орто положение, но не параграф положение, ведущее к большему количеству параграф товар.
Эффект проиллюстрирован для электрофильных ароматических замещений с алкильными заместителями с различной стерической потребностью для электрофильного ароматического нитрования.[13]
| Субстрат | толуол [-CH3] | этилбензол [-CH2CH3] | кумол [-CH (CH3)2] | терт-бутилбензол [-C (CH3)3] |
|---|---|---|---|---|
| орто товар | 58 | 45 | 30 | 16 |
| мета товар | 5 | 6 | 8 | 11 |
| параграф товар | 37 | 59 | 62 | 73 |
| орто / пара соотношение | 1.57 | 0.76 | 0.48 | 0.22 |
Метильная группа в толуоле мала и приведет к орто продукт является основным продуктом. С другой стороны, т-бутильная группа очень объемна (к одному атому углерода присоединены 3 метильные группы) и будет приводить к параграф продукт как основной. Даже с толуолом продукт имеет соотношение не 2: 1, а немного меньше. орто товар.
Направляющий эффект на несколько заместителей
Когда в кольце уже присутствуют два заместителя, место третьего заместителя будет в определенном месте. Правила для заместителя следующие:
- Когда два орто/параграф директора мета друг к другу, третий заместитель не будет находиться между ними.
 Стрелка показывает основные продукты
Стрелка показывает основные продукты - Когда оба орто/параграф директор и мета директор присутствует на кольце, место третьего заместителя зависит от орто/параграф директор.
 Стрелка показывает основные продукты
Стрелка показывает основные продукты - Когда обе группы являются одним и тем же директором, третий заместитель зависит от более сильного.
 Стрелка показывает основные продукты
Стрелка показывает основные продукты - Когда обе группы имеют одинаковый направляющий эффект и параграф друг к другу третий заместитель зависит от менее затрудненного.[14]
 Стрелка показывает основные продукты
Стрелка показывает основные продукты
Рационализация направляющих эффектов
Пока стерические эффекты являются соображениями, основной рационализацией электронодонорных и электроноакцепторных групп является их нарушение электронного распределения ароматического кольца, в основном за счет мезомерных эффектов, которые распространяются на всю сопряженную систему, для создания областей с избыточной или недостаточной π-электронной плотностью . В этом отношении полезно учитывать резонансные формы, поскольку они предоставляют удобные средства определения местоположения этих возмущений. Более конкретно, любые формальные отрицательные или положительные заряды в незначительных элементах резонанса (которые соответствуют естественной поляризации, но не обязательно подчиняются Правило октета ) отражают местоположения, имеющие больший или меньший коэффициент, соответственно, в занимаемой высокой энергии π молекулярной орбитали (ах). Атом углерода с большим коэффициентом будет предпочтительно атакован из-за более благоприятного перекрытия орбиталей с электрофилом.[15]

Возмущение сопрягающей электроноакцепторной или электронодонорной группы приводит к тому, что распределение π-электронов напоминает распределение электронодефицитного бензильного катиона или электронно-избыточного бензильного аниона, соответственно, хотя изменение электронного распределения происходит в меньшей степени, чем в эти предельные случаи. Таким образом, мы можем использовать эти простые частицы, распределение π-электронов которых можно рассчитать с помощью простых Теория Хюккеля, как модели для обоснования региохимического результата электрофильного ароматического замещения. Как видно, заселенность π-электронов на орто и параграф позиции обеднены для случая электроноакцепторной группы, вызывая мета нападение должно происходить как наименее неблагоприятный вариант. Напротив, когда присутствует электронодонорная группа, орто и параграф позиции имеют повышенную заселенность π-электронов по сравнению с мета позицию, отдавая предпочтение атаке орто и параграф позиции по мета позиция.[16]
Это именно тот результат, который можно было бы предсказать при рисовании резонансных структур. Например, в нитробензол резонансные структуры имеют положительные заряды вокруг кольцевой системы (см. рисунок ниже):
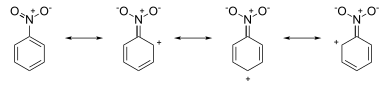
Атака происходит в мета положение, поскольку орто и параграф позиции имеют (частичные) формальные положительные заряды, которые указывают на недостаток π-электронов в этих позициях, оставляя мета позиционирует немного более высокую концентрацию электронов. С другой стороны, в анилин резонансные структуры имеют отрицательные заряды вокруг кольцевой системы (см. рисунок ниже):

Атака происходит в орто и параграф позиции, которые имеют (частичные) формальные отрицательные заряды, что указывает на избыток π-электронов в этих позициях.
Другой распространенный аргумент, который делает идентичные предсказания, рассматривает стабилизацию или дестабилизацию заместителями промежуточных продуктов Веланда в результате электрофильной атаки на орто/параграф или же мета позиции. Постулат Хаммонда затем диктует, что относительные энергии переходных состояний будут отражать различия в энергиях основного состояния промежуточных продуктов Веланда.[12][17] (Видеть электрофильное ароматическое замещение для подробностей этого аргумента.)
Селективность, наблюдаемая с EDG и EWG, была впервые описана в 1892 году и известна как Правило Крам Брауна – Гибсона.[18]
Смотрите также
Рекомендации
- ^ «Электронно-выводная группа». Иллюстрированный глоссарий органической химии. UCLA Департамент химии. Получено 16 ноября 2012.
- ^ а б Охота, Ян. «Заместительные эффекты». Университет Калгари, факультет химии. Получено 16 ноября 2012.
- ^ «Группа донорства электронов». Иллюстрированный глоссарий органической химии. UCLA Департамент химии. Получено 16 ноября 2012.
- ^ «Заместительные эффекты». www.mhhe.com. Получено 2 апреля 2015.
- ^ Джеймс, Эшенхерст (29 января 2018 г.). «Орто-, пара- и метадиректоры в электрофильном ароматическом замещении». Магистр органической химии.
- ^ Норман, Ричард О. С.; Коксон, Джеймс М. (1993). Принципы органического синтеза (3-е изд.). CRC Press. С. 353–354. ISBN 9780748761623.
- ^ Hoggett, J. G .; Moodie, R. B .; Penton, J. R .; Шофилд, К. (1971). Нитрование и ароматическая реакционная способность. Лондон: Издательство Кембриджского университета. п.200. ISBN 0521080290. OCLC 205846.
- ^ а б Смит, Эд (12 февраля 2018 г.). «ЛЕКЦИЯ 2» (PDF). Раздаточные материалы для лекций по органической химии, читаемых в Имперском колледже Лондона, химия. п. 3.
- ^ Розенталь, Джоэл; Шустер, Дэвид И. (2003-06-01). «Аномальная реакционная способность фторбензола при электрофильном ароматическом замещении и связанных с ним явлениях». Журнал химического образования. 80 (6): 679–690. Дои:10.1021 / ed080p679. ISSN 0021-9584.
- ^ а б Джонатан., Клейден (2012). Органическая химия. Гривс, Ник., Уоррен, Стюарт Г. (2-е изд.). Оксфорд: Издательство Оксфордского университета. ISBN 9780199270293. OCLC 761379371.
- ^ Эндрю, Д. Абелл; Брент, К. Наббс; Алан, Р. Баттерсби (12 февраля 1998 г.). «Синтез и свойства дезактивированных кольцом дейтерированных (гидроксиметил) пирролов». Дои:10.1021 / ja973656 +. Цитировать журнал требует
| журнал =(помощь) - ^ а б К., Воллхардт, К. Питер (29 января 2018 г.). Органическая химия: структура и функции. Schore, Neil Eric, 1948- (8-е изд.). Нью-Йорк. ISBN 9781319079451. OCLC 1007924903.
- ^ Питер, Сайкс (1979). "2" (PDF). Некоторые пути органических реакций. п. 32. ISBN 0851869998.
- ^ «12.15. Эффекты множественных множественных заместителей» (PDF). п. 7.
- ^ Э., Льюис, Дэвид (2016). Продвинутая органическая химия. Нью-Йорк. ISBN 9780199758975. OCLC 933277973.
- ^ 1935-, Флеминг, Ян (1976). Пограничные орбитали и органические химические реакции. Лондон: Уайли. ISBN 0471018201. OCLC 2048204.CS1 maint: числовые имена: список авторов (связь)
- ^ 1937-, Кэри, Фрэнсис А. (2013-01-07). Органическая химия. Джулиано, Роберт М., 1954- (Девятое изд.). Нью-Йорк, штат Нью-Йорк. ISBN 9780073402741. OCLC 822971422.CS1 maint: числовые имена: список авторов (связь)
- ^ Браун, А. Крам; Гибсон, Джон (1892). "XXX. - Правило определения того, должно ли данное монопроизводное бензола давать мета-ди-производное или смесь орто- и параграф-ди-производные " (PDF). J. Chem. Soc. 61: 367–369. Дои:10.1039 / ct8926100367.




