Альфа-цепь фибриногена - Fibrinogen alpha chain
Альфа-цепь фибриногена это белок что у людей кодируется FGA ген.
Функция
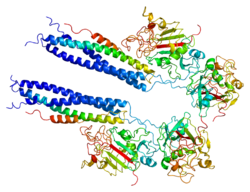
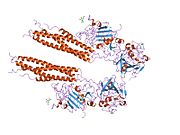
Белок, кодируемый этим геном, является альфа-компонентом фибриноген, гликопротеин крови, состоящий из трех пар неидентичных полипептидных цепей. После повреждения сосудов фибриноген расщепляется тромбином с образованием фибрина, который является наиболее распространенным компонентом сгустков крови. Кроме того, различные продукты расщепления фибриногена и фибрина регулируют адгезию и распространение клеток, проявляют сосудосуживающую и хемотаксическую активность и являются митогенами для нескольких типов клеток. Мутации в этом гене приводят к нескольким нарушениям, включая дисфибриногенемию, гипофибриногенемию, афибриногенемию и амилоидоз почек. Альтернативный сплайсинг приводит к двум изоформам, которые различаются по карбоксиконцу.[5]
Взаимодействия
Было показано, что альфа-цепь фибриногена взаимодействовать с тканевый активатор плазминогена.[6][7]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000171560 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000028001 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ген Entrez: альфа-цепь фибриногена FGA».
- ^ Цурупа Г., Медведь Л. (январь 2001 г.). «Идентификация и характеристика новых сайтов связывания tPA и плазминогена в пределах альфа C-доменов фибрина (оген)». Биохимия. 40 (3): 801–808. Дои:10.1021 / bi001789t. PMID 11170397.
- ^ Ичиносе А., Такио К., Фудзикава К. (июль 1986 г.). «Локализация сайта связывания активатора плазминогена тканевого типа с фибрином». Журнал клинических исследований. 78 (1): 163–169. Дои:10.1172 / JCI112546. ЧВК 329545. PMID 3088041.
дальнейшее чтение
- Дулитл РФ (1984). «Фибриноген и фибрин». Ежегодный обзор биохимии. 53: 195–229. Дои:10.1146 / annurev.bi.53.070184.001211. PMID 6383194.
- Галанакис Д.К. (1994). «Унаследованная дисфибриногенемия: возникающие ассоциации аномальной структуры с патологическими и непатологическими дисфункциями». Семинары по тромбозу и гемостазу. 19 (4): 386–395. Дои:10.1055 / с-2007-993290. PMID 8140431.
- Herrick S, Blanc-Brude O, Gray A, Laurent G (июль 1999 г.). «Фибриноген». Международный журнал биохимии и клеточной биологии. 31 (7): 741–746. Дои:10.1016 / S1357-2725 (99) 00032-1. PMID 10467729.
- Беннетт Дж. С. (2001). «Взаимодействие тромбоцитов с фибриногеном». Летопись Нью-Йоркской академии наук. 936: 340–354. Дои:10.1111 / j.1749-6632.2001.tb03521.x. PMID 11460491. S2CID 25431334.
- Редман CM, Ся Х (2001). «Биосинтез фибриногена. Сборка, внутриклеточная деградация и связь с синтезом и секрецией липидов». Летопись Нью-Йоркской академии наук. 936: 480–495. Дои:10.1111 / j.1749-6632.2001.tb03535.x. PMID 11460506. S2CID 31741202.
- Мацуда М., Суго Т. (август 2002 г.). «Структура и функция человеческого фибриногена, полученного из дисфибриногенов». Международный журнал гематологии. 76 Дополнение 1: 352–60. Дои:10.1007 / bf03165284. PMID 12430881. S2CID 11165476. Проверить значения даты в:
| год = / | дата = несоответствие(помощь) - Everse SJ (август 2002 г.). «Новое понимание структуры и функции фибрина (огена)». Vox Sanguinis. 83 Дополнение 1: 375–82. Дои:10.1111 / j.1423-0410.2002.tb05338.x. PMID 12617173. S2CID 21813767. Проверить значения даты в:
| год = / | дата = несоответствие(помощь) - Скотт Э.М., Ариенс Р.А., Грант П.Дж. (сентябрь 2004 г.). «Генетические и экологические детерминанты структуры и функции фибрина: актуальность для клинического заболевания». Артериосклероз, тромбоз и биология сосудов. 24 (9): 1558–1566. Дои:10.1161 / 01.ATV.0000136649.83297.bf. PMID 15217804. Проверить значения даты в:
| год = / | дата = несоответствие(помощь) - Лорд СТ (май 2007 г.). «Фибриноген и фибрин: каркасные белки в гемостазе». Текущее мнение в гематологии. 14 (3): 236–241. Дои:10.1097 / MOH.0b013e3280dce58c. PMID 17414213. S2CID 31315177.
- Коттрелл Б.А., Strong DD, Watt KW, Doolittle RF (ноябрь 1979). «Исследования аминокислотной последовательности альфа-цепи фибриногена человека. Точное расположение акцепторных сайтов сшивания». Биохимия. 18 (24): 5405–5410. Дои:10.1021 / bi00591a023. PMID 518845. Проверить значения даты в:
| год = / | дата = несоответствие(помощь) - Ватт К.В., Коттрелл Б.А., Стронг Д.Д., Дулиттл РФ (ноябрь 1979 г.). «Исследования аминокислотной последовательности альфа-цепи фибриногена человека. Перекрывающиеся последовательности, обеспечивающие полную последовательность». Биохимия. 18 (24): 5410–5416. Дои:10.1021 / bi00591a024. PMID 518846. Проверить значения даты в:
| год = / | дата = несоответствие(помощь) - Fretto LJ, Ferguson EW, Steinman HM, McKee PA (апрель 1978 г.). «Локализация акцепторных сайтов сшивки альфа-цепи фибрина человека». Журнал биологической химии. 253 (7): 2184–95. PMID 632262.
- Бломбек Б., Хессель Б., Хогг Д. (май 1976 г.). «Дисульфидные мостики в nh2 -концевой части фибриногена человека». Исследование тромбоза. 8 (5): 639–658. Дои:10.1016/0049-3848(76)90245-0. PMID 936108.
- Купман Дж., Хаверкейт Ф., Гримберген Дж., Эгбринг Р., Лорд С. Т. (октябрь 1992 г.). «Фибриноген Марбург: гомозиготный случай дисфибриногенемии, недостаток аминокислот A альфа 461-610 (Lys 461 AAA -> stop TAA)». Кровь. 80 (8): 1972–9. Дои:10.1182 / кровь.V80.8.1972.1972. PMID 1391954.
- Fu Y, Weissbach L, Plant PW, Oddoux C, Cao Y, Liang TJ, Roy SN, Redman CM, Grieninger G (декабрь 1992 г.). «Карбоксиконцевой удлиненный вариант альфа-субъединицы фибриногена человека: новый экзон, придающий выраженную гомологию бета- и гамма-субъединицам». Биохимия. 31 (48): 11968–11972. Дои:10.1021 / bi00163a002. PMID 1457396. Проверить значения даты в:
| год = / | дата = несоответствие(помощь) - Мартин П.Д., Робертсон В., Терк Д., Хубер Р., Бод В., Эдвардс Б.Ф. (апрель 1992 г.). «Структура остатков 7-16 альфа-цепи А человеческого фибриногена, связанного с бычьим тромбином при разрешении 2,3-А». Журнал биологической химии. 267 (11): 7911–20. PMID 1560020.
- Стаббс М.Т., Ошкинат Х., Майр И., Хубер Р., Англикер Х., Стоун С.Р., Боде В. (май 1992 г.). «Взаимодействие тромбина с фибриногеном. Структурная основа его специфичности». Европейский журнал биохимии / FEBS. 206 (1): 187–195. Дои:10.1111 / j.1432-1033.1992.tb16916.x. PMID 1587268.
- Маэкава Х., Ямадзуми К., Мурамацу С., Канеко М., Хирата Х., Такахаши Н., Ароча-Пинанго С.Л., Родригес С., Надь Х., Перес-Рекехо Д.Л. (июль 1992 г.). «Фибриноген Лима: гомозиготный дисфибриноген с заменой альфа-аргинина-141 на серин, связанной с дополнительным N-гликозилированием в альфа-аспарагине-139». Нарушение образования геля фибрина, но нормальная активация плазминогена, обусловленная фибрином, катализируемая активатором плазминогена тканевого типа ". Журнал клинических исследований. 90 (1): 67–76. Дои:10.1172 / JCI115857. ЧВК 443064. PMID 1634621.
- Маэкава Х., Ямадзуми К., Мурамацу С., Канеко М., Хирата Х., Такахаши Н., де Бош Н. Б., Карвахал З., Охеда А., Ароча-Пиньянго С. Л. (июнь 1991 г.). «Замена A альфа Ser-434 на N-гликозилированный Asn в дисфибриногене, фибриногене Каракас II, характеризующемся нарушением образования геля фибрина». Журнал биологической химии. 266 (18): 11575–81. PMID 1675636.
- Ву К., Чанг А.Е. (октябрь 1991 г.). «Возможная роль энтактина в гемостазе. Специфическое взаимодействие энтактина с фибриногеном A альфа и B бета цепями». Журнал биологической химии. 266 (28): 18802–7. PMID 1680863.