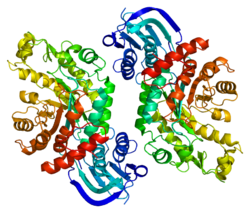
HEXB - HEXB
Бета-гексозаминидаза субъединица бета является фермент что у людей кодируется HEXB ген.[5][6][7]
Гексозаминидаза B представляет собой бета-субъединицу лизосомального фермента бета-гексозаминидазы, которая вместе с кофактором GM2 активаторным белком катализирует деградацию ганглиозида GM2 и других молекул, содержащих концевые N-ацетилгексозамины. Бета-гексозаминидаза состоит из двух субъединиц, альфа и бета, которые кодируются отдельными генами. Альфа- и бета-субъединицы бета-гексозаминидазы являются членами 20-го семейства гликозилгидролаз. Мутации в генах альфа- или бета-субъединиц приводят к накоплению ганглиозида GM2 в нейронах и нейродегенеративным нарушениям, называемым ганглиозидозами GM2. Мутации гена субъединицы бета приводят к Болезнь Сандхоффа (GM2-ганглиозидоз II типа).[7]
Структура
Ген
В HEXB ген лежит на хромосома расположение 5q13.3 и состоит из 15 экзоны, охватывающий 35-40Кб.
Протеин
HEXB состоит из 556 аминокислота остатков и весит 63111Да.
Функция
HEXB - одна из двух субъединиц, образующих β-гексозаминидаза который функционирует как гликозилгидролаза которые удаляют β-связанный невосстанавливающий концевой GalNAc или GlcNAc остатки в лизосома.[8] Неспособность HEXB приведет к дефекту β-гексозаминидазы и приведет к группе рецессивных заболеваний, называемых GM2. ганглиозидозы, характеризующийся накоплением GM2 ганглиозид.[9]
Клиническое значение
Генетические дефекты в HEXB может привести к накоплению ганглиозида GM2 в нервных тканях и двум из трех лизосомных болезней накопления, известных под общим названием ганглиозидоз GM2, из которых Болезнь Сандхоффа (дефекты в β субъединица) является наиболее изученной.[8] Пациенты обращаются с нейросоматическими проявлениями. Терапевтические эффекты трансдукции гена субъединицы Hex изучали на модельных мышах с болезнью Сандхоффа.[10] Внутрицеребровентрикулярное введение модифицированной β-гексозаминидазы B мышам в режиме Sandhoff восстановило активность β-гексозаминидазы в головном мозге и уменьшило накопление ганглиозидов GM2 в паренхиме.[11]
Взаимодействия
HEXB взаимодействует с HEXA[12] и ганглиозид.[10]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000049860 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000021665 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ О'Дауд Б.Ф., Куан Ф., Уиллард Х.Ф., Ламхонва А.М., Корнелюк Р.Г., Лоуден Дж.А., Гравел Р.А., Махуран Д.Д. (февраль 1985 г.). «Выделение клонов кДНК, кодирующих бета-субъединицу бета-гексозаминидазы человека». Труды Национальной академии наук Соединенных Штатов Америки. 82 (4): 1184–8. Дои:10.1073 / pnas.82.4.1184. ЧВК 397219. PMID 2579389.
- ^ Korneluk RG, Mahuran DJ, Neote K, Klavins MH, O'Dowd BF, Tropak M, Willard HF, Anderson MJ, Lowden JA, Gravel RA (июнь 1986). «Выделение клонов кДНК, кодирующих альфа-субъединицу бета-гексозаминидазы человека. Обширная гомология между альфа- и бета-субъединицами и исследования болезни Тея – Сакса». Журнал биологической химии. 261 (18): 8407–13. PMID 3013851.
- ^ а б «Ген Entrez: гексозаминидаза B HEXB (бета-полипептид)».
- ^ а б Bateman KS, Cherney MM, Mahuran DJ, Tropak M, James MN (март 2011 г.). «Кристаллическая структура β-гексозаминидазы B в комплексе с пириметамином, потенциальным фармакологическим шапероном». Журнал медицинской химии. 54 (5): 1421–9. Дои:10.1021 / jm101443u. ЧВК 3201983. PMID 21265544.
- ^ Соннино С, Чигорно В (сентябрь 2000 г.). «Молекулярные виды ганглиозидов, содержащие С18- и С20-сфингозин в нервных тканях млекопитающих и культурах нейрональных клеток». Biochimica et Biophysica Acta (BBA) - Обзоры биомембран. 1469 (2): 63–77. Дои:10.1016 / с0005-2736 (00) 00210-8. PMID 10998569.
- ^ а б Итакура Т., Куроки А., Ишибаши Ю., Цудзи Д., Кавасита Е., Хигашин И., Сакураба Х., Яманака С., Ито К. (август 2006 г.). «Неэффективность элиминации ганглиозидов GM2 путем переноса гена бета-субъединицы бета-гексозаминидазы лизосом человека в линию фибробластных клеток, полученную от мышей модели болезни Сандхоффа». Биологический и фармацевтический бюллетень. 29 (8): 1564–9. Дои:10.1248 / bpb.29.1564. PMID 16880605.
- ^ Мацуока К., Тамура Т., Цудзи Д., Додзоно Ю., Китакадзе К., Оно К., Сайто С., Сакураба Х., Ито К. (июнь 2011 г.). «Терапевтический потенциал интрацеребровентрикулярной замены модифицированной β-гексозаминидазы человека B при ганглиозидозе GM2». Молекулярная терапия. 19 (6): 1017–24. Дои:10.1038 / мт.2011.27. ЧВК 3129794. PMID 21487393.
- ^ Горт Л., де Олано Н., Масиас-Видаль Дж, Колл. Массачусетс (сентябрь 2012 г.). «Ганглиозидозы GM2 в Испании: анализ генов HEXA и HEXB у 34 пациентов Tay-Sachs и 14 пациентов Sandhoff». Ген. 506 (1): 25–30. Дои:10.1016 / j.gene.2012.06.080. PMID 22789865.
дальнейшее чтение
- Махуран DJ (февраль 1991 г.). «Биохимия мутаций генов HEXA и HEXB, вызывающих ганглиозидоз GM2». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1096 (2): 87–94. Дои:10.1016 / 0925-4439 (91) 90044-А. PMID 1825792.
- Махуран DJ (октябрь 1999 г.). «Биохимические последствия мутаций, вызывающих ганглиозидозы GM2». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1455 (2–3): 105–38. Дои:10.1016 / S0925-4439 (99) 00074-5. PMID 10571007.
- Гилберт Ф., Кучерлапати Р., Криган Р.П., Мурнэйн М.Дж., Дарлингтон Дж.Дж., Раддл Ф.Х. (январь 1975 г.). «Болезни Тея-Сакса и Сандхоффа: отнесение генов гексозаминидазы А и В к отдельным хромосомам человека». Труды Национальной академии наук Соединенных Штатов Америки. 72 (1): 263–7. Дои:10.1073 / pnas.72.1.263. ЧВК 432284. PMID 1054503.
- Макиннес Б., Потье М., Вакамацу Н., Меланкон С. Б., Клавинс М. Х., Цуджи С., Махуран Д. Д. (август 1992 г.). «Необычная мутация сплайсинга в гене HEXB связана с совершенно разными фенотипами у пациентов из разных расовых групп». Журнал клинических исследований. 90 (2): 306–14. Дои:10.1172 / JCI115863. ЧВК 443103. PMID 1386607.
- Bolhuis PA, Bikker H (ноябрь 1992 г.). «Делеция 5'-области в одном или двух аллелях HEXB у 15 из 30 пациентов с болезнью Сандхоффа». Генетика человека. 90 (3): 328–9. Дои:10.1007 / bf00220096. PMID 1487253. S2CID 219692.
- Вакамацу Н., Кобаяси Х, Миятаке Т., Цудзи С. (февраль 1992 г.). «Новая мутация экзона в гене бета-субъединицы бета-гексозаминидазы человека влияет на выбор 3'-сайта сплайсинга». Журнал биологической химии. 267 (4): 2406–13. PMID 1531140.
- Банерджи П., Сицилиано Л., Оливери Д., МакКейб Н. Р., Бойерс М. Дж., Хорвиц А. Л., Ли С. К., Доусон Г. (ноябрь 1991 г.). «Молекулярная основа взрослой формы дефицита бета-гексозаминидазы B с заболеванием двигательных нейронов». Сообщения о биохимических и биофизических исследованиях. 181 (1): 108–15. Дои:10.1016 / S0006-291X (05) 81388-9. PMID 1720305.
- Boose JA, Tifft CJ, Proia RL, Myerowitz R (ноябрь 1990 г.). «Синтез лизосомального фермента человека, бета-гексозаминидазы B, с использованием системы экспрессии бакуловируса». Экспрессия и очистка белков. 1 (2): 111–20. Дои:10.1016 / 1046-5928 (90) 90003-Н. PMID 1967020.
- Махуран ди-джей (апрель 1990 г.). «Характеристика человеческой плацентарной бета-гексозаминидазы I2. Протеолитические промежуточные продукты обработки гексозаминидазы А». Журнал биологической химии. 265 (12): 6794–9. PMID 2139028.
- Neote K, McInnes B, Mahuran DJ, Gravel RA (ноябрь 1990 г.). «Структура и распространение делеционной мутации Alu-типа при болезни Сандхоффа». Журнал клинических исследований. 86 (5): 1524–31. Дои:10.1172 / JCI114871. ЧВК 296899. PMID 2147027.
- Neote K, Brown CA, Mahuran DJ, Gravel RA (декабрь 1990 г.). «Инициирование трансляции в гене HEXB, кодирующем бета-субъединицу бета-гексозаминидазы человека». Журнал биологической химии. 265 (34): 20799–806. PMID 2147427.
- Длотт Б., д'Аццо А., Куон Д.В., Нойфельд Е.Ф. (октябрь 1990 г.). «Две мутации вызывают вставку интрона в мРНК и удлиненную бета-субъединицу бета-гексозаминидазы человека». Журнал биологической химии. 265 (29): 17921–7. PMID 2170400.
- Накано Т., Сузуки К. (март 1989 г.). «Генетическая причина ювенильной формы болезни Сандхоффа. Аномальное сплайсинг транскрипта бета-цепи бета-гексозаминидазы из-за точечной мутации в интроне 12». Журнал биологической химии. 264 (9): 5155–8. PMID 2522450.
- Хаббс М., Каллахан Дж., Гравел Р., Махуран Д. (июнь 1989 г.). «Аминоконцевые последовательности в про-альфа- и -бета-полипептидах лизосомальных бета-гексозаминидаз человека А и В сохраняются в зрелых изоферментах». Письма FEBS. 249 (2): 316–20. Дои:10.1016/0014-5793(89)80649-0. PMID 2525487. S2CID 83872800.
- Биккер Х., Ван ден Берг Ф.М., Вольтерман Р.А., де Вейлдер Дж.Дж., Болхуис, Пенсильвания (февраль 1989 г.). «Демонстрация ассоциированной с болезнью Сандхоффа аутосомной делеции 50 kb с помощью гель-электрофореза с инверсией поля». Генетика человека. 81 (3): 287–8. Дои:10.1007 / BF00279006. PMID 2921040. S2CID 39411971.
- Bolhuis PA, Oonk JG, Kamp PE, Ris AJ, Michalski JC, Overdijk B, Reuser AJ (январь 1987 г.). «Хранение ганглиозидов, лабильность гексозаминидазы и олигосахариды в моче при болезни Сандхоффа у взрослых». Неврология. 37 (1): 75–81. Дои:10.1212 / wnl.37.1.75. PMID 2948136. S2CID 20622020.
- Proia RL (март 1988 г.). «Ген, кодирующий бета-цепь бета-гексозаминидазы человека: обширная гомология размещения интронов в генах альфа- и бета-цепей». Труды Национальной академии наук Соединенных Штатов Америки. 85 (6): 1883–7. Дои:10.1073 / pnas.85.6.1883. ЧВК 279885. PMID 2964638.
- Махуран Д. Д., Неоте К., Клавинс М. Х., Леунг А., Гравий Р. А. (апрель 1988 г.). «Протеолитический процессинг про-альфа и про-бета предшественников бета-гексозаминидазы человека. Генерация зрелых альфа- и бета-бета-субъединиц». Журнал биологической химии. 263 (10): 4612–8. PMID 2965147.