Аденоассоциированный вирус - Adeno-associated virus
| Аденоассоциированный вирус | |
|---|---|
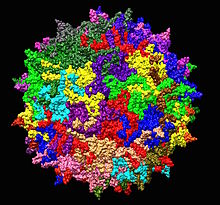 | |
| Структура аденоассоциированного вируса серотипа 2 из 1LP3. В центре показана одна пятеричная ось. | |
| Научная классификация | |
| (без рейтинга): | Вирус |
| Область: | Моноднавирия |
| Королевство: | Shotokuvirae |
| Тип: | Cossaviricota |
| Учебный класс: | Quintoviricetes |
| Заказ: | Piccovirales |
| Семья: | Parvoviridae |
| Подсемейство: | Parvovirinae |
| Род: | Депендопарвовирус |
| Вирусы включены: | |
| |
Аденоассоциированные вирусы (AAV) маленькие вирусы которые заражают людей и некоторые другие виды приматов. Они принадлежат к род Депендопарвовирус, который, в свою очередь, принадлежит семья Parvoviridae. Они маленькие (20 нм ) дефектный по репликации, вирусы без оболочки и имеют линейные одноцепочечные ДНК (оцДНК) примерно 4,8 килобазы (КБ)[нужна цитата ].
В настоящее время не известно, что AAV вызывает болезнь. Вирусы вызывают очень легкое иммунная реакция. Несколько дополнительных функций делают AAV привлекательным кандидатом для создания вирусные векторы за генная терапия,[1] и для создания модели изогенных болезней человека.[2] Генная терапия векторов использование AAV может инфицировать как делящиеся, так и покоящиеся клетки и сохраняться во внехромосомном состоянии без интеграции в геном клетки-хозяина, хотя в нативном вирусе происходит интеграция вирусных генов в геном хозяина.[3] Интеграция может быть важной для определенных приложений, но также может иметь нежелательные последствия. Недавние клинические испытания на людях с использованием AAV для генной терапии сетчатки показали обещание.[4]
История
Аденоассоциированный вирус (AAV), который ранее считался контаминантом в препаратах аденовируса, был впервые идентифицирован как зависимый парвовирус в 1960-х годах в лабораториях Боба Атчисона в Питтсбурге и Уоллеса Роу в Национальные институты здравоохранения США. Серологические исследования на людях впоследствии показали, что, несмотря на присутствие у людей, инфицированных вспомогательные вирусы например, аденовирус или вирус герпеса, сам по себе AAV не вызывает никаких заболеваний.[5]
Использование в генной терапии
Достоинства и недостатки
AAV дикого типа вызвал значительный интерес исследователей генной терапии из-за ряда особенностей. Главным из них является очевидное отсутствие патогенности вируса. Он также может инфицировать неделящиеся клетки и обладает способностью стабильно интегрироваться в геном клетки-хозяина в конкретном сайте (обозначенном AAVS1) в организме человека. хромосома 19.[6][7] Эта функция делает его несколько более предсказуемым, чем ретровирусы, которые представляют угрозу случайного внедрения и мутагенеза, который иногда сопровождается развитием рак. Геном AAV наиболее часто интегрируется в упомянутый сайт, тогда как случайные включения в геном происходят с незначительной частотой. Однако разработка AAV в качестве векторов генной терапии устранила эту интегративную способность за счет удаления представитель и колпачок от ДНК вектора. Желаемый ген вместе с промотором для управления транскрипцией гена вставляется между инвертированный терминал повторяет (ITR), которые помогают в объединитель образование в ядре после того, как одноцепочечная векторная ДНК превращается комплексами ДНК-полимеразы клетки-хозяина в двухцепочечную ДНК. Форма векторов генной терапии на основе AAV эписомальный конкатемеры в ядре клетки-хозяина. В неделящихся клетках эти конкатемеры остаются нетронутыми в течение всей жизни клетки-хозяина. В делящихся клетках ДНК AAV теряется в результате деления клеток, поскольку эписомальная ДНК не реплицируется вместе с ДНК клетки-хозяина.[8] Случайная интеграция ДНК AAV в геном хозяина обнаруживается, но происходит с очень низкой частотой.[8] AAV также очень низкие иммуногенность, по-видимому, ограничивается генерацией нейтрализующих антитела, в то время как они не вызывают четко определенного цитотоксический ответ.[9][10][11] Эта особенность, наряду с возможностью заражения покоящиеся клетки представить свое господство над аденовирусы как векторы для человека генная терапия.
Использование вируса имеет некоторые недостатки. Способность клонирования вектора относительно ограничена, и для большинства терапевтических генов требуется полная замена 4,8-килобазного генома вируса. Поэтому большие гены не подходят для использования в стандартном векторе AAV. В настоящее время изучаются варианты преодоления ограниченных возможностей кодирования.[12] ITR AAV двух геномов могут отжигаться с образованием конкатемеров «голова к хвосту», что почти удваивает емкость вектора. Вставка сайтов сплайсинга позволяет удалить ITR из транскрипта.
Из-за преимуществ специализированной генной терапии AAV исследователи создали измененную версию AAV, названную самокомплементарный аденоассоциированный вирус (scAAV). В то время как AAV упаковывает одну цепь ДНК и должен ждать, пока ее вторая цепь будет синтезирована, scAAV упаковывает две более короткие цепи, которые комплементарны друг другу. Избегая синтеза второй цепи, scAAV может экспрессироваться быстрее, хотя, как предостережение, scAAV может кодировать только половину и без того ограниченной емкости AAV.[13] Недавние сообщения предполагают, что векторы scAAV более иммуногенны, чем одноцепочечные аденовирусные векторы, вызывая более сильную активацию цитотоксические Т-лимфоциты.[14]
Считается, что гуморальный иммунитет, вызванный инфекцией дикого типа, является обычным явлением. Связанная с этим нейтрализующая активность ограничивает применимость наиболее часто используемого серотипа AAV2 в определенных приложениях. Соответственно, большинство текущих клинических испытаний включает доставку AAV2 в мозг, относительно иммунологически привилегированный орган. В головном мозге AAV2 сильно нейрон-специфичен.
Клинические испытания
По состоянию на 2019 год векторы AAV использовались в более чем 250 клинических испытаниях по всему миру, что составляет примерно 8,3% испытаний генной терапии с вирусным вектором.[15] Недавно были получены многообещающие результаты испытаний фазы 1 и фазы 2 для ряда заболеваний, включая Врожденный амавроз Лебера,[4][16][17] гемофилия,[18] хроническая сердечная недостаточность,[19] спинальная мышечная атрофия,[20] дефицит липопротеинлипазы[21], и болезнь Паркинсона.[22]
| Индикация | Ген | Путь введения | Фаза | Номер темы | Положение дел |
| Кистозный фиброз | CFTR | Легкие через аэрозоль | я | 12 | Полный |
| CFTR | Легкие через аэрозоль | II | 38 | Полный | |
| CFTR | Легкие через аэрозоль | II | 100 | Полный | |
| Гемофилия B | ИСПРАВИТЬ | Внутримышечный | я | 9 | Полный |
| ИСПРАВИТЬ | Печеночная артерия | я | 6 | Закончился | |
| Артрит | TNFR: Fc | Внутрисуставной | я | 1 | Непрерывный |
| Наследственный эмфизема | AAT | Внутримышечный | я | 12 | Непрерывный |
| Врожденный амавроз Лебера | RPE65 | Субретинальный | I – II | Несколько | Несколько текущих и завершенных |
| Возрастная дегенерация желтого пятна | sFlt-1 | Субретинальный | I – II | 24 | Непрерывный |
| Мышечная дистрофия Дюшенна | SGCA | Внутримышечный | я | 10 | Непрерывный |
| болезнь Паркинсона | GAD65, GAD67 | Внутричерепной | я | 12 | Полный[24] |
| Болезнь Канавана | AAC | Внутричерепной | я | 21 | Непрерывный |
| Болезнь Баттена | CLN2 | Внутричерепной | я | 10 | Непрерывный |
| Болезнь Альцгеймера | NGF | Внутричерепной | я | 6 | Непрерывный |
| Спинальная мышечная атрофия | SMN1 | Внутривенно и интратекально | I – III | 15 | Несколько текущих и завершенных |
| Хроническая сердечная недостаточность | SERCA2a | Внутрикоронарный | IIb | 250 | Непрерывный |
Структура
Геном, транскриптом и протеом
Геном AAV построен из одноцепочечной дезоксирибонуклеиновой кислоты (ssДНК ), с положительным или отрицательным восприятием, длина которого составляет около 4,7 килобаз. Геном состоит из ITR на обоих концах цепи ДНК и двух открытые рамки для чтения (ORF): представитель и колпачок. Первый состоит из четырех перекрывающиеся гены кодирующие белки Rep, необходимые для жизненного цикла AAV, и последний содержит перекрывающиеся нуклеотидные последовательности капсид белки: VP1, VP2 и VP3, которые взаимодействуют с образованием капсида с икосаэдрической симметрией.[25]
Последовательности ITR
В инвертированный терминальный повтор (ITR) последовательности содержат 145 оснований каждая. Они были названы так из-за их симметрии, которая, как было показано, необходима для эффективного размножения генома AAV.[26] Особенностью этих последовательностей, которая придает им это свойство, является их способность образовывать заколка для волос, что способствует так называемому самовсасыванию, что позволяет прима -независимый синтез второй цепи ДНК. Было также показано, что ITR необходимы как для интеграции ДНК AAV в геном клетки-хозяина (19-я хромосома у человека), так и для спасения от него.[27][28] а также для эффективных инкапсуляция ДНК AAV в сочетании с генерацией полностью собранной, дезоксирибонуклеаза -устойчивые частицы AAV.[29]
Что касается генной терапии, ITR кажутся единственными необходимыми последовательностями. в снг рядом с терапевтическим геном: структурный (колпачок) и упаковка (представитель) белки могут быть доставлены в транс. Исходя из этого предположения, было разработано множество методов эффективного получения рекомбинантных векторов AAV (rAAV), содержащих репортер или терапевтический ген. Однако было также опубликовано, что РМЭ - не единственные необходимые элементы. в снг для эффективной репликации и инкапсидации. Несколько исследовательских групп определили последовательность, обозначенную цис-действующий Реп-зависимый элемент (CARE) внутри кодовой последовательности представитель ген. Было показано, что CARE увеличивает репликацию и инкапсидацию, если присутствует. в снг.[30][31][32][33]
представитель ген и Rep белки
На «левой стороне» генома есть два промоутеры называемые p5 и p19, из которых две перекрывающиеся мессенджеры рибонуклеиновые кислоты (мРНК ) разной длины. Каждый из них содержит интрон который может быть либо сращенный или нет. Учитывая эти возможности, можно синтезировать четыре различных мРНК и, следовательно, четыре различных белка Rep с перекрывающимися последовательностями. Их имена обозначают их размеры в килодальтон (кДа): Rep78, Rep68, Rep52 и Rep40.[34] Rep78 и 68 могут специально связывать заколка для волос формируется ITR в акте самопримирования и расщепляется в специфической области, обозначенной конечным сайтом разрешения, внутри шпильки. Также было показано, что они необходимы для AAVS1-специфической интеграции генома AAV. Было показано, что все четыре Rep-белка связываются АТФ и владеть геликаза Мероприятия. Также было показано, что они усиливают транскрипцию с промотора p40 (упомянутого ниже), но подавляют как промоторы p5, так и p19.[28][34][35][36][37][38]
колпачок ген и белки VP
Правая сторона позитивно воспринимаемого генома AAV кодирует перекрывающиеся последовательности трех капсидных белков, VP1, VP2 и VP3, которые начинаются с одного промотора, обозначенного p40. Молекулярные массы этих белков составляют 87, 72 и 62 килодальтона соответственно.[39] Капсид AAV состоит из смеси VP1, VP2 и VP3, всего 60 мономеров, расположенных в икосаэдр симметрия в соотношении 1: 1: 10 с расчетным размером 3,9 мегадальтона.[40]В Кристальная структура белка VP3 определяли Xie, Bue, и другие.[41]

В колпачок Ген производит дополнительный неструктурный белок, называемый белком, активирующим сборку (ААР). Этот белок вырабатывается из ORF2 и необходим для процесса сборки капсида.[42] Точная функция этого белка в процессе сборки и его структура до сих пор не решены.
Все три VP транслируются с одной мРНК. После того, как эта мРНК синтезирована, ее можно сращенный двумя способами: длиннее или короче интрон могут быть вырезаны, что приведет к образованию двух пулов мРНК: пула мРНК длиной 2,3 т.п.н. и пула мРНК длиной 2,6 т.п. Обычно, особенно при наличии аденовирус, более длинный интрон является предпочтительным, поэтому мРНК длиной 2,3 т.п.н. представляет собой так называемый «основной сплайсинг». В таком виде первый Кодон AUG, из которого начинается синтез белка VP1, отключается, что приводит к снижению общего уровня синтеза белка VP1. Первый кодон AUG, который остается в основном сплайсинге, является кодоном инициации для белка VP3. Однако перед этим кодоном в той же открытой рамке считывания лежит последовательность ACG (кодирующая треонин), которая окружена оптимальным Козак контекст. Это способствует низкому уровню синтеза белка VP2, который фактически является белком VP3 с дополнительными N-концевыми остатками, как и VP1.[43][44][45][46]
Поскольку для сплайсинга предпочтительнее интрон большего размера, и поскольку в основном сплайсинге кодон ACG гораздо слабее перевод сигнал инициации, соотношение, при котором синтезируются структурные белки AAV in vivo составляет примерно 1: 1: 20, что такое же, как в зрелой вирусной частице.[47] Было показано, что уникальный фрагмент на N-конце белка VP1 обладает фосфолипаза Активность A2 (PLA2), которая, вероятно, необходима для высвобождения частиц AAV из поздних эндосомы.[48] Муралидхар и другие. сообщили, что VP2 и VP3 имеют решающее значение для правильной сборки вириона.[45] Однако совсем недавно Уоррингтон и другие. показали, что VP2 не является необходимым для полного образования вирусных частиц и эффективной инфекционности, а также представили, что VP2 может выдерживать большие вставки на своем N-конце, тогда как VP1 не может, вероятно, из-за присутствия домена PLA2.[49]
Классификация, серотипы, рецепторы и природный тропизм
Два вида AAV были признаны Международный комитет по таксономии вирусов в 2013: аденоассоциированный зависимый парвовирус А (ранее AAV-1, -2, -3 и -4) и аденоассоциированный зависимый парвовирус B (ранее AAV-5).[50][51]
До 1990-х годов практически вся биология AAV изучалась с использованием серотипа AAV 2. Однако AAV широко распространен у людей и других приматов, и несколько серотипов были выделены из различных образцов тканей. Серотипы 2, 3, 5 и 6 были обнаружены в клетках человека, серотипы AAV 1, 4 и 7–11 - в образцах нечеловеческих приматов.[52] По состоянию на 2006 год насчитывалось 11 AAV. серотипы описан, 11 числа 2004 г.[53] Капсидные белки AAV содержат 12 гипервариабельных участков поверхности, при этом наибольшая вариабельность проявляется в трехкратных проксимальных пиках, но геном парвовируса в целом представляет собой высококонсервативные гены репликации и структурные гены по всем серотипам.[52] Все известные серотипы могут инфицировать клетки из множества различных типов тканей. Тканевая специфичность определяется серотипом капсида, и псевдотипирование векторов AAV для изменения диапазона их тропизма, вероятно, будет важным для их использования в терапии.
Серотип 2
Серотип 2 (AAV2) до сих пор изучен наиболее полно.[54][55][56][57][58][59] AAV2 представляет собой естественный тропизм к скелетные мышцы,[60] нейроны,[54] гладкие мышцы сосудов клетки[61] и гепатоциты.[62]
Для AAV2 описаны три клеточных рецептора: гепарансульфат протеогликан (HSPG), аVβ5 интегрин и фактор роста фибробластов рецептор 1 (FGFR-1). Первый функционирует как первичный рецептор, в то время как последние два обладают корецепторной активностью и позволяют AAV проникать в клетку посредством рецептор-опосредованного эндоцитоз.[63][64][65] Эти результаты исследования были оспорены Цю, Ханда, и другие.[66] HSPG функционирует как первичный рецептор, хотя его изобилие в внеклеточный матрикс может собирать частицы AAV и снижать эффективность заражения.[67]
Исследования показали, что серотип 2 вируса (AAV-2) убивает раковые клетки, не нанося вреда здоровым. «Наши результаты показывают, что аденоассоциированный вирус типа 2, который инфицирует большую часть населения, но не имеет известных побочных эффектов, убивает несколько типов раковых клеток, но не влияет на здоровые клетки», - сказал Крейг Мейерс.[68] профессор иммунология и микробиология на Penn State Медицинский колледж в Пенсильвания в 2005 году.[69] Это может привести к появлению нового противоракового агента.
Другие серотипы
Хотя AAV2 является наиболее популярным серотипом в различных исследованиях на основе AAV, было показано, что другие серотипы могут быть более эффективными в качестве векторов доставки генов. Например, AAV6 намного лучше поражает эпителиальные клетки дыхательных путей,[70][71] AAV7 представляет очень высокую скорость трансдукции клеток скелетных мышц мышей (аналогично AAV1 и AAV5), AAV8 превосходно трансдуцирует гепатоциты.[72][73][74] и было показано, что AAV1 и 5 очень эффективны в доставке генов к эндотелиальным клеткам сосудов.[75] В головном мозге большинство серотипов AAV проявляют нейрональный тропизм, в то время как AAV5 также трансдуцирует астроциты.[76] AAV6, гибрид AAV1 и AAV2,[74] также демонстрирует более низкую иммуногенность, чем AAV2.[73]
Серотипы могут различаться в зависимости от рецепторов, с которыми они связаны. Например, трансдукция AAV4 и AAV5 может ингибироваться растворимыми сиаловые кислоты (разной формы для каждого из этих серотипов),[77] и было показано, что AAV5 проникает в клетки через фактор роста тромбоцитов рецептор.[78]
Синтетические серотипы
Было приложено много усилий для разработки и улучшения новых вариантов AAV как для клинических, так и для исследовательских целей. Такие модификации включают новые тропизмы, направленные на конкретные ткани, и модифицированные поверхностные остатки, чтобы избежать обнаружения иммунной системой. Помимо выбора определенных сортов рекомбинантный AAV (rAAV) для нацеливания на определенные клетки, исследователи также изучили псевдотипирование AAV, практику создания гибридов определенных штаммов AAV для достижения еще более точной цели. Гибрид создается путем взятия капсида из одного штамма и генома из другого штамма. Например, исследование с участием AAV2 / 5, гибрида с геномом AAV2 и капсидом AAV5, смогло достичь большей точности и диапазона в клетках мозга, чем AAV2, которого удалось бы достичь без гибридизации. Исследователи продолжили эксперименты с псевдотипированием, создав штаммы с гибридными капсидами. AAV-DJ имеет гибридный капсид из восьми различных штаммов AAV; как таковой, он может инфицировать различные клетки во многих областях тела - свойство, которым не обладает один штамм AAV с ограниченным тропизмом.[79] Другие усилия по разработке и улучшению новых вариантов AAV включали реконструкцию предков вирусов для создания новых векторов с улучшенными свойствами для клинического применения и изучение биологии AAV.[80]
Иммунология
AAV представляет особый интерес для генных терапевтов из-за его очевидной ограниченной способности вызывать иммунные ответы у людей, фактора, который должен положительно влиять на эффективность векторной трансдукции при одновременном снижении риска любых иммуно-ассоциированных патология.
Считается, что AAV не играет какой-либо известной роли в заболевании.[81][82]
Врожденный
В врожденный иммунный ответ на векторы AAV был охарактеризован на животных моделях. Внутривенное введение мышам вызывает временное производство провоспалительных цитокины и некоторое проникновение нейтрофилы и другие лейкоциты в печень, которая, по-видимому, связывает большой процент введенных вирусных частиц. Как уровни растворимого фактора, так и клеточная инфильтрация возвращаются к исходному уровню в течение шести часов. Напротив, более агрессивные вирусы вызывают врожденную реакцию продолжительностью 24 часа или дольше.[83]
Гуморальный
Известно, что вирус вызывает надежные гуморальный иммунитет на животных моделях и в человеческой популяции, где считается, что до 80% людей серопозитивный для AAV2. Антитела известно, что они нейтрализуют, и для применения в генной терапии они действительно влияют на эффективность трансдукции вектора через некоторые пути введения. Наряду с постоянными уровнями специфических антител к AAV, как показывают исследования с первичной бустом на животных, так и клинические испытания, B-клеточная память также сильна.[84] У серопозитивных людей циркулирующие IgG Антитела к AAV2, по-видимому, в основном состоят из подклассов IgG1 и IgG2, при этом IgG3 или IgG4 практически отсутствуют.[85]
Клеточно-опосредованный
В клеточно-опосредованный реакция на вирус и переносчики плохо изучена и в значительной степени игнорировалась в литературе еще в 2005 году.[84] Клинические испытания с использованием вектора на основе AAV2 для лечения гемофилии B, по-видимому, указывают на то, что может происходить целенаправленное разрушение трансдуцированных клеток.[86] В сочетании с данными, которые показывают, что CD8 + Т-клетки может распознавать элементы капсида AAV in vitro,[87] похоже, что может быть ответ цитотоксических Т-лимфоцитов на векторы AAV. Цитотоксические ответы предполагают участие CD4 + Т-хелперные клетки в ответ на AAV и in vitro данные исследований на людях показывают, что вирус действительно может вызывать такие ответы, включая ответы памяти как Th1, так и Th2.[85] Ряд кандидатов на стимуляцию Т-лимфоцитов эпитопы были идентифицированы в капсидном белке VP1 AAV, который может быть привлекательной мишенью для модификации капсида, если вирус будет использоваться в качестве вектора для генной терапии.[85][86]
Цикл заражения
Цикл заражения AAV состоит из нескольких этапов, от заражения клетки до образования новых инфекционных частиц:[нужна цитата ]
- привязанность к клеточная мембрана
- рецептор-опосредованный эндоцитоз
- эндосомный трафик
- убежать от позднего эндосома или же лизосома
- перевод в ядро
- непокрытие
- образование двухцепочечной репликативной формы ДНК генома AAV
- выражение представитель гены
- геном репликация
- выражение колпачок гены, синтез частиц потомства оцДНК
- сборка полного вирионы, и
- выход из инфицированной клетки.
Некоторые из этих шагов могут выглядеть по-разному в разных типах клеток, что отчасти способствует определенному и довольно ограниченному природному тропизму AAV. Репликация вируса также может варьироваться в одном типе клеток, в зависимости от текущего состояния клетки. клеточный цикл фаза.[88]
Характерной особенностью аденоассоциированного вируса является недостаточность репликации и, следовательно, его неспособность размножаться в незатронутых клетках. Аденоассоциированный вирус распространяется путем совместного инфицирования клетки вспомогательным вирусом. Первым вспомогательным вирусом, который был описан как обеспечивающий успешную генерацию новых частиц AAV, был аденовирус, от которого произошло название AAV. Затем было показано, что репликации AAV могут способствовать выбранные белки, происходящие из генома аденовируса,[89][90] другими вирусами, такими как HSV[91] или коровьей оспы, или генотоксическими агентами, такими как УФ облучение или гидроксимочевина.[92][93][94] В зависимости от наличия или отсутствия вируса-помощника жизненный цикл AAV следует либо по литическому, либо по лизогенному пути, соответственно.[95] Если есть вирус-помощник, экспрессия гена AAV активируется, позволяя вирусу реплицироваться с использованием полимеразы клетки-хозяина. Когда вирус-помощник убивает клетку-хозяина, высвобождаются новые вирионы AAV. Если вирус-помощник отсутствует, AAV проявляет лизогенное поведение. Когда AAV заражает только клетку, экспрессия его гена подавляется (AAV не реплицируется), и его геном включается в геном хозяина (в хромосому 19 человека). В редких случаях лизис может происходить без вспомогательного вируса, но обычно AAV не может реплицироваться и убивать клетку самостоятельно.[96]
Минимальный набор аденовирусных генов, необходимых для эффективной генерации дочерних частиц AAV, был обнаружен Мацуситой, Эллингером. и другие.[89] Это открытие позволило разработать новые методы получения рекомбинантных AAV, которые не требуют совместной инфекции аденовирусами AAV-продуцирующих клеток. В отсутствие вируса-помощника или генотоксических факторов ДНК AAV может либо интегрироваться в геном хозяина, либо сохраняться в эписомальный форма. В первом случае интеграция опосредуется белками Rep78 и Rep68 и требует наличия ITR, фланкирующих интегрируемую область. У мышей геном AAV сохранялся в течение длительных периодов времени в покоящихся тканях, таких как скелетные мышцы, в эписомальной форме (круглая конформация голова к хвосту).[97]
Смотрите также
- Модели изогенных заболеваний человека
- Онколитический ААВ
- Рекомбинантная геномная инженерия, опосредованная AAV
Рекомендации
- ^ Bak, Rasmus O .; Портеус, Мэтью Х. (18 июля 2017 г.). «CRISPR-опосредованная интеграция больших генных кассет с использованием донорных векторов AAV». Отчеты по ячейкам. 20 (3): 750–756. Дои:10.1016 / j.celrep.2017.06.064. ISSN 2211-1247. ЧВК 5568673. PMID 28723575.
- ^ Григер Дж. К., Самульски Р. Дж. (2005). «Аденоассоциированный вирус как вектор генной терапии: разработка вектора, производство и клиническое применение». Аденоассоциированный вирус как вектор генной терапии: разработка, производство и клиническое применение векторов. Достижения в области биохимической инженерии / биотехнологии. 99. С. 119–45. Дои:10.1007/10_005. ISBN 978-3-540-28404-8. PMID 16568890.
- ^ Дейл Д.Р., Рассел Д.В. (август 2009 г.). «Интеграция вектора аденоассоциированного вируса». Современное мнение о молекулярной терапии. 11 (4): 442–7. ЧВК 2929125. PMID 19649989.
- ^ а б Магуайр А.М., Симонелли Ф., Пирс Э.А., Пью Э.Н., Мингоцци Ф., Бенничелли Дж. И др. (Май 2008 г.). «Безопасность и эффективность переноса генов при врожденном амаврозе Лебера». Медицинский журнал Новой Англии. 358 (21): 2240–8. Дои:10.1056 / NEJMoa0802315. ЧВК 2829748. PMID 18441370.
- ^ Картер Б.Дж. (декабрь 2004 г.). «Аденоассоциированный вирус и развитие аденоассоциированных вирусных векторов: историческая перспектива». Молекулярная терапия. 10 (6): 981–9. Дои:10.1016 / j.ymthe.2004.09.011. PMID 15564130.
- ^ Котин Р.М., Синискалько М., Самульски Р.Дж., Жу XD, Хантер Л., Лафлин К.А., Маклафлин С., Музыка Н., Роччи М., Бернс К.И. (март 1990 г.). «Сайт-специфическая интеграция аденоассоциированного вируса». Труды Национальной академии наук Соединенных Штатов Америки. 87 (6): 2211–5. Bibcode:1990PNAS ... 87.2211K. Дои:10.1073 / pnas.87.6.2211. ЧВК 53656. PMID 2156265.
- ^ Суроски Р.Т., Урабе М., Годвин С.Г., Маккуистон С.А., Курцман Г.Дж., Одзава К., Нацулис Г. (октябрь 1997 г.). «Аденоассоциированные вирусные Rep-белки нацелены на последовательности ДНК в уникальный локус в геноме человека». Журнал вирусологии. 71 (10): 7951–9. Дои:10.1128 / JVI.71.10.7951-7959.1997. ЧВК 192153. PMID 9311886.
- ^ а б Дайя С., Бернс К.И. (октябрь 2008 г.). «Генная терапия с использованием аденоассоциированных вирусных векторов». Обзоры клинической микробиологии. 21 (4): 583–93. Дои:10.1128 / CMR.00008-08. ЧВК 2570152. PMID 18854481.
- ^ Чирмул Н., Проперт К., Магосин С., Цянь Ю., Цянь Р., Уилсон Дж. (Сентябрь 1999 г.). «Иммунные ответы на аденовирус и аденоассоциированный вирус у людей». Генная терапия. 6 (9): 1574–83. Дои:10.1038 / sj.gt.3300994. PMID 10490767.
- ^ Эрнандес Ю.Дж., Ван Дж., Кирнс В.Г., Лойлер С., Пуарье А., Флотт Т.Р. (октябрь 1999 г.). «Латентная аденоассоциированная вирусная инфекция вызывает гуморальный, но не клеточно-опосредованный иммунный ответ в модели приматов, отличных от человека». Журнал вирусологии. 73 (10): 8549–58. Дои:10.1128 / JVI.73.10.8549-8558.1999. ЧВК 112875. PMID 10482608.
- ^ Поннажаган С., Мукерджи П., Йодер М.С., Ван XS, Чжоу С.З., Каплан Дж., Уодсворт С., Шривастава А. (апрель 1997 г.). «Аденоассоциированный вирус 2-опосредованный перенос гена in vivo: органотропизм и экспрессия трансдуцированных последовательностей у мышей». Ген. 190 (1): 203–10. Дои:10.1016 / S0378-1119 (96) 00576-8. PMID 9185868.
- ^ Bak, Rasmus O .; Портеус, Мэтью Х. (18 июля 2017 г.). «CRISPR-опосредованная интеграция больших генных кассет с использованием донорных векторов AAV». Отчеты по ячейкам. 20 (3): 750–756. Дои:10.1016 / j.celrep.2017.06.064. ISSN 2211-1247. ЧВК 5568673. PMID 28723575.
- ^ Маккарти Д.М., Монахан П.Е., Самульски Р.Дж. (август 2001 г.). «Самокомплементарные векторы рекомбинантного аденоассоциированного вируса (scAAV) способствуют эффективной трансдукции независимо от синтеза ДНК». Генная терапия. 8 (16): 1248–54. Дои:10.1038 / sj.gt.3301514. PMID 11509958.
- ^ Роджерс Г.Л., Мартино А.Т., Золотухин И., Эртл ХК, Герцог Р.В. (январь 2014 г.). «Роль векторного генома и лежащая в основе мутация фактора IX в иммунных ответах на генную терапию AAV при гемофилии B». Журнал трансляционной медицины. 12: 25. Дои:10.1186/1479-5876-12-25. ЧВК 3904690. PMID 24460861.
- ^ «Векторы, используемые в клинических испытаниях генной терапии». Журнал генной медицины. Вайли. Декабрь 2019.
- ^ Бейнбридж Дж. В., Смит А. Дж., Баркер С. С., Робби С., Хендерсон Р., Балагган К., Вишванатан А., Холдер Г. Е., Стокман А., Тайлер Н., Петерсен-Джонс С., Бхаттачарья С. С., Трэшер А. Дж., Фицке Ф. В., Картер Б. Дж., Рубин Г. Мур А. Т., Али Р. Р. (май 2008 г.). «Влияние генной терапии на зрительную функцию при врожденном амаврозе Лебера». Медицинский журнал Новой Англии. 358 (21): 2231–9. CiteSeerX 10.1.1.574.4003. Дои:10.1056 / NEJMoa0802268. PMID 18441371.
- ^ Хаусвирт В.В., Алеман Т.С., Каушал С., Сидесиян А.В., Шварц С.Б., Ван Л., Конлон Т.Дж., Бой С.Л., Флотт Т.Р., Бирн Б.Дж., Якобсон С.Г. (октябрь 2008 г.). «Лечение врожденного амавроза Лебера, вызванного мутациями RPE65, путем субретинальной инъекции в глаз вектора гена аденоассоциированного вируса: краткосрочные результаты исследования фазы I». Генная терапия человека. 19 (10): 979–90. Дои:10.1089 / гум.2008.107. ЧВК 2940541. PMID 18774912.
- ^ Натвани А.С., Тудденхэм Э.Г., Рангараджан С., Росалес С., Макинтош Дж., Линч Д.К. и др. (Декабрь 2011 г.). «Аденовирус-ассоциированный вирусный вектор-опосредованный перенос генов при гемофилии B». Медицинский журнал Новой Англии. 365 (25): 2357–65. Дои:10.1056 / NEJMoa1108046. ЧВК 3265081. PMID 22149959.
- ^ Джессап М., Гринберг Б., Манчини Д., Каппола Т., Поли Д. Ф., Яски Б., Ярошинский А., Зебо К. М., Диттрих Н., Хаджар Р. Дж. (Июль 2011 г.). «Повышение уровня кальция при чрескожном введении генной терапии при сердечных заболеваниях (CUPID): исследование фазы 2 интракоронарной генной терапии Са2 + -АТФазы саркоплазматического ретикулума у пациентов с тяжелой сердечной недостаточностью». Тираж. 124 (3): 304–13. Дои:10.1161 / CIRCULATIONAHA.111.022889. ЧВК 5843948. PMID 21709064.
- ^ «AveXis сообщает данные продолжающегося исследования фазы 1 AVXS-101 при спинальной мышечной атрофии 1 типа». Avexis. 6 мая 2016. Архивировано с оригинал 11 июня 2017 г.. Получено 8 мая 2016.
- ^ Gaudet D, Méthot J, Déry S, Brisson D, Essiembre C, Tremblay G и др. (Апрель 2013). «Эффективность и долгосрочная безопасность генной терапии алипогена типарвовек (AAV1-LPLS447X) при дефиците липопротеинлипазы: открытое испытание». Джин Тер. 20 (4): 361–9. Дои:10.1038 / gt.2012.43. ЧВК 4956470. PMID 22717743.
- ^ LeWitt PA, Rezai AR, Leehey MA, Ojemann SG, Flaherty AW, Eskandar EN, et al. (Апрель 2011 г.). «Генная терапия AAV2-GAD для запущенной болезни Паркинсона: двойное слепое рандомизированное исследование, контролируемое фиктивным хирургическим вмешательством». Ланцет. Неврология. 10 (4): 309–19. Дои:10.1016 / S1474-4422 (11) 70039-4. PMID 21419704. S2CID 37154043.
- ^ Картер Би Джей (май 2005 г.). «Аденоассоциированные вирусные векторы в клинических испытаниях». Генная терапия человека. 16 (5): 541–50. Дои:10.1089 / hum.2005.16.541. PMID 15916479.
- ^ Каплитт М.Г., Фейгин А., Тан С., Фицсаймонс Х.Л., Мэттис П., Лоулор П.А., Блэнд Р.Дж., Янг Д., Стрибинг К., Эйдельберг Д., Во время MJ (июнь 2007 г.). «Безопасность и переносимость генной терапии с геном GAD, переносимым аденоассоциированным вирусом (AAV), при болезни Паркинсона: открытое испытание, фаза I». Ланцет. 369 (9579): 2097–105. Дои:10.1016 / S0140-6736 (07) 60982-9. PMID 17586305. S2CID 24491886.
- ^ Картер Б.Дж. (2000). «Аденоассоциированные вирусные и аденоассоциированные вирусные векторы для доставки генов». В Lassic DD, Templeton NS (ред.). Генная терапия: терапевтические механизмы и стратегии. Нью-Йорк: Marcel Dekker, Inc., стр. 41–59. ISBN 978-0-585-39515-9.
- ^ Богенцкий Р.А., Лефевр РБ, Бернс К.И. (октябрь 1988 г.). «Требования к последовательности и симметрии во внутренних палиндромных последовательностях концевого повтора аденоассоциированного вируса». Вирусология. 166 (2): 316–27. Дои:10.1016/0042-6822(88)90502-8. PMID 2845646.
- ^ Ван XS, Поннажаган С., Шривастава А. (июль 1995 г.). «Спасательные и репликационные сигналы генома аденоассоциированного вируса 2». Журнал молекулярной биологии. 250 (5): 573–80. Дои:10.1006 / jmbi.1995.0398. PMID 7623375.
- ^ а б Weitzman MD, Kyöstiö SR, Kotin RM, Owens RA (июнь 1994 г.). «Реп-белки аденоассоциированного вируса (AAV) опосредуют образование комплекса между ДНК AAV и местом его интеграции в ДНК человека». Труды Национальной академии наук Соединенных Штатов Америки. 91 (13): 5808–12. Bibcode:1994PNAS ... 91.5808W. Дои:10.1073 / пнас.91.13.5808. ЧВК 44086. PMID 8016070.
- ^ Чжоу X, Музыка Н. (апрель 1998 г.). «Упаковка ДНК аденоассоциированного вируса in vitro». Журнал вирусологии. 72 (4): 3241–7. Дои:10.1128 / JVI.72.4.3241-3247.1998. ЧВК 109794. PMID 9525651.
- ^ Нони П., Тессье Дж., Шадеф Дж., Уорд П., Жиро А., Дугаст М., Линден Р. М., Мулье П., Сальветти А. (октябрь 2001 г.). «Новый цис-действующий элемент репликации в геноме аденоассоциированного вируса 2 типа участвует в амплификации интегрированных последовательностей rep-cap». Журнал вирусологии. 75 (20): 9991–4. Дои:10.1128 / JVI.75.20.9991-9994.2001. ЧВК 114572. PMID 11559833.
- ^ Нони П., Чадеф Дж., Тесье Дж., Мулье П., Сальветти А. (январь 2003 г.). «Доказательства упаковки последовательностей rep-cap в капсиды аденоассоциированного вируса (AAV) типа 2 в отсутствие инвертированных концевых повторов: модель для генерации реп-положительных частиц AAV». Журнал вирусологии. 77 (1): 776–81. Дои:10.1128 / JVI.77.1.776-781.2003. ЧВК 140600. PMID 12477885.
- ^ Филпотт Нью-Джерси, Жиро-Вали К., Дюпюи С., Гомос Дж., Гамильтон Х., Бернс К.И., Фальк-Педерсен Э. (июнь 2002 г.). «Для эффективной интеграции рекомбинантных аденоассоциированных вирусных ДНК-векторов требуется последовательность p5-rep в цис». Журнал вирусологии. 76 (11): 5411–21. Дои:10.1128 / JVI.76.11.5411-5421.2002. ЧВК 137060. PMID 11991970.
- ^ Туллис Г.Е., Шенк Т. (декабрь 2000 г.). «Эффективная репликация векторов аденоассоциированного вируса типа 2: цис-действующий элемент вне концевых повторов и минимальный размер». Журнал вирусологии. 74 (24): 11511–21. Дои:10.1128 / JVI.74.24.11511-11521.2000. ЧВК 112431. PMID 11090148.
- ^ а б Kyöstiö SR, Owens RA, Weitzman MD, Antoni BA, Chejanovsky N, Carter BJ (май 1994). «Анализ аденоассоциированных вирусов (AAV) дикого типа и мутантных белков Rep на их способность отрицательно регулировать уровни мРНК p5 и p19 AAV». Журнал вирусологии. 68 (5): 2947–57. Дои:10.1128 / JVI.68.5.2947-2957.1994. ЧВК 236783. PMID 8151765.
- ^ Im DS, Muzyczka N (май 1990 г.). «Связывающий белок Rep68, связывающий начало AAV, является АТФ-зависимой сайт-специфической эндонуклеазой с ДНК-геликазной активностью». Клетка. 61 (3): 447–57. Дои:10.1016 / 0092-8674 (90) 90526-К. PMID 2159383. S2CID 27997617.
- ^ Im DS, Muzyczka N (февраль 1992 г.). «Частичная очистка аденоассоциированного вируса Rep78, Rep52 и Rep40 и их биохимическая характеристика». Журнал вирусологии. 66 (2): 1119–28. Дои:10.1128 / JVI.66.2.1119-1128.1992. ЧВК 240816. PMID 1309894.
- ^ Самульский RJ (2003). «Векторы AAV, будущая рабочая лошадка генной терапии человека». Генная терапия человека: современные возможности и будущие тенденции. Семинар исследовательского фонда Эрнста Шеринга. С. 25–40. Дои:10.1007/978-3-662-05352-2_3. ISBN 978-3-662-05354-6. PMID 12894449.
- ^ Тремпе Дж. П., Картер Б. Дж. (Январь 1988 г.). «Регулирование экспрессии гена аденоассоциированного вируса в клетках 293: контроль количества и трансляции мРНК». Журнал вирусологии. 62 (1): 68–74. Дои:10.1128 / JVI.62.1.68-74.1988. ЧВК 250502. PMID 2824856.
- ^ Джей FT, Лафлин, Калифорния, Картер Би Джей (май 1981 г.). «Контроль трансляции эукариот: на синтез аденоассоциированного вируса влияет мутация ДНК-связывающего белка аденовируса». Труды Национальной академии наук Соединенных Штатов Америки. 78 (5): 2927–31. Bibcode:1981PNAS ... 78.2927J. Дои:10.1073 / pnas.78.5.2927. ЧВК 319472. PMID 6265925.
- ^ Sonntag F, Schmidt K, Kleinschmidt JA (июнь 2010 г.). «Фактор сборки вируса способствует образованию капсида AAV2 в ядрышке». Труды Национальной академии наук Соединенных Штатов Америки. 107 (22): 10220–5. Bibcode:2010ПНАС..10710220С. Дои:10.1073 / pnas.1001673107. ЧВК 2890453. PMID 20479244.
- ^ Xie Q, Bu W, Bhatia S, Hare J, Somasundaram T, Azzi A, Chapman MS (август 2002). «Атомная структура аденоассоциированного вируса (AAV-2), вектора для генной терапии человека». Труды Национальной академии наук Соединенных Штатов Америки. 99 (16): 10405–10. Bibcode:2002PNAS ... 9910405X. Дои:10.1073 / pnas.162250899. ЧВК 124927. PMID 12136130.
- ^ Sonntag F, Köther K, Schmidt K, Weghofer M, Raupp C, Nieto K, Kuck A, Gerlach B, Böttcher B, Müller OJ, Lux K, Hörer M, Kleinschmidt JA (декабрь 2011 г.). «Белок, активирующий сборку, способствует сборке капсида различных серотипов аденоассоциированного вируса». Журнал вирусологии. 85 (23): 12686–97. Дои:10.1128 / JVI.05359-11. ЧВК 3209379. PMID 21917944.
- ^ Бесерра С.П., Роуз Дж. А., Харди М., Баруди Б. М., Андерсон К. В. (декабрь 1985 г.). «Прямое картирование капсидных белков B и C аденоассоциированного вируса: возможный кодон инициации ACG». Труды Национальной академии наук Соединенных Штатов Америки. 82 (23): 7919–23. Bibcode:1985PNAS ... 82.7919B. Дои:10.1073 / пнас.82.23.7919. ЧВК 390881. PMID 2999784.
- ^ Кассинотти П., Вайц М., Трачин Дж. Д. (ноябрь 1988 г.). «Организация гена капсида аденоассоциированного вируса (AAV): картирование минорной сплайсированной мРНК, кодирующей белок капсида вируса 1». Вирусология. 167 (1): 176–84. Дои:10.1016/0042-6822(88)90067-0. PMID 2847413.
- ^ а б Муралидхар С., Бесерра С.П., Роуз Д.А. (январь 1994 г.). «Сайт-направленный мутагенез кодонов инициации структурного белка аденоассоциированного вируса 2 типа: влияние на регуляцию синтеза и биологическую активность». Журнал вирусологии. 68 (1): 170–6. Дои:10.1128 / JVI.68.1.170-176.1994. ЧВК 236275. PMID 8254726.
- ^ Тремпе Дж. П., Картер Б. Дж. (Сентябрь 1988 г.). «Для синтеза капсидного белка VP1 аденоассоциированного вируса требуется альтернативный сплайсинг мРНК». Журнал вирусологии. 62 (9): 3356–63. Дои:10.1128 / JVI.62.9.3356-3363.1988. ЧВК 253458. PMID 2841488.
- ^ Рабинович Дж. Э., Самульски Р. Дж. (Декабрь 2000 г.). «Создание лучшего вектора: манипуляции с вирионами AAV». Вирусология. 278 (2): 301–8. Дои:10.1006 / viro.2000.0707. PMID 11118354.
- ^ Girod A, Wobus CE, Zádori Z, Ried M, Leike K, Tijssen P, Kleinschmidt JA, Hallek M (май 2002 г.). «Капсидный белок VP1 аденоассоциированного вируса типа 2 несет домен фосфолипазы А2, необходимый для инфицирования вируса». Журнал общей вирусологии. 83 (Pt 5): 973–8. Дои:10.1099/0022-1317-83-5-973. PMID 11961250.
- ^ Уоррингтон KH, Горбатюк OS, Харрисон JK, Opie SR, Zolotukhin S, Muzyczka N (июнь 2004 г.). «Капсидный белок VP2 аденоассоциированного вируса типа 2 является несущественным и может выдерживать большие пептидные вставки на своем N-конце». Журнал вирусологии. 78 (12): 6595–609. Дои:10.1128 / JVI.78.12.6595-6609.2004. ЧВК 416546. PMID 15163751.
- ^ «История таксономии ICTV: аденоассоциированный зависимый парвовирус A». ICTV. Получено 31 января 2020.
- ^ «История таксономии ICTV: аденоассоциированный зависимый парвовирус B». ICTV. Получено 31 января 2020.
- ^ а б Weitzman MD, Linden RM (2011). «Биология аденоассоциированного вируса». В Snyder, R.O., Moullier, P (eds.). Методы и протоколы аденоассоциированных вирусов. Тотова, Нью-Джерси: Humana Press. ISBN 978-1-61779-370-7.
- ^ Мори С., Ван Л., Такеучи Т., Канда Т. (декабрь 2004 г.). «Два новых аденоассоциированных вируса от яванского макака: характеристика капсидного белка с помощью псевдотипирования». Вирусология. 330 (2): 375–83. Дои:10.1016 / j.virol.2004.10.012. PMID 15567432.
- ^ а б Бартлетт Дж. С., Самульски Р. Дж., МакКаун Т. Дж. (Май 1998 г.). «Селективное и быстрое поглощение аденоассоциированного вируса 2 типа в головном мозге». Генная терапия человека. 9 (8): 1181–6. Дои:10,1089 / пом.1998.9.8-1181. PMID 9625257.
- ^ Фишер А.С., Бек С.Е., Смит К.И., Лаубе Б.Л., Аскин Ф.Б., Гуджино С.Е., Адамс Р.Дж., Флотт Т.Р., Гуджино В.Б. (декабрь 2003 г.). «Успешная экспрессия трансгена с серийными дозами аэрозольных векторов rAAV2 у макак-резусов». Молекулярная терапия. 8 (6): 918–26. Дои:10.1016 / j.ymthe.2003.08.015. PMID 14664794.
- ^ Никлин С.А., Буэнинг Х., Дисхарт К.Л., де Алвис М., Жирод А., Хакер Ю., Трэшер А.Дж., Али Р.Р., Халлек М., Бейкер А.Х. (сентябрь 2001 г.). «Эффективный и селективный AAV2-опосредованный перенос гена, направленный на эндотелиальные клетки сосудов человека». Молекулярная терапия. 4 (3): 174–81. Дои:10.1006 / mthe.2001.0424. PMID 11545607.
- ^ Рабиновиц Дж. Э., Сяо В., Самульски Р. Дж. (Декабрь 1999 г.). «Инсерционный мутагенез капсида AAV2 и получение рекомбинантного вируса». Вирусология. 265 (2): 274–85. Дои:10.1006 / viro.1999.0045. PMID 10600599.
- ^ Ши В., Бартлетт Дж. С. (апрель 2003 г.). «Включение RGD в VP3 обеспечивает векторы на основе аденоассоциированного вируса типа 2 (AAV2) с независимым от гепарансульфата механизмом входа в клетки». Молекулярная терапия. 7 (4): 515–25. Дои:10.1016 / S1525-0016 (03) 00042-X. PMID 12727115.
- ^ Wu P, Xiao W., Conlon T., Hughes J, Agbandje-McKenna M, Ferkol T., Flotte T, Muzyczka N (сентябрь 2000 г.). "Mutational analysis of the adeno-associated virus type 2 (AAV2) capsid gene and construction of AAV2 vectors with altered tropism". Журнал вирусологии. 74 (18): 8635–47. Дои:10.1128/JVI.74.18.8635-8647.2000. ЧВК 102071. PMID 10954565.
- ^ Manno CS, Chew AJ, Hutchison S, Larson PJ, Herzog RW, Arruda VR, et al. (Апрель 2003 г.). "AAV-mediated factor IX gene transfer to skeletal muscle in patients with severe hemophilia B". Кровь. 101 (8): 2963–72. Дои:10.1182/blood-2002-10-3296. PMID 12515715.
- ^ Richter M, Iwata A, Nyhuis J, Nitta Y, Miller AD, Halbert CL, Allen MD (April 2000). "Adeno-associated virus vector transduction of vascular smooth muscle cells in vivo". Физиологическая геномика. 2 (3): 117–27. Дои:10.1152/physiolgenomics.2000.2.3.117. PMID 11015590.
- ^ Koeberl DD, Alexander IE, Halbert CL, Russell DW, Miller AD (February 1997). "Persistent expression of human clotting factor IX from mouse liver after intravenous injection of adeno-associated virus vectors". Труды Национальной академии наук Соединенных Штатов Америки. 94 (4): 1426–31. Bibcode:1997PNAS...94.1426K. Дои:10.1073/pnas.94.4.1426. ЧВК 19807. PMID 9037069.
- ^ Qing K, Mah C, Hansen J, Zhou S, Dwarki V, Srivastava A (January 1999). "Human fibroblast growth factor receptor 1 is a co-receptor for infection by adeno-associated virus 2". Природа Медицина. 5 (1): 71–7. Дои:10.1038/4758. PMID 9883842. S2CID 31602526.
- ^ Summerford C, Samulski RJ (February 1998). "Membrane-associated heparan sulfate proteo-glycan is a receptor for adeno-associated virus type 2 virions". Журнал вирусологии. 72 (2): 1438–45. Дои:10.1128/JVI.72.2.1438-1445.1998. ЧВК 124624. PMID 9445046.
- ^ Summerford C, Bartlett JS, Samulski RJ (January 1999). "AlphaVbeta5 integrin: a co-receptor for adeno-associated virus type 2 infection". Природа Медицина. 5 (1): 78–82. Дои:10.1038/4768. PMID 9883843. S2CID 23326070.
- ^ Qiu J, Handa A, Kirby M, Brown KE (March 2000). "The interaction of heparin sulfate and adeno-associated virus 2". Вирусология. 269 (1): 137–47. Дои:10.1006/viro.2000.0205. PMID 10725206.
- ^ Pajusola K, Gruchala M, Joch H, Lüscher TF, Ylä-Herttuala S, Büeler H (November 2002). "Cell-type-specific characteristics modulate the transduction efficiency of adeno-associated virus type 2 and restrain infection of endothelial cells". Журнал вирусологии. 76 (22): 11530–40. Дои:10.1128/JVI.76.22.11530-11540.2002. ЧВК 136795. PMID 12388714.
- ^ "Common virus 'kills cancer'". CNN. 22 июня 2005 г.. Получено 5 августа 2009.
- ^ Penn State (23 June 2005). "Harmless Virus Kills Some Cancers". Science Daily.
- ^ Limberis MP, Vandenberghe LH, Zhang L, Pickles RJ, Wilson JM (February 2009). "Transduction efficiencies of novel AAV vectors in mouse airway epithelium in vivo and human ciliated airway epithelium in vitro". Молекулярная терапия. 17 (2): 294–301. Дои:10.1038/mt.2008.261. ЧВК 2835069. PMID 19066597.
- ^ Strobel B, Duechs MJ, Schmid R, Stierstorfer BE, Bucher H, Quast K, Stiller D, Hildebrandt T, Mennerich D, Gantner F, Erb KJ, Kreuz S (September 2015). "Modeling Pulmonary Disease Pathways Using Recombinant Adeno-Associated Virus 6.2". American Journal of Respiratory Cell and Molecular Biology. 53 (3): 291–302. Дои:10.1165/rcmb.2014-0338MA. PMID 25845025.
- ^ Gao GP, Alvira MR, Wang L, Calcedo R, Johnston J, Wilson JM (September 2002). "Novel adeno-associated viruses from rhesus monkeys as vectors for human gene therapy". Труды Национальной академии наук Соединенных Штатов Америки. 99 (18): 11854–9. Bibcode:2002PNAS...9911854G. Дои:10.1073/pnas.182412299. ЧВК 129358. PMID 12192090.
- ^ а б Halbert CL, Allen JM, Miller AD (July 2001). "Adeno-associated virus type 6 (AAV6) vectors mediate efficient transduction of airway epithelial cells in mouse lungs compared to that of AAV2 vectors". Журнал вирусологии. 75 (14): 6615–24. Дои:10.1128/JVI.75.14.6615-6624.2001. ЧВК 114385. PMID 11413329.
- ^ а б Rabinowitz JE, Bowles DE, Faust SM, Ledford JG, Cunningham SE, Samulski RJ (May 2004). "Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups". Журнал вирусологии. 78 (9): 4421–32. Дои:10.1128/JVI.78.9.4421-4432.2004. ЧВК 387689. PMID 15078923.
- ^ Chen S, Kapturczak M, Loiler SA, Zolotukhin S, Glushakova OY, Madsen KM, Samulski RJ, Hauswirth WW, Campbell-Thompson M, Berns KI, Flotte TR, Atkinson MA, Tisher CC, Agarwal A (February 2005). "Efficient transduction of vascular endothelial cells with recombinant adeno-associated virus serotype 1 and 5 vectors". Генная терапия человека. 16 (2): 235–47. Дои:10.1089/hum.2005.16.235. ЧВК 1364465. PMID 15761263.
- ^ Ortinski PI, Dong J, Mungenast A, Yue C, Takano H, Watson DJ, Haydon PG, Coulter DA (May 2010). "Selective induction of astrocytic gliosis generates deficits in neuronal inhibition". Природа Неврология. 13 (5): 584–91. Дои:10.1038/nn.2535. ЧВК 3225960. PMID 20418874.
- ^ Kaludov N, Brown KE, Walters RW, Zabner J, Chiorini JA (August 2001). "Adeno-associated virus serotype 4 (AAV4) and AAV5 both require sialic acid binding for hemagglutination and efficient transduction but differ in sialic acid linkage specificity". Журнал вирусологии. 75 (15): 6884–93. Дои:10.1128/JVI.75.15.6884-6893.2001. ЧВК 114416. PMID 11435568.
- ^ Di Pasquale G, Davidson BL, Stein CS, Martins I, Scudiero D, Monks A, Chiorini JA (October 2003). "Identification of PDGFR as a receptor for AAV-5 transduction". Природа Медицина. 9 (10): 1306–12. Дои:10.1038/nm929. PMID 14502277. S2CID 32547188.
- ^ "Adeno-associated Virus (AAV) Guide".
- ^ Zinn E, Pacouret S, Khaychuk V, Turunen HT, Carvalho LS, Andres-Mateos E, Shah S, Shelke R, Maurer AC, Plovie E, Xiao R, Vandenberghe LH (August 2015). "In Silico Reconstruction of the Viral Evolutionary Lineage Yields a Potent Gene Therapy Vector". Отчеты по ячейкам. 12 (6): 1056–68. Дои:10.1016/j.celrep.2015.07.019. ЧВК 4536165. PMID 26235624.
- ^ Flotte TR, Berns KI (April 2005). "Adeno-associated virus: a ubiquitous commensal of mammals". Генная терапия человека. 16 (4): 401–7. Дои:10.1089/hum.2005.16.401. PMID 15871671.
- ^ Garolla A, Pizzol D, Bertoldo A, Menegazzo M, Barzon L, Foresta C (November 2013). "Sperm viral infection and male infertility: focus on HBV, HCV, HIV, HPV, HSV, HCMV, and AAV". Журнал репродуктивной иммунологии. 100 (1): 20–9. Дои:10.1016/j.jri.2013.03.004. PMID 23668923.
- ^ Zaiss AK, Liu Q, Bowen GP, Wong NC, Bartlett JS, Muruve DA (May 2002). "Differential activation of innate immune responses by adenovirus and adeno-associated virus vectors". Журнал вирусологии. 76 (9): 4580–90. Дои:10.1128/JVI.76.9.4580-4590.2002. ЧВК 155101. PMID 11932423.
- ^ а б Zaiss AK, Muruve DA (June 2005). "Immune responses to adeno-associated virus vectors". Современная генная терапия. 5 (3): 323–31. Дои:10.2174/1566523054065039. PMID 15975009.
- ^ а б c Madsen D, Cantwell ER, O'Brien T, Johnson PA, Mahon BP (November 2009). "Adeno-associated virus serotype 2 induces cell-mediated immune responses directed against multiple epitopes of the capsid protein VP1". Журнал общей вирусологии. 90 (Pt 11): 2622–33. Дои:10.1099/vir.0.014175-0. ЧВК 2885037. PMID 19641045.
- ^ а б Manno CS, Pierce GF, Arruda VR, Glader B, Ragni M, Rasko JJ, et al. (Март 2006 г.). "Successful transduction of liver in hemophilia by AAV-Factor IX and limitations imposed by the host immune response". Природа Медицина. 12 (3): 342–7. Дои:10.1038/nm1358. PMID 16474400. S2CID 14664182.
- ^ Sabatino DE, Mingozzi F, Hui DJ, Chen H, Colosi P, Ertl HC, High KA (December 2005). "Identification of mouse AAV capsid-specific CD8+ T cell epitopes". Молекулярная терапия. 12 (6): 1023–33. Дои:10.1016/j.ymthe.2005.09.009. PMID 16263332.
- ^ Rohr UP, Kronenwett R, Grimm D, Kleinschmidt J, Haas R (September 2002). "Primary human cells differ in their susceptibility to rAAV-2-mediated gene transfer and duration of reporter gene expression". Журнал вирусологических методов. 105 (2): 265–75. Дои:10.1016/S0166-0934(02)00117-9. PMID 12270659.
- ^ а б Matsushita T, Elliger S, Elliger C, Podsakoff G, Villarreal L, Kurtzman GJ, Iwaki Y, Colosi P (July 1998). "Adeno-associated virus vectors can be efficiently produced without helper virus". Генная терапия. 5 (7): 938–45. Дои:10.1038/sj.gt.3300680. PMID 9813665.
- ^ Myers MW, Laughlin CA, Jay FT, Carter BJ (July 1980). "Adenovirus helper function for growth of adeno-associated virus: effect of temperature-sensitive mutations in adenovirus early gene region 2". Журнал вирусологии. 35 (1): 65–75. Дои:10.1128/JVI.35.1.65-75.1980. ЧВК 288783. PMID 6251278.
- ^ Handa H, Carter BJ (July 1979). "Adeno-associated virus DNA replication complexes in herpes simplex virus or adenovirus-infected cells". Журнал биологической химии. 254 (14): 6603–10. PMID 221504.
- ^ Yalkinoglu AO, Heilbronn R, Bürkle A, Schlehofer JR, zur Hausen H (June 1988). "DNA amplification of adeno-associated virus as a response to cellular genotoxic stress". Исследования рака. 48 (11): 3123–9. PMID 2835153.
- ^ Yakobson B, Koch T, Winocour E (April 1987). "Replication of adeno-associated virus in synchronized cells without the addition of a helper virus". Журнал вирусологии. 61 (4): 972–81. Дои:10.1128/JVI.61.4.972-981.1987. ЧВК 254052. PMID 3029431.
- ^ Yakobson B, Hrynko TA, Peak MJ, Winocour E (March 1989). "Replication of adeno-associated virus in cells irradiated with UV light at 254 nm". Журнал вирусологии. 63 (3): 1023–30. Дои:10.1128/JVI.63.3.1023-1030.1989. ЧВК 247794. PMID 2536816.
- ^ "Introduction to Adeno-Associated Virus (AAV)".
- ^ "Adeno-Associated Virus and Adeno-associated Viral Vectors". Архивировано из оригинал 20 сентября 2018 г.. Получено 19 сентября 2018.
- ^ Duan D, Sharma P, Yang J, Yue Y, Dudus L, Zhang Y, Fisher KJ, Engelhardt JF (November 1998). "Circular intermediates of recombinant adeno-associated virus have defined structural characteristics responsible for long-term episomal persistence in muscle tissue". Журнал вирусологии. 72 (11): 8568–77. Дои:10.1128/JVI.72.11.8568-8577.1998. ЧВК 110267. PMID 9765395.
внешняя ссылка
- Kimball JW (17 May 2015). "Gene Therapy II". Kimball's Biology Pages. Архивировано из оригинал 18 марта 2005 г.. Получено 13 мая 2005.
- "Аденоассоциированный вирус". Браузер таксономии NCBI. 272636.
