Гемофагоцитарный лимфогистиоцитоз - Hemophagocytic lymphohistiocytosis
| Гемофагоцитарный лимфогистиоцитоз | |
|---|---|
| Другие имена | HLH |
 | |
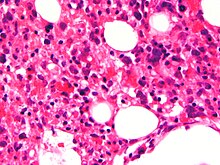
| Микрофотография показывая красные кровяные клетки внутри макрофагов. H&E пятно. | |
| Специальность | Гематология |
Гемофагоцитарный лимфогистиоцитоз (HLH), также известен как гемофагоцитарный лимфогистиоцитоз (Британская орфография ), и гемофагоцитарный или гемофагоцитарный синдром,[1] это редкость гематологическое заболевание чаще встречается у детей, чем у взрослых. Это опасное для жизни заболевание тяжелой степени. гипервоспаление вызвано неконтролируемым распространением активированных лимфоциты и макрофаги, характеризуется пролиферацией морфологически доброкачественных лимфоцитов и макрофагов, которые секретируют большое количество воспалительные цитокины. Классифицируется как один из цитокиновый шторм синдромы. Различают наследственные и ненаследственные (приобретенные) причины гемофагоцитарного лимфогистиоцитоза (ГЛГ).
Признаки и симптомы
Начало ГЛГ происходит в возрасте до одного года примерно в 70% случаев. Следует заподозрить семейный ГЛГ, если у братьев и сестер диагностирован ГЛГ или если симптомы повторяются после прекращения терапии. У каждого полноправного брата или сестры ребенка с семейным HLH есть 25% -ный шанс развития болезни, 50% -ный шанс быть носителем дефектного гена (что очень редко связано с каким-либо риском заболевания) и 25%. –Процентный шанс не быть затронутым и не иметь дефект гена.[нужна цитата ]
Пациентам с ГЛГ, особенно без лечения, может потребоваться интенсивная терапия. Следовательно, HLH следует включать в дифференциальную диагностику пациентов отделения интенсивной терапии с цитопения и гиперферритинемия.[2] Пациенты на ранних стадиях ГЛГ часто госпитализируются в медицина внутренних органов подопечные.[3]
Клинически ГЛГ проявляется высокая температура, увеличение печени и селезенки, увеличенные лимфатические узлы, желтое изменение цвета кожи и глаз, а сыпь.[4] Лабораторные данные могут включать повышенный уровень триглицеридов, низкий уровень фибриногена, трансаминит и повышенный уровень ферритина (среди прочего).[4]
Причины
Первичный HLH вызывается: потеря функции (т.е. инактивация) мутаций в генах, кодирующих белки цитотоксические Т-клетки и NK-клетки использовать для уничтожения целевых клеток, например, инфицированных патогены словно Вирус Эпштейна-Барра (EBV) или Вирус денге.[5] Эти мутации включают мутации в следующих генах: UNC13D, STX11, RAB27A, STXBP2, LYST, PRF1 1, SH2D1A, BIRC4, ITK, CD27, и MAGT1.[6]
Вторичный ГЛГ (sHLH) связан и, как считается, стимулируется злокачественный и доброкачественные заболевания, которые также ослабляют способность иммунная система способность атаковать EBV-инфицированные клетки. Злокачественные заболевания, связанные с вторичным HLH, включают: Т-клеточная лимфома, В-клеточная лимфома, острый лимфолейкоз, острый миелоидный лейкоз, и миелодиспластический синдром. Незлокачественные нарушения, связанные с вторичным HLH, включают: аутоиммунные нарушения, такие как ювенильный идиопатический артрит, несовершеннолетний Болезнь Кавасаки, системная красная волчанка, ювенильное начало и взрослые формы болезни Стилла, и ревматоидный артрит;[6] иммунодефицитные расстройства такие как тяжелый комбинированный иммунодефицит, Синдром ДиДжорджи, Синдром Вискотта – Олдрича, атаксия – телеангиэктазия, и врожденный дискератоз );[7] и инфекции, вызванные EBV, цитомегаловирус, ВИЧ / СПИД, бактерии, простейшие, грибы и возможно SARS-CoV-2.[8] Вторичный ГЛГ также может быть результатом ятрогенный такие причины, как трансплантация костного мозга или других органов; химиотерапия; или терапия иммунодепрессантами;[9]
Около 33% всех случаев HLH, ~ 75% случаев HLH в Азии и почти 100% случаев HLH, вызванных мутациями в SH2D1A (увидеть Х-сцепленное лимфопролиферативное заболевание 1 типа ) связаны с ВЭБ-инфекцией, а мысли о ней спровоцированы или спровоцированы. Эти случаи HLH классифицируются как принадлежащие к классу Лимфопролиферативные заболевания, ассоциированные с вирусом Эпштейна – Барра и назвал EBV + HLH.[10]
Патофизиология
Основные причины, унаследованные или приобретенные, приводят к неконтролируемому иммунному ответу при воздействии триггеров. Нарушение цитотоксичности NK-клеток является отличительной чертой HLH. Все генетические дефекты семейного HLH связаны с гранула -зависимая цитотоксичность. Эта неспособность удалить инфицированные и антигенпрезентирующие клетки и прекратить иммунный ответ приводит к неконтролируемой пролиферации и активации иммунной системы с высвобождением избыточных цитокинов. Затем эти клетки проникают в органы, высвобождая больше цитокинов, что дает клиническую картину. Лихорадка вызвана Ил-1, Ил-6 и TNF-альфа; то цитопения происходит из-за подавляющего воздействия на кроветворение TNF-альфа и TNF-гамма. TNF-альфа и TNF-гамма также могут приводить к ингибированию липопротеинов. липаза или стимулировать синтез триглицеридов. Активированные макрофаги выделяют ферритин и активатор плазминогена ведущий к гиперфибринолиз.[11]
Генетика
Описаны пять генетических подтипов (FHL1, FHL2, FHL3, FHL4 и FHL5) с предполагаемой общей распространенностью один на 50 000 и равным гендерным распределением. Молекулярно-генетическое тестирование четырех причинных генов, PRF1 (FHL2), UNC13D (FHL3), STX11 (FHL4) и STXBP2 (FHL5), доступно на клинической основе. Симптомы FHL обычно проявляются в течение первых нескольких месяцев жизни и могут даже развиться. в утробе матери. Однако в некоторых случаях наблюдаются симптоматические проявления в детстве и даже в молодом возрасте.[нужна цитата ]
Пять подтипов FHL[12] связаны с определенным геном:
- FHL1: HPLH1
- FHL2: PRF1 (Перфорин )
- FHL3: UNC13D (Munc13-4)
- FHL4: STX11 (Синтаксин 11)
- FHL5: STXBP2 (Синтаксин-связывающий белок 2 ) / UNC18-2
Почти половина случаев семейного гемофагоцитарного лимфогистиоцитоза 2 типа обусловлена биаллельными мутациями PRF1.[13]
Диагностика
Анализ крови обычно показывает снижение количества клеток крови —В том числе уменьшенное количество обращающихся красные кровяные клетки, белые кровяные клетки, и тромбоциты Костный мозг может показать гемофагоцитоз Функциональные пробы печени обычно повышены. Низкий уровень белка альбумин в крови встречается часто.[нужна цитата ]
Сыворотка С-реактивный белок, скорость оседания эритроцитов, и ферритин уровень заметно повышен. У детей ферритин выше 10000 очень чувствителен и специфичен для диагностики HLH,[14] однако диагностическая ценность ферритина меньше для взрослых пациентов с HLH.[15]
Сыворотка фибриноген уровень обычно низкий и D-димер уровень повышен.
В сфингомиелиназа находится на возвышении.[16]
Шоу биопсии костного мозга гистиоцитоз.[17]
Классификация
Первичный HLH, также известный как семейный гемофагоцитарный лимфогистиоцитоз (FHL), или семейный эритрофагоцитарный лимфогистиоцитоз, является гетерогенным аутосомно-рецессивным заболеванием, которое, как было установлено, более распространено среди родительского кровного родства.[нужна цитата ]
Вторичный гемофагоцитарный лимфогистиоцитоз (приобретенный гемофагоцитарный лимфогистиоцитоз) возникает после сильной иммунологической активации, такой как та, которая может возникать при системной инфекции, иммунодефиците или злокачественном новообразовании.[нужна цитата ]
Обе формы характеризуются подавляющей активацией нормальных Т-лимфоцитов и макрофагов, что неизменно приводит к клиническим и гематологическим изменениям и смерти при отсутствии лечения.[нужна цитата ]
Описан подтип первичного HLH, при котором воспаление ограничивается центральной нервной системой.[18]
Диагностические критерии
Текущие (2008 г.) диагностические критерии ГЛГ:[19]
1. Молекулярный диагноз, соответствующий HLH. Они включают идентификацию патологических мутаций PRF1, UNC13D или STX11.
ИЛИ
2. Выполнение пяти из восьми критериев ниже:
- Высокая температура (определяется как температура> 100,3 ° F,> 38 ° C)
- Увеличение селезенки
- Снижение количества клеток крови, затрагивающее по крайней мере две из трех линий периферической крови:
- Гемоглобин <9 г / 100 мл (у младенцев <4 недель: гемоглобин <10 г / 100 мл) (анемия )
- Тромбоциты <100 × 109/ L (тромбоцитопения )
- Нейтрофилы <1 × 109/ L (нейтропения )
- Высокий уровень триглицеридов в крови (натощак, больше или равно 265 мг / 100 мл) и / или уменьшенное количество фибриноген в крови (≤ 150 мг / 100 мл)
- Ферритин ≥ 500 нг / мл
- Гемофагоцитоз в Костный мозг, селезенка или лимфатический узел
- Низкий или отсутствует естественная клетка-убийца Мероприятия
- Растворимый CD25 (растворимый рецептор IL-2)> 2400 Ед / мл (или согласно местной справочной лаборатории)
Кроме того, в случае семейного HLH не должно быть очевидных признаков злокачественности.
Не все пять из восьми критериев требуются для диагностики ГЛГ у взрослых, и для постановки диагноза требуется высокий индекс подозрительности, поскольку отсрочка приводит к увеличению смертности. Диагностические критерии были разработаны в педиатрической популяции и не были валидированы для взрослых пациентов с HLH.[20] Попытки улучшить диагностику HLH включали использование HScore, который можно использовать для оценки индивидуального риска HLH.[21] Было обнаружено, что у взрослых растворимый ИЛ-2 является очень чувствительным маркером ГЛГ, демонстрируя 100% чувствительность для исключения ГЛГ ниже порогового значения 2400 Ед / мл и оптимального порогового значения для исключения при 2515 Ед / мл (чувствительность 100 %; специфичность 72,5%) со специфичностью 93% при> 10 000 Ед / мл.[22]
Дифференциальный диагноз
Дифференциальный диагноз ГЛГ включает вторичный ГЛГ и синдром активации макрофагов или другой первичные иммунодефициты которые проявляются гемофагоцитарным лимфогистиоцитозом, например Х-сцепленное лимфопролиферативное заболевание.[нужна цитата ]
Другие условия, которые можно спутать с этим состоянием, включают: аутоиммунный лимфопролиферативный синдром.[23] Как синдром интенсивного воспаления его необходимо дифференцировать от сепсис, что может оказаться чрезвычайно сложным.[24]
Диагноз приобретенного или вторичного HLH обычно ставится в связи с инфекцией, вызванной вирусами, бактериями, грибами или паразитами, или в связи с лимфомой, аутоиммунным заболеванием или нарушением обмена веществ. Приобретенный HLH мог быть уменьшенным, нормальным или увеличенным NK клетка Мероприятия.[нужна цитата ]
Синдром Грищелли
Основной дифференциальный диагноз ГЛГ: Синдром Грищелли (тип 2). Это редкое аутосомно-рецессивное заболевание, характеризующееся частичным альбинизмом, гепатоспленомегалией, панцитопенией, гепатитом, иммунологическими аномалиями и лимфогистиоцитозом. Большинство случаев были диагностированы в возрасте от 4 месяцев до 7 лет, средний возраст - около 17 месяцев.[нужна цитата ]
Различают три типа синдрома Гричелли: тип 1 имеет неврологические симптомы и мутации в MYO5A. Прогноз зависит от тяжести неврологических проявлений. Тип 2 имеет мутации в RAB27A и гемофагоцитарный синдром с аномальной активацией Т-клеток и макрофагов. При отсутствии лечения у этого типа есть тяжелый прогноз. Тип 3 имеет мутации в меланофилин и характеризуется частичным альбинизмом. Этот тип не представляет угрозы для пострадавших.[нужна цитата ]
лечение
Во вторичных случаях показано лечение причины, если это возможно. Кроме того, обычно требуется лечение самого HLH.
Хотя оптимальное лечение ГЛГ все еще обсуждается, текущие схемы лечения обычно включают высокие дозы кортикостероиды, этопозид и циклоспорин.[нужна цитата ] Внутривенно иммуноглобулин также используется. Метотрексат и винкристин также использовались. Другие лекарства включают: цитокиновая таргетная терапия.
20 ноября 2018 г. FDA одобрило моноклональные антитела против IFN-гамма. эмапалумаб (собственное название Gamifant) для лечения первичного HLH у детей и взрослых.[25]
Прогноз
Прогноз безопасный, общая летальность составляет 50%. Плохие прогностические факторы включали HLH, связанный со злокачественными новообразованиями, при этом половина пациентов умирала через 1,4 месяца по сравнению с 22,8 месяцами для пациентов с HLH, не связанным с опухолью.[26]
Вторичный ГЛГ у некоторых людей может купироваться самостоятельно, поскольку пациенты могут полностью выздороветь после получения только поддерживающего лечения (т. Е. Внутривенного введения). иммуноглобулин только). Однако длительная ремиссия без использования цитотоксической и иммуносупрессивной терапии маловероятна у большинства взрослых с ГЛГ и у пациентов с поражением Центральная нервная система (головной и / или спинной мозг).[12]
История
Первый отчет о HLH был опубликован в 1952 году.[27]
Исследование
В недавно проведенном систематическом обзоре сообщалось, что объединенная доля включает лихорадку 97,2%, гепатомегалия 70,2%, спленомегалия 78,4%, тромбоцитопения 90,1%, анемия 76,0% и ферритин сыворотки ≥500 мкг / л 97,1%. Летальность среди пациентов с гемофагоцитарным лимфогистиоцитозом денге составляет 14,6%.[28]
Смотрите также
использованная литература
- ^ Фисман, Дэвид Н. (2000). «Гемофагоцитарные синдромы и инфекции». Возникающий зараз. Dis. 6 (6): 601–8. Дои:10.3201 / eid0606.000608. ЧВК 2640913. PMID 11076718.
- ^ Махович, Рафаль; Янка, Гритта; Виктор-Енджейчак, Веслав (01.01.2016). «У вашего пациента в интенсивной терапии может быть HLH (гемофагоцитарный лимфогистиоцитоз)». Критический уход. 20 (1): 215. Дои:10.1186 / s13054-016-1369-3. ISSN 1364-8535. ЧВК 4937543. PMID 27389585.
- ^ Махович, Рафаль; Басак, Гжегож (05.03.2020). «Как терапевт может спасти пациента с гемофагоцитарным лимфогистиоцитозом (ГЛГ)?». Польский архив внутренней медицины. 130 (5): 431–437. Дои:10.20452 / pamw.15226. PMID 32134401.
- ^ а б Esteban, Ysabella M .; де Йонг, Джилл Л. О .; Тешер, Мелисса С. (1 августа 2017 г.). «Обзор гемофагоцитарного лимфогистиоцитоза». Педиатрические анналы. 46 (8): e309 – e313. Дои:10.3928/19382359-20170717-01. PMID 28806468.
- ^ Giang HT, Banno K, Minh LH, Trinh LT, Loc LT, Eltobgy A, Tai LL, Khan A, Tuan NH, Reda Y, Samsom M. Гемофагоцитарный синдром денге: систематический обзор и метаанализ эпидемиологии, клинических признаков, исходы и факторы риска. Обзоры по медицинской вирусологии. 2018 Ноябрь; 28 (6): e2005. https://onlinelibrary.wiley.com/doi/abs/10.1002/rmv.2005 https://doi.org/10.1002/rmv.2005
- ^ а б Высоцкий CA (декабрь 2017 г.). «Сравнение гемофагоцитарного лимфогистиоцитоза у детей и взрослых». Текущее мнение в области аллергии и клинической иммунологии. 17 (6): 405–413. Дои:10.1097 / ACI.0000000000000405. PMID 28957822. S2CID 11439142.
- ^ Боде С.Ф., Амманн С., Аль-Херц В., Батанеант М., Дворжак С.С., Геринг С., Геннери А., Гилмор К.С., Гонсалес-Гранадо Л.И., Грос-Вильч Ю., Ифверсен М., Лингман-Фрамм Дж., Маттес-Мартин С., Местерс R, Meyts I, van Montfrans JM, Pachlopnik Schmid J, Pai SY, Soler-Palacin P, Schuermann U, Schuster V, Seidel MG, Speckmann C, Stepensky P, Sykora KW, Tesi B, Vraetz T, Waruiru C, Bryceson YT , Мошус Д., Лемберг К., Джордан МБ, Эль С. (июль 2015 г.). «Синдром гемофагоцитарного лимфогистиоцитоза при первичных иммунодефицитах: значение для дифференциальной диагностики и патогенеза». Haematologica. 100 (7): 978–88. Дои:10.3324 / haematol.2014.121608. ЧВК 4486233. PMID 26022711.
- ^ Мехта, пуджа; McAuley, Daniel F .; Браун, Майкл; Санчес, Эмили; Tattersall, Rachel S .; Мэнсон, Джессика Дж. (28 марта 2020 г.). «COVID-19: рассмотрите синдромы цитокинового шторма и иммуносупрессию». Ланцет. 395 (10229): 1033–1034. Дои:10.1016 / S0140-6736 (20) 30628-0. ISSN 0140-6736. ЧВК 7270045. PMID 32192578.
- ^ Дэвер Н., Макклейн К., Аллен С.Е., Парих С.А., Отрок З., Рохас-Эрнандес С., Блехач Б., Ван С., Минков М., Джордан МБ, Ла Розе П., Кантарджан Х.М. (сентябрь 2017 г.). «Консенсус-обзор гемофагоцитарного лимфогистиоцитоза, связанного со злокачественными новообразованиями, у взрослых». Рак. 123 (17): 3229–3240. Дои:10.1002 / cncr.30826. ЧВК 5568927. PMID 28621800.
- ^ Марш РА (2017). «Вирус Эпштейна – Барра и гемофагоцитарный лимфогистиоцитоз». Границы иммунологии. 8: 1902. Дои:10.3389 / fimmu.2017.01902. ЧВК 5766650. PMID 29358936.
- ^ Усмани, Г. Нахид; Woda, Брюс A .; Ньюбургер, Питер Э. (2013). «Достижения в понимании патогенеза HLH». Британский журнал гематологии. 161 (5): 609–622. Дои:10.1111 / bjh.12293. ISSN 1365-2141. PMID 23577835.
- ^ а б Чжан, Кэцзянь; Филопович, Александра Х .; Джонсон, Джудит; Марш, Ребекка А.; Вильянуэва, Джойс (17 января 2013 г.). «Гемофагоцитарный лимфогистиоцитоз, семейный». GeneReviews. PMID 20301617. NBK1444.
- ^ Трапани Дж. А., Тиа К. Ю., Эндрюс М. и др. (Апрель 2013). «Мутации перфорина человека и подверженность множественным первичным ракам». Онкоиммунология. 2 (4): e24185. Дои:10.4161 / onci.24185. ЧВК 3654607. PMID 23734337.
- ^ Аллен, Карл (июнь 2008 г.). «Высокий уровень ферритина и диагностика гемофагоцитарного лимфогистиоцитоза». Детская кровь и рак. 50 (6): 1227–35. Дои:10.1002 / pbc.21423. PMID 18085676.
- ^ Шрам, Элисон (5 марта 2015 г.). «Выраженная гиперферритинемия не позволяет прогнозировать ГЛГ у взрослого населения». Кровь. 125 (10): 1548–52. Дои:10.1182 / кровь-2014-10-602607. PMID 25573993.
- ^ Дженкинс Р.В., Кларк С.Дж., Лукас Дж.Т. и др. (Ноябрь 2013). «Оценка роли секреторной сфингомиелиназы и биоактивных сфинголипидов как биомаркеров гемофагоцитарного лимфогистиоцитоза». Am. J. Hematol. 88 (11): E265–72. Дои:10.1002 / ajh.23535. ЧВК 4348111. PMID 23828274.
- ^ Лимфогистиоцитоз, + Гемофагоцитарный в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- ^ Бенсон Л.А., Ли Х., Хендерсон Л.А., Соломон И.Х., Солдатос А., Мерфи Дж., Билекова Б., Кеннеди А.Л., Ривкин М.Дж., Дэвис К.Дж., Хсу А.П., Холланд С.М., Гал В.А., Сундель Р.П., Леманн Л.Э., Ли М.А., Александреску С. , Дегар Б.А., Дункан К.Н., Горман М.П. (2019) Гемофагоцитарный лимфогистиоцитоз, изолированный от ЦНС, у детей. Neurol Neuroimmunol Neuroinflamm 6 (3): e560
- ^ Иордания МБ, Филипович А.Х. (октябрь 2008 г.). «Трансплантация гемопоэтических клеток при гемофагоцитарном лимфогистиоцитозе: путешествие в тысячу миль начинается с одного (большого) шага». Пересадка костного мозга. 42 (7): 433–7. Дои:10.1038 / bmt.2008.232. PMID 18679369.
- ^ Шрам, Элисон (7 мая 2015 г.). «Как я лечу гемофагоцитарный лимфогистиоцитоз у взрослого пациента». Кровь. 125 (19): 2908–14. Дои:10.1182 / кровь-2015-01-551622. PMID 25758828.
- ^ Фардет, Лоуренс (9 сентября 2014 г.). «Разработка и проверка HScore, шкалы для диагностики реактивного гемофагоцитарного синдрома». Артрит и ревматология. 66 (9): 2613–20. Дои:10.1002 / арт.38690. PMID 24782338.
- ^ Хайден, Анна (декабрь 2017 г.). «Растворимый рецептор интерлейкина-2 является чувствительным диагностическим тестом у взрослых HLH». Кровавые достижения. 1 (26): 2529–2534. Дои:10.1182 / bloodadvances.2017012310. ЧВК 5728644. PMID 29296904.
- ^ Рудман Спергель А., Валкович К., Прайс С. и др. (Ноябрь 2013). «Аутоиммунный лимфопролиферативный синдром, ошибочно диагностированный как гемофагоцитарный лимфогистиоцитоз». Педиатрия. 132 (5): e1440–4. Дои:10.1542 / пед.2012-2748. ЧВК 3813387. PMID 24101757.
- ^ Machowicz R, Janka G, Wiktor-Jedrzejczak W (март 2017 г.). «Похоже, но не то же самое: Дифференциальный диагноз ГЛГ и сепсиса». Критические обзоры в онкологии / гематологии. 114: 1–12. Дои:10.1016 / j.critrevonc.2017.03.023. PMID 28477737.
- ^ «Объявления для прессы - FDA одобряет первое лечение специально для пациентов с редким и опасным для жизни типом иммунного заболевания». 2019-03-06.
- ^ Парих, Самир (апрель 2014 г.). «Факторы прогноза и исходы у взрослых с гемофагоцитарным лимфогистиоцитозом». Труды клиники Мэйо. 89 (4): 484–92. Дои:10.1016 / j.mayocp.2013.12.012. PMID 24581757. Получено 14 декабря, 2015.
- ^ Фаркуар, Джеймс У .; Клеро, Альбер Э. (декабрь 1952 г.). «Семейный гемофагоцитарный ретикулез». Архив детских болезней. 27 (136): 519–525. Дои:10.1136 / adc.27.136.519. ЧВК 1988563. PMID 13008468.
- ^ Джанг, Хоанг Тхи Нам; Банно, Кейта; Минь, Ле Хуу Нхат; Трин, Лам Тайет; Loc, Le Thai; Элтобги, Асмаа; Тай, Луу Лам Тханг; Хан, Аднан; Туан, Нгуен Хоанг (15.08.2018). «Гемофагоцитарный синдром денге: систематический обзор и метаанализ по эпидемиологии, клиническим признакам, исходам и факторам риска». Обзоры в медицинской вирусологии. 28 (6): e2005. Дои:10.1002 / RMV.2005. ISSN 1052-9276. PMID 30109914. S2CID 52002485.
внешние ссылки
| Классификация | |
|---|---|
| Внешние ресурсы |
