Наследственная сенсорная и вегетативная нейропатия I типа - Hereditary sensory and autonomic neuropathy type I - Wikipedia
| Наследственная сенсорная и вегетативная нейропатия I типа | |
|---|---|
| Специальность | Неврология |
Наследственная сенсорная и вегетативная нейропатия I типа (HSAN I) или наследственная сенсорная нейропатия I типа (HSN I) представляет собой группу аутосомно-доминантный наследственные неврологические заболевания, влияющие на периферическая нервная система особенно на сенсорный и автономные функции. Отличительным признаком заболевания является выраженная потеря болевой и температурной чувствительности в дистальный части нижних конечностей. Вегетативные нарушения, если они присутствуют, проявляются как нарушение потоотделения.[1][2]
Начало болезни варьируется от юность и взрослая жизнь. Поскольку пострадавшие не могут чувствовать боль, незначительные ранки или волдыри в безболезненной области могут быть не сразу распознаны и могут перерасти в обширные и глубокие стопы. изъязвления. Как только происходит заражение, осложнения Такие как воспаление может последовать прогрессирующее разрушение подлежащих костей, что может потребовать ампутация окрестностей.[1][2][3][4]
HSAN I - самый распространенный из пяти типов HSAN. Как гетерогенную группу заболеваний HSAN I можно разделить на пять подтипов HSAN IA-E. Большинство из гены связанных с заболеваниями не выявлено. Однако молекулярные пути, ведущие к проявлению заболеваний, до конца не изучены. Следовательно, потенциальные цели терапевтических вмешательств неизвестны. Более того, генная терапия для пациентов с заболеваниями на сегодняшний день недоступна, поэтому поддерживающая терапия является единственным лечением, доступным для пациентов.[2]
Признаки и симптомы
Вначале больные часто отмечают потерю боли и чувствительности к температуре или все сенсорные модальности в их ногах. По мере прогрессирования заболевания сенсорные аномалии могут распространяться до колен. Однако они часто долгое время не замечают потери чувствительности.[5] Многие пораженные люди узнают о болезни только тогда, когда замечают безболезненные травмы и ожоги или когда обращаются за медицинской помощью по поводу медленно заживающих ран или язв стопы. Язвы на стопах могут появиться из-за постоянного давления, например, долгих прогулок или плохо сидящей обуви. Незначительные раны или волдыри могут привести к глубоким изъязвлениям стопы. Как только происходит инфекция, могут последовать такие осложнения, как воспаление и разрушение подлежащих костей.[1][2][3][6] Больные, не теряющие чувствительности, могут испытывать спонтанную боль.[3] Кроме того, у многих пораженных людей в разной степени проявляются симметричная дистальная мышечная слабость и истощение.[7][6]
HSAN I характеризуется выраженными сенсорными нарушениями, в основном потерей болевых ощущений и температурной чувствительности в дистальных отделах нижних конечностей. Потеря чувствительности также может распространяться на проксимальный части нижних и верхних конечностей по мере прогрессирования заболевания.[2] Некоторые больные не теряют чувствительность, а вместо этого испытывают сильные стреляющие, жгучие и стреляющие боли в конечностях или хобот. Вегетативные нарушения, если они присутствуют, проявляются снижением потоотделения.[3][8] Степень мотор нарушения очень разнообразны, даже внутри семьи, от отсутствия до тяжелых дистальных мышечная слабость и тратить.[1]
Заболевание медленно прогрессирует, но часто через долгое время серьезно вырабатывает у больных людей. Начало болезни колеблется между 2-м и 5-м десятилетием жизни,[2] хотя врожденный или иногда сообщалось о начале заболевания в детстве.[1][9] По мере прогрессирования заболевания пораженные люди теряют способность чувствовать боль в ступнях и ногах. Незначительные травмы в безболезненной области могут привести к медленно заживающим ранам, которые, если их сразу не распознать, могут перерасти в хронические язвы. Как только происходит заражение, эти язвы могут привести к тяжелым осложнения что приводит к деформация стопы, Такие как воспаление нижележащих костей, спонтанные переломы костей и прогрессирующие вырождение несущей суставы. Кроме того, деформация стопы способствует изменениям кожи, например: гиперкератоз в точках давления. Эти осложнения могут потребовать ампутация пораженной стопы.[3][8]
Биопсии серьезно пострадавших икроножный нерв (короткий подкожный нерв) у пациентов с HSAN I показали доказательства нейронный перерождение. Лишь очень немногие миелинизированный волокна наблюдались некоторые из которых проявляли признаки первичной (сегментарной) демиелинизации. Разумное количество немиелинизированных аксоны остались, хотя наличие стопок сплющенных Шванновская ячейка процессы предполагали немиелинизированную потерю аксонов.[1] Электрофизиологический тестирование предоставляет дополнительные доказательства того, что дегенерация нейронов лежит в основе заболевания. Сенсорные потенциалы обычно отсутствуют в нижних конечностях, но часто регистрируются или даже нормальны для верхних конечностей пациентов.[1][3] Кроме того, моторная проводимость медленный, возможно, подразумевает демиелинизирующий процесс.[10][11]
Причина
Достижения в области молекулярной генетики позволили идентифицировать большинство генов, связанных с HSAN I. Однако молекулярные механизмы, лежащие в основе заболевания, до конца не изучены и изучаются. Одна из задач исследования - выяснить, как повсеместно экспрессируются дефектные гены, которые участвуют в основных клеточных функциях, таких как сфинголипид метаболизм, поддержание органеллар честность, мембрана динамика и транскрипция регуляции, влияют на определенные популяции нейронов.[8]
HSAN IA
HSAN IA связан с гетерозиготный миссенс-мутации в SPTLC1 ген.[9][12][13][14] Ген кодирует белок SPTLC1, который вместе с белком SPTLC2 образует серинпальмитоилтрансферазу (SPT) у человека. SPT - это пиридоксаль-5'-фосфат -зависимый фермент который катализирует первый и ограничивающий скорость шаг в de novo биосинтез сфинголипидов.[15] Вместе с холестерин, сфинголипиды составляют основной компонент липидные рафты, структуры в плазматическая мембрана которые способствуют эффективному преобразование сигнала.[16] Много средний сфингоид базы и их производные, а также сложные сфинголипиды активны как внеклеточный и внутриклеточный регуляторы роста, дифференциации, миграции, выживания и клеточных реакций на стресс.[17]
Первоначально мутации в SPTLC1 ген были связаны с повышенной активностью SPT.[12] Последующие исследования скорее показали, что мутации снижают активность фермента.[18][19] Однако он не может объяснить аберрантные клеточные особенности, связанные со сфинголипидом, в гетерозиготных клетках, полученных от пациентов.[20] или клинические особенности HSAN IA у гетерозиготных мышей.[21] Эти результаты предполагают, что активность немутантного белка SPTLC1 может быть достаточной для поддержания нормального сфинголипида. биосинтез и жизнеспособность клеток. Следовательно, дегенерация нейронов в HSAN IA, вероятно, связана с более тонкими и довольно долгосрочными эффектами мутаций или, возможно, накоплением токсичных липидов, продуцируемых мутантными ферментами.[20]
Дальнейшие исследования подтвердили последнее мнение. Были показаны мутации in vitro для облегчения субстратной неразборчивости SPT. Мутантный SPT опосредует конденсацию не только своего нормального субстрата. серин, но и аланин или же глицин, с пальмитоил-коэнзим А. Реакции приводят к образованию двух аберрантных сфинголипидов. метаболиты 1-дезоксисфинганин и 1-дезоксиметил-сфинганин соответственно. Поскольку метаболиты не имеют гидроксильная группа что требуется для их дальнейшего преобразования и деградации, они накапливаются внутри клетки.[22][23] Было показано, что метаболиты более токсичны для сенсорных нейронов, чем для мотонейронов.[22] Они накапливаются в периферической нервной системе, где проявляется HSAN, но не в Центральная нервная система у мышей, несущих мутацию, связанную с HSAN IA.[24] Кроме того, диета, обогащенная серином, снижает уровень метаболитов и улучшает сенсорные и двигательные функции мышей. Небольшой клиническое испытание также показал аналогичные результаты. Эти исследования продемонстрировали, что измененная субстратная селективность мутантного SPT является ключом к патофизиология HSAN IA.[25]
HSAN IB
HSAN IB привязан к интервалу 3,42 см на хромосома 3p 22 – стр. 24.[26] Это открытие было подтверждено в другой семье с аналогичными клиническими признаками. Однако анализ мутаций генов в области-кандидате не выявил ни одного болезнетворного гена.[27] С тех пор об этой редкой форме HSAN I не сообщалось в других семьях. Ген, связанный с заболеванием, еще предстоит идентифицировать.[нужна цитата ]
HSAN IC
HSAN IC связан с гетерозиготными миссенс-мутациями в SPTLC2 ген. Ген кодирует белок SPTLC2, который является одним из двух подразделения SPT. Поскольку мутации в гене влияют на тот же фермент, что и мутации в гене SPTLC1 ген, молекулярная основа заболевания предположительно такая же, как у HSAN IA.[28]
Идентификатор HSAN
HSAN ID вызывается гетерозиготными миссенс-мутациями в ATL1 ген, который кодирует атластин-1.[29] Атластин-1 является членом связывающего динамин / Mx / гуанилат белка. надсемейство большого GTPases. Фермент содержит эндоплазматический ретикулум (ER) удерживающий фрагмент, что указывает на то, что он функционирует преимущественно в органелле. Он высоко экспрессируется в центральной нервной системе млекопитающих и обогащен гиппокамп и пирамидные нейроны.[30] Однако информация об экспрессии гена в периферической нервной системе все еще отсутствует.[8]
У плодовой мушки (Drosophila melanogaster ), атластин-1, как было показано, вызывает связывание и слияние мембран, прилегающих к ER, чтобы помочь поддерживать целостность ER.[31] Функция атластина-1 в решающей степени зависит от его активности ГТФазы. У людей мутация, связанная с HSAN ID, вызвала значительную потерю активности фермента GTPase, что привело к заметному нарушению сети ER.[29] Помимо поддержания целостности ER, атластин-1 также выполняет функции, связанные с нейронами. Фермент участвует в транспортировке и передаче сигналов рецепторы костного морфогенетического белка (BMP) I типа в зебра (Данио Рерио). Передача сигналов BMP участвует в ведении аксонов и синапс формирование, а также аксональный транспорт и организация микротрубочка сеть в развивающихся нейронах. Передача сигналов нарушается при нескольких нейродегенеративных расстройствах.[32] Он также регулирует динамику мембран в нейронах. конус роста в крысе.[33]
Мутации в ATL1 гены также являются частой причиной раннего начала наследственная спастическая параплегия (HSP) у человека.[34] Заболевание характеризуется прогрессирующей скованностью и сокращением (спастичность ) в нижних конечностях из-за повреждения или дисфункции нервов. Подавляющее большинство мутаций, связанных с HSP, представляют собой миссенс-мутации, которые разбросаны по всему пораженному белку. Было показано, что некоторые из этих мутаций снижают активность ГТФазы атластина-1. in vitro.[33] Однако уникальная молекулярная подпись мутаций или функциональных доменов ATL1 ген, пораженный у пациентов с HSAN ID и HSP, который мог бы объяснить различия в клинических характеристиках этих двух заболеваний, не ясен. Это открытие указывает на то, что дополнительные генетические факторы и / или факторы окружающей среды могут модулировать клиническое проявление основной причинной мутации.[8]
HSAN IE
HSAN IE связан с гетерозиготными миссенс-мутациями в DNMT1 ген, который кодирует ДНК-метилтрансфераза 1 (Dnmt1).[35] Dnmt1 принадлежит к семейству ферментов, которые катализируют перенос метильная группа из S-аденозилметионин к ДНК. Dnmt1 отдает предпочтение гемиметилированная ДНК, отсюда и название поддерживающей метилтрансферазы. Белок также имеет de novo Активность ДНК-метилтрансферазы, которая отвечает за создание метилирование шаблоны во время эмбриональное развитие.[36] Dnmt1 высоко экспрессируется в пост-митотический нейроны в центральной нервной системе взрослого, с максимальной экспрессией во время S-фаза из клеточный цикл.[37]
Мутации расположены в целевой последовательности ДНК. домен Dnmt1, который отвечает за хроматин связывания во время поздней S-фазы и для поддержания ассоциации Dnmt1 с ДНК во время G2 и М-фазы клеточного цикла. Мутант Dnmt1 неправильно свернут и не может связываться с гетерохроматин после S-фазы. Следовательно, мутантные белки быстро подвергаются деградации. У пациентов с мутациями наблюдается глобальное гипометилирование и локальное гиперметилирование. геномная ДНК. Эти наблюдения устанавливают формальную причинную связь между дефектами метилирования ДНК и заболеванием периферической нервной системы.[36]
Диагностика
Диагноз HSAN I основан на наблюдении описанных выше симптомов и подтверждается семейным анамнезом, предполагающим аутосомно-доминантное наследование. Диагноз также подтверждается дополнительными тестами, такими как исследования нервной проводимости в нижних конечностях для подтверждения сенсорной и моторной невропатии. В спорадических случаях приобретенные невропатии, такие как диабетическая стопа синдром и алкогольная невропатия, можно исключить с помощью магнитно-резонансная томография и путем междисциплинарного обсуждения между неврологами, дерматологами и ортопедами.[1][2]
В диагностике болезни произошла революция благодаря выявлению генов, вызывающих заболевание. Диагноз теперь основан на обнаружении мутаций прямым последовательность действий генов. Тем не менее точный фенотипирование пациентов остается решающим в диагностике.[4] Беременным пациенткам прерывание беременности не рекомендуется.[1][2]
HSAN I следует отличать от наследственная моторная и сенсорная нейропатия (HMSN) и другие типы наследственных сенсорных и вегетативных невропатий (HSAN II-V). Выраженные сенсорные аномалии и изъязвления стопы - единственные признаки, позволяющие отличить HSAN I от HMSN.[2][38][39] HSAN II можно отличить от HSAN I, поскольку он передается по аутосомному рецессивный признак у него более раннее начало заболевания, потеря чувствительности распространяется на все тело, и у него меньше или совсем нет двигательных симптомов. HSAN III-V можно легко отличить от HSAN I из-за начала врожденного заболевания. Более того, эти типы демонстрируют типичные особенности, такие как преобладающие вегетативные нарушения при HSAN III или врожденная потеря боли и ангидроз в HSAN IV.[1][2]
Подтипы
В 1993 году Питер Джеймс Дайк разделил HSAN I на пять подтипов HSAN IA-E на основе наличия дополнительных функций. Считалось, что эти особенности являются результатом генетического разнообразия HSAN I (т. Е. Экспрессии разных генов, разных аллели одного гена или модифицирующих генов) или факторов окружающей среды.[40] Позднее молекулярно-генетические исследования подтвердили генетическое разнообразие болезни.[41]
| Подтип | Ген или локус | Мутация (ДНК / аминокислота)* | Клинические признаки | Возраст начала | OMIM* |
|---|---|---|---|---|---|
| Я | SPTLC1 | 399T> G / C133W; 398G> A / C133Y;[12][13] 431T> A / V144D[12] | Преобладающая потеря болевой и температурной чувствительности; иногда начальный признак с длительным сохранением чувства вибрации; жгучие и стреляющие боли; язвенные увечья; вариабельное вовлечение дистальных двигателей | Подростковый возраст* | 162400 |
| IB | 3п24-п22[26][27] | неизвестный | Преобладающая сенсорная нейропатия с кашлем и гастроэзофагеальный рефлюкс; изъязвления стопы (редко) | Совершеннолетие | 608088 |
| IC | SPTLC2[28] | 1075G> A / V359M; 1145G> T / G382V; 1510A> T / I504F | Потеря болевого и температурного ощущения; стреляющая боль; язвенные увечья; вариабельное дистальное моторное вовлечение; акро-увечья осложнения | Совершеннолетие*[42] | 613640 |
| Я БЫ | ALT1[29] | 196G> C / E66Q; 976delG / [V326WfsX8]* | Тяжелая дистальная потеря чувствительности и амиотрофия в нижних конечностях; трофические изменения кожи и ногтей; язвенные увечья | Совершеннолетие | 613708 |
| IE | DNMT1[35] | 1484A> G / Y495C; 1470-1472TCC> ATA / D490E-P491Y* | Утрата всех соматосенсорных модальностей; стреляющая боль; язвенные увечья; сенсонейрональная потеря слуха, слабоумие | Совершеннолетие | 614116 |
- ^ ДНК; A: аденин, T: тимин, G: гуанин, C: цитозин. Аминокислота; C: цистеин, W: триптофан, Y: тирозин, V: валин, D: аспарагиновая кислота, M: метионин, G: глицин, I: изолейцин, F: фенилаланин, E: глутаминовая кислота, Q: глутамин, P: пролин.
- ^ Нуклеотидная делеция, по прогнозам, вызовет большое усечение С-конца белка.
- ^ Тройное изменение нуклеотидов.
- ↑ Врожденное начало у одного пациента с гипотонией, катарактой, микроцефалией и параличом голосовых связок.
- ^ Начало в детстве у одного пациента.
- ^ OMIM: Интернет-Менделирующее наследование в человеке.
Управление
Генная терапия для пациентов с HSAN I на сегодняшний день недоступна, поэтому поддерживающая терапия является единственным доступным лечением для пациентов. Калечащие язвы осложнения являются наиболее серьезными, заметными и ведущими диагностическими признаками в HSAN I. Поскольку осложнения имитируют язвы стопы, вызванные диабетической невропатией, лечение язв стопы и инфекций может осуществляться в соответствии с рекомендациями, данными для лечения диабетической стопы, которое начинается с ранней стадии. и точное консультирование пациентов о факторах риска развития язв стопы. Также следует включить ортопедический уход и использование хорошо сидящей обуви без точек давления. В последнее время лечение осложнений стопы достигло эффективного уровня, позволяющего лечить амбулаторный основание. Раннее лечение осложнений со стопой часто позволяет избежать госпитализации и, в частности, ампутации. В общем, принципы лечения - это снятие давления на язвы, искоренение инфекции и после этого специальная защитная обувь.[1][2]
Генетическое консультирование
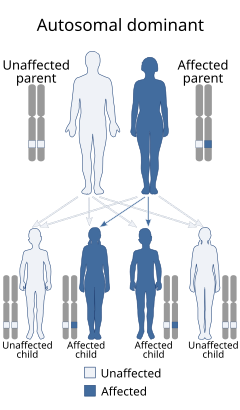
Генетическое консультирование - важный инструмент для предотвращения новых случаев, если этого хотят члены семьи из группы риска. Соответствующее генетическое консультирование основано на точном диагнозе. Поэтому клиницисты и консультанты-генетики должны использовать язвенно-калечные осложнения в качестве основных диагностических критериев.[43] Поскольку болезнь наследуется по аутосомно-доминантному признаку, существует Менделевский риск 50% для последующих поколений независимо от пола. Пренатальное тестирование на беременность с повышенным риском возможно, если в семье выявлена мутация, вызывающая заболевание. Прогностическое тестирование полезно молодым людям, чтобы избежать серьезных осложнений заболевания.[1][2]
Прогноз
Если пациенты с HSAN I получат соответствующее лечение и консультации, прогноз будет хорошим. Раннее лечение инфекций стопы позволяет избежать серьезных осложнений. Тем не менее, осложнения поддаются лечению, что обеспечивает приемлемое качество жизни. Заболевание медленно прогрессирует и не влияет на продолжительность жизни при правильном лечении признаков и симптомов.[1][2]
Эпидемиология
HSAN I представляет собой клинически и генетически неоднородную группу заболеваний низкого распространенность. Подробные эпидемиологические данные в настоящее время отсутствуют. Частота заболевания по-прежнему отражается в отчетах о нескольких пострадавших семьях. Хотя впечатляющие клинические характеристики HSAN I видны неврологи, врачи общей практики, ортопеды и дерматологи, это заболевание все еще может быть недооценено, особенно для единичных случаев и пациентов, которые не проявляют характерных клинических признаков.[1][2]
История
Первое описание спорадических и семейных случаев заболевания, совместимого с HSAN, было сделано во французской литературе в 19 веке. Основным признаком семейного случая были язвы на единственный ног.[44][45] В 1922 году Хикс описал подобное состояние в лондонской семье, в которой 10 человек страдали от перфорирующий язвы на ногах, стреляющие и стреляющие боли и глухота.[46] Впоследствии Jughenn et al.[47] и Денни-Браун[7] продемонстрировал, что патологический процесс, лежащий в основе клинических признаков, наблюдаемых в этих условиях, был невропатия, а не анатомический беспорядок как было предложено ранее. С тех пор сообщалось о многих других семейных состояниях с похожими клиническими проявлениями.[3][48][49][50][51][52][5][10][чрезмерное цитирование ]
Ранние названия унаследованных невропатий были даны после наиболее характерных черт или предполагаемого основного механизма заболеваний, таких как Mal Perforant Du pied, язвенно-калечная нейропатия, наследственные перфоративные язвы, семейный трофоневроз, семейная сирингомиелия, наследственная сенсорная корешковая невропатия и другие. В дерматологический В литературе термин синдром Тевенара все еще используется для обозначения семейных форм, тогда как синдром Бюро-Баррьера используется для обозначения спорадических форм.[41]
В 1975 году Дайк и Ота предложили описательную классификацию болезней и ввели термин наследственная сенсорная нейропатия (HSN), который позже был изменен на наследственную сенсорную и вегетативную невропатию (HSAN), учитывая существенное участие вегетативной нервной системы в заболеваниях.[3] Заболевания были разделены на пять типов HSAN I-V в зависимости от способа наследования, преобладающих клинических признаков и возраста в начало. Заболевания, которые характеризуются аутосомно-доминантным типом наследования и дебютом заболевания в подростковом или зрелом возрасте, классифицируются в HSAN I.[41][40]
Смотрите также
- Наследственная сенсорная и вегетативная нейропатия
- Наследственная сенсорная и вегетативная нейропатия III типа (Семейная дизавтономия )
- Наследственная сенсорная и вегетативная нейропатия IV типа (Врожденная нечувствительность к боли при ангидрозе )
- Наследственная моторная и сенсорная нейропатия
- Жизнь без боли
Рекомендации
- ^ а б c d е ж грамм час я j k л м п Houlden, H; King, R; Блейк, Дж; Гровс, М; Любовь, S; Вудворд, C; Хамманс, S; Николл, Дж; Леннокс, G; О'Донован, генеральный директор; Габриэль, C; Томас, ПК; Рейли, ММ (февраль 2006 г.). «Клиническая, патологическая и генетическая характеристика наследственной сенсорной и вегетативной нейропатии 1 типа (HSAN I)». Мозг: журнал неврологии. 129 (Pt 2): 411–25. Дои:10.1093 / мозг / awh712. PMID 16364956.
- ^ а б c d е ж грамм час я j k л м п Ауэр-Грумбах, М. (18 марта 2008 г.). «Наследственная сенсорная нейропатия I типа». Журнал редких заболеваний Orphanet. 3: 7. Дои:10.1186/1750-1172-3-7. ЧВК 2311280. PMID 18348718.
- ^ а б c d е ж грамм час Дайк, П.Дж.; Охта, М. (1975). «Нервная атрофия и дегенерация, поражающие преимущественно периферические сенсорные нейроны». In Dyck, PJ; Томас, ПК; Ламберт, EH (ред.). Периферическая невропатия. Торонто: WB Saunders Co., стр. 791–812.
- ^ а б Рейли, ММ; Застенчивый, ME (2009). «Диагностика и новые методы лечения генетических невропатий» (PDF). J Neurol Neurosurg Psychiatry. 80 (12): 1304–14. Дои:10.1136 / jnnp.2008.158295. PMID 19917815. S2CID 28303.
- ^ а б Уоллес, округ Колумбия (1970). «Наследственная сенсорная корешковая нейропатия: семейное исследование». Медицинская монография Арчдалла № 8. Сидней: Australian Medical Pub Co Ltd., стр. 13–22.
- ^ а б Auer-Grumbach M, Timmerman V, De Vriendt E, Wagner K, Hartung HP (1999). «Клиническая и генетическая гетерогенность при язвенно-калечных невропатиях». Дж. Перифер. Nerv. Syst. 4: 238.
- ^ а б Денни-Браун, Д. (ноябрь 1951 г.). «Наследственная сенсорная корешковая нейропатия». Журнал неврологии, нейрохирургии и психиатрии. 14 (4): 237–52. Дои:10.1136 / jnnp.14.4.237. ЧВК 499526. PMID 14898294.
- ^ а б c d е Роттье, А; Баэтс, Дж; Тиммерман, В; Янссенс, К. (24 января 2012 г.). «Механизмы болезни при наследственных сенсорных и вегетативных невропатиях». Обзоры природы Неврология. 8 (2): 73–85. Дои:10.1038 / nrneurol.2011.227. PMID 22270030. S2CID 23592739.
- ^ а б Роттиер А., Баетс Дж., Де Вриндт Э., Якобс А., Ауэр-Грумбах М., Леви Н., Бонелло-Пало Н., Килич С.С., Вайс Дж., Насименто А., Свинкельс М., Крюйт М.С., Джорданова А., Де Йонге П., Тиммерман В. (Октябрь 2009 г.). «Гены наследственных сенсорных и вегетативных нейропатий: корреляция генотип-фенотип». Мозг: журнал неврологии. 132 (Пт 10): 2699–711. Дои:10.1093 / мозг / awp198. ЧВК 2759337. PMID 19651702.
- ^ а б Whitaker, JN; Фальчак, З.М. Engel, WK; Blaese, RM; Стробер, W (май 1974 г.). «Наследственная сенсорная нейропатия. Связь с повышенным синтезом иммуноглобулина А.». Архив неврологии. 30 (5): 359–71. Дои:10.1001 / archneur.1974.00490350017003. PMID 4132408.
- ^ Dubourg, O; Бархуми, К; Аззедин, H; Birouk, N; Брайс, А; Bouche, P; Легерн, Э (октябрь 2000 г.). «Фенотипическое и генетическое исследование семьи с наследственной сенсорной нейропатией и выраженной слабостью». Мышцы и нервы. 23 (10): 1508–14. Дои:10.1002 / 1097-4598 (200010) 23:10 <1508 :: aid-mus6> 3.0.co; 2-д.. PMID 11003785.
- ^ а б c d Докинз, JL; Халм, диджей; Brahmbhatt, SB; Ауэр-Грумбах, М; Николсон, Джорджия (март 2001 г.). «Мутации в SPTLC1, кодирующем серинпальмитоилтрансферазу, длинноцепочечную субъединицу-1, вызывают наследственную сенсорную нейропатию I типа». Природа Генетика. 27 (3): 309–12. Дои:10.1038/85879. PMID 11242114. S2CID 25336349.
- ^ а б Беджауи К., Ву С., Шеффлер М.Д., Хаан Г., Эшби П., Ву Л., де Йонг П., Браун Р.Х. (март 2001 г.). «SPTLC1 мутирован при наследственной сенсорной нейропатии 1 типа». Природа Генетика. 27 (3): 261–2. Дои:10.1038/85817. PMID 11242106. S2CID 34442339.
- ^ Николсон, Джорджия; Докинз, JL; Блэр, ИП; Кеннерсон, ML; Гордон, MJ; Черрисон, AK; Нэш, Дж; Бананис, Т. (май 1996 г.). «Ген наследственной сенсорной нейропатии I типа (HSN-I) отображается на хромосоме 9q22.1-q22.3». Природа Генетика. 13 (1): 101–4. Дои:10.1038 / ng0596-101. PMID 8673084. S2CID 12356846.
- ^ Ханада, К. (2003). «Серин пальмитоилтрансфераза, ключевой фермент метаболизма сфинголипидов». Biochim Biophys Acta. 1632 (1–3): 16–30. Дои:10.1016 / S1388-1981 (03) 00059-3. PMID 12782147.
- ^ Саймонс, К; Иконен, Э (5 июня 1997 г.). «Функциональные рафты в клеточных мембранах». Природа. 387 (6633): 569–72. Bibcode:1997Натура.387..569S. Дои:10.1038/42408. PMID 9177342. S2CID 4359503.
- ^ Hannun, YA; Обейд, Л. М. (февраль 2008 г.). «Принципы передачи сигналов биоактивными липидами: уроки сфинголипидов». Обзоры природы Молекулярная клеточная биология. 9 (2): 139–50. Дои:10.1038 / nrm2329. PMID 18216770. S2CID 8692993.
- ^ Гейбл, К; Вешать; Monaghan, E; Бачикова, Д; Натараджан, М; Уильямс, Р. Данн, TM (22 марта 2002 г.). «Мутации в генах дрожжевых LCB1 и LCB2, в том числе соответствующие мутации типа I наследственной сенсорной нейропатии, в основном инактивируют серинпальмитоилтрансферазу». Журнал биологической химии. 277 (12): 10194–200. Дои:10.1074 / jbc.M107873200. PMID 11781309.
- ^ Беджауи К., Учида Ю., Ясуда С., Хо М., Нисидзима М., Браун Р. Х., Холлеран В. М., Ханада К. (ноябрь 2002 г.). «Мутации наследственной сенсорной нейропатии типа 1 оказывают доминирующее негативное влияние на серинпальмитоилтрансферазу, критически важную для синтеза сфинголипидов». Журнал клинических исследований. 110 (9): 1301–8. Дои:10.1172 / JCI16450. ЧВК 151618. PMID 12417569.
- ^ а б Дедов В.Н., Дедова И.В., Меррил А.Х., Николсон Г.А. (2 марта 2004 г.). «Активность частично ингибированной серинпальмитоилтрансферазы достаточна для нормального метаболизма сфинголипидов и жизнеспособности клеток пациента HSN1». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1688 (2): 168–75. Дои:10.1016 / j.bbadis.2003.12.005. PMID 14990347.
- ^ Ходжати, MR; Ли, Z; Цзян, XC (15 октября 2005 г.). «Дефицит сериновой пальмитоил-КоА трансферазы (SPT) и уровни сфинголипидов у мышей». Biochimica et Biophysica Acta (BBA) - молекулярная и клеточная биология липидов. 1737 (1): 44–51. Дои:10.1016 / j.bbalip.2005.08.006. PMID 16216550.
- ^ а б Пенно А., Рейли М.М., Хоулден Х., Лаура М., Рентч К., Нидеркофлер В., Стоекли Е. Т., Николсон Г., Эйхлер Ф., Браун Р. Х., фон Эккардштейн А., Хорнеманн Т. (9 апреля 2010 г.). «Наследственная сенсорная нейропатия 1 типа вызвана накоплением двух нейротоксичных сфинголипидов». Журнал биологической химии. 285 (15): 11178–87. Дои:10.1074 / jbc.M109.092973. ЧВК 2856995. PMID 20097765.
- ^ Гейбл, К; Гупта, SD; Вешать; Niranjanakumari, S; Хармон, JM; Данн, TM (23 июля 2010 г.). «Болезненная мутация в активном центре серинпальмитоилтрансферазы вызывает каталитическую распущенность». Журнал биологической химии. 285 (30): 22846–52. Дои:10.1074 / jbc.M110.122259. ЧВК 2906276. PMID 20504773.
- ^ Эйхлер Ф.С., Хорнеманн Т., Маккэмпбелл А., Кулджис Д., Пенно А., Варде Д., Тамразиан Э, Гарофало К., Ли Х.Дж., Кини Л., Селиг М., Фрош М., Гейбл К., фон Эккардштайн А., Вульф К.Дж., Гуан Джи, Хармон JM, Dunn TM, Brown RH (18 ноября 2009 г.). «Сверхэкспрессия субъединицы SPT1 дикого типа снижает уровни дезоксисфинголипидов и восстанавливает фенотип HSAN1». Журнал неврологии. 29 (46): 14646–51. Дои:10.1523 / JNEUROSCI.2536-09.2009. ЧВК 3849752. PMID 19923297.
- ^ Гарофало К., Пенно А., Шмидт Б. П., Ли Х. Дж., Фрош М. П., фон Эккардштейн А., Браун Р. Х., Хорнеманн Т., Эйхлер Ф. С. (декабрь 2011 г.). «Пероральный прием L-серина снижает выработку нейротоксичных дезоксисфинголипидов у мышей и людей с наследственной сенсорной вегетативной нейропатией 1 типа» (PDF). Журнал клинических исследований. 121 (12): 4735–45. Дои:10.1172 / JCI57549. ЧВК 3225995. PMID 22045570.
- ^ а б Весна, ПДж; Кок, С; Николсон, Джорджия; Ing, AJ; Шпионы, JM; Бассетт, ML; Кэмерон, Дж; Kerlin, P; Bowler, S; Так, R; Поллард, JD (декабрь 2005 г.). «Аутосомно-доминантная наследственная сенсорная нейропатия с хроническим кашлем и гастроэзофагеальным рефлюксом: клинические признаки в двух семьях, связанные с хромосомой 3p22-p24». Мозг: журнал неврологии. 128 (Pt 12): 2797–810. Дои:10.1093 / мозг / awh653. PMID 16311270.
- ^ а б Кок, С; Кеннерсон, ML; Весна, ПДж; Ing, AJ; Поллард, JD; Николсон, Джорджия (сентябрь 2003 г.). «Локус наследственной сенсорной нейропатии с кашлем и гастроэзофагеальным рефлюксом на хромосоме 3p22-p24». Американский журнал генетики человека. 73 (3): 632–7. Дои:10.1086/377591. ЧВК 1180687. PMID 12870133.
- ^ а б Роттиер А., Ауэр-Грумбах М., Янссенс К., Баетс Дж., Пенно А, Алмейда-Соуза Л., Ван Хоф К., Якобс А., Де Вриндт Е., Шлоттер-Вайгель Б., Лёшер В., Вондрачек П., Зееман П., Де Йонге П. , Ван Дейк П., Йорданова А., Хорнеманн Т., Тиммерман В. (8 октября 2010 г.). «Мутации в субъединице SPTLC2 серин-пальмитоилтрансферазы вызывают наследственную сенсорную и вегетативную нейропатию I типа». Американский журнал генетики человека. 87 (4): 513–22. Дои:10.1016 / j.ajhg.2010.09.010. ЧВК 2948807. PMID 20920666.
- ^ а б c Guelly C, Zhu PP, Leonardis L, Papić L, Zidar J, Schabhüttl M, Strohmaier H, Weis J, Strom TM, Baets J, Willems J, De Jonghe P, Reilly MM, Fröhlich E, Hatz M, Trajanoski S, Pieber Т.Р., Янеке А.Р., Блэкстоун С., Ауэр-Грумбах М. (7 января 2011 г.). «Целевое высокопроизводительное секвенирование определяет мутации атластина-1 как причину наследственной сенсорной нейропатии I типа». Американский журнал генетики человека. 88 (1): 99–105. Дои:10.1016 / j.ajhg.2010.12.003. ЧВК 3014370. PMID 21194679.
- ^ Zhu, PP; Паттерсон, А; Лавуа, B; Стадлер, Дж; Шоеб, М; Патель, Р. Блэкстоун, К. (5 декабря 2003 г.). «Клеточная локализация, олигомеризация и мембранная ассоциация наследственного спастического параплегии 3A (SPG3A) белка атластина». Журнал биологической химии. 278 (49): 49063–71. Дои:10.1074 / jbc.M306702200. PMID 14506257.
- ^ Орсо, G; Пендин, Д; Лю, S; Тозетто, Дж; Мосс, TJ; Фауст, Дж. Э .; Micaroni, M; Егорова А; Мартинуцци, А; McNew, JA; Дага, А (20 августа 2009 г.). «Гомотипическое слияние мембран ER требует динамин-подобного атластина GTPase». Природа. 460 (7258): 978–83. Bibcode:2009Натура.460..978O. Дои:10.1038 / природа08280. PMID 19633650. S2CID 4337931.
- ^ Фасье, К; Hutt, JA; Scholpp, S; Ламсден, А; Giros, B; Nothias, F; Schneider-Maunoury, S; Houart, C; Хазан, Дж (ноябрь 2010 г.). «Атластин рыбок данио контролирует подвижность и архитектуру спинных моторных аксонов посредством ингибирования пути BMP». Природа Неврология. 13 (11): 1380–7. Дои:10.1038 / номер 2662. PMID 20935645. S2CID 24018464.
- ^ а б Zhu, PP; Содерблом, К; Tao-Cheng, JH; Стадлер, Дж; Блэкстоун, К. (15 апреля 2006 г.). «Белок SPG3A атластин-1 обогащен конусами роста и способствует удлинению аксонов во время развития нейронов». Молекулярная генетика человека. 15 (8): 1343–53. Дои:10.1093 / hmg / ddl054. PMID 16537571.
- ^ Дюрр, А; Камузат, А; Колин, Э; Таллаксен, К; Hannequin, D; Коутиньо, П; Fontaine, B; Росси, А; Gil, R; Руссель, К; Руберг, М; Стеванин, Г; Брайс, А (декабрь 2004 г.). «Мутации Atlastin1 часто встречаются при аутосомно-доминантной спастической параплегии с началом у молодых». Архив неврологии. 61 (12): 1867–72. Дои:10.1001 / archneur.61.12.1867. PMID 15596607.
- ^ а б Кляйн С.Дж., Ботуян М.В., Ву Й., Уорд С.Дж., Николсон Г.А., Хамманс С., Ходжо К., Яманиши Х., Карпф А.Р., Уоллес, округ Колумбия, Саймон М., Лендер К., Бордман Л.А., Каннингем Дж. М., Смит Г.Э., Личи В.Дж., Боэс Б. , Аткинсон Э. Дж., Мидда С., Б. Дайк П. Дж., Паризи Дж. Э., Мер Дж., Смит Д. И., Дайк П. Дж. (Июнь 2011 г.). «Мутации в DNMT1 вызывают наследственную сенсорную невропатию с деменцией и потерей слуха». Природа Генетика. 43 (6): 595–600. Дои:10,1038 / нг. 830. ЧВК 3102765. PMID 21532572.
- ^ а б Портела, А; Эстеллер, М. (октябрь 2010 г.). «Эпигенетические модификации и болезни человека». Природа Биотехнологии. 28 (10): 1057–68. Дои:10.1038 / nbt.1685. PMID 20944598. S2CID 3346771.
- ^ Tawa, R; Оно, Т; Куришита, А; Окада, S; Хиросе, С. (октябрь 1990 г.). «Изменение уровня метилирования ДНК в пре- и постнатальном периоде у мышей». Дифференциация; Исследования в области биологического разнообразия. 45 (1): 44–8. Дои:10.1111 / j.1432-0436.1990.tb00455.x. PMID 2292362.
- ^ Квон, JM; Эллиотт, JL; Да, туалет; Иванович, Дж; Скаварда, штат Нью-Джерси; Moolsintong, PJ; Гудфеллоу, П. Джей (октябрь 1995 г.). «Присвоение второго локуса Шарко-Мари-Тута типа II хромосоме 3q». Американский журнал генетики человека. 57 (4): 853–8. ЧВК 1801519. PMID 7573046.
- ^ Эллиотт, JL; Квон, JM; Goodfellow, PJ; Йи, WC (январь 1997 г.). «Наследственная моторная и сенсорная нейропатия IIБ: клинико-электродиагностическая характеристика». Неврология. 48 (1): 23–8. Дои:10.1212 / wnl.48.1.23. PMID 9008488. S2CID 46145090.
- ^ а б Дайк, П.Дж. (1993). «Нейрональная атрофия и дегенерация, преимущественно затрагивающие периферические сенсорные и вегетативные нейроны». In Dyck, PJ; Томас, ПК; Гриффин, JW; Низкий, PA; Подушло, JF (ред.). Периферическая невропатия (3-е изд.). Филадельфия: WB Saunders Co., стр. 1065–1093.
- ^ а б c Auer-Grumbach M, De Jonghe P, Verhoeven K, Timmerman V, Wagner K, Hartung HP, Nicholson GA (март 2003 г.). «Аутосомно-доминантные наследственные невропатии с выраженной потерей чувствительности и увечьями: обзор». Архив неврологии. 60 (3): 329–34. Дои:10.1001 / archneur.60.3.329. PMID 12633143.
- ^ Klein, CJ; Wu, Y; Kruckeberg, KE; Hebbring, SJ; Андерсон, С.А.; Каннингем, JM; Дайк, П.Дж.; Klein, DM; Тибодо, С. Н.; Дайк, П.Дж. (июль 2005 г.). «Анализ мутаций SPTLC1 и RAB7 при доминантно наследственных и идиопатических сенсорных невропатиях». Журнал неврологии, нейрохирургии и психиатрии. 76 (7): 1022–4. Дои:10.1136 / jnnp.2004.050062. ЧВК 1739730. PMID 15965219.
- ^ Ауэр-Грумбах, М. (май 2004 г.). «Наследственные сенсорные невропатии». Наркотики сегодняшнего дня. 40 (5): 385–94. Дои:10.1358 / точка.2004.40.5.850487. PMID 15319794.
- ^ Леплат, М (1846). "Dictionnaire de medecine en 30 томов". Париж. 30: 25.
- ^ Нелатон, М. (1852). "Особая привязанность". Gazette Hopitaux Civils Militaires. 4: 13–20.
- ^ Хикс, Э. (1922). «Наследственная перфоративная язва стопы». Ланцет. 199 (5138): 319–21. Дои:10.1016 / с0140-6736 (01) 27079-2.
- ^ Jughenn, H; Krucke, W; Вадулла (1949). "Zur Frage der familiaren syringomyelie (Klinisch-anatomische Untersuchungen uber familiare neurovasculare Dystrophie der Extremitaten)". Arch Psychiat Nervenkr. 182: 153–76.
- ^ Кэмпбелл, AM; Хоффман, HL (март 1964 г.). «Сенсорная корешковая невропатия, связанная с истощением мышц в двух случаях». Мозг: журнал неврологии. 87: 67–74. Дои:10.1093 / мозг / 87.1.67. PMID 14152213.
- ^ Тевенар, А. (1942). "L'acropathie ulcero-mutilante familiale". Rev. Neurol. (Париж). 74: 193–203.
- ^ Тевенар, А (1953). "L'acropathie ulcero-mutilante familiale". Acta Neurol Belg. 53: 1–23.
- ^ Джексон, М. (2 апреля 1949 г.). «Семейная пояснично-крестцовая сирингомиелия и значение ошибок развития спинного мозга и колонны». Медицинский журнал Австралии. 1 (14): 433–9. Дои:10.5694 / j.1326-5377.1949.tb67733.x. PMID 18129941.
- ^ Уоллес, округ Колумбия (1965). «Наблюдения за преимущественно сенсорной наследственной невропатией». Труды Австралийской ассоциации неврологов. 3: 101–9. PMID 5881776.
внешняя ссылка
| Классификация |
|---|
