Белок железо-сера - Iron–sulfur protein - Wikipedia
Белки железо-сера (или же железо-серные белки в Британская орфография ) находятся белки характеризуется наличием железо-серные кластеры содержащий сульфид -связанные центры ди-, три- и тетражелеза в переменных состояния окисления. Кластеры железо-сера обнаружены в различных металлопротеины, такой как ферредоксины, а также НАДН-дегидрогеназа, гидрогеназы, коэнзим Q - цитохром с редуктаза, сукцинат - коэнзим Q редуктаза и нитрогеназа.[1] Кластеры железо-сера наиболее известны своей ролью в окислительно-восстановительные реакции электронного транспорта в митохондриях и хлоропластах. И комплекс I, и комплекс II окислительного фосфорилирования имеют несколько кластеров Fe – S. У них много других функций, включая катализ, как показано на рисунке. аконитаза, генерация радикалов, как показано СЭМ -зависимые ферменты, и как доноры серы в биосинтезе липоевая кислота и биотин. Кроме того, некоторые белки Fe – S регулируют экспрессию генов. Белки Fe – S уязвимы для атак биогенных оксид азота, формируя динитрозильные комплексы железа. В большинстве белков Fe – S концевые лиганды на Fe являются тиолатами, но существуют исключения.[2]
Преобладание этих белков в метаболических путях большинства организмов приводит некоторых ученых к предположению, что соединения железа и серы играли важную роль в происхождение жизни в железо-серная мировая теория.
Структурные мотивы
Почти во всех Fe – S-белках Fe-центры являются тетраэдрическими, а концевые лиганды представляют собой тиолатосерные центры из цистеинильных остатков. Сульфидные группы бывают двух- или трехкоординированными. Наиболее распространены три различных типа кластеров Fe – S с этими особенностями.
Кластеры 2Fe – 2S

Простейшая полиметаллическая система [Fe2S2], состоит из двух ионов железа, соединенных мостиком между двумя сульфид-ионами и координированных четырьмя цистеинил лиганды (в Fe2S2 ферредоксины ) или двумя цистеины и два гистидины (в Белки Риске ). Окисленные белки содержат два Fe3+ ионов, тогда как восстановленные белки содержат один Fe3+ и один Fe2+ ион. Эти разновидности существуют в двух степенях окисления (FeIII)2 и FeIIIFeII. CDGSH железо-серный домен также связан с кластерами 2Fe-2S.
Кластеры 4Fe – 4S
Общий мотив состоит из четырех ионов железа и четырех ионов сульфида, размещенных в вершинах кластер кубанового типа. Центры Fe обычно дополнительно координируются цистеиниловыми лигандами. [Fe4S4] белки-переносчики электронов ([Fe4S4] ферредоксины ) можно подразделить на низкопотенциальные (бактериального типа) и высокопотенциальные (HiPIP) ферредоксины. Ферредоксины с низким и высоким потенциалом связаны следующей окислительно-восстановительной схемой:

В HiPIP кластер перемещается между [2Fe3+, 2Fe2+] (Fe4S42+) и [3Fe3+, Fe2+] (Fe4S43+). Потенциалы для этой окислительно-восстановительной пары находятся в диапазоне от 0,4 до 0,1 В. В бактериальных ферредоксинах пара степеней окисления [Fe3+, 3Fe2+] (Fe4S4+) и [2Fe3+, 2Fe2+] (Fe4S42+). Потенциалы для этой окислительно-восстановительной пары находятся в диапазоне от -0,3 до -0,7 В. Два семейства кластеров 4Fe – 4S разделяют Fe4S42+ степень окисления. Разница в окислительно-восстановительных парах объясняется степенью водородной связи, которая сильно изменяет основность цистеинилтиолатных лигандов.[нужна цитата ] Еще одна окислительно-восстановительная пара, которая все еще восстанавливает больше, чем бактериальные ферредоксины, участвует в нитрогеназа.
Некоторые кластеры 4Fe – 4S связываются с субстратами и поэтому классифицируются как кофакторы ферментов. В аконитаза кластер Fe – S связывает аконитировать в одном центре Fe, в котором отсутствует тиолатный лиганд. Кластер не подвергается окислительно-восстановительным процессам, но служит Кислота Льюиса катализатор для превращения цитрата в изоцитрат. В радикальный SAM ферменты, кластер связывает и уменьшает S-аденозилметионин для образования радикала, который участвует во многих биосинтезах.[3]
Кластеры 3Fe – 4S
Известно также, что белки содержат [Fe3S4] центры, которые содержат на одно железо меньше, чем более распространенные [Fe4S4] ядер. Три иона сульфида связывают два иона железа каждый, а четвертый сульфид связывает три иона железа. Их формальная степень окисления может варьироваться от [Fe3S4]+ (все-Fe3+ форма) в [Fe3S4]2− (все-Fe2+ форма). В ряде железо-серных белков [Fe4S4] может быть обратимо преобразован путем окисления и потери одного иона железа до [Fe3S4] кластер. Например, неактивная форма аконитаза обладает [Fe3S4] и активируется добавлением Fe2+ и восстановитель.
Другие кластеры Fe – S
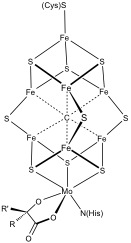
Обычны более сложные полиметаллические системы. Примеры включают кластеры 8Fe и 7Fe в нитрогеназа. Угарный газ дегидрогеназа и [FeFe] -гидрогеназа также есть необычные кластеры Fe – S. Специальный 6-координированный цистеином [Fe4S3] кластер обнаружен в кислород-толерантных мембраносвязанных [NiFe] гидрогеназах.[4][5]
Биосинтез
Биосинтез кластеров Fe – S хорошо изучен.[6][7][8]Биогенез кластеров железной серы изучен наиболее полно у бактерий. Кишечная палочка и A. vinelandii и дрожжи С. cerevisiae. К настоящему времени идентифицированы по крайней мере три различные биосинтетические системы, а именно системы nif, suf и isc, которые впервые были идентифицированы у бактерий. Система nif отвечает за кластеры фермента нитрогеназы. Системы suf и isc более общие.
Система дрожжей isc описана лучше всего. Некоторые белки образуют биосинтетический аппарат через путь isc. Процесс происходит в два основных этапа: (1) кластер Fe / S собирается на каркасном белке с последующим (2) переносом предварительно сформированного кластера на белки-реципиенты. Первый этап этого процесса происходит в цитоплазма из прокариотический организмов или в митохондриях эукариотический организмы. Таким образом, у высших организмов кластеры переносятся из митохондрии и включаются во внемитохондриальные ферменты. Эти организмы также обладают набором белков, вовлеченных в процессы переноса и включения кластеров Fe / S, которые не гомологичны белкам, обнаруженным в прокариотических системах.
Синтетические аналоги
О синтетических аналогах природных кластеров Fe – S впервые сообщил Holm и коллеги.[9] Обработка солей железа смесью тиолатов и сульфидов дает такие производные, как (Et4N )2Fe4S4(SCH2Ph)4].[10][11]
Смотрите также
Рекомендации
- ^ С. Дж. Липпард, Дж. М. Берг «Принципы биоинорганической химии» Университетские научные книги: Милл-Вэлли, Калифорния; 1994 г. ISBN 0-935702-73-3.
- ^ Bak, D. W .; Эллиотт, С. Дж. (2014). «Альтернативные кластерные лиганды FeS: настройка окислительно-восстановительных потенциалов и химия». Curr. Мнение. Chem. Биол. 19: 50–58. Дои:10.1016 / j.cbpa.2013.12.015.
- ^ Сьюзен С. Ван; Перри А. Фрей (2007). «S-аденозилметионин как окислитель: радикальное суперсемейство SAM». Тенденции в биохимических науках. 32 (3): 101–10. Дои:10.1016 / j.tibs.2007.01.002. PMID 17291766.
- ^ Фрич, Дж; Scheerer, P; Frielingsdorf, S; Крощинский, С; Фридрих, B; Ленц, О; Спан, CMT (16 октября 2011 г.). «Кристаллическая структура толерантной к кислороду гидрогеназы раскрывает новый железо-серный центр». Природа. 479 (7372): 249–252. Дои:10.1038 / природа10505. PMID 22002606.
- ^ Шомура, Й; Юн, Канзас; Нишихара, H; Хигучи, Y (2011-10-16). «Структурная основа кластера [4Fe-3S] в толерантной к кислороду мембраносвязанной [NiFe] -гидрогеназе». Природа. 479 (7372): 253–256. Дои:10.1038 / природа10504. PMID 22002607.
- ^ Джонсон Д., Декан Д. Р., Смит А. Д., Джонсон М.К. (2005). «Структура, функция и формирование биологических кластеров железо-сера». Ежегодный обзор биохимии. 74 (1): 247–281. Дои:10.1146 / annurev.biochem.74.082803.133518. PMID 15952888.
- ^ Джонсон, М. и Смит, A.D. (2005) Белки железо-сера в: Энциклопедия неорганической химии (King, R.B., Ed.), 2-е изд., John Wiley & Sons, Chichester.
- ^ Lill R, Mühlenhoff U (2005). «Железо-серно-белковый биогенез у эукариот». Тенденции в биохимических науках. 30 (3): 133–141. Дои:10.1016 / j.tibs.2005.01.006. PMID 15752985.
- ^ Т. Херсковиц; Б. А. Аверилл; Р. Х. Холм; Дж. А. Иберс; У. Д. Филлипс; Дж. Ф. Вейхер (1972). «Структура и свойства синтетического аналога бактериальных железо-серных белков». Труды Национальной академии наук. 69 (9): 2437–2441. Дои:10.1073 / пнас.69.9.2437. ЧВК 426959. PMID 4506765.
- ^ Holm, R.H .; Ло, В. (2016). «Структурные превращения синтетических и связанных с белками кластеров железа и серы». Chem. Rev. 116: 13685–13713. Дои:10.1021 / acs.chemrev.6b00276.
- ^ Lee, S.C .; Низкий.; Холм, Р. Х. (2014). "Развитие биомиметической химии кластеров железо-сера кубанового типа и более высокой ядерности". Химические обзоры. 114: 3579–3600. Дои:10.1021 / cr4004067. ЧВК 3982595. PMID 24410527.
дальнейшее чтение
- Бейнерт, Х. (2000). «Белки железо-сера: древние структуры, полные сюрпризов». J. Biol. Неорг. Chem. 5 (1): 2–15. Дои:10.1007 / s007750050002. PMID 10766431.
- Beinert, H .; Кили, П.Дж. (1999). «Белки Fe-S в сенсорных и регулирующих функциях». Curr. Мнение. Chem. Биол. 3 (2): 152–157. Дои:10.1016 / S1367-5931 (99) 80027-1. PMID 10226040.
- Джонсон, М. (1998). «Белки железо-сера: новые роли старых кластеров». Curr. Мнение. Chem. Биол. 2 (2): 173–181. Дои:10.1016 / S1367-5931 (98) 80058-6. PMID 9667933.
- Номенклатурный комитет Международного союза биохимиков (NC-IUB) (1979). «Номенклатура железо-серных белков. Рекомендации 1978 г.». Евро. J. Biochem. 93 (3): 427–430. Дои:10.1111 / j.1432-1033.1979.tb12839.x. PMID 421685.
- Нудлман, Л., Ловелл, Т., Лю, Т., Химо, Ф. и Торрес, Р.А. (2002). «Понимание свойств и энергетики белков железо-серы от простых кластеров до нитрогеназы». Curr. Мнение. Chem. Биол. 6 (2): 259–273. Дои:10.1016 / S1367-5931 (02) 00309-5. PMID 12039013.CS1 maint: несколько имен: список авторов (связь)
- Спиро, Т.Г., Под ред. (1982). Белки железо-сера. Нью-Йорк: Вили. ISBN 0-471-07738-0.CS1 maint: несколько имен: список авторов (связь)
внешняя ссылка
- Железо-сера + белки в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Примеры железо-серных кластеров
