Злокачественная рабдоидная опухоль - Malignant rhabdoid tumour
Эта статья может быть слишком техническим для большинства читателей, чтобы понять. Пожалуйста помогите улучшить это к сделать понятным для неспециалистов, не снимая технических деталей. (Апрель 2019) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Злокачественная рабдоидная опухоль | |
|---|---|
| Специальность | Онкология |
Злокачественная рабдоидная опухоль (MRT) - очень агрессивная форма опухоль первоначально описывался как вариант Опухоль Вильмса, что в первую очередь почка опухоль, встречающаяся преимущественно у детей.
МРТ впервые была описана как вариант Опухоль Вильмса почки в 1978 г.[1] МРТ - редкое и крайне злокачественное детство новообразование. Позднее сообщалось о рабдоидных опухолях за пределами почки во многих тканях, включая печень, мягкие ткани и Центральная нервная система. Было зарегистрировано несколько случаев первичной внутричерепной МРТ с момента ее выделения в качестве отдельного объекта в 1978 году. рабдоид был использован из-за его сходства с рабдомиосаркома под световым микроскопом. Точный патогенез МРТ неизвестен.
В мозжечок является наиболее частым местом проведения первичной интрацеребральной МРТ (т. е. атипичная тератоидная рабдоидная опухоль ). Biggs et al. были первыми, кто сообщил о первичной внутричерепной МРТ примерно в 1987 году.[2]
Хотя происхождение ячейки неизвестно, цитогенетические исследования предложили общую генетическую основу для рабдоидных опухолей независимо от местоположения с аномалиями в хромосома 22 часто встречающиеся.
Генетика
Сообщалось о случаях наличия у ребенка как атипичных тератоидных рабдоидных опухолей головного мозга, так и рабдоидных опухолей почек. Weeks и коллеги сообщили о 111 случаях почечного рабдоида, из которых 13,5% также имели злокачественное новообразование центральной нервной системы. Было высказано предположение, что мутация INI зародышевой линии может предрасполагать ребенка к этим опухолям. В литературе есть ссылки на новый диагноз, называемый синдромом рабдоидной предрасположенности, связанный с геном hSNF5 / INI1.
Эти опухоли были связаны с мутациями связанного с SWI / SNF матрикс-зависимого актин-зависимого регулятора члена 1 подсемейства В хроматина (SMARCB1 ) расположен на длинной руке хромосома 22 (22q11) и активатор транскрипции BRG1 / АТФ-зависимый ремоделер хроматина (SMARCA4 ) расположен на коротком плече хромосома 19 (19p13.2).[3]
Рабдоидные опухоли почек и головного мозга
Значительные дебаты были сосредоточены на том, являются ли атипичные тератоидные рабдоидные опухоли тем же, что и рабдоидные опухоли почек (то есть просто экстраренальные МРТ). Недавнее признание того, что как атипичные тератоидные / рабдоидные опухоли ЦНС, так и МРТ имеют делеции гена INI1 в хромосоме 22, указывает на то, что рабдоидные опухоли почек и мозга являются идентичными или близкородственными образованиями, хотя вариант ЦНС, как правило, имеет свои мутации в таксоне 9. и MRT в других местах. Это наблюдение неудивительно, потому что рабдоидные опухоли в обоих местах обладают схожими гистологическими, клиническими и демографическими характеристиками. Более того, у 10-15% пациентов с МРТ наблюдаются синхронные или метахронные опухоли головного мозга, многие из которых являются вторыми первичными злокачественными рабдоидными опухолями. Это сходство исключает сложные рабдоидные опухоли, которые встречаются в основном у взрослых.
Диагностика
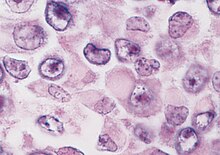
Гистологический диагноз злокачественной рабдоидной опухоли зависит от идентификации характерных рабдоидных клеток - крупных клеток с эксцентрично расположенными ядрами и обильной эозинофильной цитоплазмой. Однако гистология может быть неоднородной, и диагностика МРТ часто затруднена. Могут произойти неправильные классификации.
В MRT ген INI1 (SMARCB1) на хромосоме 22q функционирует как классический ген-супрессор опухоли. Инактивация INI1 может происходить через делецию, мутацию или приобретенный UPD.[4]
В недавнем исследовании[4] При кариотипировании массива однонуклеотидного полиморфизма были обнаружены делеции или LOH 22q в 49/51 рабдоидных опухолях. Из них 14 были копийно-нейтральными LOH (или приобретенными UPD), которые можно обнаружить с помощью кариотипирования массива SNP, но не с помощью FISH, цитогенетики или массива CGH. MLPA обнаружила гомозиготную делецию одного экзона в одном образце, которая была ниже разрешающей способности массива SNP. Кариотипирование массива SNP может использоваться, например, для отличия медуллобластомы с изохромосомой 17q от первичной рабдоидной опухоли с потерей 22q11.2. Если указано, затем можно использовать молекулярный анализ INI1 с использованием MLPA и прямого секвенирования. После обнаружения связанных с опухолью изменений можно провести анализ ДНК зародышевой линии пациента и родителей, чтобы исключить наследственную или de novo мутацию зародышевой линии или делецию INI1, чтобы можно было провести соответствующую оценку риска рецидива.[4]
Прогноз
Независимо от местоположения все рабдоидные опухоли очень агрессивны, имеют плохой прогноз и, как правило, возникают у детей в возрасте до двух лет.
Смотрите также
Рекомендации
- ^ Беквит Дж. Б., Палмер Н. Ф. (1978). «Гистопатология и прогноз опухолей Вильмса: результаты Первого национального исследования опухолей Вильмса». Рак. 41 (5): 1937–48. Дои:10.1002 / 1097-0142 (197805) 41: 5 <1937 :: AID-CNCR2820410538> 3.0.CO; 2-U. PMID 206343.
- ^ Пи Джей Биггс; Гарен П.Д.; Пауэрс JM; Гарвин А.Дж. (1987). «Злокачественная рабдоидная опухоль центральной нервной системы». Патология человека. 18 (4): 332–337. Дои:10.1016 / S0046-8177 (87) 80161-2. PMID 3030922.
- ^ Finetti MA, Grabovska Y, Bailey S, Williamson D (2020) Трансляционная геномика злокачественных рабдоидных опухолей: текущее влияние и будущие возможности. Семин Рак Биол
- ^ а б c Джексон Э.М., Сиверт А.Дж., Гай Х и др. (Март 2009 г.). «Геномный анализ с использованием массивов олигонуклеотидов на основе однонуклеотидного полиморфизма высокой плотности и мультиплексной лигирования-зависимой амплификации зонда обеспечивает всесторонний анализ INI1 / SMARCB1 в злокачественных рабдоидных опухолях». Clin. Рак Res. 15 (6): 1923–30. Дои:10.1158 / 1078-0432.CCR-08-2091. ЧВК 2668138. PMID 19276269.
Литература
- Доннер Л. Р., Уэйнрайт Л. М., Чжан Ф., Бигель Дж. А. (2007). «Мутация гена INI1 в сложной рабдоидной опухоли эндометрия». Гм. Патол. 38 (6): 935–9. Дои:10.1016 / j.humpath.2006.12.003. ЧВК 1963314. PMID 17376508.
- Джеффри С. Доум, доктор медицины; Д. Эшли Хилл, доктор медицины (8 января 2007 г.). «Злокачественная рабдоидная опухоль». EMedicine от WebMD.
- Перри А., Фуллер К.Э., Джудкинс А.Р., Денер Л.П., Бигель Дж. А. (2005). «Экспрессия INI1 сохраняется в сложных рабдоидных опухолях, включая рабдоидные менингиомы». Мод. Патол. 18 (7): 951–8. Дои:10.1038 / modpathol.3800375. PMID 15761491.
- Бигель Дж. А., Фогельгрен Б., Уэйнрайт Л. М., Чжоу Дж. Ю., Беван Г., Рорке Л. Б. (2000). «Мутация INI1 зародышевой линии у пациента с атипичной тератоидной опухолью центральной нервной системы и рабдоидной опухолью почек» (аннотация страница). Гены Хромосомы Рак. 28 (1): 31–7. Дои:10.1002 / (SICI) 1098-2264 (200005) 28: 1 <31 :: AID-GCC4> 3.0.CO; 2-Y. PMID 10738300.
- Huret J, Sevenet N (2000). «Синдром рабдоидной предрасположенности». Атлас генетики и цитогенетики в онкологии и гематологии (1): 31–7. Архивировано из оригинал на 2005-12-26.
- Уикс Д.А., Беквит Дж. Б., Миерау Г. В., Лаки Д. В. (1989). «Рабдоидная опухоль почки. Отчет о 111 случаях из Национального центра патологии опухолей Вильмса». Американский журнал хирургической патологии. 13 (6): 439–58. Дои:10.1097/00000478-198906000-00001. PMID 2543225.
внешняя ссылка
| Классификация |
|---|
