Атипичная тератоидная рабдоидная опухоль - Atypical teratoid rhabdoid tumor - Wikipedia
| Атипичная тератоидная рабдоидная опухоль | |
|---|---|
 | |
| МРТ AT / RT | |
| Специальность | Онкология |
An атипичная тератоидная рабдоидная опухоль (AT / RT) является редким опухоль обычно диагностируется в детстве. Хотя обычно опухоль головного мозга, AT / RT может произойти в любом месте Центральная нервная система (CNS), включая спинной мозг. Около 60% будет в задняя черепная ямка (особенно мозжечок ). Один обзор оценил 52% в задней черепной ямке, 39% - в задней ямке. супратенториальный примитивные нейроэктодермальные опухоли (sPNET), 5% находятся в шишковидная железа, 2% являются позвоночник, и 2% - мультифокальные.[1]
В Соединенных Штатах ежегодно диагностируется трое детей на 1 000 000 или около 30 новых случаев ПТ / ЛТ. AT / RT составляет около 3% педиатрических раки ЦНС.[2]Около 17% всех онкологических заболеваний у детей поражает ЦНС, что делает эти виды рака наиболее распространенной солидной опухолью у детей.[нужна цитата ] Выживаемость при опухолях ЦНС составляет около 60%. Рак головного мозга у детей является второй по значимости причиной смерти от рака у детей сразу после лейкемия. Последние тенденции предполагают, что частота общей диагностики опухолей ЦНС увеличивается примерно на 2,7% в год. По мере того, как методы диагностики с использованием генетических маркеров улучшаются и используются все чаще, ожидается, что доля диагнозов AT / RT будет расти.
AT / RT была признана юридическим лицом только в 1996 году и добавлена к Всемирная организация здоровья Классификация опухолей головного мозга в 2000 г. (степень IV).[3] Относительно недавняя классификация и редкость способствовали первоначальному ошибочному диагнозу и неоптимальной терапии. Это привело к исторически плохому прогнозу.[4]
Текущие исследования сосредоточены на использовании химиотерапия протоколы, которые эффективны против рабдомиосаркома в сочетании с хирургическим вмешательством и лучевой терапией.
Недавние исследования с использованием мультимодальной терапии показали значительно улучшенные данные о выживаемости. В 2008 году Институт рака Дана-Фарбер в Бостоне сообщил о двухлетней общей выживаемости 53% и бессобытийной выживаемости 70% (средний возраст при постановке диагноза - 26 месяцев).[5] В 2013 году Венский медицинский университет сообщил, что пятилетняя общая выживаемость составила 100%, а выживаемость без событий - 89% (средний возраст на момент постановки диагноза - 24 месяца).[6]
Показатели выживаемости могут быть значительно улучшены, если вначале будет поставлен правильный генетический диагноз и после этого будет применено специальное мультимодальное лечение.
Признаки и симптомы
Клинические признаки и симптомы зависят от расположения опухоли.
Поскольку многие опухоли возникают в задняя ямка, они проявляются, как и другие опухоли задней черепной ямки, часто с головной болью, рвотой, летаргия, и атаксия (нетвердая походка). Случай семимесячного ребенка с первичным опухоль позвоночника представленный прогрессивным параплегия сообщалось о ненормальном ощущении в ногах.[7]
Генетика
Генетический сходство было обнаружено внутри рабдоидных опухолей. В частности, хромосомный 22 удаление очень часто встречается в AT / RT. В хромосома 22 область содержит hSNF5 / INI1 ген который, кажется, функционирует как классический подавитель опухолей ген.[8] Большинство рабдоидных опухолей имеют INI1 делеции, происходят ли они в ЦНС, почках или где-либо еще. Этот мутация рассматривается как «первый удар», который предрасполагает детей к злокачественным новообразованиям. INI1 / hSNF5, компонент хроматин ремоделирующий комплекс SWI / SNF, является критическим опухолевым супрессором, биаллельно инактивированным в рабдоидных опухолях. Идентификация INI1 как опухолевый супрессор облегчает точную диагностику рабдоидных опухолей.
Скорость транскрипция для SWI / SNF и HDAC комплексы, кажется, регулируются INI1 ген. Комплекс SWI / SNF играет роль в ремоделировании хроматина. AT / RT - первая опухоль головного мозга у детей, для которой был идентифицирован ген-кандидат-супрессор опухоли. Мутация или удаление в INI1 / hSNF5 Ген встречается в большинстве опухолей AT / RT. До 90% случаев AT / RT связаны с делецией 22 хромосомы. В основном это точечные мутации в hSNF5 / INI1 ген (то есть можно диагностировать AT / RT без делеции 22 хромосомы в другом месте). В hSNF5 / INI1 ген регулирует около 15 белков в структуре хроматина. В дополнение OPN ген имеет более высокую экспрессию в опухолях AT / RT. Считается, что все виды рака AT / RT не связаны с hSNF5 / INI1 ген, поскольку 14 дополнительных белков в структуре хроматина контролируются другими генами. Существуют также некоторые новые мышиные модели рака AT / RT, а также экспериментальные клеточные линии, полученные из опухолей. Несмотря на эти достижения, функция гена еще не изучена. Недостаточно известно о функции INI1, как независимого модулятора экспрессии гена, или через его связь с SWI / SNF комплекс, чтобы иметь возможность использовать специфические целевые биологические агенты для лечения. Проспективные клинические и биологические исследования крайне необходимы для понимания эффективности терапевтических вмешательств, а также роли гена.
Риск для братьев и сестер и других членов семьи
Атипичные тератоидные / рабдоидные опухоли очень редки, и об абсолютном риске для братьев и сестер в литературе не сообщается. Однако существуют некоторые сообщения о наличии AT / RT у двух членов одной семьи или у одного члена семьи с AT / RT, а у другого - почечной рабдоидной опухоли или другой опухоли ЦНС. Предполагается, что они возникают из зародышевый генетические мутации у родителя, общие для затронутых братьев и сестер.
- Известна семья из трех поколений, в которой у двух сводных братьев были диагностированы атипичные тератоидные / рабдоидные опухоли ЦНС (AT / RT). У двух мальчиков, которым был поставлен диагноз в возрасте 2 и 17 месяцев, была вставочная мутация зародышевой линии в экзоне 4 INI1 ген, унаследованный от здоровой матери. Дядя по материнской линии умер в детстве от опухоли мозга и злокачественной рабдоидной опухоли почки. Идентификация двух незатронутых носителей в семье, разделяющей мутацию зародышевой линии и рабдоидную опухоль, подтверждает гипотезу о том, что могут существовать различные риски развития рабдоидной опухоли в контексте мутации зародышевой линии. Большинство рабдоидных опухолей могут возникать в период развития. Это семейство подчеркивает важность анализа мутаций у всех пациентов с подозрением на рабдоидную опухоль.[9]
- В первом случае отчет о монозиготный близнецы, оба с опухолями головного мозга, имеющими похожие генетические изменения, авторы предполагают общий генетический путь.[10]
- Сообщалось о случае у младенца, у которого развились как AT / RT, так и почечные рабдоидные опухоли, которые были идентичны по макроскопической и иммунологической гистологии.[11]
- В одной семье было несколько поколений опухолей задней черепной ямки, включая рабдоидные опухоли и карцинома сосудистого сплетения. Мутация зародышевой линии (SMARCB1) был обнаружен как у пораженных, так и у некоторых здоровых членов семьи.[12]
- Двум сестрам был поставлен диагноз AT / RT с разницей в 15 дней. В отчете о случае указано, что нет кариотипический аномалий не отмечалось.[13]
- У трех братьев и сестер произошла мутация SMARCB1 ген и у одного было сосудистое сплетение карцинома а у двух был AT / RT. Хотя у матери была нормальная соматическая ДНК, мутация, по-видимому, была унаследована от материнской зародышевой линии из-за мутации во время оогенез.[14]
- Izycka-Swieszewska et al. описывают пятимесячного ребенка с AT / RT, у отца которого была диагностирована примитивная нейроэктодермальная опухоль (PNET) позвоночного канала. Флуоресцентный на месте гибридизация Анализ показал значительные генетические различия в образцах, которые предполагают, что возникновение этих вирулентных злокачественных новообразований ЦНС в пределах одной семьи было случайным.[15]
Патология
AT / RT и рабдоидная опухоль имеют общий термин «рабдоидная», потому что под микроскопом обе опухоли напоминают рабдомиосаркома.

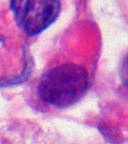
Гистология
Опухоль гистопатология это перемешанные мелкие и большие клетки. В ткань этой опухоли содержит много разных типов клеток, включая рабдоидные клетки, большие веретенообразные клетки, эпителиальный и мезенхимальные клетки, и области, напоминающие примитивная нейроэктодермальная опухоль (PNET). До 70% опухоли может состоять из PNET-подобных клеток. Ультраструктура характерные завитки промежуточные нити видны в рабдоидные опухоли (как и при рабдоидных опухолях на любом участке тела). Ho и соавторы обнаружили серповидные охватывающие клетки, о чем ранее не сообщалось, во всех 11 случаях AT / RT.[16]
Иммуногистохимия

Иммуногистохимическое окрашивание широко используется в диагностике и лечении рака. Специфические молекулярные маркеры характерны для определенных типов рака. Иммуногистохимия также широко используется в фундаментальных исследованиях для понимания распределения и локализации биомаркеров в различных частях ткани. Белки, обнаруженные в ATeratoid / RT:
- Виментин -положительный
- Цитокератин -положительный
- Нейронспецифическая енолаза-положительная
- Антиген-положительный результат на эпителиальной мембране
- Глиальный фибриллярный кислый белок - положительный
- Синаптофизин
- Хромогранин
- Гладкая мышца актин
- Desmin
- Карциноэмбрионарный антиген
- CD99 антиген;[17][18]
- С-100
- нейрофиламенты
- AFP - не найден
- ХГЧ - отрицательный
Цитогенетические исследования
Цитогенетика это исследование генетической структуры опухоли. Флуоресцентный на месте гибридизация может помочь найти мутацию или аномалию, которая может способствовать росту опухоли.[19] Было показано, что этот метод полезен для идентификации некоторых опухолей и различения двух гистологически похожих опухолей друг от друга (таких как AT / RT и PNET). В частности, медуллобластмы / PNET могут быть цитогенетически дифференцированы от AT / RT, поскольку хромосомные делеции 17p относительно обычны для медуллобластомы, а аномалии 22q11.2 не наблюдаются. Однако делеции хромосомы 22 очень распространены при AT / RT.
По важности hSNF5 / INI1 Ген, расположенный на хромосомной полосе 22q11.2, выделен, так как наличия мутации достаточно, чтобы изменить диагноз с медуллобластомы или PNET на более агрессивную классификацию AT / RT. Однако эта мутация отсутствует в 100% случаев. Следовательно, если мутация не присутствует в классическом иммуногистохимическом и морфологическом паттерне AT / RT, тогда диагноз остается AT / RT.
Диагностика
Стандартное обследование для AT / RT включает:
- Магнитно-резонансная томография (МРТ) головного и спинного мозга
- Поясничная пункция искать болезнь M1
- Компьютерная томография (КТ) грудной клетки и живота для проверки на опухоль
- Аспирация костного мозга проверить наличие опухолей костей. Иногда врач выполняет трансплантация стволовых клеток
- Биопсия костного мозга
- Рентген
Первоначальный диагноз опухоли ставится с помощью рентгенографический изучать (МРТ[20] или же CT -). Если сначала была проведена КТ, обычно выполняется МРТ, поскольку изображения часто более подробны и могут выявить ранее не обнаруженные метастатический опухоли в других отделах головного мозга. Кроме того, МРТ позвоночник обычно выполняется. Опухоль AT / RT часто распространяется на позвоночник. AT / RT сложно диагностировать только на основании рентгенологического исследования; Обычно патолог должен выполнить цитологический или генетический анализ.
Рассмотрение спинномозговая жидкость важно (CSF), так как у трети пациентов будет внутричерепное диссеминация с вовлечением CSF. Крупные опухолевые клетки, эксцентриситет ядер и выступающие ядрышки - последовательные результаты.[21] Обычно только небольшая часть биопсий AT / RT содержит рабдоидные клетки, что затрудняет диагностику. Все чаще рекомендуется проводить генетический анализ опухоли головного мозга, особенно для определения наличия делеции в гене INI1 / hSNF5 (по всей видимости, это составляет более 80% случаев). Правильный диагноз опухоли имеет решающее значение для любого протокола. Исследования показали, что от 8% до более 50% опухолей AT / RT диагностируются неправильно.[нужна цитата ]
Классификация
AT / RT может иметь отношение к злокачественная рабдоидная опухоль (MRT), который возникает вне ЦНС, обычно в почках.[нужна цитата ] Обнаружение того, что AT / RT и MRT имеют делеции INI1 ген[нужна цитата ] указывает на то, что рабдоидные опухоли почек и мозга, по крайней мере, тесно связаны. AT / RT и MRT также имеют похожие гистология и аналогичные клинические и демографические особенности. Более того, 10–15% пациентов с МРТ имеют одновременные или последующие опухоли головного мозга, многие из которых являются вторичными или первичными.
Дифференциальная диагностика
Важнейшим шагом в планировании лечения является определение правильной гистологии опухоли. Неправильная идентификация гистологии опухоли может привести к ошибкам в лечении и прогнозе.[22]
Атипичная тератоидная / рабоидная опухоль очень похожа на медуллобластому,[23] примитивная нейроэктодермальная опухоль, карцинома сосудистого сплетения, и некоторые виды опухоль зародышевых клеток.[нужна цитата ] Поскольку рабдоидные характеристики не являются единственным компонентом AT / RT, некоторые участки AT / RT могут напоминать другие опухоли. Эти характеристики могут присутствовать только в фокусных областях или могут быть менее выраженными.
Рассмотрение AT / RT при подозрении на медуллобластому или PNET важно, особенно у детей в возрасте до одного года. Цитогенетический исследования могут помочь отличить MB / PNET от AT / RT. Некоторые виды опухолей половых клеток выделяют онкомаркеры AFP или же бХГЧ; AT / RT - нет.[нужна цитата ]
Появление на рентгенологическом исследовании
AT / RT могут происходить на любых участках в CNS; однако около 60% находятся в задней ямке или области мозжечка. Исследование ASCO показало 52% задней черепной ямки; 39% sPNET; 5% шишковидная железа; 2% позвоночник, и 2% мультифокальные.[1]
Внешний вид опухолей на КТ и МРТ неспецифичен, имеет тенденцию к большим размерам, кальцификации, некроз (отмирание тканей) и кровотечение (кровотечение). Сами по себе радиологические исследования не могут идентифицировать AT / RT; патолог почти всегда должен оценить образец ткани мозга.
Повышенная клеточность опухоли может показаться на КТ без трансформации как увеличенное ослабление. Солидные части опухоли часто усиливаются при контрастном обнаружении МРТ. Т1 и Т2 взвешенные изображения переменные. Предконтрастные T2-взвешенные изображения могут показывать изосигнал или слегка гиперсигнал. Твердые компоненты опухоли могут усиливаться контрастом, но не всегда. МРТ-исследования, по-видимому, более способны выявить метастатические очаги в других внутричерепных, а также внутриспинальных местах.
Для выявления метастазов необходимы предоперационные и последующие исследования.
Уход
Хирургия
Хирургия играет решающую роль в получении ткань сделать точный диагноз. Сама по себе операция не лечит. Кроме того, 30% AT / RT расположены супратенториально, и существует склонность к мостомозжечковому углу,[24] что затрудняет хирургическую резекцию. У одной трети или более детей будет диссеминированное заболевание на момент диагностики. Тотальная или почти полная резекция часто невозможна.
Химиотерапия
Около 50% AT / RT будут временно отвечать, но химиотерапия сам по себе редко бывает лечебным. Стандартное лечение AT / RT неизвестно. Различные химиотерапевтические агенты использовались против AT / RT, которые также используются против других опухолей ЦНС, включая цисплатин, карбоплатина, циклофосфамид, винкристин, и этопозид. Немного схемы химиотерапии перечислены ниже:
- Клиническое испытание CCG CCG-9921 было запущено в 1993 году и опубликовало свои результаты в 2005 году. Предложенные методы лечения не имели различных результатов и не улучшали предыдущие методы лечения.[25] Гейер опубликовал обзор химиотерапии 299 младенцев с опухолями ЦНС, в котором оценивали скорость ответа, бессобытийную выживаемость (EFS) и токсичность двух химиотерапевтических схем лечения детей младше 36 месяцев со злокачественными опухолями головного мозга. Пациенты были случайным образом распределены по одной из двух схем индукционной химиотерапии (винкристин, цисплатин, циклофосфамид и этопозид винкристин, карбоплатин, ифосфамид и этопозид). Интенсивная индукционная химиотерапия привела к высокому уровню ответа злокачественных опухолей головного мозга у младенцев. Выживаемость была сопоставима с таковой в предыдущих исследованиях, и большинство выживших пациентов не получали лучевую терапию.[25]
- Саркома протоколы. В литературе было как минимум одно сообщение о злокачественных рабдоидных опухолях ЦНС, рассматриваемых как внутричерепные опухоли высокой степени злокачественности. саркома. В этих трех случаях была проведена хирургическая операция, химиотерапия, лучевая терапия и тройное лечение. интратекальный химиотерапия, аналогичная рекомендациям Межгруппового исследования рабдомиосаркомы III.[26]
- Интратекальный протоколы. Одна из трудностей с опухолями головного и спинного мозга заключается в том, что гематоэнцефалический барьер нужно пересечь, чтобы лекарство могло попасть в опухоль. Один из механизмов доставки лекарства - это устройство, называемое Водохранилище Оммая. Это устройство имеет некоторые общие характеристики с шунтом, в котором трубка хирургическим путем помещается в жидкость, окружающую мозг, и резервуар в форме луковицы, прикрепленный к трубке, помещается под кожу черепа. Когда ребенок получит интратекальный химиотерапия, лекарство вводится в эту емкость. В других случаях интратекальные химиотерапевтические агенты доставляются через поясничная пункция (спинномозговая пункция). Действующий детский консорциум по опухолям головного мозга Протокол использует интратекальный мафосфамид, предварительно активированный циклофосфамид производное, в дополнение к другим способам, чтобы попытаться воздействовать на эту опухоль.[27]
- Высокодозная химиотерапия с спасением стволовых клеток. В этой терапии используется химиотерапия в дозах, достаточно высоких, чтобы полностью подавить Костный мозг. До начала этой терапии у ребенка есть центральная линия размещены и стволовые клетки собраны. После терапии эти клетки возвращаются ребенку. вырастить костный мозг. Спасение стволовых клеток или аутологичный трансплантация костного мозга, изначально считалось полезным для широкой группы пациентов, но снизился за история химиотерапии протоколы.
Радиационная терапия
Традиционная практика лечения опухолей головного мозга у детей заключалась в применении химиотерапии и отсрочке радиационная терапия до тех пор, пока ребенок не достигнет возраста трех лет. Эта стратегия основана на наблюдениях за детьми в возрасте до трех лет, у которых в результате облучения головного мозга наблюдаются серьезные долгосрочные осложнения. Однако отдаленные результаты AT / RT настолько плохи, что некоторые протоколы требуют предварительной лучевой терапии, часто, несмотря на молодой возраст.[28]
Доза и объем облучения не были стандартизированы, но радиация, похоже, улучшает выживаемость. Использование излучения у детей младше трех лет ограничено из-за риска серьезных нейрокогнитивных нарушений. Чтобы вылечить эту опухоль, используются протоколы, использующие конформное локальное излучение у маленьких детей.
Внешний луч (конформное) излучение использует несколько лучей, которые пересекаются в месте расположения опухоли; нормальная ткань головного мозга получает меньше радиации, и когнитивные функции в меньшей степени страдают.
Излучение пучка протонов предлагалось только в Массачусетская больница общего профиля в Бостоне и в Лома Линда, Калифорния, по состоянию на 2002 год. С 2003 года в Соединенных Штатах открылось еще три или четыре центра протонной терапии. Детская исследовательская больница Сент-Джуда строит новую больницу в Мемфисе, штат Теннесси. Некоторые центры с тех пор открылись в Европе. (Германия, Швейцария и Франция).[29][30][31][32][33][34]
Агенты ремоделирования хроматина
Этот протокол все еще проходит доклиническую оценку. Ингибиторы гистон-деацетилазы представляют собой новый класс противоопухолевых агентов, нацеленных непосредственно на ремоделирование хроматина. Эти агенты использовались при остром промиелоцитарном лейкозе, и было обнаружено, что они влияют на HDAC -опосредованная репрессия транскрипции. Понимание INI1 Недостаточно, чтобы предсказать, будут ли ингибиторы HDAC эффективны против AT / RT. Некоторые лабораторные результаты показывают, что он эффективен против определенных клеточных линий AT / RT.[35]
Прогноз
Прогноз для AT / RT был очень плохим, хотя есть некоторые признаки того, что терапия на основе IRSIII может обеспечить долгосрочную выживаемость (от 60 до 72 месяцев). Двухлетняя выживаемость составляет менее 20%, средняя выживаемость после операции составляет 11 месяцев, и врачи часто рекомендуют паллиативную помощь, особенно детям младшего возраста из-за плохих результатов.[нужна цитата ] Недавно протокол, использованный в многоцентровом исследовании, опубликован в Журнал клинической онкологии привел к 70% выживаемости через 2–3 года, при этом большинство рецидивов происходит в течение месяцев, что дает надежду на то, что существует точка, за которой пациенты могут считаться излеченными.[36]
Пациенты с метастазами (диссеминированная опухоль), более крупными опухолями, опухолями, которые не удалось полностью удалить или рецидивом опухоли, и которые были моложе 36 месяцев, имели худшие результаты (то есть более короткое время выживания).[нужна цитата ]
Ретроспективный опрос 36 случаев AT / RT в Детская больница Святого Иуды с 1984 по 2003 год показали, что двухлетняя бессобытийная выживаемость (EFS) для детей до трех лет составляла 11%, а общая выживаемость (OS) составляла 17%. Для детей в возрасте 3 лет и старше EFS составил 78%, а OS - 89%.[4] Ретроспективный регистр 42 пациентов с АТ / ЛТ в Детской больнице Кливленда показал, что среднее время выживания составляет 16,25 месяцев, а коэффициент выживаемости составляет около 33%.[37] В четверти этих случаев мутации в INI1 / hSNF5 ген.
В литературе описаны следующие наиболее длительные периоды выживания:
- (а) Хильден и его сотрудники сообщили о ребенке, который все еще не болел через 46 месяцев после постановки диагноза.[38]
- (б) Олсон и его коллеги сообщили о ребенке, у которого не было болезни через пять лет после постановки диагноза на основании протокола IRS III.[39]
- (c) В 2003 году Хирт сообщил о пациенте, у которого не было болезни более шести лет.[40]
- (d) Циммерман в 2005 году сообщил о показателях выживаемости от 50 до 72 месяцев у четырех пациентов с использованием протокола на основе IRS III. Двое из этих длительно выживших лечились после рецидива AT / RT.[41]
- (e) В исследовании NYU (Gardner 2004) участвовали четыре из 12 пациентов, перенесших AT / RT в течение длительного периода времени; самый старший из них был жив через 46 месяцев после постановки диагноза.[42]
- (f) Венский медицинский университет, 2013 год, сообщил о 16-летнем выжившем среди других длительно выживших. [6]
Лечение рака у детей, выживших в течение длительного периода времени, обычно вызывает ряд негативных последствий для физического благополучия, фертильности, когнитивных функций и учусь.[43][44][45][46]
Метастаз
Метастатическое распространение отмечается примерно в одной трети случаев ПТ / ЛТ на момент постановки диагноза, и опухоли могут возникать в любом месте ЦНС. Исследование ASCO 188 задокументированных случаев ПТ / ЛТ до 2004 г. показало, что 30% случаев имели метастазы на момент постановки диагноза.[1] Метастатическое распространение в мозговые оболочки (лептоменигеальное распространение, иногда называемое сахарным налетом) часто встречается как вначале, так и при рецидивах. Средняя продолжительность жизни снижается при наличии метастазов. Первичные опухоли ЦНС обычно метастазируют только в ЦНС.
Один случай метастазирования в брюшную полость через вентрикулоперитонеально шунт было сообщено с AT / RT. Сообщалось о метастатическом распространении через этот механизм при других опухолях головного мозга, включая герминомы, медуллобластомы, астроцитомы, глиобластомы, эпендимомы, и опухоли энтодермального синуса. Guler и Sugita отдельно сообщили о случаях метастазов в легкие без шунта.[47][48]
Эпидемиология
По оценкам, 3% опухолей головного мозга у детей являются AT / RT, хотя этот процент может увеличиваться с лучшей дифференциацией между опухолями PNET / медуллобластомы и AT / RT.[нужна цитата ]
Как и в случае с другими опухолями ЦНС, у мужчин поражается больше, чем у женщин (соотношение 1,6: 1). Исследование ASCO показало соотношение мужчин и женщин 1,4: 1.[1]
История
Атипичная тератоидная / рабдоидная опухоль была впервые описана как отдельный объект в 1987 году.[требуется медицинская цитата ] До 1978 года, когда была описана рабдоидная опухоль, AT / RT, вероятно, ошибочно диагностировали как медуллобластома. В некоторых ранних отчетах опухоль была известна также как злокачественная рабдоидная опухоль (МРТ) ЦНС. Между 1978 и 1987 годами AT / RT обычно ошибочно диагностировали как рабдоидная опухоль. Однако как ПТ / ЛТ, так и МРТ без ЦНС имеют худший прогноз, чем медуллобластома, и устойчивы к стандартным протоколам лечения медуллобластомы.[нужна цитата ]
К 1995 году AT / RT стал рассматриваться как новый агрессивный, биологически уникальный класс опухолей головного и спинного мозга, обычно поражающий младенцев и маленьких детей.[49] В январе 2001 г. Национальный институт рака и Отделение редких заболеваний провел семинар по детским атипичным тератоидным / рабдоидным опухолям центральной нервной системы. Двадцать два участника из 14 учреждений собрались вместе, чтобы обсудить биологию, методы лечения и новые стратегии лечения этих опухолей. Документ о консенсусе по биологии опухоли был опубликован в журнале Clinical Research.[50]Признание, сделанное семинаром, что атипичные тератоидные / рабдоидные опухоли ЦНС (AT / RT) имеют делеции гена INI1, указывает на то, что рабдоидные опухоли почек и мозга являются идентичными или тесно связанными образованиями. Это наблюдение неудивительно, потому что рабдоидные опухоли в обоих местах обладают схожими гистологическими, клиническими и демографическими характеристиками.
Направления исследований
Атипичная тератоидная рабдоидная опухоль встречается редко, и не было доказано, что ни терапия, обеспечивающая долгосрочное выживание, ни набор протоколов стали стандартными. Таким образом, большинство детей с AT / RT зачислены в клинические испытания попытаться найти эффективное лекарство. Клинические испытания не являются стандартом лечения; это исследование. Некоторые клинические испытания сравнивают экспериментальное лечение со стандартным лечением, но только в том случае, если такое стандартное лечение существует.
Исследования в области трансплантации стволовых клеток продолжаются.
Культура
В 2011, Житель Нью-Йорка опубликовал статью Александар Хемон, о битве дочери автора с AT / RT.[51]
В августе 2011 года шестилетняя девочка по имени Аваланна Раус боролась с AT / RT на Институт рака Даны – Фарбера была устроена мнимая свадьба со своим кумиром Джастин Бибер Доктора и медсестры предоставили картонный вырез в натуральную величину с изображением Бибера, гитариста, цветов и футболки с надписью «Будущая миссис Бибер». В феврале 2012 года она провела день лично со своим притворным мужем Джастином Бибером после Facebook поход на встречу со своим кумиром.[52] 26 сентября 2012 года она умерла после пяти с половиной лет борьбы с AT / RT.[53]
Видеоигра Этот Дракон, Рак основан на опыте Райана и Эми Грин, воспитывающих своего сына Джоэла после того, как ему в 12 месяцев поставили диагноз атипичной тератоидной рабдоидной опухоли и осталось жить всего четыре месяца. Джоэл продолжал выживать еще четыре года после того, как страдал от семи дополнительных опухолей и в конечном итоге скончался от рака 13 марта 2014 года. Райан Грин хотел поделиться опытом воспитания Джоэла в форме видеоигры, чтобы помочь игроку понять трудности и реалии, с которыми им пришлось иметь дело за это время.[54][55] После смерти Джоэла игра была переработана, чтобы вместо этого служить данью уважения пяти коротким годам Райана и Эми с их третьим ребенком. Опыт семьи Грин также задокументирован в фильме. Спасибо за игру.
Смотрите также
Рекомендации
- ^ а б c d Киран М.В. (2006). "Обновленная информация об опухолях зародышевых клеток, атипичных тератоидных / рабоидных опухолях и опухолях сосудистого сплетения. Редкие опухоли 3: опухоли головного мозга --- опухоли зародышевых клеток, атипичные тератоидные / рабдоидные опухоли и опухоли сосудистого сплетения". Американское общество клинической онкологии. Образование. Книга. Архивировано из оригинал на 2008-01-07. Получено 2007-05-20.
- ^ Мера D6: Типы детского рака - 2006 Таблицы D6a и D6b. Агентство по охране окружающей среды США. Проверено 17 апреля 2008.
- ^ Kleihues, П. (2000). Патология и генетика опухолей нервной системы. IARC Press: Lyon 2000. ISBN 92-83-22409-4.
- ^ а б Tekautz TM, Fuller CE, Blaney S, et al. (2005). «Атипичные тератоидные / рабдоидные опухоли (ATRT): улучшенная выживаемость у детей в возрасте 3 лет и старше с лучевой терапией и химиотерапией на основе высоких доз алкилаторов». J. Clin. Онкол. 23 (7): 1491–9. Дои:10.1200 / JCO.2005.05.187. PMID 15735125. См. Рисунок 1.
- ^ Чи, Сьюзен (2008). «Интенсивное комплексное лечение детей с недавно диагностированной атипичной тератоидной рабдоидной опухолью ЦНС». Журнал клинической онкологии. 27 (3): 385–389. Дои:10.1200 / JCO.2008.18.7724. ЧВК 2645855. PMID 19064966.
- ^ а б Славц, Ирэн (2014). «Атипичная тератоидная рабдоидная опухоль: улучшенная долгосрочная выживаемость благодаря интенсивной мультимодальной терапии и отсроченной лучевой терапии. Опыт Венского медицинского университета 1992–2012 гг.». Онкология. 3 (1): 91–100. Дои:10.1002 / cam4.161. ЧВК 3930393. PMID 24402832.
- ^ Тамия Т., Накашима Х, Оно Й и др. (2000). «Спинальная атипичная тератоидная / рабдоидная опухоль у младенца». Педиатр Нейрохирург. 32 (3): 145–9. Дои:10.1159/000028920. PMID 10867562. S2CID 34074177.
- ^ Чунг-Лан Као; Ши-Хва Чиу; Янн-Ян Чен; Шер Сингх; Хан-Цо Линь; Рен-Шянь Лю; Чи-Вен Ло; Чи-Чанг Ян; Чин-Вэнь Чи; Чен-хсен Ли; Тай-Тонг Вонг (2005). «Повышенная экспрессия гена остеопонтина в атипичной тератоидной / рабдоидной опухоли центральной нервной системы». Современная патология. 18 (6): 769–778. Дои:10.1038 / modpathol.3800270. PMID 15776015.
- ^ Янсон К., Недзи Л.А., Дэвид О. и др. (2006). «Предрасположенность к атипичной тератоидной / рабдоидной опухоли из-за наследственной мутации INI1». Педиатр Рак крови. 47 (3): 279–84. Дои:10.1002 / pbc.20622. PMID 16261613.
- ^ Фернандес, К; Бувье, C; Sévenet, N; Липранди, А; Coze, C; Лена, Г; Фигарелла-Брангер, Д. (2002). «Врожденная диссеминированная злокачественная рабдоидная опухоль и опухоль мозжечка, имитирующая медуллобластому у монозиготных близнецов: патологическая и молекулярная диагностика». Am J Surg Pathol. 26 (2): 266–70. Дои:10.1097/00000478-200202000-00016. PMID 11812951. S2CID 45546297.
- ^ Бейгель Я.А.; Fogelgren B; Уэйнрайт LM; и другие. (2000). «Мутации INI1 зародышевой линии у пациента с атипичной тератоидной опухолью центральной нервной системы и рабдоидной опухолью почек». Гены Хромосомы Рак. 28 (1): 31–7. Дои:10.1002 / (SICI) 1098-2264 (200005) 28: 1 <31 :: AID-GCC4> 3.0.CO; 2-Y. PMID 10738300.
- ^ Тейлор, доктор медицины, Гокгоз Н., Андрулис, И.Л., Mainprize TG, Дрейк, Дж. М., Рутка, Д. Т. (2000). «Семейные опухоли задней черепной ямки головного мозга младенчества, вторичные по отношению к мутации зародышевой линии гена hSNF5». Являюсь. J. Hum. Genet. 66 (4): 1403–6. Дои:10.1086/302833. ЧВК 1288204. PMID 10739763.
- ^ Пруст Ф, Лакерриер А, Константин Б., Ручу М.М., Ванье Дж. П., Фрегер П. (1999). «Одновременное проявление атипичной тератоидной / рабдоидной опухоли у братьев и сестер» (PDF). J. Neurooncol. 43 (1): 63–70. Дои:10.1023 / А: 1006114732613. PMID 10448873. S2CID 10500489.
- ^ Sevent N, Sheridan E, Amran D и др. (1999). «Конституционные мутации гена hSNF / INI1 предрасполагают к развитию различных видов рака». Am J Hum Genet (65): 1343–48.
- ^ Ева Изицка-Свешевска; Мария Дебик-Рихтер; Бартош Васаг; и другие. (Февраль 2003 г.), «Уникальное явление церебральной атипичной тератоидной / рабдоидной опухоли у младенца и примитивной нейроэктодермальной опухоли позвоночного канала у ее отца», Журнал нейроонкологии, 61 (3): 219–225, Дои:10.1023 / А: 1022532727436, PMID 12675315, S2CID 2766929
- ^ Хо Д.М., Сюй Си, Вонг Т.Т., Тинг Л.Т., Чианг Х. (2000). «Атипичная тератоидная / рабдоидная опухоль центральной нервной системы: сравнительное исследование с примитивной нейроэктодермальной опухолью / медуллобластомой». Acta Neuropathol. 99 (5): 482–8. Дои:10.1007 / s004010051149. PMID 10805090. S2CID 22159380.
- ^ "CD99". Ncbi.nlm.nih.gov. 2013-01-30. Получено 2013-02-22.
- ^ "Вторая ссылка CD99". Ncbi.nlm.nih.gov. Получено 2013-02-22.
- ^ Брух Л.А., Хилл Д.А., Цай Д.X., Леви Б.К., Денер Л.П., Перри А. (2001). «Роль флуоресцентного обнаружения in situ гибридизации дозировки хромосомы 22q в различении атипичных тератоидных / рабдоидных опухолей от медуллобластомы / центральных примитивных нейроэктодермальных опухолей». Гм. Патол. 32 (2): 156–62. Дои:10.1053 / hupa.2001.21572. PMID 11230702.
- ^ Meyers SP, Khademianc ZP, Biegeld JA, Chuange SH, Koronesb DN, Zimmerman RA (май 2006 г.). «Первичные внутричерепные атипичные тератоидные / рабдоидные опухоли в младенчестве и детстве: особенности МРТ и исходы для пациентов». Американский журнал нейрорадиологии. 27 (5): 962–971. PMID 16687525. Получено 2008-05-05.
- ^ Лу Л., Уилкинсон Э. Дж., Ячнис А. Т. (2000). «Цитология спинномозговой жидкости атипичной тератоидной / рабдоидной опухоли головного мозга у двухлетней девочки: описание случая». Диаг. Цитопатол. 23 (5): 329–32. Дои:10.1002 / 1097-0339 (200011) 23: 5 <329 :: AID-DC9> 3.0.CO; 2-W. PMID 11074628.
- ^ Джей В., Эдвардс В., Халлидей В., Рутка Дж., Лау Р. (1997). ""Полифенотипические «опухоли центральной нервной системы: проблемы нозологии и классификации». Педиатр Патол Лаб Мед. 17 (3): 369–89. Дои:10.1080/107710497174697. PMID 9185218.
- ^ Burger PC, Yu IT, Tihan T, et al. (1998). «Атипичная тератоидная / рабдоидная опухоль центральной нервной системы: очень злокачественная опухоль младенчества и детства, которую часто ошибочно принимают за медуллобластому: исследование педиатрической онкологической группы». Являюсь. J. Surg. Патол. 22 (9): 1083–92. Дои:10.1097/00000478-199809000-00007. PMID 9737241.
- ^ "PDF" (PDF). Архивировано из оригинал (PDF) на 2013-02-17. Получено 2013-02-22.
- ^ а б Гейер Дж. Р., Спосто Р., Дженнингс М. и др. (2005). «Мультиагентная химиотерапия и отложенная лучевая терапия у младенцев со злокачественными опухолями головного мозга: отчет Детской онкологической группы». J. Clin. Онкол. 23 (30): 7621–31. Дои:10.1200 / JCO.2005.09.095. PMID 16234523.
- ^ «Лечение рабдомиосаркомы в детстве». Национальный институт рака. 1980-01-01. В архиве из оригинала от 4 июля 2007 г.. Получено 2007-07-09.
- ^ Пуссен Т.Ю., Филипс П.К., Ваджапеям С. и др. (2007). «Центр нейровизуализации Консорциума детских опухолей головного мозга - совместная нейровизуализация в исследовании опухолей головного мозга у детей: работа в стадии разработки». AJNR. Американский журнал нейрорадиологии. 28 (4): 603–7. PMID 17416804.
- ^ Сквайр С.Е., Чан, доктор медицины, Маркус К.Дж. (2007). «Атипичная тератоидная / рабдоидная опухоль: противоречие, лежащее в основе лучевой терапии». J. Neurooncol. 81 (1): 97–111. Дои:10.1007 / s11060-006-9196-z. PMID 16855864. S2CID 22170046.
- ^ «Принципы протонно-лучевой терапии». Massgeneral.org. Архивировано из оригинал в 2013-09-26. Получено 2013-02-22.
- ^ Кристофер Оуэн - обслуга страниц. «Протонно-лучевая лучевая терапия в Массачусетсе». Neurosurgery.mgh.harvard.edu. Получено 2013-02-22.
- ^ Статья о протонно-лучевой терапии В архиве 8 октября 2007 г. Wayback Machine
- ^ Британский журнал рака (1 июня 2009 г.). "Протонно-лучевая терапия - BJC Abstract". Британский журнал рака. 93 (8): 849–854. Дои:10.1038 / sj.bjc.6602754. ЧВК 2361650. PMID 16189526.
- ^ Медицинский центр Лома Линда Центр протонной терапии - Обзор В архиве 6 февраля 2007 г. Wayback Machine
- ^ Лома Линда обзор детских опухолей головного мозга В архиве 12 апреля 2007 г. Wayback Machine
- ^ Чжан З.К., Дэвис К.П., Аллен Дж. И др. (2002). «Остановка клеточного цикла и репрессия транскрипции циклина D1 с помощью INI1 / hSNF5». Мол. Клетка. Биол. 22 (16): 5975–88. Дои:10.1128 / MCB.22.16.5975-5988.2002. ЧВК 133966. PMID 12138206.
- ^ «Новая надежда для пациентов с редкими опухолями головного мозга». Danafarberchildrens.org. 2009-03-10. Получено 2013-02-22.
- ^ Hilden, Joanne M .; Меербаум, Шарон; Бургер, Питер; Финли, Джонатан; Янсс, Анна; Scheithauer, Bernd W .; Уолтер, Эндрю В .; Рорке, Люси Б .; Бигель, Жаклин А. (2004-07-15). «Атипичная тератоидная / рабдоидная опухоль центральной нервной системы: результаты лечения детей, зарегистрированных в реестре». Журнал клинической онкологии. 22 (14): 2877–2884. Дои:10.1200 / JCO.2004.07.073. ISSN 0732-183X. PMID 15254056.
- ^ Хилден Дж. М., Меербаум С., Бургер П. и др. (2004). «Атипичная тератоидная / рабдоидная опухоль центральной нервной системы: результаты лечения детей, включенных в регистр». J. Clin. Онкол. 22 (14): 2877–84. Дои:10.1200 / JCO.2004.07.073. PMID 15254056.
- ^ Олсон Т.А., Баяр Э., Коснич Э. (1995). «Успешное лечение диссеминированных злокачественных рабдоидных опухолей центральной нервной системы». J Педиатр Гематол Онкол. 17 (1): 71–75. Дои:10.1097/00043426-199502000-00013. PMID 7743242.
- ^ Хирт А., Педерсен PH, Вестер К. и др. (2003). «Церебральная атипичная тератоидная / рабдоидная опухоль младенчества: долгосрочное выживание после мультимодального лечения, включая тройную интратекальную химиотерапию и радиохирургию гамма-ножом - отчет о клиническом случае (аннотация)». Детская гематология и онкология. 20 (4): 327–332. Дои:10.1080/713842315.
- ^ Циммерман М.А., Гумнерова Л.С., Проктор М. и др. (2005). «Непрерывная ремиссия вновь диагностированной и рецидивной атипичной тератоидной / рабдоидной опухоли центральной нервной системы». J. Neurooncol. 72 (1): 77–84. Дои:10.1007 / s11060-004-3115-y. PMID 15803379. S2CID 22624213.
- ^ Гарднер С., Диц Б., Грин А. и др. (Июнь 2004 г.). "THER 27. ИНТЕНСИВНАЯ ИНДУКЦИОННАЯ ХИМИОТЕРАПИЯ С ПОМОЩЬЮ ВЫСОКОДОЗНОЙ ХИМИОТЕРАПИИ С АВТОЛОГИЧЕСКОЙ РЕАБИЛИТАЦИЕЙ СТВОЛОВЫХ КЛЕТК (ASCR) У ДЕТЕЙ МОЛОДОГО ДИАГНОСТИКА ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ (CNS) АТИПИЧЕСКАЯ ХИМИЧЕСКАЯ СИСТЕМА (ЦНС) АТИПИЧЕСКАЯ ХИМИЧЕСКАЯ СИСТЕМА (АТРАТОИДНАЯ РИТАБИТА)" (PDF). Тезисы докладов одиннадцатого международного симпозиума по детской нейроонкологии. Архивировано из оригинал (PDF) на 2007-10-25. Получено 2007-06-03.
- ^ Фулади М., Гилгер Э., Коджак М. и др. (1 октября 2005 г.). "Intellectual and Functional Outcome of Children 3 Years Old or Younger Who Have CNS Malignancies". Журнал клинической онкологии. 23 (28): 7152–60. Дои:10.1200/JCO.2005.01.214. PMID 16192599.
- ^ Monteleone P, Meadows AT (June 6, 2006). "Late Effects of Childhood Cancer and Treatment". EMedicine from WebMD.
- ^ Foreman NK, Faestel PM, Pearson J, et al. (Январь 1999 г.). "Health Status in 52 Long-term Survivors of Pediatric Brain Tumors". Журнал нейроонкологии. 41 (1): 47–52. Дои:10.1023/A:1006145724500. PMID 10222422. S2CID 10230653.
- ^ Meyers EA, Kieran MW (2002). "Brief Report Psychological adjustment of surgery-only pediatric neuro-oncology patients: a retrospective analysis". Psycho-Oncology. 11 (1): 74–79. Дои:10.1002/pon.553. PMID 11835594. Архивировано из оригинал на 2012-12-17.
- ^ Güler E, Varan A, Söylemezoglu F, et al. (2001). "Extraneural metastasis in a child with atypical teratoid rhabdoid tumor of the central nervous system" (PDF). J. Neurooncol. 54 (1): 53–6. Дои:10.1023/A:1012540700093. PMID 11763423. S2CID 349180.
- ^ Sugita Y, Takahashi Y, Hayashi I, Morimatsu M, Okamoto K, Shigemori M (1999). "Pineal malignant rhabdoid tumor with chondroid formation in an adult". Pathol. Int. 49 (12): 1114–8. Дои:10.1046/j.1440-1827.1999.00988.x. PMID 10632935.
- ^ Rorke LB, Packer R, Biegel J (1995). "Central nervous system atypical teratoid/rhabdoid tumors of infancy and childhood". J. Neurooncol. 24 (1): 21–8. Дои:10.1007/BF01052653. PMID 8523069. S2CID 8100347.
- ^ Biegel JA, Kalpana G, Knudsen ES, et al. (2002). "The role of INI1 and the SWI/SNF complex in the development of rhabdoid tumors: meeting summary from the workshop on childhood atypical teratoid/rhabdoid tumors". Рак Res. 62 (1): 323–8. PMID 11782395.
- ^ Hemon, Aleksandar (June 13, 2011). "Аквариум". Житель Нью-Йорка. Получено 2 марта, 2012.
- ^ "Justin Bieber Meets With Merrimac Girl Battling Brain Cancer". CBS Boston. CBS Local Media, a division of CBS Radio Inc. February 13, 2012. Получено 2 марта, 2012.
- ^ "'Mrs. Bieber' Avalanna Routh dies at age 6". CNN.com. 27 сентября 2012 г.. Получено 26 октября, 2012.
- ^ Robertson, Andy (July 12, 2013). "That Dragon, Cancer: the video game helping a father face his son's disease". Дейли Телеграф. Получено 13 марта, 2014.
- ^ Futter, Mike (March 13, 2014). "Joel Green, Inspiration For That Dragon, Cancer, Passes Away At Age 5". Информер игры. Получено 13 марта, 2014.
дальнейшее чтение
- Hilden JM, Meerbaum S, Burger P, Finlay J, Janss A, Scheithauer BW, Walter AW, Rorke LB, Biegel JA (July 2004). "Central nervous system atypical teratoid/rhabdoid tumor: results of therapy in children enrolled in a registry". J. Clin. Онкол. 22 (14): 2877–84. Дои:10.1200/JCO.2004.07.073. PMID 15254056.
- Biegel JA, Kalpana G, Knudsen ES, Packer RJ, Roberts CW, Thiele CJ, Weissman B, Smith M (January 2002). "The role of INI1 and the SWI/SNF complex in the development of rhabdoid tumors: meeting summary from the workshop on childhood atypical teratoid/rhabdoid tumors". Рак Res. 62 (1): 323–8. PMID 11782395.
- Huret J, Sevenet N (2002). "Rhabdoid predispostion syndrome". Атлас генетики и цитогенетики в онкологии и гематологии. Архивировано из оригинал on 2005-12-26.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
