Мутационные подписи - Mutational signatures
Мутационные подписи являются характерными комбинациями типов мутаций, возникающими из определенных мутагенез такие процессы как Репликация ДНК неверность, экзогенная и эндогенная генотоксины обнажения, дефектные Ремонт ДНК пути и ферментативное редактирование ДНК.[1]
Расшифровка мутационных сигнатур в рак дает представление о биологических механизмах, участвующих в канцерогенез и нормальный соматический мутагенез.[2] Мутационные сигнатуры показали свою применимость в лечении и профилактике рака. Достижения в области онкогеномика позволили разработать и использовать молекулярно таргетная терапия, но такие методы лечения исторически были сосредоточены на подавлении онкогенных факторов (например, EGFR усиление функции мутации и Ингибитор EGFR лечение в колоректальный рак [3]). Совсем недавно профилирование мутационных сигнатур оказалось успешным в руководстве онкологическим лечением и использованием целевых методов лечения (например, иммунотерапия в ремонт несоответствия дефицит различных видов рака,[4] платина и Ингибитор PARP использовать синтетическая летальность в гомологичная рекомбинация неполноценный рак молочной железы ).[5]
Общие понятия

Механизмы - обзор
Биологический мутагенез механизмы, лежащие в основе мутационных сигнатур (например, КОСМИЧЕСКИЙ Подписи с 1 по 30) включают, но не ограничиваются:[а][6]
- Репликация ДНК неверность
- Вычитка ДНК это процесс, посредством которого ДНК-полимераза удаляет неправильно введенный нуклеотид через экзонуклеаза ферментативная реакция. Неспособность ДНК-полимераза исправление этих ошибок репликации приводит к прогрессивному накоплению мутаций через последовательные клеточные митоз.
- Генотоксины
- Эндогенные клеточные (например, спонтанные 5-метилцитозин дезаминирование приводит к C> T переход (генетика) ) мутации (см. Повреждение ДНК (естественное) )
- Экзогенный /канцерогены
- Ультрафиолетовый излучение: излучение UVB вызывает прямые Повреждение ДНК и является известным фактором риска рак кожи (например. меланома )
- Алкилирующие противоопухолевые средства: Эта группа химиотерапия агенты добавляет алкильная группа к ДНК, что вызывает сшивание ДНК и мешает Репликация ДНК и Ремонт ДНК. Рак клетки наиболее подвержены воздействию из-за их высокого митоз показатель.
- Табак: Табак содержит несколько канцерогены которые вредны для ДНК, в том числе полициклические ароматические углеводороды, акролеин, нитрозамины, цианид и другие (см. воздействие табака на здоровье )
- Дефицит репарации ДНК
- Гомологичная рекомбинация дефицит (HRD): ДНК двухниточный разрыв требует гомологичная рекомбинация механизм точного ремонта точек останова.
- Восстановление несоответствия ДНК (MMR) дефицит: механизм устранения несоответствия распознает и исправляет ошибочную вставку, удаление или неправильное включение пары оснований.
- Ферментативное редактирование ДНК
- Ферменты цитидиндезаминазы: это семейство ферментов является частью врожденная иммунная система и участвуют в контроле ретровирусы и транспозоны элементы (включая эндогенные ретровирусы ). Эти ферменты (цитидин дезаминаза / CDA, цитидин дезаминаза, индуцированная активацией и АПОБЕК семейство белков) активно вызывают цитидин дезаминирование и поэтому введем C> T переход (генетика) мутации.
- Репликация ДНК неверность
Геномные данные
Для анализа мутационных сигнатур рака требуются геномные данные из секвенирование генома рака с парно-нормальным Секвенирование ДНК для создания каталога мутаций опухоли (типов и количества мутаций) конкретной опухоли. Различные типы мутации (например, однонуклеотидные варианты, инделки, структурные варианты) могут использоваться индивидуально или в комбинации для моделирования мутационных сигнатур при раке.
Типы мутаций: замены оснований
Существует шесть классов подстановки оснований: C> A, C> G, C> T, T> A, T> C, T> G. Замена G> T считается эквивалентной замене C> A, поскольку невозможно дифференцировать, на какой цепи ДНК (прямой или обратной) первоначально произошла замена. Таким образом, замены C> A и G> T считаются частью класса «C> A». По той же причине мутации G> C, G> A, A> T, A> G и A> C считаются частью «C> G», «C> T», «T> A», « T> C "и" T> G "классы соответственно.
Получение информации из 5 'и 3' соседних оснований (также называемых фланкирующими парами оснований или тринуклеотидным контекстом) приводит к 96 возможным типам мутаций (например, A [C> A] A, A [C> A] T и т. Д.). Каталог мутаций опухоли создается путем категоризации каждого варианта единственного нуклеотида (SNV) (синонимы: замена пары оснований или замена точечная мутация ) в одном из 96 типов мутаций и подсчитывая общее количество замен для каждого из этих 96 типов мутаций (см. рисунок).
Каталог мутаций опухоли

После того, как каталог мутаций (например, подсчет для каждого из 96 типов мутаций) опухоли получен, есть два подхода к расшифровке вклада различных мутационных сигнатур в геномный ландшафт опухоли:
- Каталог мутаций опухоли сравнивается с эталонным каталогом мутаций или эталонным набором данных по сигнатурам мутаций, таким как «30 сигнатур мутационных процессов при раке человека». [6] из Каталога соматических мутаций при раке (КОСМИЧЕСКИЙ ) база данных.[1]
- De novo моделирование мутационных сигнатур может быть выполнено с использованием статистических методов, таких как неотрицательная матричная факторизация для выявления потенциальных новых мутационных процессов.[7]
Выявление вклада различных мутационных сигнатур в канцерогенез дает представление о биологии опухоли и может предложить возможности для таргетная терапия.
Виды мутаций: инделы
Подпись 3, видна на гомологичная рекомбинация (HR) дефицитная опухоль, связана с повышенным бременем больших инделы (до 50 нуклеотидов) с перекрывающейся микрогомологией в точках разрыва.[6] В таких опухолях ДНК двухниточные разрывы ремонтируются неточными механизмами ремонта негомологичное соединение концов (NHEJ) или соединение концов, опосредованное микрогомологией (MMEJ) вместо ремонта HR с высокой точностью.
Подпись 6, наблюдаемая в опухолях с микроспутниковая нестабильность, также отличается обогащением инделей длиной 1 п.н. в областях нуклеотидных повторов.
Типы мутаций: структурные варианты
Гомологичная рекомбинация его дефицит приводит к паттерну замены сигнатуры 3, но также увеличивает количество структурных вариантов. В отсутствие гомологичная рекомбинация, негомологичное соединение концов приводит к большим структурным вариантам, таким как хромосомные транслокации, хромосомные инверсии и копировать варианты номера.
Мутационные подписи
Краткое описание выбранных мутационных процессов и связанных с ними мутационных сигнатур в рак будут включены в разделы ниже. Некоторые подписи встречаются повсеместно в разных рак типы (например, Подпись 1), в то время как некоторые другие имеют тенденцию ассоциироваться с конкретными видами рака (например, Подпись 9 и лимфоидные злокачественные новообразования).[6]
Некоторые мутационные сигнатуры характеризуются сильным транскрипционным смещением с заменами, преимущественно затрагивающими одну из нитей ДНК, транскрибируемую или нетранскрибируемую цепь (сигнатуры 5, 7, 8, 10, 12, 16).[6]
Подпись 1 показывает преобладание C> T переход (генетика) в контексте тринуклеотида Np [C> T] G и коррелирует с возрастом пациента на момент рак диагноз. В основе предлагаемого биологического механизма лежит спонтанное дезаминирование 5-метилцитозин.[6]
Сигнатура 5 имеет преобладание замен Т> С в тринуклеотидном контексте ApTpN со смещением транскрипционной цепи.[2]
Гомологичный рекомбинационный дефицит
Подпись 3 отображает большое количество мутаций нескольких классов мутаций и связана с зародышевый и соматический (биология) BRCA1 и BRCA2 мутации в нескольких рак типы (например, груди, поджелудочной железы, яичников, простаты). Эта подпись является результатом ДНК двухниточный разрыв ремонт дефекта (или дефицит гомологичной рекомбинации ). Подпись 3 связана с большим бременем инделы с микрогомологией в точках излома.[2]
Ферменты APOBEC
APOBEC3 семья цитидин дезаминаза ферменты реагируют на вирусные инфекции редактированием вирусного генома, но ферментативная активность APOBEC3A и APOBEC3B также было обнаружено, что вызывает нежелательное редактирование генома хозяина и может даже участвовать в онкогенезе в вирус папилломы человека связанные с раком.[8]
Подпись 2 и подпись 13 обогащены заменами C> T и C> G и, как считается, возникают из цитидин дезаминаза деятельность АИД /АПОБЕК семейство ферментов.[2]
Полиморфизм делеции зародышевой линии с участием APOBEC3A и APOBEC3B связан с высоким бременем мутаций Signature 2 и Signature 13.[9] Считается, что этот полиморфизм имеет умеренную пенетрантность (вдвое выше фонового риска) для риска рака груди.[10] Точные роли и механизмы, лежащие в основе АПОБЕК -опосредованное редактирование генома еще не полностью очерчено, но цитидин дезаминаза, индуцированная активацией (AID) /АПОБЕК Считается, что комплекс участвует в иммунном ответе хозяина на вирусные инфекции и липидном обмене.[11]
И сигнатура 2, и сигнатура 13 содержат замены цитозина на урацил за счет цитидиндезаминаз. Подпись 2 имеет более высокую долю замен C [T> C] N, а подпись 13 - более высокую долю замен T [C> G] N. APOBEC3A и APOBEC3B -опосредованный мутагенез преимущественно вовлекает отстающую цепь ДНК во время репликации.[12]
Недостаток исправления несоответствия
Четыре КОСМИЧЕСКИЙ мутационные сигнатуры были связаны с Восстановление несоответствия ДНК дефицит и обнаружен в опухолях с микроспутниковая нестабильность: Подпись 6, 15, 20 и 26.[2] Потеря функции MLH1, MSH2, MSH6 или PMS2 гены вызывают дефектные Восстановление несоответствия ДНК.
Вычитка ДНК
Сигнатура 10 имеет транскрипционный сдвиг и обогащена заменами C> A в контексте TpCpT, а также заменами T> G в контексте TpTpTp.[2] Подпись 10 связана с измененной функцией ДНК-полимераза эпсилон, что приводит к дефициту Вычитка ДНК Мероприятия. И зародышевые, и соматические ПОЛЮС (ген) Мутации экзонуклеазного домена связаны с сигнатурой 10.[13]
Базовая эксцизионная пластика
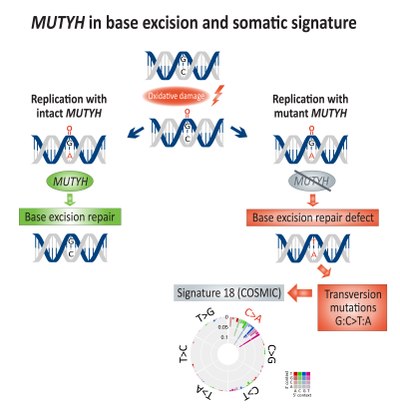
Соматическое обогащение для трансверсия мутации (G: C> T: A) были связаны с базовая эксцизионная пластика (BER) дефицит и связан с дефектным МУТЫХ, а ДНК гликозилаза, при колоректальном раке.[14] непосредственный Окисление ДНК повреждение приводит к созданию 8-оксогуанин, которая, если она не будет отремонтирована, приведет к включению аденин вместо того цитозин во время репликации ДНК. МУТЫХ кодирует MUTY аденин фермент гликозилазы, который удаляет несовпадающие аденин от 8-оксогуанин:аденин спаривание оснований, что позволяет Ремонт ДНК механизмы с участием OGG1 (Оксогуанингликозилаза) и NUDT1 (Гидролаза 1 Nudix, также известная как MTH1, Гомолог MutT 1) для удаления поврежденных 8-оксогуанин.[15]
Воздействие экзогенных генотоксинов
Избранные экзогенные генотоксины /канцерогены и их мутаген -индуцированные механизмы повреждения и восстановления ДНК были связаны со специфическими молекулярными сигнатурами.
Ультрафиолетовая радиация
- В сигнатуре 7 преобладают динуклеотидные мутации CC> TT в пиримидин-пиримидиновых фотодимерах, репарируемых посредством транскрипционно-связанных эксцизионная репарация нуклеотидов. Он имеет сильную транскрипционную предвзятость с заменами C> T, обогащенными нетранскрибируемой цепью ДНК.[2] Ультрафиолетовый Радиационное облучение является предполагаемым основным мутагенным механизмом этой сигнатуры.
Алкилирующие агенты
- Подпись 11 была идентифицирована в опухолях, ранее подвергавшихся воздействию темозоламида, алкилирующий агент.[2] Эта сигнатура обогащается заменами C> T на гуанин оснований, связанных с транскрипцией эксцизионная репарация нуклеотидов. В этой сигнатуре присутствует сильное смещение транскрипционной цепи.
Табак
- Обе Подпись 4 (табак курение рак легких ) и Подпись 29 (табак жевательный, гингиво-буккальный оральный плоскоклеточная карцинома ) демонстрируют смещение транскрипционной цепи и обогащение замен C> A, но их соответствующий состав и паттерны (пропорция каждого типа мутации) немного отличаются.[2]
- Предлагаемый основной механизм сигнатуры 4 - удаление аддуктов ДНК (табак бензо (а) пирен ковалентно ограничен гуанин ) транскрипционно связанными эксцизионная репарация нуклеотидов (NER) техника.[16]
Гипермутация гена иммуноглобулина
Подпись 9 идентифицирована в хронический лимфолейкоз и злокачественный В-клеточная лимфома и обогащение признаков при T> G трансверсия События. Считается, что это результат подверженной ошибкам полимеразы. η (ПОЛЬША ген) -ассоциированный мутагенез.[6]
В последнее время полимераза η сигнатура синтеза, подверженная ошибкам, была связана с негематологическими видами рака (например, рак кожи ) и предположили, что вносят вклад в мотив YCG мутагенез и может частично объяснить увеличение количества замен динуклеотидов TC.[17]
История
В 80-е годы Кертис Харрис в Национальном институте рака США и Берт Фогельштейн в Онкологическом центре Джона Хопкинса в Балтиморе удалось показать, что разные типы рака имеют свой уникальный набор мутаций в p53, которые, вероятно, были вызваны различными агентами, такими как химические вещества в табачный дым или ультрафиолетовый свет от солнца.[18][19] С появлением секвенирование следующего поколения, Майкл Стрэттон увидели потенциал технологии революционизировать наше понимание генетических изменений внутри отдельных опухолей, задавая Институт Wellcome Sanger огромные группы машин для секвенирования ДНК в движении, чтобы прочитать каждую букву ДНК в опухоли.[20] К 2009 году Стрэттон и его команда создали первые последовательности целого генома рака. Это были подробные карты, показывающие все генетические изменения и мутации, которые произошли в двух отдельных раковых опухолях - меланоме кожи и опухоли легких.[21][22] Геномы меланомы и рака легких были убедительным доказательством того, что отпечатки пальцев конкретных виновников могут быть замечены при раке с одной основной причиной. Эти опухоли все еще содержали много мутаций, которые нельзя было объяснить ультрафиолетом или курением табака. Детективная работа значительно усложнилась в случае рака со сложным, множественным или даже совершенно неизвестным происхождением. В качестве аналогии представьте, что судмедэксперт вытирает отпечатки пальцев на месте убийства. Судмедэксперт может оказаться удачливым и найти набор идеальных отпечатков на оконном стекле или дверной ручке, которые соответствуют известному убийце. Однако они с гораздо большей вероятностью обнаружат мешанину из отпечатков пальцев, принадлежащих целому ряду людей - от жертвы и потенциальных подозреваемых до невиновных сторон и полицейских следователей, - все они лежат друг на друге на самых разных поверхностях.[20] Это очень похоже на геномы рака, где несколько мутационных паттернов обычно накладываются друг на друга, что делает данные непонятными. К счастью, аспирант Страттона, Людмил Александров придумал способ математического решения проблемы. Александров продемонстрировал, что мутационные паттерны отдельных мутагенов, обнаруженных в опухоли, можно отличить друг от друга, используя математический подход, называемый слепое разделение источников. Недавно распутанные паттерны мутаций были названы мутационными сигнатурами.[20] В 2013 году Александров и Страттон опубликовали первую вычислительную платформу для расшифровки мутационных сигнатур из геномика рака данные.[23] Впоследствии они применили эту схему к более чем семи тысячам геномов рака, создав первую полную карту мутационных сигнатур рака человека.[24] В настоящее время выявлено более ста мутационных сигнатур в репертуаре рака человека.[25]
Список заметок
- ^ Поскольку репликация, поддержание и репарация ДНК не являются линейным процессом, некоторые сигнатуры вызваны перекрывающимися механизмами мутагенеза.
использованная литература
- ^ а б Forbes SA, Beare D, Boutselakis H, Bamford S, Bindal N, Tate J и др. (Январь 2017 г.). «КОСМИКА: генетика соматического рака в высоком разрешении». Исследования нуклеиновых кислот. 45 (D1): D777 – D783. Дои:10.1093 / нар / gkw1121. ЧВК 5210583. PMID 27899578.
- ^ а б c d е ж г час я Александров Л.Б., Джонс PH, Клин, округ Колумбия, Сейл Дж.Э., Кэмпбелл П.Дж., Ник-Зайнал С., Страттон М.Р. (декабрь 2015 г.). «Часовые мутационные процессы в соматических клетках человека». Природа Генетика. 47 (12): 1402–7. Дои:10.1038 / ng.3441. ЧВК 4783858. PMID 26551669.
- ^ Сеу Х, Ип В.К., Фифис Т (март 2016 г.). «Достижения в области таргетной и иммунной терапии колоректального рака в эпоху генома». ОнкоЦели и терапия. 9 (9): 1899–920. Дои:10.2147 / OTT.S95101. ЧВК 4821380. PMID 27099521.
- ^ Chuk MK, Chang JT, Theoret MR, Sampene E, He K, Weis SL, Helms WS, Jin R, Li H, Yu J, Zhao H, Zhao L, Paciga M, Schmiel D, Rawat R, Keegan P, Pazdur R (Октябрь 2017 г.). «Резюме утверждения FDA: ускоренное одобрение пембролизумаба для лечения метастатической меланомы второй линии». Клинические исследования рака. 23 (19): 5666–5670. Дои:10.1158 / 1078-0432.CCR-16-0663. PMID 28235882.
- ^ О'Нил, Найджел Дж .; Бейли, Мелани Л .; Хитер, Филипп (26 июня 2017 г.). «Синтетическая летальность и рак». Природа Обзоры Генетика. 18 (10): 613–623. Дои:10.1038 / nrg.2017.47. PMID 28649135. S2CID 3422717.
- ^ а б c d е ж г час я Александров Л.Б., Ник-Зайнал С, Клин Д.К., Апарисио С.А., Бехяти С, Бьянкин А.В. и др. (Август 2013). «Сигнатуры мутационных процессов при раке человека» (PDF). Природа. 500 (7463): 415–21. Bibcode:2013Натура.500..415.. Дои:10.1038 / природа12477. ЧВК 3776390. PMID 23945592.
- ^ а б Zhao EY, Shen Y, Pleasance E, Kasaian K, Leelakumari S, Jones M и др. (Декабрь 2017 г.). «Дефицит гомологической рекомбинации и результаты терапии на основе платины при запущенном раке груди». Клинические исследования рака. 23 (24): 7521–7530. Дои:10.1158 / 1078-0432.CCR-17-1941. PMID 29246904.
- ^ Уоррен К., Вестрих Дж., Дорслаер К., Пён Д. (август 2017 г.). «Роль APOBEC3A и APOBEC3B в инфицировании вирусом папилломы человека и прогрессировании заболевания». Вирусы. 9 (8): 233. Дои:10.3390 / v9080233. ЧВК 5580490. PMID 28825669.
- ^ Миддлбрукс CD, Banday AR, Matsuda K, Udquim KI, Onabajo OO, Paquin A и др. (Ноябрь 2016 г.). «Связь вариантов зародышевой линии в области APOBEC3 с риском рака и обогащением с помощью сигнатурных мутаций APOBEC в опухолях». Природа Генетика. 48 (11): 1330–1338. Дои:10,1038 / нг.3670. ЧВК 6583788. PMID 27643540.
- ^ Ник-Зайнал С., Клин Д.К., Александров Л.Б., Петляк М., Батлер А.П., Болли Н. и др. (Май 2014 г.). «Связь полиморфизма числа копий в зародышевой линии APOBEC3A и APOBEC3B с бременем предполагаемых APOBEC-зависимых мутаций при раке груди». Природа Генетика. 46 (5): 487–91. Дои:10,1038 / нг.2955. ЧВК 4137149. PMID 24728294.
- ^ Ян Б., Ли X, Лей Л., Чен Дж. (Сентябрь 2017 г.). «APOBEC: От мутатора к редактору». Журнал генетики и геномики = И Чуань Сюэ Бао. 44 (9): 423–437. Дои:10.1016 / j.jgg.2017.04.009. PMID 28964683.
- ^ Hoopes JI, Cortez LM, Mertz TM, Malc EP, Mieczkowski PA, Roberts SA (февраль 2016 г.). «APOBEC3A и APOBEC3B предпочтительно дезаминируют матрицу отстающей цепи во время репликации ДНК». Отчеты по ячейкам. 14 (6): 1273–1282. Дои:10.1016 / j.celrep.2016.01.021. ЧВК 4758883. PMID 26832400.
- ^ Райнер Э., Ван Гул И. К., Паллес С., Кирси С. Е., Боссе Т., Томлинсон И., Черч Д. Н. (февраль 2016 г.). «Множество ошибок: мутации домена коррекции считывания полимеразы при раке». Обзоры природы. Рак. 16 (2): 71–81. Дои:10.1038 / nrc.2015.12. PMID 26822575. S2CID 9359891.
- ^ а б Viel, A, Bruselles, A, Meccia, E, et al. (Апрель 2017 г.). «Специфическая мутационная сигнатура, связанная с сохранением ДНК 8-оксогуанина при MUTYH-дефектном колоректальном раке». EBioMedicine. 20: 39–49. Дои:10.1016 / j.ebiom.2017.04.022. ЧВК 5478212. PMID 28551381.
- ^ Дэвид, СС, О'Ши, В.Л., Кунду, С. (2007). «Базовая эксцизионная репарация окислительного повреждения ДНК». Природа. 447 (7147): 941–950. Bibcode:2007Натура.447..941D. Дои:10.1038 / природа05978. ЧВК 2896554. PMID 17581577.
- ^ Александров Л. Б., Джу Ю. С., Хаасе К., Ван Лу П., Мартинкорена И., Ник-Зайнал С., Тотоки Ю., Фудзимото А., Накагава Х., Шибата Т., Кэмпбелл П. Дж., Вайнис П., Филлипс Д. Г., Страттон М. Р. (ноябрь 2016 г.). «Мутационные сигнатуры, связанные с курением табака при раке человека». Наука. 354 (6312): 618–622. Bibcode:2016Научный ... 354..618А. Дои:10.1126 / science.aag0299. ЧВК 6141049. PMID 27811275.
- ^ Рогозин И.Б., Гончеаренко А., Лада А.Г., Де С, Юрченкод В., Нудельман Г., Панченко А.Р., Купер Д.Н., Павлов Ю.И. (февраль 2018). «ДНК-полимераза η мутационных сигнатур обнаруживается при различных типах рака». Клеточный цикл. 17 (3): 348–355. Дои:10.1080/15384101.2017.1404208. ЧВК 5914734. PMID 29139326.
- ^ Холлштейн М., Сидранский Д., Фогельштейн Б., Харрис С.К. (июль 1991 г.). «мутации p53 при раке человека». Наука. 253 (5015): 49–53. Bibcode:1991Наука ... 253 ... 49H. Дои:10.1126 / science.1905840. PMID 1905840.
- ^ Оливье М., Хусейн С.П., Карон де Фроментель С., Эно П., Харрис СС (2004). «Спектры мутации TP53 и нагрузка: инструмент для генерации гипотез об этиологии рака». Научные публикации МАИР (157): 247–70. PMID 15055300.
- ^ а б c Мозаика, Кэт Арни. «Детективы ДНК, которые ищут причины рака». CNN. Получено 2018-09-25.
- ^ Pleasance ED, Cheetham RK, Stephens PJ, McBride DJ, Humphray SJ, Greenman CD и др. (Январь 2010 г.). «Исчерпывающий каталог соматических мутаций генома рака человека». Природа. 463 (7278): 191–6. Bibcode:2010Натура.463..191П. Дои:10.1038 / природа08658. ЧВК 3145108. PMID 20016485.
- ^ Pleasance ED, Stephens PJ, O'Meara S, McBride DJ, Meynert A, Jones D и др. (Январь 2010 г.). «Геном мелкоклеточного рака легких со сложными признаками воздействия табака». Природа. 463 (7278): 184–90. Bibcode:2010Натура.463..184П. Дои:10.1038 / nature08629. ЧВК 2880489. PMID 20016488.
- ^ Александров Л.Б., Ник-Зайнал С., Клин Д.К., Кэмпбелл П.Дж., Страттон М.Р. (январь 2013 г.). «Расшифровка сигнатур мутационных процессов, действующих при раке человека». Отчеты по ячейкам. 3 (1): 246–59. Дои:10.1016 / j.celrep.2012.12.008. ЧВК 3588146. PMID 23318258.
- ^ Александров Л.Б., Ник-Зайнал С, Клин Д.К., Апарисио С.А., Бехяти С, Бьянкин А.В. и др. (Август 2013). «Сигнатуры мутационных процессов при раке человека». Природа. 500 (7463): 415–21. Bibcode:2013Натура.500..415.. Дои:10.1038 / природа12477. ЧВК 3776390. PMID 23945592.
- ^ Александров Л., Ким Дж., Харадхвала Н.Дж., Хуанг М.Н., Нг А.В., Бут А, Ковингтон К.Р., Горденин Д.А., Бергстром Э. (15.05.2018). "Репертуар мутационных сигнатур при раке человека". bioRxiv 10.1101/322859.
