Вирусные квазивиды - Viral quasispecies
А вирусные квазивиды это структура населения из вирусы с большим количеством вариантов геномы (связанные мутациями). Квазивиды являются результатом высокого частота мутаций поскольку мутанты возникают постоянно и меняются относительные частота в качестве вирусная репликация и отбор продолжается.
Теория предсказывает, что вирусный квазивиды на низком уровне, но эволюционно нейтральный и высокосвязный (то есть плоский) регион в фитнес-ландшафт будет побеждать квазивиды, находящиеся на более высоком, но более узком пике приспособленности, к которому окружающие мутанты непригодны.[1][2] Это явление было названо «эффектом квазивидов» или, в последнее время, «выживанием самых плоских».[3]
Термин квазивиды был заимствован из теории происхождение жизни в котором примитивный репликоны состояла из мутантных распределений, как было обнаружено экспериментально с современными РНК-вирусы в их хозяин.[4][5] Теория дала новое определение дикого типа при описании вирусов и концептуальной основе для интерпретации адаптивный потенциал РНК-вирусов, которые контрастировали с классическими исследованиями, основанными на консенсусные последовательности.
Модель квазивидов наиболее применима, когда размер генома ограничен, а частота мутаций высока, и поэтому она наиболее актуальна для РНК-вирусы (включая важные патогены ) потому что у них высокий частота мутаций (примерно одна ошибка за раунд репликация),[6] хотя эти концепции могут применяться к другим биологическим объектам. В таких сценариях сложные распределения близкородственных вариантных геномов подвергаются генетическая вариация, конкуренция и отбор, и может действовать как единица выбора. Следовательно, эволюционная траектория вирусной инфекции не может быть предсказана исключительно на основе характеристик наиболее подходящей последовательности. Высокая частота мутаций также ставит верхний предел совместим с наследуемой информацией. Преодоление такого предела приводит к РНК исчезновение вируса, переход, лежащий в основе антивирусного дизайна, называемый летальный мутагенез, и имеет отношение к противовирусной медицине.
Актуальность квазивидов в вирусологии была предметом широких дискуссий. Однако стандартные клональные анализы и глубокое секвенирование методологии подтвердили наличие множества мутантных геномов в вирусных популяциях и их участие в адаптивные процессы.
История
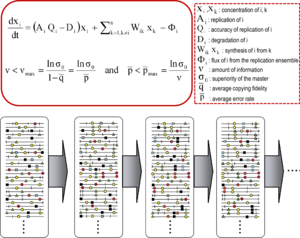
Теория квазивидов была разработана в 1970-х гг. Манфред Эйген и Питер Шустер объяснить самоорганизацию и приспособляемость примитивных репликоны (термин, используемый для обозначения любой воспроизводящейся сущности), как ингредиент гиперциклический организации, которые связывают генотипический и фенотипический информация, как важный шаг в зарождении жизни.[9][7] Теория изображает популяции ранних репликонов как организованные мутантные спектры, в которых доминирует мастер-последовательность, наделенная самой высокой последовательностью. фитнес (репликативная способность) в распределении. Он ввел понятие мутантного ансамбля как единицы отбора, тем самым подчеркивая актуальность внутрипопуляционные взаимодействия понять ответ на селективные ограничения. Одно из его следствий - порог ошибки взаимосвязь, которая отмечает максимальную скорость мутаций, при которой основная (или доминантная) последовательность может стабилизировать мутантный ансамбль. Нарушение порога ошибки приводит к потере доминирования мастер-последовательности и дрейф населения в пространство последовательности.[7][10][11][12]
Основные концепции квазивидов описываются двумя фундаментальными уравнениями: репликация с производством ошибочных копий и пороговое отношение ошибки. Они отражают две основные особенности РНК-вирусов на уровне популяции: наличие мутантного спектра и неблагоприятное влияние увеличения частоты мутаций на выживаемость вируса, каждое из которых имеет несколько производных.
Существование мутантного спектра было экспериментально подтверждено сначала клональным анализом РНК бактериофага Qβ популяции, репликация которых была инициирована одной вирусной частицей. Индивидуальные геномы отличались от согласованной последовательности в среднем от одной до двух мутаций на индивидуальный геном.[13] Пригодность биологических клонов была хуже, чем у родительской неклонированной популяции, различие также задокументировано для вирус везикулярного стоматита (VSV).[14] В репликативная способность ансамбля популяций не обязательно должны совпадать с его отдельными компонентами. Открытие того, что вирусная популяция представляет собой по существу пул мутантов, произошло в то время, когда мутации в общей генетике считались редкими событиями, и вирусологи связывали вирусный геном с определенным нуклеотидная последовательность, что до сих пор подразумевается в содержании банки данных.[15] Облачная природа Qβ понималась как следствие его высокой скорости мутаций, рассчитанной в 10−4 мутации, введенные на копируемый нуклеотид,[16] вместе с толерантность отдельных геномов, чтобы принять неопределенную долю вновь возникающих мутаций, несмотря на затраты на приспособленность. Частота ошибок, оцененная для бактериофага Qβ, подтверждена и сопоставима со значениями, рассчитанными для других РНК-вирусов.[6][17]
Высокая частота мутаций и квазивиды были подтверждены для других РНК-вирусов на основании анализа вирусных популяций путем молекулярного или биологического клонирования и анализа последовательностей отдельных клонов. Джон Холланд и его коллеги были первыми, кто осознал, что быстро развивающийся мир РНК, внедренный в биосферу на основе ДНК, имеет множество эволюционных и медицинских последствий.[14][18][19][20] Пластичность генома РНК-вирусов подозревалась в течение многих десятилетий. Ключевыми ранними наблюдениями были вариации вирусных признаков, описанные Финдли в 1930-х годах, исследования Граноффа о переходах бляшка морфология Вирус болезни Ньюкасла, или высокая частота конверсий между устойчивость к лекарству и зависимость в Вирус Коксаки A9, среди других исследований с вирусами животных и растений в середине 20 века.[21] Если поместить в контекст современных знаний, мы понимаем, что эти наблюдения фенотипических изменений были верхушкой айсберга чрезвычайно сложной реальности вирусных популяций. РНК-вирусы характеризуются высокой частотой мутаций и популяционной гетерогенностью, что имеет последствия для вирусного патогенеза и борьбы с вирусными заболеваниями. Детальные исследования динамики квазивидов in vivo были выполнены с вирус иммунодефицита человека 1 типа (ВИЧ-1) и вирус гепатита С.[8][22][23]
Текущий объем
Первая математическая формулировка квазивидов была детерминированной; предполагалось установившееся распределение мутантов в генетическое равновесие без возмущений, вызванных изменениями окружающей среды или численность населения.[24] Эти условия являются обычными для первоначальных теоретических формулировок сложных явлений, поскольку они придают математическую поддачу. С тех пор было разработано несколько расширений теории на неравновесные условия со стохастическими компонентами с целью поиска общих решений для многопиковых фитнес-пейзажи. Эти цели приближают квазивиды к реальному случаю РНК-вирусов, которые вынуждены иметь дело с резкими изменениями в размере популяции и окружающей среде.[25] Исследования квазивидов проходили по нескольким теоретическим и экспериментальным направлениям, включая продолжение исследований эволюционной оптимизации и происхождения жизни, РНК-РНК взаимодействия и репликаторные сети, порог ошибки в условиях изменчивой пригодности, учет химического мутагенеза и механизмов проверки, эволюция опухолевых клеток, бактериальные популяции или стволовые клетки, хромосомная нестабильность, лекарственная устойчивость и конформационные распределения в прионы (класс белков с конформационно-зависимым патогенным потенциалом; в этом случае квазивид определяется распределением конформаций).[8][26] Новые данные в экспериментальных исследованиях квазивидов были получены благодаря глубокому секвенированию для исследования вирусных и клеточных популяций, распознаванию взаимодействий в мутантных спектрах, моделям вирусных динамика населения связанные с прогрессированием заболевания и передачей патогенов, а также новые учения, основанные на верных вариантах вирусов.[26] Здесь мы суммируем основные аспекты динамики квазивидов и недавние разработки, относящиеся к эволюции и патогенезу вирусов.
Динамическая неоднородность
Молекулярная основа высокой частоты ошибок - ограниченная точность копирования шаблона. РНК-зависимые РНК-полимеразы (RdRps) и РНК-зависимые ДНК-полимеразы (также называемые обратными транскриптазами, RT). Кроме того, эти ферменты нарушают корректура[27] потому что им не хватает 3–5 футов экзонуклеаза домен присутствует в репликативных клеточных ДНК-полимеразах.[28] Кроме того, пути пострепликативной репарации, многочисленные для коррекции генетических повреждений в реплицирующейся клеточной ДНК, оказываются неэффективными для двухцепочечных РНК или гибридов РНК-ДНК. Наличие корректурно-ремонтной деятельности в коронавирусы увеличивает их точность копирования примерно в 15 раз.[29] Эта и другие восстановительные действия, которые могут действовать на стандартную РНК или ретровирусный геномы,[30][31][32][33] не препятствуют образованию мутантных спектров, хотя их амплитуда может быть ниже, чем для других РНК-вирусов, по крайней мере, в популяциях, близких к клональному (единичному геному) происхождению. Динамика квазивидов будет действовать в любой вирусной или клеточной системе, в которой из-за высокой скорости мутаций (в результате полимераз нуклеиновых кислот низкой точности или изменений окружающей среды) быстро генерируются мутантные спектры.[8][34][35][36][37][38]
Исследования с разными вирус-хост-системы установили некоторые общие наблюдения о механизмах генерации мутантов и последствиях динамики квазивидов.[8][39][40][41][42][43][44][45][46][47][48] В генетике РНК-вирусов, когда мы говорим о «мутанте», мы имеем дело с облаком мутантов, в котором конкретная мутация, на которую мы обращаем наше внимание, присутствует во всех (или в подавляющем большинстве) отдельных геномах. Не существует таких вещей, как вирус дикого типа или мутантный вирус. Они всегда тучи мутантов. Изменения относительного преобладания компонентов мутантных спектров особенно сильны во время in vivo инфекции, со сложной динамикой неоднородности и вариаций внутри хозяина. Биоинформатика были разработаны процедуры выявления взаимосвязей между различными, но тесно связанными типами генома, которые могут указывать на некоторый иерархический порядок приобретения мутаций или идентификации кластеров передачи (примеры: пискусство Аанализ Qуазид, PAQ[49] или же QUасвиды Eобороты Nоснованный на работе Тпередача ВФеренция, КВЕНТИН[50]).
Фенотипические резервуары
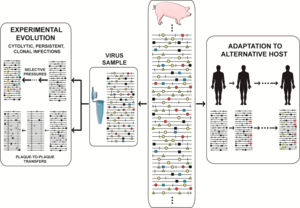
Суть вопроса, касающегося квазивидов, заключается в том, что в любой момент времени вирусная популяция включает в себя резервуар не только генотипический но также фенотипический варианты, наделяющие население некоторыми адаптивными плюрипотентность. Накопление лабораторных и клинических данных делает невозможным исключение меньших компонентов мутантных спектров на том основании, что они существуют. нейтральный. Они могут участвовать в избирательных процессах и не могут быть исключены из интерпретации поведения вирусов. Вариация повсеместно включает точечные мутации и он также может включать рекомбинация (в его репликативном и нерепликативном режимах), и реассортация сегментов генома.[40] Все способы молекулярной вариации совместимы, ограничены только объемом механизмов, доступных репликативному аппарату, и необходимостью сохранения функциональности вирусных геномов. Дэвид Эванс и его коллеги идентифицировали множество событий рекомбинации, связанных с энтеровирус репликации, и только несколько рекомбинантов пробились к продолжению репликации.[51] Рекомбинация может опосредовать адаптивность и вирулентность.[52] Высокие скорости мутаций и рекомбинации привели к концептуальному различию между механически неизбежными и эволюционно значимыми вариациями в связи с проблемой клональной и неклональной природы эволюция вируса (микробная эволюция в целом).[53][54] Только небольшая часть возникающих вариаций во время репликации может быть успешно размножена. В пределах, установленных биологические ограничения, каждая популяция состоит из массива вариантных геномов, общее количество которых соизмеримо с размером популяции вируса. Чтобы заразить растение, животное или культуру клеток 103 инфекционные единицы могут иметь совсем другие последствия, чем заражение 1010 инфекционных единиц не только потому, что защита хозяина системы могут быть подавлены высокой инфекционной дозой, но также и потому, что репертуар мутантов, участвующих в адаптивных исследованиях, шире. Часть вариантов мутантного спектра, изолированно или совместно с другими,[55] может работать лучше, чем другие члены того же населения, в случае изменения окружающей среды. Селективное давление способствует репликации одних компонентов мутантного спектра по сравнению с другими, несмотря на то, что все они связаны между собой мутациями. Дифференциальная производительность может быть на уровне вирусных геномов (при репликации, внутриклеточной экспрессия гена, взаимодействие с факторами хозяина и т. д.) или вирусными частицами (для термостабильности, Вход в или же выход из клетки, чтобы противостоять нейтрализующим антителам и т. д.).[20][8][21][22][23][40][41][42] Адаптивность РНК-вирусов связана с параметрами, которые облегчают исследование пространства последовательностей: размер генома (от 1,8 до 33 КБ), размер популяции (варьируется, но может достигать впечатляющих 1012 отдельные геномы в инфицированном хозяине в данный момент времени), скорость репликации, скорость мутаций, плодовитость (выход вирусных частиц на клетку) и количество мутаций, необходимых для фенотипического изменения (неожиданно низкое для нескольких важных признаков[56]).
Динамика спектра мутантов изображалась по-разному, и мы выбрали тот, который охватывает частые события в естественных популяциях и исследованиях, например изоляция вируса от инфицированного хозяина, адаптация к культуре клеток для исследований экспериментальной эволюции или адаптация к альтернативным хозяевам in vivo. Реальность еще более сложна, учитывая большие размеры популяции, с неопределенной долей геномов, активно реплицирующихся в любой момент времени (иногда приравниваемой к эффективному размеру популяции в общей генетике) и несущих множественные мутации на геном. Сценарии, предлагаемые текущими экспериментальными данными, бросают вызов нашему воображению. Относительная частота отдельных мутаций колеблется в результате непрерывного исследования пространства последовательностей,[57][58][8] при этом фенотипические изменения (не только генотипические изменения) происходят гораздо чаще, чем считалось ранее. В экспериментальная эволюция Дизайн, который состоит из передачи вирусных популяций в течение длительных периодов времени (много последовательных инфекций), часто бывает чрезвычайно показательным. В вирус ящура (FMDV) такая конструкция привела к замечательной фенотипической диверсификации на субпопуляции колонизаторов и конкурентов, которые модулировали вирулентность ансамбля мутантов.[59] В случае вируса гепатита С такая конструкция раскрыла непрерывные волны мутаций и более точное понимание типов ландшафтов пригодности, занятых вирусами высокой пригодности.[58][60]
Ограничения и неопределенности
Нуклеотидная последовательность отдельного генома из популяции (независимо от степени сложности популяции) может быть определена либо после события биологического или молекулярного клонирования, либо путем глубокого секвенирования целых вирусных геномов таким образом, чтобы мутационная связь ( отнесение различных мутаций к одной и той же молекуле генома). Каждая из этих процедур подразумевает некоторые ограничения: биологическое клонирование может смещать представление в пользу инфекционных геномов, тогда как молекулярное клонирование может вводить в анализ неинфекционные (дефектные) геномы.[20][56][57] Описание квазивидов с полным геномом все еще технически сложно из-за искусственного введения мутаций. Большинство современных платформ глубокого секвенирования дают последовательности коротких считываний для данного ампликона (анализируемая последовательность); меньшие мутации в ампликоне не могут быть надежно связаны с мутациями в другом ампликоне того же генома; в лучшем случае могут быть предложены статистические выводы о связи. Несмотря на эти ограничения, контрольные эксперименты и усовершенствования биоинформатических процедур подтверждают, что большая часть гетерогенности последовательностей, проанализированных в вирусных популяциях, действительно отражает различия в естественных популяциях матрицы. Если мутационная связь может быть решена на рутинной основе, новая волна молекулярной информации, относящейся к эпистатическим взаимодействиям, войдет в картину.
Есть дополнительные уровни неопределенности в последовательном анализе вирусных популяций, в особенности тех, которые реплицируются in vivo. Компоненты мутантного спектра, представленные в данный момент в образце, взятом для секвенирования, могут отличаться от таковых в следующий момент времени, либо из-за неопределенностей выборки, либо из-за истинных колебаний частот генома. Неоправданно принимать грубое сходство, потому что даже одна мутация в данном контексте последовательности может повлиять на биологические свойства.[8] По словам Джона Холланда и его коллег: «Важно помнить, что каждый рой геномов квазивидов у инфицированного человека уникален и« новый »в том смысле, что никогда не существовало идентичной популяции геномов, и ни одна такая популяция никогда не будет существовать снова. ».[61] Помимо мимолетного характера любого распределения мутантов, стандартные методы, доступные для характеристики квазивидов, обеспечивают геномные последовательности меньшинства населения (оценивается в 10−8 до 10−13 для молекулярного клонирования-секвенирования по Сэнгеру, а в 10−6 до 10−11 для глубокого секвенирования).[56] Мы можем иметь только приблизительное представление о вирусных популяциях и их динамике, о чем свидетельствуют многие экспериментальные исследования.[13][18][8][41][42][56][58][62]
Дескрипторы, не основанные на консенсусе
Пункты, изложенные в предыдущих разделах, полностью оправдывают обращение к аналитическим инструментам в отношении спектра мутантов, а не игнорирование его или рассмотрение его наличия как побочного вопроса. Использование согласованных последовательностей для описания генома изолята вируса, несмотря на то, что оно оправдано трудностями передачи информации, обобщенной в мутантном спектре, размывает и ослабляет биологические интерпретации. Экспериментальные результаты продемонстрировали, что геномы меньшинства из мутантного спектра (которые не могут быть идентифицированы путем изучения согласованной последовательности) могут включать мутации, которые придают устойчивость к противовирусные ингибиторы, нейтрализующие антитела или же цитотоксические Т-клетки, или это может изменить способность вызывать интерферон (IFN) или для ответа на IFN, вирулентность или стабильность частиц, среди других фенотипических признаков.[8][40][44][58][62][63][64][65] Спектры мутантов также могут опосредовать циклическую адаптацию к разным типам клеток.[39] Спектр мутантов определяет консенсус, но консенсус - это абстракция; он не может быть представлен в населении. Многие события в вирусном патогенезе и эволюции происходят из-за модификаций или взаимодействий мутантного спектра, которые не могут быть должным образом интерпретированы исключительно на основе согласованных последовательностей.[13][8][20][21][26][39][38][41][42][51][52][55][58][61]
Коллективный ответ
Спектры мутантов - это не просто совокупность мутантов, действующих независимо. Они часто участвуют в коллективных ответах двух основных типов: те, которые зависят от наличия наборов вариантов, и те, которые зависят от взаимодействий внутри мутантного спектра.
Варианты, которые стимулируют реакцию на выборочные ограничения
Поведение реконструированных квазивидов
В некоторых случаях широкий выбор (очень сильный отбор по признаку), индивидуум (или ограниченное количество особей), который кодирует сигнатуры, склонные к отбору, может приблизиться к доминированию, став основателем мутантного облака (поскольку формирование облака присуще репликации). Условия для доминирования (в данном случае в ответ на отбор) заключаются в том, что геном чувствует избирательный захват и что его репликация в новой селективной среде разрешена. В остальных случаях отбирается коллекция мутантов. Это было проиллюстрировано на примере квазивидов ящура, который был реконструирован в лаборатории с множественными антигенными вариантами (каждый с низкой частотой), которые принадлежали к двум разным категориям и имели общую устойчивость к одному и тому же моноклональное антитело.[66] В одну категорию вошли мутанты с аминокислотной заменой, которая затронула распознавание рецепторов (поскольку антигенная детерминанта перекрывается с рецептор интегрина сайт признания); в другой категории замены затронули антигенную детерминанту, но не сайт узнавания рецептора. Пассажи вируса в отсутствие моноклонального антитела приводили к преобладанию антигенных вариантов, которые сохраняли способность распознавания рецептора, но доминантные варианты были окружены облаком мутантов другой категории антигенных вариантов. Напротив, пассажи в присутствии антитела приводили к отбору вариантов с измененным распознаванием рецептора, окруженных облаком антигенных вариантов, которые поддерживали распознавание рецептора. Результаты подчеркнули роль мутантных облаков в селективных событиях и раскрыли новый механизм антигенной гибкости.[66]
Память квазивидов
Квазивидовая память - это тип молекулярной памяти, зависящий от недавней истории эволюционного происхождения и целостности мутантного спектра.[67][68] Поиски памяти были вызваны сложным поведением адаптивной системы квазивидов вируса, предполагаемым наличием основной информации (считающейся той, которая определяет вирусную идентичность), несмотря на вариации составляющих элементов (спектр мутантов). Хорошо известный пример: память в иммунной системе который мобилизует и расширяет меньшие компоненты в ответ на стимулы, с которыми ранее сталкивалась система.[69] В экспериментах, направленных на выявление памяти у квазивидов вирусов, частота членов мутантного спектра увеличивалась в результате их репликации во время события отбора, которое привело их к доминированию. Когда селективное ограничение было снято, геномы памяти оставались на уровнях, которые были в 10-100 раз выше, чем базальные уровни, связанные исключительно с их генерацией в результате мутации, что подтверждено независимыми генетическими маркерами ящура и ВИЧ-1. in vivo.[67][68][70][71] Таким образом, память - это зависящее от истории коллективное свойство квазивидов, которое дает избирательное преимущество для реакции на изменения окружающей среды, ранее испытанные той же самой эволюционной линией. Он может проявляться только в том случае, если спектр мутантов сохраняет свою полноту, поскольку память теряется, когда популяция подвергается горлышко бутылки событие, исключающее меньшинства. Соответствующий пример последствий памяти имеет место в противовирусной фармакологии с введением во второй раз того же или родственного противовирусного агента (способного вызывать общие мутации устойчивости), использованного в предыдущем лечении. Второе вмешательство может столкнуться с устойчивыми к ингибиторам геномами памяти от более раннего лечения, что будет способствовать ускользанию вируса.[67] Этому аспекту не уделялось должного внимания при планировании противовирусных вмешательств для пациентов, которые не прошли первый курс лечения и должны быть подвергнуты второму лечению.
Внутримутантные спектральные взаимодействия для интерференции, дополнения или сотрудничества
Отдельные геномы, окруженные облаком родственных мутантов, можно либо подавить, чтобы сохранить с низкой частотой, либо помочь поддержать в популяции. Две альтернативные судьбы зависят от нескольких факторов, одним из которых является окружающий спектр мутантов на тех этапах инфекционного цикла, в которых устанавливается эффективная конкуренция между вариантами, например, внутри репликационных комплексов. Это важное понятие было впервые получено теоретически,[10][72] а потом подошел экспериментально с несколькими вирусами. В одном из ранних исследований Хуан Карлос де ла Торре и Джон Холланд описали подавление VSV высокой пригодности мутантными спектрами низкой приспособленности.[10] С тех пор подавляющие эффекты были задокументированы для стандартных и мутагенизированных вирусных популяций. Вот несколько примеров:
- Подавление высокофункциональных антигенных вариантов ящура мутантами с низкой пригодностью, ускользающими от антител.[73]
- Подавление вирулентных полиовирус (PV) ослабленным вирусом в вакцины против полиовируса.[63]
- Подавление патогенных вирус лимфоцитарного хориоменгита (LCMV) (которые вызывают дефицит гормона роста у мышей) непатогенными вариантами LCMV.[74]
- Подавление ящура мутагенизированной популяцией ящура.[75]
- Подавление ящура мутантами капсида и полимеразы ящура.[76]
- Подавление устойчивых к лекарствам вирусных мутантов во время противовирусной терапии.[77][78]
Противоположностью подавлению является поддержание мутанта либо за счет благоприятного положения в фитнес-ландшафте, либо за счет взаимодействия дополнение или же сотрудничество с представителями мутантного спектра. Положение в фитнес-ландшафте влияет на уязвимость к мутациям, что популярно с помощью терминов «преимущество самого плоского» или «выживаемость самого плоского», что указывает на то, что вариант, расположенный на вершине острого пика пригодности, имеет более высокую вероятность снижения приспособленности, поскольку в результате новых мутаций, чем тот же вариант, расположенный в плато фитнеса.[2][79][80] Выживание самых плоских также было предложено в качестве ингредиента в некоторых моделях порога ошибки.[81]
Коллективное поведение вирусов подтверждено мутантными РНК-вирусами, устойчивыми к аналогам нуклеотидов. Изучение этого класса мутантов сыграло важную роль в понимании молекулярных основ верности шаблонного копирования, а также последствий изменений верности адаптивной способности и патогенного потенциала РНК-вирусов.[82][83][84] В первом изученном мутанте аминокислотная замена G46S в полимеразе PV привела к примерно четырехкратному увеличению точности копирования матрицы. Эта модификация снижает адаптивность PV и инфекционный потенциал in vivo.[82][83] Изолированный мутант не реплицировался эффективно в мозге восприимчивых мышей, но это имело место, когда его мутантный спектр был расширен за счет 5-фторурацил мутагенез или когда он был совместно инокулирован с PV дикого типа.[83]
Комплементация (часто возникающая, когда функциональный белок, кодируемый набором геномов, используется другим набором геномов, кодируемый белок не является функциональным), может лежать в основе некоторых коллективных реакций квазивидов, таких как приспособленность индивидов, изолированных из популяции, уступающая приспособленности квазивидов. численность населения.[13][28] Комплементация была описана между двумя укороченными геномными формами ящура.[85] Геномы с внутренними делециями стали обнаруживаться после пассажа с высокой множественностью клональной популяции стандартного вируса ящура, вируса с одночастичным геномом одноцепочечной РНК. Инфекция была вызвана комплементацией двух усеченных форм в отсутствие стандартных полноразмерных геномов вируса ящура. Чтобы комплементация была эффективной, требовалось предварительное исследование пространства последовательностей посредством точечных мутаций.[86] Система претерпела поразительный эволюционный переход, похожий на сегментацию генома. Серьезные генетические нарушения в вирусных геномах трудно наблюдать, если такой механизм, как комплементация, не помогает девиантным геномам. Сообщалось о дополнительных примерах комплементации среди РНК-вирусов.[87][88][89][40][42] Комплементация - это средство поддержания дефектных геномов на обнаруживаемой частоте в вирусных популяциях.
Было сделано различие между комплементацией и кооперацией, при которых два разных генома порождают новый фенотип посредством взаимодействия между двумя вариантными белками.[90] Пример сотрудничества был охарактеризован во время исследований вируса кори по слиянию мембран, которое необходимо для проникновения вируса в клетки. Поскольку слияние этого вируса опосредовано двумя белками, называемыми H и F. Укороченному H было недостаточно слияния клеток, но активность восстанавливалась, когда усеченный H сопровождался двумя формами F, но не одной из форм по отдельности.[90]
Поэтому дополнение, сотрудничество, вмешательство и подавление может возникать в результате взаимодействий между компонентами мутантных спектров, которые происходят из случайных мутаций. Отбор воздействует на любые наборы мутантов, которые могут дать полезный признак, чтобы превратить случайные явления в биологический смысл.
Узкие места

Средство для прерывания участия отдельных геномов во взаимодействиях с их мутантным спектром состоит в том, чтобы рой квазивидов подвергался резкому сокращению размера популяции, изолирующему один или несколько отдельных геномов от их окружения. Такие сокращения называются узкими местами, и они играют важную роль в формировании эволюционных линий для всех видов организмов, а также для вирусов. Они часто возникают не только при передаче от хоста к хосту, но и внутри инфицированных хостов.[91][92][93] и они могут нарушать положительные и отрицательные события отбора в процессах, которые трудно идентифицировать и охарактеризовать.
Резкие «узкие места» были воспроизведены с лабораторными популяциями вирусов в форме переноса бляшки на бляшку.[94][95] Эта конструкция служила для экспериментальной проверки работы Трещотка Мюллера, или снижение приспособленности из-за необратимого включения мутаций в бесполые организмы в отсутствие компенсаторных механизмов.[96] Серийный перенос «узкого места» выявил наличие редких мутаций, не наблюдаемых в стандартных лабораторных или естественных вирусных популяциях. В отсутствие случаев принудительного возникновения узких мест такие редкие мутации будут потеряны в результате отрицательного отбора из-за стоимости их пригодности.[97] Исследование того, как клоны ящура, ослабленные храповым механизмом Мюллера, восстанавливали репликативную пригодность, выявило несколько альтернативных молекулярных путей восстановления приспособленности.[98] Последствия этого наблюдения оставались в значительной степени незамеченными до недавних результатов с вирус гепатита С (HCV) также высказали предположение о доступности нескольких путей улучшения физической формы.[58][60] Кроме того, обширный пассаж биологического клона ящура в Клетки BHK-21 предоставил способность инфицировать несколько линий клеток человека в дополнение к ожидаемому увеличению приспособленности к размножению в клетках BHK-21.[99] Таким образом, несколько линий доказательств предполагают, что увеличение приспособленности в конкретной среде может парадоксальным образом расширить фенотипический потенциал вируса. Было бы интересно исследовать, может ли целенаправленная адаптация других вирусов к определенной среде также повлечь за собой расширение разнообразия, когда многие фенотипические варианты достигают аналогичных уровней приспособленности. Если обобщить, это расширение фенотипического пространства обеспечит новую интерпретацию молекулярной основы адаптации и объяснит, почему адаптация к альтернативной среде может не приводить к затухание.
Лишение отдельного вируса возможного подавления, дополнения или сотрудничества может представлять собой освобождение для запуска нового эволюционного процесса или приговор к исчезновению. При освобождении от подавления изолированный геном должен реплицироваться и быть в состоянии реконструировать мутантное облако, чтобы восстановить способность к адаптации. Это привело к предположению, что высокая частота мутаций способствовала восстановлению такого мутантного спектра после возникновения узких мест. В других моделях высокая частота мутаций объясняется адаптивной оптимизацией, независимой от узких мест, или механистическими последствиями быстрой репликации.[56] Каким бы ни было их изначальное происхождение, высокая частота мутаций служит цели адаптации во многих обстоятельствах, а не только после устранения узких мест. Вирус-основатель может ввести другой фенотип для последующей эволюции. Эволюцию вирусов в природе и как возбудителей болезней можно рассматривать как последовательность изменений спектра мутантов, подверженных расширению и уменьшению размера популяции в непрерывном взаимодействии положительного и отрицательного отбора и случайного дрейфа. В то время как краткосрочная (например, внутрихозяйственная) эволюция наблюдаема и поддается измерению, вирусы могут казаться относительно статичными в долгосрочной перспективе в течение десятилетий (как видно на примере антигенных вариантов ящура. [100]) или дольше. Эволюция внутри хозяина, как правило, происходит быстрее, чем эволюция между хозяевами, что подтверждается вирусами.[8] и другие биологические системы.[101] Кажущаяся инвариантность может быть результатом отбора для долгосрочного выживания популяций, которые ранее лихорадочно тестировали эволюционные результаты в краткосрочных процессах.[56]
Вирусное заболевание
Вскоре после того, как квазивиды были обнаружены для вирусов, некоторые медицинские последствия стали очевидными.[18][102] Ниже приведены некоторые конкретные и общие моменты.[8][41][64][26]
- Высокая частота мутаций и популяционная гетерогенность наделяют вирусы потенциалом избежать иммунного давления (в том числе из-за вакцинация ) и противовирусные ингибиторы, используемые в терапии. Это открытый вопрос, может ли вакцинация способствовать долгосрочному развитию антигенных детерминант.
- Вакцины с ослабленным РНК-вирусом могут возвращаться в вирулентные формы. РНК-вирусы, выделяемые в природе для борьба с вредителями цели могут мутировать в новые фенотипы.
- Ослабление и вирулентность вируса зависит от генетических признаков вируса. Вариантные формы данного вируса могут проявлять повышенную вирулентность или атипичное заболевание.
- Компоненты мутантного спектра могут демонстрировать разные клеточный тропизм или же диапазон хоста чем большинство геномов в той же популяции, с последствиями для возникновения и повторного возникновения вирусного заболевания.
- На патогенез вирусов влияют: микроэволюционный процессы, при которых одни вирусные субпопуляции заменяются другими для сохранения или вторжения в новые типы клеток, тканей или органов.
- Чем больше размер активно реплицирующейся (эффективной) популяции и скорость репликации, тем эффективнее исследование пространства последовательностей для фенотипических расширений, которые способствуют выживанию и устойчивости.
- Существует связь между четырьмя параметрами, которые характеризуют вирусы во время инфекционных процессов: скорость репликации (скорость, с которой вирусная РНК или ДНК синтезируется внутриклеточно для производства вирусного потомства), вирусная нагрузка (общее количество вируса, определенное количественно в инфицированном хозяине или компартменте хозяина. ), генетическая гетерогенность и репликативная пригодность (выход инфекционных частиц, которые могут способствовать следующему поколению). Они могут влиять на прогрессирование болезни, и любой из них может быть выбран для борьбы с болезнью.
Во всех взаимодействиях, ведущих к заболеванию, клетки-хозяева по отдельности и как группы в тканях и органах играют решающую роль. Последствия вирусной инфекции всегда зависят от хозяина. Однако сам вирус представляет собой серьезную проблему, с которой помогает более глубокое понимание динамики квазивидов.[26]
Противовирусные стратегии
Растет мнение о том, что дарвиновские принципы должны помочь в планировании противовирусных конструкций.[103] Цель вакцинации - вызвать защитную реакцию, которая предотвращает репликацию вируса или заболевание. Целью противовирусного фармакологического вмешательства является подавление репликации вируса, чтобы дать иммунной системе возможность избавиться от вируса. Проще говоря, прямая опасность для вакцинации и лечения заключается в том, что вирус может ускользнуть через отбор мутантов, устойчивых к компонентам защиты, запускаемым вакциной, или к ингибиторам, вводимым извне. Это привело к нескольким предложениям по борьбе с вирусными заболеваниями, которые можно кратко изложить ниже.[56]
Воздействие вакцины на множественные В-клеточные и Т-клеточные эпитопы
Вакцины должны включать репертуар В клетка и Т-клетка эпитопы, чтобы вызвать обильные иммунная реакция. Широкий ответ должен свести к минимуму отбор ускользающих мутантов, которые могут присутствовать в качестве неосновных компонентов в мутантных спектрах, что неоднократно подтверждалось экспериментально.[8][20][42][67] Из имеющихся в настоящее время типов вакцин те, которые лучше всего соответствуют множеству эпитоп требования в порядке ожидаемой эффективности для обеспечения защиты от вирусов с высокой вариабельностью: ослабленный > инактивированный целый вирус > несколько экспрессированных белков> один экспрессированный белок > множественные синтетические пептидные антигены > единственный пептидный антиген. Нехватка эффективных синтетических вакцин против РНК-вирусных патогенов, несмотря на огромные научные и экономические усилия, является отражением основных проблем.
Противовирусные средства, используемые в комбинации
Противовирусное средство монотерапия (использование одного противовирусного агента) следует избегать. Следующие рекомендации были сделаны и в некоторых случаях успешно реализованы:
- Ингибиторы, используемые в комбинации, должны быть нацелены на продукты различных вирусных генов.
- Разделение лечения на два этапа: первый - индукционный, второй - поддерживающий. Лекарства, вводимые на двух этапах, должны быть разными.
- Нацеливание на клеточные функции, необходимые для жизненного цикла вируса.
- Использование препаратов, стимулирующих врожденный иммунный ответ (например, ингибиторов ферментов, участвующих в биосинтезе пиримидина).
- Комбинированное использование иммунотерапия и химиотерапия.
- Смертельный мутагенез или исчезновение вируса из-за избытка мутаций, внесенных во время репликации вируса.
Эти стратегии имеют своей основной целью избежать отбора мутантов, избегающих лечения, с помощью множества селективных ограничений, которые не могут быть преодолены вирусом.[56][104] Контроль эффективен либо потому, что исследование пространства последовательностей не может достичь требуемых множественных мутаций (даже если рекомбинация доступна), либо потому, что множественные мутации вызывают серьезные затраты на приспособленность.[104] Вакцины, вызывающие множественные эпитопы, и комбинированная терапия придерживаются той же стратегии, цель которой - ограничить возможные пути выхода вирусных квазивидов перед лицом подавляющего ограничения.
Смертельный мутагенез
Смертельный мутагенез это процесс вымирания вируса с такой частотой ошибок, при которой вирус больше не может поддерживать свою генетическую информацию.[8][26][42][56][60][81][105][106] Применение летального мутагенеза в качестве противовирусной стратегии заслуживает внимания в контексте данной статьи, потому что его истоки лежат в теории квазивидов в форме отношения порога ошибки. И порог ошибки, и летальный мутагенез в значительной степени зависят от ландшафта приспособленности, но оба могут иметь место в сложных ландшафтах приспособленности, относящихся к вирусным популяциям.[81] Термин летальный мутагенез был придуман Лаверенсом Лебом и его коллегами,[105] и в настоящее время он широко используется для описания противовирусной активности аналогов оснований и нуклеозидов, которые увеличивают скорость вирусных мутаций. Хотя было предложено несколько моделей для объяснения исчезновения вируса избыточными мутациями,[81] вероятным механизмом является расширение нарушения порога ошибки.[107][106] Интересно, что некоторые противовирусные агенты, лицензированные для использования человеком, которые первоначально считались действующими только как ингибиторы репликации вирусов, могут фактически проявлять свою противовирусную активность против некоторых РНК-вирусов, по крайней мере частично, посредством летального мутагенеза. Это случай фавипиравир (Т-705; 6-фтор-3-гидрокси-2-пиразинкарбоксамид) и рибавирин (1-β-D-рибофуранозил-1-H-1,2,4-триазол-3-карбоксамид), которые в настоящее время интенсивно исследуются как летальные мутагены.[106]
Защитные механизмы, основанные на модификации генома вторгшихся генетических паразитов, такие как редактирование клеточной активности, которая задействована как часть врожденного иммунного ответа (АДАР, АПОБЕК, РВАТЬ, так далее.)[108] представляют собой естественный аналог принципа, используемого в летальном мутагенезе. Применимость к патогенным клеточным элементам - реальная возможность, и летальный мутагенез для контроля опухолевых клеток - активная область исследований.[109][110] Таким образом, признание динамики квазивидов предложило некоторые фундаментальные рекомендации по профилактике заболеваний и борьбе с ними, которые постепенно проникают в клиническую практику. Это соответствует признанной необходимости применения дарвиновских принципов для борьбы с инфекционными заболеваниями.
Порог ошибки
Это можно определить как «Неспособность генетического элемента поддерживаться в популяции, поскольку точность его репликационного аппарата снижается выше определенного порогового значения».[111]
Теоретически, если бы частота мутаций была достаточно высокой, вирусная популяция не могла бы поддерживать генотип с наивысшей приспособленностью, и, следовательно, способность популяции адаптироваться к окружающей среде была бы нарушена. Практическое применение этой динамики - в противовирусных препаратах, использующих летальный мутагенез. Например, повышенные дозы мутагена Рибавирин снижает инфекционность полиовируса.[112]
Однако эти модели предполагают, что только мутации, которые происходят в наиболее подходящей последовательности, являются вредными и, более того, они не смертельны. Утверждалось, что если мы примем во внимание пагубное влияние мутаций на популяцию вариантов и тот факт, что многие мутации являются летальными, то порог ошибки исчезает, то есть наиболее подходящая последовательность всегда сохраняется.[113][111][114] Эмпирические данные о влиянии мутаций на вирусы редки, но, похоже, соответствуют этому сценарию.[115]
Возможные эволюционные последствия
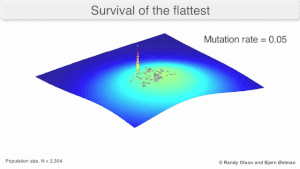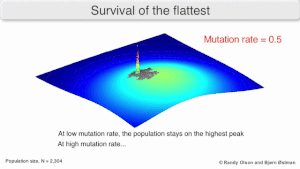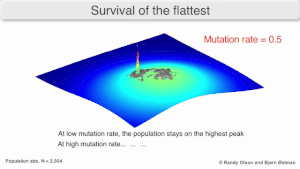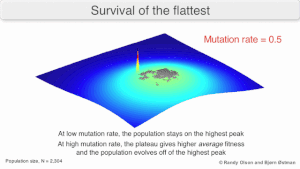
Мутационная устойчивость
На долгосрочную эволюцию вируса может повлиять то, что он может быть лучше эволюционно устойчивая стратегия генерировать широкий квазивид с членами примерно равной приспособленности, чем иметь четко определенный `` наиболее подходящий '' единственный генотип (с мутационными соседями существенно меньше подходят). Это было названо «выживанием самых плоских» - имея в виду профили пригодности двух стратегий соответственно.[2]
В долгосрочной перспективе более плоский фитнес-профиль может лучше позволить квазивидам использовать изменения в давление отбора аналогично тому, как половые организмы используют рекомбинация сохранить разнообразие в популяции. По крайней мере, при моделировании можно показать, что более медленный репликатор может превзойти более быстрый репликатор в тех случаях, когда он более надежен и скорость мутаций высока.[1]
Однако будь мутационная устойчивость эволюционировали или присущи генетическим системам, не подтверждено, потому что основной механизм устойчивости будет зависеть от особенностей каждой системы.[3]
Сотрудничество
Экспериментальное манипулирование полиовирус чтобы дать им более высокую точность полимераза - и, следовательно, снизить скорость их мутаций - показали, что эти варианты имеют более низкую патогенность чем дикого типа последовательности.[83] Затем патогенность может быть восстановлена применением мутагена. Это было интерпретировано как означающее, что более низкая частота мутаций снизила приспособляемость (или широта) квазивидов. Мутантные вирусы, извлеченные из ткани головного мозга, сами по себе не были патогенными, и авторы предполагают, что может существовать комплементация между различными членами квазивидов, которая может позволить вирусам колонизировать различные ткани и системы хозяина.
Рекомендации
![]() Эта статья была адаптирована из следующего источника под CC BY 4.0 лицензия (0200 ) (отчеты рецензента ): «Вирусные квазивиды», PLOS Genetics, 15 (10): e1008271, 17 октября 2019 г., Дои:10.1371 / JOURNAL.PGEN.1008271, ISSN 1553-7390, ЧВК 6797082, PMID 31622336, Викиданные Q86320171
Эта статья была адаптирована из следующего источника под CC BY 4.0 лицензия (0200 ) (отчеты рецензента ): «Вирусные квазивиды», PLOS Genetics, 15 (10): e1008271, 17 октября 2019 г., Дои:10.1371 / JOURNAL.PGEN.1008271, ISSN 1553-7390, ЧВК 6797082, PMID 31622336, Викиданные Q86320171
- ^ а б ван Нимвеген Э, Кратчфилд Дж. П., Хьюнен М. (август 1999 г.). «Нейтральная эволюция мутационной устойчивости». Труды Национальной академии наук Соединенных Штатов Америки. 96 (17): 9716–20. arXiv:adap-org / 9903006. Bibcode:1999PNAS ... 96.9716V. Дои:10.1073 / пнас.96.17.9716. ЧВК 22276. PMID 10449760.
- ^ а б c Wilke CO, Wang JL, Ofria C, Lenski RE, Adami C (июль 2001 г.). «Эволюция цифровых организмов с высоким уровнем мутаций приводит к выживанию самых плоских». Природа. 412 (6844): 331–3. Bibcode:2001 Натур 412..331Вт. Дои:10.1038/35085569. PMID 11460163.
- ^ а б Елена С.Ф., Агудело-Ромеро П., Карраско П., Кодоньер Ф.М., Мартин С., Торрес-Барсело С., Санхуан Р. (май 2008 г.). «Экспериментальная эволюция РНК-вирусов растений». Наследственность. 100 (5): 478–83. Дои:10.1038 / sj.hdy.6801088. ЧВК 7094686. PMID 18253158.
- ^ Эйген М., Маккаскилл Дж, Шустер П. (1988). «Молекулярные квазивиды». Журнал физической химии. 92 (24): 6881–6891. Дои:10.1021 / j100335a010. HDL:11858 / 00-001M-0000-002C-84A7-C. S2CID 96727272.
- ^ Новак М.А. (апрель 1992 г.). «Что такое квазивид?». Тенденции в экологии и эволюции. 7 (4): 118–21. Дои:10.1016/0169-5347(92)90145-2. PMID 21235976.
- ^ а б Дрейк Дж. У., Холланд Дж. Дж. (Ноябрь 1999 г.). «Скорость мутаций среди РНК-вирусов». Труды Национальной академии наук Соединенных Штатов Америки. 96 (24): 13910–3. Bibcode:1999PNAS ... 9613910D. Дои:10.1073 / пнас.96.24.13910. ЧВК 24164. PMID 10570172.
- ^ а б c Эйген, Манфред; Шустер, Питер (1979). «Гиперцикл». Naturwissenschaften. 65 (1): 7–41. Дои:10.1007 / bf00420631. ISSN 0028-1042.
- ^ а б c d е ж грамм час я j k л м п о Доминго Э., Шелдон Дж., Пералес С. (июнь 2012 г.). «Эволюция вирусных квазивидов». Обзоры микробиологии и молекулярной биологии. 76 (2): 159–216. Дои:10.1128 / MMBR.05023-11. ЧВК 3372249. PMID 22688811.
- ^ Эйген М. (октябрь 1971 г.). «Самоорганизация материи и эволюция биологических макромолекул». Die Naturwissenschaften. 58 (10): 465–523. Bibcode:1971NW ..... 58..465E. Дои:10.1007 / bf00623322. PMID 4942363.
- ^ а б c Светина Дж, Шустер П. (декабрь 1982 г.). «Саморепликация с ошибками. Модель полинуклеотидной репликации». Биофизическая химия. 16 (4): 329–45. Дои:10.1016/0301-4622(82)87037-3. PMID 7159681.
- ^ Форнес Дж., Томас Ласаро Дж., Аларкон Т., Елена С.Ф., Сарданьес Дж. (Январь 2019 г.). «Режимы репликации вирусов в условиях фитнеса с одним пиком: анализ динамических систем». Журнал теоретической биологии. 460: 170–183. Дои:10.1016 / j.jtbi.2018.10.007. PMID 30300648.
- ^ Шустер П. (2016). Квазивиды на фитнес-ландшафтах. Актуальные темы микробиологии и иммунологии. 392. Издательство Springer International. С. 61–120. Дои:10.1007/82_2015_469. ISBN 9783319238975. PMID 26597856.
- ^ а б c d Доминго Э., Сабо Д., Танигучи Т., Вайсманн С. (апрель 1978 г.). «Гетерогенность нуклеотидной последовательности популяции РНК-фага». Клетка. 13 (4): 735–44. Дои:10.1016/0092-8674(78)90223-4. PMID 657273.
- ^ а б Duarte EA, Novella IS, Ledesma S, Clarke DK, Moya A, Elena SF и др. (Июль 1994 г.). «Субклональные компоненты согласованной пригодности в клоне РНК-вируса». Журнал вирусологии. 68 (7): 4295–301. Дои:10.1128 / JVI.68.7.4295-4301.1994. ЧВК 236352. PMID 8207804.
- ^ Доминго Е., Брун А., Нуньес Дж. И., Кристина Дж., Брионес С., Эскарм С. (10 мая 2006 г.). «Геномика вирусов». Патогеномика. Wiley-VCH Verlag GmbH & Co. KGaA: 367–388. Дои:10.1002 / 352760801x.ch17. ISBN 9783527608010.
- ^ Бачелет Э., Доминго Э., Вайсманн Ц. (январь 1976 г.). «Доля ревертантных и мутантных фагов в растущей популяции как функция мутации и скорости роста». Ген. 1 (1): 27–32. Дои:10.1016/0378-1119(76)90004-4. PMID 1052321.
- ^ Брэдуэлл К., Комб М., Доминго-Калап П., Санхуан Р. (сентябрь 2013 г.). «Корреляция между частотой мутаций и размером генома в рибовирусах: частота мутаций бактериофага Qβ». Генетика. 195 (1): 243–51. Дои:10.1534 / генетика.113.154963. ЧВК 3761305. PMID 23852383.
- ^ а б c Холланд Дж., Шпиндлер К., Городиски Ф., Грабау Э., Никол С., ВандеПол С. (март 1982 г.). «Быстрая эволюция геномов РНК». Наука. 215 (4540): 1577–85. Bibcode:1982Научный ... 215.1577H. Дои:10.1126 / science.7041255. PMID 7041255.
- ^ Доминго Э., Мартинес-Салас Э., Собрино Ф., де ла Торре Х.С., Портела А, Ортин Дж. И др. (Январь 1985 г.). «Квазивидовая (чрезвычайно гетерогенная) природа популяций вирусных РНК геномов: биологическая значимость - обзор». Ген. 40 (1): 1–8. Дои:10.1016/0378-1119(85)90017-4. PMID 3912262.
- ^ а б c d е Доминго Э., Холланд Дж. Дж., Алквист П. (1988). Доминго Э., Холланд Дж. Дж., Алквист П. (ред.). РНК генетика. Дои:10.1201/9781351076432. ISBN 9781351076432.
- ^ а б c Голландия JJ (2006). «Переходы в понимании РНК-вирусов: историческая перспектива». Квазивиды: концепция и значение для вирусологии. Актуальные темы микробиологии и иммунологии. 299. Springer-Verlag. стр.371–401. Дои:10.1007/3-540-26397-7_14. ISBN 3540263950. PMID 16568907.
- ^ а б Meyerhans A, Cheynier R, Albert J, Seth M, Kwok S, Sninsky J, et al. (Сентябрь 1989 г.). «Временные колебания квазивидов ВИЧ in vivo не отражаются последовательными выделениями ВИЧ». Клетка. 58 (5): 901–10. Дои:10.1016/0092-8674(89)90942-2. PMID 2550139.
- ^ а б Фарси П. (ноябрь 2011 г.). «Новые взгляды на квазивиды и компартментализацию ВГС». Семинары по заболеванию печени. 31 (4): 356–74. Дои:10.1055 / с-0031-1297925. PMID 22189976.
- ^ Эйген М., Шустер П. (ноябрь 1977 г.). «Гиперцикл. Принцип естественной самоорганизации. Часть A: Возникновение гиперцикла». Die Naturwissenschaften. 64 (11): 541–65. Дои:10.1007 / bf00450633. PMID 593400.
- ^ Саакян Д.Б., Ху СК (2016). «Математические модели теории квазивидов и точные результаты для динамики». Актуальные темы микробиологии и иммунологии. Издательство Springer International. 392: 121–39. Дои:10.1007/82_2015_471. ISBN 9783319238975. PMID 26342705.
- ^ а б c d е ж Доминго Э., Шустер П., ред. (2016). Квазивиды: от теории к экспериментальным системам. Актуальные темы микробиологии и иммунологии. 392. Дои:10.1007/978-3-319-23898-2. ISBN 978-3-319-23897-5.
- ^ Штайнхауэр Д.А., Доминго Э., Холланд Дж. Дж. (Декабрь 1992 г.). «Отсутствие доказательств механизмов корректуры, связанных с полимеразой РНК-вируса». Ген. 122 (2): 281–8. Дои:10.1016 / 0378-1119 (92) 90216-с. PMID 1336756.
- ^ а б Бернад А., Бланко Л., Ласаро Дж. М., Мартин Дж., Салас М. (октябрь 1989 г.). «Консервативный активный сайт 3 '---- 5' экзонуклеазы в прокариотических и эукариотических ДНК-полимеразах». Клетка. 59 (1): 219–28. Дои:10.1016/0092-8674(89)90883-0. PMID 2790959.
- ^ Eckerle LD, Lu X, Sperry SM, Choi L, Denison MR (ноябрь 2007 г.). «Высокая точность репликации вируса гепатита мышей снижена в мутантах экзорибонуклеазы nsp14». Журнал вирусологии. 81 (22): 12135–44. Дои:10.1128 / jvi.01296-07. ЧВК 2169014. PMID 17804504.
- ^ Nagy PD, Carpenter CD, Simon AE (февраль 1997 г.). «Новый механизм репарации 3'-конца в РНК-вирусе». Труды Национальной академии наук Соединенных Штатов Америки. 94 (4): 1113–8. Bibcode:1997ПНАС ... 94.1113Н. Дои:10.1073 / pnas.94.4.1113. ЧВК 19753. PMID 9037015.
- ^ Баханашвили М. (апрель 2001 г.). «Экзонуклеолитическая корректура белком p53». Европейский журнал биохимии. 268 (7): 2047–54. Дои:10.1046 / j.1432-1327.2001.02075.x. PMID 11277927.
- ^ Смит EC, Денисон MR (05.12.2013). «Коронавирусы как подражатели ДНК: новая модель для регуляции верности репликации РНК-вируса». Патогены PLOS. 9 (12): e1003760. Дои:10.1371 / journal.ppat.1003760. ЧВК 3857799. PMID 24348241.
- ^ Смит Э. К., Секстон Н. Р., Денисон М. Р. (ноябрь 2014 г.). «Мышление вне треугольника: точность репликации крупнейших РНК-вирусов». Ежегодный обзор вирусологии. 1 (1): 111–32. Дои:10.1146 / annurev-virology-031413-085507. PMID 26958717.
- ^ Вагнер Н, Ацмон-Раз Й, Ашкенасы Г (2016). «Теоретические модели обобщенных квазивидов». Актуальные темы микробиологии и иммунологии. Издательство Springer International. 392: 141–59. Дои:10.1007/82_2015_456. ISBN 9783319238975. PMID 26373410.
- ^ Schmidt TT, Reyes G, Gries K, Ceylan CÜ, Sharma S, Meurer M и др. (Май 2017). «Инактивация GLN3 вызывает несбалансированные пулы dNTP и усиление мутагенеза». Труды Национальной академии наук Соединенных Штатов Америки. 114 (22): E4442 – E4451. Дои:10.1073 / pnas.1618714114. ЧВК 5465912. PMID 28416670.
- ^ Такахаши К., Секизука Т., Фукумото Х., Накамичи К., Сузуки Т., Сато Й. и др. (Январь 2017 г.). «Идентификация глубокой последовательности и роль в репликации вируса квазивидов JC у пациентов с прогрессирующей мультифокальной лейкоэнцефалопатией». Журнал вирусологии. 91 (1). Дои:10.1128 / jvi.01335-16. ЧВК 5165223. PMID 27795410.
- ^ Доминго-Калап П., Шуберт Б., Джоли М., Солис М., Унтрау М., Карапито Р. и др. (Октябрь 2018 г.). «Необычно высокая скорость замены в ассоциированном с трансплантатом полиомавирусе BK in vivo дополнительно концентрируется в HLA-C-связанных вирусных пептидах». Патогены PLOS. 14 (10): e1007368. Дои:10.1371 / journal.ppat.1007368. ЧВК 6207329. PMID 30335851.
- ^ а б Санчес-Кампос С., Домингес-Уэрта Дж., Диас-Мартинес Л., Томас Д.М., Навас-Кастильо Дж., Морионес Е., Гранде-Перес А. (2018-07-02). «Различная форма мутантных спектров геминивирусов в культивируемых и диких хозяевах с инвариантными вирусными консенсусными последовательностями». Границы науки о растениях. 9: 932. Дои:10.3389 / fpls.2018.00932. ЧВК 6036239. PMID 30013589.
- ^ а б c Донохью Р.К., Пфаллер К.К., Каттанео Р. (февраль 2019 г.). «Циклическая адаптация квазивидов вируса кори к эпителиальным и лимфоцитарным клеткам: к V или не к V». Патогены PLOS. 15 (2): e1007605. Дои:10.1371 / journal.ppat.1007605. ЧВК 6395005. PMID 30768648.
- ^ а б c d е Агол В.И., Гмыл А.П. (июнь 2018 г.). «Экстренные службы вирусных РНК: ремонт и ремоделирование». Обзоры микробиологии и молекулярной биологии. 82 (2): e00067-1. Дои:10.1128 / ммр. 00067-17. ЧВК 5968460. PMID 29540453.
- ^ а б c d е Фиглерович, Магдалена; Алейска, Магдалена; Курзинская-Кокорняк, Анна; Фиглерович, Марек (23 сентября 2003 г.). "Генетическая изменчивость: ключевая проблема профилактики и лечения вирусных инфекций, вызванных РНК". ХимИнформ. 34 (38). Дои:10.1002 / подбородок.200338243. ISSN 0931-7597.
- ^ а б c d е ж грамм Доминго Э., Пералес С. (май 2018 г.). «Квазивиды и вирус». Европейский биофизический журнал. 47 (4): 443–457. Дои:10.1007 / s00249-018-1282-6. PMID 29397419.
- ^ Санхуан Р., Доминго-Калап П. (декабрь 2016 г.). «Механизмы вирусной мутации». Клеточные и молекулярные науки о жизни. 73 (23): 4433–4448. Дои:10.1007 / s00018-016-2299-6. ЧВК 5075021. PMID 27392606.
- ^ а б Лауринг А.С., Андино Р. (июль 2010 г.). «Теория квазивидов и поведение РНК-вирусов». Патогены PLOS. 6 (7): e1001005. Дои:10.1371 / journal.ppat.1001005. ЧВК 2908548. PMID 20661479.
- ^ van Boheemen S, Tas A, Anvar SY, van Grootveld R, Albulescu IC, Bauer MP, et al. (Май 2017). «Квазивидовой состав и эволюция типичного клинического изолята вируса Зика из Суринама». Научные отчеты. 7 (1): 2368. Bibcode:2017НатСР ... 7.2368В. Дои:10.1038 / s41598-017-02652-w. ЧВК 5443807. PMID 28539654.
- ^ Влок М., Ланг А.С., Саттл, Калифорния (апрель 2019 г.). «Квазивиды морских РНК-вирусов распространены по всему океану». мСфера. 4 (2): e00157-19. Дои:10.1128 / mspheredirect.00157-19. ЧВК 6449609. PMID 30944212.
- ^ Хиросе Й., Онуки М., Тенджимбаяси Й., Мори С., Исии Й, Такеучи Т. и др. (Июнь 2018). «Вариации вируса папилломы человека внутри хозяина выявляют сигнатурный мутагенез APOBEC в вирусном геноме». Журнал вирусологии. 92 (12): e00017-18. Дои:10.1128 / jvi.00017-18. ЧВК 5974501. PMID 29593040.
- ^ Gisder S, Möckel N, Eisenhardt D, Genersch E (декабрь 2018 г.). «Эволюция вирулентности in vivo: переключение вируса деформированного крыла между хозяевами приводит к изменениям вирулентности и сдвигам последовательности». Экологическая микробиология. 20 (12): 4612–4628. Дои:10.1111/1462-2920.14481. PMID 30452113.
- ^ Баккам П., Томпсон Р. Дж., Федриго О., Карпентер С., Корнетт Дж. Л. (январь 2001 г.). "PAQ: Разделительный анализ квазивидов". Биоинформатика. 17 (1): 16–22. Дои:10.1093 / биоинформатика / 17.1.16. PMID 11222259.
- ^ Скумс П., Зеликовский А., Сингх Р., Гусслер В., Димитрова З., Князев С. и др. (Январь 2018). «КВЕНТИН: реконструкция передачи болезней по геномным данным вирусных квазивидов». Биоинформатика. 34 (1): 163–170. Дои:10.1093 / биоинформатика / btx402. ЧВК 6355096. PMID 29304222.
- ^ а б Лоури К., Вудман А., Кук Дж., Эванс DJ (июнь 2014 г.). «Рекомбинация в энтеровирусах - это двухфазный репликативный процесс, включающий образование« неточных »промежуточных продуктов, превышающих длину генома». Патогены PLOS. 10 (6): e1004191. Дои:10.1371 / journal.ppat.1004191. ЧВК 4055744. PMID 24945141.
- ^ а б Xiao Y, Rouzine IM, Bianco S, Acevedo A, Goldstein EF, Farkov M, et al. (Сентябрь 2017 г.). «Рекомбинация РНК повышает адаптивность и необходима для распространения вирусов и вирулентности». Клеточный хозяин и микроб. 22 (3): 420. Дои:10.1016 / j.chom.2017.08.006. ЧВК 5807061. PMID 28910639.
- ^ Тибайренц М., Аяла Ф.Дж. (ноябрь 2012 г.). «Репродуктивная клональность патогенов: взгляд на патогенные вирусы, бактерии, грибы и паразитические простейшие». Труды Национальной академии наук Соединенных Штатов Америки. 109 (48): E3305-13. Дои:10.1073 / pnas.1212452109. ЧВК 3511763. PMID 22949662.
- ^ Пералес С., Морено Е., Доминго Е. (июль 2015 г.). «Клональность и внутриклеточная полиплоидия в эволюции и патогенезе вирусов». Труды Национальной академии наук Соединенных Штатов Америки. 112 (29): 8887–92. Bibcode:2015ПНАС..112.8887П. Дои:10.1073 / pnas.1501715112. ЧВК 4517279. PMID 26195777.
- ^ а б Villarreal LP, Witzany G (ноябрь 2013 г.). «Переосмысление теории квазивидов: от наиболее приспособленных к совместным консорциумам». Всемирный журнал биологической химии. 4 (4): 79–90. Дои:10.4331 / wjbc.v4.i4.79. ЧВК 3856310. PMID 24340131.
- ^ а б c d е ж грамм час я Доминго Э. (сентябрь 2015 г.). Вирус как популяции: состав, сложность, динамика и биологические последствия. Академическая пресса. ISBN 978-0-12-800837-9.
- ^ а б Асеведо А., Бродский Л., Андино Р. (январь 2014 г.). «Мутационные и фитнес-ландшафты РНК-вируса, выявленные посредством популяционного секвенирования». Природа. 505 (7485): 686–90. Bibcode:2014Натура.505..686A. Дои:10.1038 / природа12861. ЧВК 4111796. PMID 24284629.
- ^ а б c d е ж Морено Э., Гальего I, Грегори Дж., Лусия-Санс А., Сориа М.Э., Кастро V и др. (Май 2017). «Внутреннее неравновесие и фенотипическая диверсификация во время репликации вируса гепатита С в неэволюционирующей клеточной среде». Журнал вирусологии. 91 (10). Дои:10.1128 / jvi.02505-16. ЧВК 5411618. PMID 28275194.
- ^ Охоснегрос С., Бееренвинкель Н., Антал Т., Новак М.А., Эскармис С., Доминго Э. (февраль 2010 г.). «Конкуренция-колонизация в РНК-вирусе». Труды Национальной академии наук Соединенных Штатов Америки. 107 (5): 2108–12. Bibcode:2010PNAS..107.2108O. Дои:10.1073 / pnas.0909787107. ЧВК 2836666. PMID 20080701.
- ^ а б c Гальего I, Грегори Дж., Сориа М.Э., Гарсиа-Креспо С., Гарсия-Альварес М., Гомес-Гонсалес А. и др. (Октябрь 2018 г.). «Устойчивость высокофункционального вируса гепатита С к летальному мутагенезу». Вирусология. 523: 100–109. Дои:10.1016 / j.virol.2018.07.030. PMID 30107298.
- ^ а б Холланд Дж. Дж., Де Ла Торре Дж. К., Штайнхауэр Д. А. (1992). «Популяции РНК-вирусов как квазивиды». Актуальные темы микробиологии и иммунологии. 176: 1–20. Дои:10.1007/978-3-642-77011-1_1. ISBN 9783642770111. OCLC 851813241. PMID 1600747.
- ^ а б Гарсия-Арриаса Дж., Охоснегрос С., Давила М., Доминго Э., Эскармис С. (июль 2006 г.). «Динамика мутации и рекомбинации в реплицирующейся популяции дополняющих, дефектных вирусных геномов». Журнал молекулярной биологии. 360 (3): 558–72. Дои:10.1016 / j.jmb.2006.05.027. PMID 16797586.
- ^ а б Чумаков К.М., Пауэрс Л.Б., Нунан К.Е., Ронинсон И.Б., Левенбук И.С. (январь 1991 г.). «Корреляция между количеством вируса с измененной нуклеотидной последовательностью и тестом на обезьянах на приемлемость пероральной полиовирусной вакцины». Труды Национальной академии наук Соединенных Штатов Америки. 88 (1): 199–203. Bibcode:1991 ПНАС ... 88..199С. Дои:10.1073 / пнас.88.1.199. ЧВК 50777. PMID 1846038.
- ^ а б Голландия JJ (1992). Генетическое разнообразие РНК-вирусов. Берлин, Гейдельберг: Springer Berlin Heidelberg. ISBN 9783642770111. OCLC 851813241.
- ^ Perales C (октябрь 2018 г.). «Квазивидовая динамика и клиническое значение противовирусной устойчивости вируса гепатита С (HCV)». Международный журнал противомикробных агентов: 105562. Дои:10.1016 / j.ijantimicag.2018.10.005. PMID 30315919.
- ^ а б Мартин В., Доминго Э. (август 2008 г.). «Влияние мутантного спектра на эволюцию вируса: сфокусированный отбор антигенных вариантов в реконструированных квазивидах вируса». Молекулярная биология и эволюция. 25 (8): 1544–54. Дои:10.1093 / molbev / msn099. PMID 18436553.
- ^ а б c d Брионес К., Доминго Э. (2008). «Отчет меньшинства: геномы со скрытой памятью у квазивидов ВИЧ-1 и возможные клинические последствия». Обзоры СПИДа. 10 (2): 93–109. PMID 18615120.
- ^ а б Руис-Харабо CM, Ариас А., Барановски Э., Эскармис С., Доминго Э. (апрель 2000 г.). «Память у квазивидов вирусов». Журнал вирусологии. 74 (8): 3543–7. Дои:10.1128 / jvi.74.8.3543-3547.2000. ЧВК 111862. PMID 10729128.
- ^ Фарбер Д.Л., Нетеа М.Г., Радбрух А., Раевский К., Зинкернагель Р.М. (февраль 2016 г.). «Иммунологическая память: уроки прошлого и взгляд в будущее». Обзоры природы. Иммунология. 16 (2): 124–8. Дои:10.1038 / нет.2016.13. PMID 26831526.
- ^ Брионес С., Доминго Э., Молина-Парис С. (август 2003 г.). «Память у квазивидов ретровирусов: экспериментальные данные и теоретическая модель вируса иммунодефицита человека». Журнал молекулярной биологии. 331 (1): 213–29. Дои:10.1016 / с0022-2836 (03) 00661-2. ЧВК 7173031. PMID 12875847.
- ^ Ариас А., Руис-Харабо К.М., Эскарм С., Доминго Е. (май 2004 г.). «Повышение пригодности памяти геномов у квазивидов вируса». Журнал молекулярной биологии. 339 (2): 405–12. Дои:10.1016 / j.jmb.2004.03.061. PMID 15136042.
- ^ Эйген М, Бибрихер СК (1988). Пространство последовательностей и распределение квазивидов. РНК генетика. CRC Press. С. 211–245. Дои:10.1201/9781351076449-12. ISBN 9781351076449.
- ^ Боррего Б., Новелла И.С., Жиральт Е., Андреу Д., Доминго Е. (октябрь 1993 г.). «Отличный репертуар антигенных вариантов вируса ящура при наличии или отсутствии иммунного отбора». Журнал вирусологии. 67 (10): 6071–9. Дои:10.1128 / JVI.67.10.6071-6079.1993. ЧВК 238028. PMID 7690417.
- ^ Teng MN, Oldstone MB, de la Torre JC (сентябрь 1996 г.). «Подавление синдрома дефицита гормона роста, вызванного вирусом лимфоцитарного хориоменингита, с помощью отрицательных по болезни вариантов вируса». Вирусология. 223 (1): 113–9. Дои:10.1006 / viro.1996.0460. PMID 8806545.
- ^ Гонсалес-Лопес С., Ариас А., Париенте Н., Гомес-Мариано Г., Доминго Е. (апрель 2004 г.). «Преэкстинкционная вирусная РНК может влиять на инфекционность». Журнал вирусологии. 78 (7): 3319–24. Дои:10.1128 / jvi.78.7.3319-3324.2004. ЧВК 371084. PMID 15016853.
- ^ Пералес К., Матео Р., Матеу М.Г., Доминго Е. (июнь 2007 г.). «Понимание спектра мутантных вирусов РНК и событий летального мутагенеза: репликационное вмешательство и комплементация множественными точечными мутантами». Журнал молекулярной биологии. 369 (4): 985–1000. Дои:10.1016 / j.jmb.2007.03.074. PMID 17481660.
- ^ Краудер С., Киркегаард К. (июль 2005 г.). «Транс-доминантное ингибирование вирусной репликации РНК может замедлить рост устойчивых к лекарствам вирусов». Природа Генетика. 37 (7): 701–9. Дои:10.1038 / ng1583. PMID 15965477.
- ^ Киркегаард К., ван Бюрен Нью-Джерси, Матео Р. (октябрь 2016 г.). «Мой кузен, мой враг: квазивидовое подавление лекарственной устойчивости». Текущее мнение в вирусологии. 20: 106–111. Дои:10.1016 / j.coviro.2016.09.011. ЧВК 5298929. PMID 27764731.
- ^ Quer J, Hershey CL, Domingo E, Holland JJ, Novella IS (август 2001 г.). «Условный нейтралитет в конкурирующих вирусных популяциях». Журнал вирусологии. 75 (16): 7315–20. Дои:10.1128 / jvi.75.16.7315-7320.2001. ЧВК 114966. PMID 11462003.
- ^ Кодоньер Ф.М., Дарос Я.А., Соле Р.В., Елена С.Ф. (декабрь 2006 г.). «Самый приспособленный против самого плоского: экспериментальное подтверждение квазивидового эффекта с субвирусными патогенами». Патогены PLOS. 2 (12): e136. Дои:10.1371 / journal.ppat.0020136. ЧВК 1757203. PMID 17196038.
- ^ а б c d Техеро Х, Монтеро Ф, Нуньо Дж. К. (2016). «Теории смертельного мутагенеза: от катастрофической ошибки до смертельного порока». Актуальные темы микробиологии и иммунологии. Издательство Springer International. 392: 161–79. Дои:10.1007/82_2015_463. ISBN 9783319238975. PMID 26210988.
- ^ а б Пфайффер Дж. К., Киркегаард К. (октябрь 2005 г.). «Повышенная достоверность снижает приспособленность к полиовирусу и вирулентность при селективном давлении у мышей». Патогены PLOS. 1 (2): e11. Дои:10.1371 / journal.ppat.0010011. ЧВК 1250929. PMID 16220146.
- ^ а б c d Виннуцци М., Стоун Дж. К., Арнольд Дж. Дж., Кэмерон К. Э., Андино Р. (январь 2006 г.). «Разнообразие квазивидов определяет патогенез через кооперативные взаимодействия в вирусной популяции». Природа. 439 (7074): 344–8. Bibcode:2006Натура.439..344V. Дои:10.1038 / природа04388. ЧВК 1569948. PMID 16327776.
- ^ Бордерия А.В., Розен-Ганьон К, Виннуцци М (2016). «Варианты верности и квазивиды РНК». Актуальные темы микробиологии и иммунологии. Издательство Springer International. 392: 303–22. Дои:10.1007/82_2015_483. ISBN 9783319238982. ЧВК 7121553. PMID 26499340.
- ^ Гарсия-Арриаса Дж., Манрубия СК, Тоха М., Доминго Э., Эскармис С. (ноябрь 2004 г.). «Эволюционный переход к дефектным РНК, которые заразны при комплементации». Журнал вирусологии. 78 (21): 11678–85. Дои:10.1128 / JVI.78.21.11678-11685.2004. ЧВК 523252. PMID 15479809.
- ^ Морено Е., Охоснегрос С., Гарсия-Арриаса Дж., Эскармис С., Доминго Е., Пералес С. (май 2014 г.). «Исследование пространства последовательностей как основа сегментации генома вирусной РНК». Труды Национальной академии наук Соединенных Штатов Америки. 111 (18): 6678–83. Bibcode:2014ПНАС..111.6678М. Дои:10.1073 / pnas.1323136111. ЧВК 4020086. PMID 24757055.
- ^ Aaskov J, Buzacott K, Thu HM, Lowry K, Holmes EC (январь 2006 г.). «Долгосрочная передача вирусов с дефектной РНК у людей и комаров Aedes». Наука. 311 (5758): 236–8. Bibcode:2006Научный ... 311..236A. Дои:10.1126 / science.1115030. PMID 16410525.
- ^ Ciota AT, Ehrbar DJ, Van Slyke GA, Willsey GG, Kramer LD (май 2012 г.). «Совместные взаимодействия в рое мутантов вируса Западного Нила». BMC Эволюционная биология. 12 (1): 58. Дои:10.1186/1471-2148-12-58. ЧВК 3358237. PMID 22541042.
- ^ Сюэ К.С., Хупер К.А., Оллодарт А.Р., Дингенс А.С., Блум Д.Д. (март 2016 г.). «Сотрудничество между различными вирусными вариантами способствует росту вируса гриппа H3N2 в культуре клеток». eLife. 5: e13974. Дои:10.7554 / elife.13974. ЧВК 4805539. PMID 26978794.
- ^ а б Широгане Й, Ватанабэ С., Янаги Й (2016). «Кооперативное взаимодействие в спектрах мутантов РНК-вирусов». Актуальные темы микробиологии и иммунологии. Издательство Springer International. 392: 219–29. Дои:10.1007/82_2015_461. ISBN 9783319238975. PMID 26162566.
- ^ Пфайффер Дж. К., Киркегаард К. (апрель 2006 г.). «Ограничение квазивидов, опосредованное узким местом, во время распространения РНК-вируса от места инокуляции в мозг». Труды Национальной академии наук Соединенных Штатов Америки. 103 (14): 5520–5. Bibcode:2006ПНАС..103.5520П. Дои:10.1073 / pnas.0600834103. ЧВК 1414638. PMID 16567621.
- ^ Гутьеррес С., Михалакис Ю., Блан С. (октябрь 2012 г.). «Узкие места в популяции вирусов во время развития внутри хоста и передачи от хоста к хосту». Текущее мнение в вирусологии. 2 (5): 546–55. Дои:10.1016 / j.coviro.2012.08.001. PMID 22921636.
- ^ Булл Р.А., Лучани Ф., МакЭлрой К., Гаудиери С., Фам С.Т., Чопра А. и др. (Сентябрь 2011 г.). «Последовательные узкие места приводят к вирусной эволюции на ранней стадии острой вирусной инфекции гепатита С». Патогены PLOS. 7 (9): e1002243. Дои:10.1371 / journal.ppat.1002243. ЧВК 3164670. PMID 21912520.
- ^ Чао Л. (ноябрь 1990 г.). «Пригодность РНК вируса снизилась храповым механизмом Мюллера». Природа. 348 (6300): 454–5. Bibcode:1990Натура.348..454C. Дои:10.1038 / 348454a0. PMID 2247152.
- ^ Дуарте Э., Кларк Д., Моя А., Доминго Э., Холланд Д. (июль 1992 г.). «Быстрая потеря пригодности клонов вируса РНК млекопитающих из-за храповика Мюллера». Труды Национальной академии наук Соединенных Штатов Америки. 89 (13): 6015–9. Bibcode:1992PNAS ... 89.6015D. Дои:10.1073 / pnas.89.13.6015. ЧВК 402129. PMID 1321432.
- ^ Мюллер HJ (май 1964 г.). «Отношение рекомбинации к мутационному продвижению». Мутационные исследования. 106 (1): 2–9. Дои:10.1016/0027-5107(64)90047-8. PMID 14195748.
- ^ Escarmís C, Dávila M, Charpentier N, Bracho A, Moya A, Domingo E (ноябрь 1996 г.). «Генетические поражения, связанные с храповым механизмом Мюллера в РНК-вирусе». Журнал молекулярной биологии. 264 (2): 255–67. Дои:10.1006 / jmbi.1996.0639. PMID 8951375.
- ^ Escarmís C, Dávila M, Domingo E (январь 1999 г.). «Множественные молекулярные пути восстановления пригодности РНК-вируса, ослабленного действием храповика Мюллера». Журнал молекулярной биологии. 285 (2): 495–505. Дои:10.1006 / jmbi.1998.2366. PMID 9878424.
- ^ Руис-Харабо К.М., Париенте Н., Барановски Е., Давила М., Гомес-Мариано Г., Доминго Е. (август 2004 г.). «Расширение тропизма клетки-хозяина вируса ящура, несмотря на репликацию в постоянной среде». Журнал общей вирусологии. 85 (Pt 8): 2289–97. Дои:10.1099 / vir.0.80126-0. PMID 15269370.
- ^ Мартинес М.А., Допасо Дж., Эрнандес Дж., Матеу М.Г., Собрино Ф., Доминго Э., Ноулз, штат Нью-Джерси (июнь 1992 г.). «Эволюция генов капсидных белков вируса ящура: антигенная вариация без накопления аминокислотных замен за шесть десятилетий». Журнал вирусологии. 66 (6): 3557–65. Дои:10.1128 / JVI.66.6.3557-3565.1992. ЧВК 241137. PMID 1316467.
- ^ Хо С.Ю., Дюшен С., Молак М., Шапиро Б. (декабрь 2015 г.). «Зависящие от времени оценки скорости молекулярной эволюции: свидетельства и причины». Молекулярная экология. 24 (24): 6007–12. Дои:10.1111 / mec.13450. PMID 26769402. S2CID 14433111.
- ^ Доминго Э (1989). «Эволюция РНК-вируса и борьба с вирусными заболеваниями». Прогресс в исследованиях лекарств. Fortschritte der Arzneimittelforschung. Progrès des Recherches Pharmaceutiques. Birkhäuser Basel. 33: 93–133. Дои:10.1007/978-3-0348-9146-2_5. ISBN 9783034899253. PMID 2687948.
- ^ Уильямс PD (февраль 2010 г.). «Дарвиновские вмешательства: укрощение патогенов с помощью эволюционной экологии». Тенденции в паразитологии. 26 (2): 83–92. Дои:10.1016 / июл 2009.11.009. PMID 20036799.
- ^ а б Пералес С., Ортега-Прието А.М., Пляж Нью-Мексико, Шелдон Дж., Менендес-Ариас Л., Доминго Е. (2017). «Квазивиды и лекарственная устойчивость». Справочник по устойчивости к противомикробным препаратам. Springer New York: 123–147. Дои:10.1007/978-1-4939-0694-9_1. ISBN 9781493906932.
- ^ а б Лоеб Л.А., Эссигманн Дж. М., Казази Ф., Чжан Дж., Роуз К. Д., Маллинс Дж. И. (февраль 1999 г.). «Смертельный мутагенез ВИЧ с мутагенными аналогами нуклеозидов». Труды Национальной академии наук Соединенных Штатов Америки. 96 (4): 1492–7. Bibcode:1999ПНАС ... 96.1492Л. Дои:10.1073 / pnas.96.4.1492. ЧВК 15492. PMID 9990051.
- ^ а б c Пералес С., Гальего I, де Авила А.И., Сория М.Э., Грегори Дж., Кер Дж., Доминго Э. (июль 2019 г.). «Возрастающее влияние летального мутагенеза вирусов». Медицинская химия будущего. 11 (13): 1645–1657. Дои:10.4155 / fmc-2018-0457. HDL:10261/216260. PMID 31469331.
- ^ Эйген М. (октябрь 2002 г.). «Ошибка катастрофы и антивирусной стратегии». Труды Национальной академии наук Соединенных Штатов Америки. 99 (21): 13374–6. Bibcode:2002PNAS ... 9913374E. Дои:10.1073 / pnas.212514799. ЧВК 129678. PMID 12370416.
- ^ Венкатесан С., Розенталь Р., Кану Н., МакГранахан Н., Бартек Дж., Кесада С.А. и др. (Март 2018 г.). «Перспектива: мутагенез APOBEC в развитии лекарственной устойчивости и иммунного бегства при ВИЧ и развитии рака». Анналы онкологии. 29 (3): 563–572. Дои:10.1093 / annonc / mdy003. ЧВК 5888943. PMID 29324969.
- ^ Фокс Э.Дж., Лоеб Л.А. (октябрь 2010 г.). «Летальный мутагенез: нацеливание на мутаторный фенотип при раке». Семинары по биологии рака. 20 (5): 353–9. Дои:10.1016 / j.semcancer.2010.10.005. ЧВК 3256989. PMID 20934515.
- ^ Лоеб Л.А. (июнь 2011 г.). «Раковые опухоли человека выражают мутаторные фенотипы: происхождение, последствия и направленность». Обзоры природы. Рак. 11 (6): 450–7. Дои:10.1038 / nrc3063. ЧВК 4007007. PMID 21593786.
- ^ а б Саммерс Дж., Литвин С. (январь 2006 г.). «Изучение теории ошибки-катастрофы». Журнал вирусологии. 80 (1): 20–6. Дои:10.1128 / JVI.80.1.20-26.2006. ЧВК 1317512. PMID 16352527.
- ^ Кротти С., Кэмерон С.Э., Андино Р. (июнь 2001 г.). «Катастрофа ошибки РНК-вируса: прямой молекулярный тест с использованием рибавирина». Труды Национальной академии наук Соединенных Штатов Америки. 98 (12): 6895–900. Bibcode:2001PNAS ... 98.6895C. Дои:10.1073 / pnas.111085598. ЧВК 34449. PMID 11371613.
- ^ Wilke CO (август 2005 г.). «Теория квазивидов в контексте популяционной генетики». BMC Эволюционная биология. 5: 44. Дои:10.1186/1471-2148-5-44. ЧВК 1208876. PMID 16107214.
- ^ Вагнер Г. П., Кралл П. (ноябрь 1993 г.). «В чем разница между моделями порогов ошибок и трещоткой Мюллера?». Журнал математической биологии. 32 (1): 33–44. Дои:10.1007 / BF00160372.
- ^ Санхуан Р., Моя А., Елена С.Ф. (июнь 2004 г.). «Распределение эффектов приспособленности, вызванных однонуклеотидными заменами в РНК-вирусе». Труды Национальной академии наук Соединенных Штатов Америки. 101 (22): 8396–401. Bibcode:2004ПНАС..101.8396С. Дои:10.1073 / pnas.0400146101. ЧВК 420405. PMID 15159545.
- ^ Использование фитнес-ландшафтов для визуализации эволюции в действии, получено 2019-10-22
внешняя ссылка
- Видео: Использование фитнес-ландшафтов для визуализации эволюции в действии - содержит пример «выживания самых плоских»
