Рецептор распознавания образов - Pattern recognition receptor
Рецепторы распознавания образов (PRR)[1] играют решающую роль в правильном функционировании врожденная иммунная система. PRR - это сенсоры хозяина, кодируемые зародышевой линией, которые обнаруживают молекулы, типичные для патогенов.[2] Они есть белки экспрессируется, в основном, клетками врожденная иммунная система, такие как дендритные клетки, макрофаги, моноциты, нейтрофилы и эпителиальные клетки,[3][4] для идентификации двух классов молекул: патоген-ассоциированные молекулярные паттерны (PAMP), которые связаны с микробными патогены, и молекулярные паттерны, связанные с повреждениями (DAMPs), которые связаны с компонентами клеток-хозяев, которые высвобождаются во время повреждения или гибели клеток. Их еще называют примитивные рецепторы распознавания образов потому что они развились раньше других частей иммунной системы, особенно до адаптивный иммунитет. PRR также опосредуют инициирование антиген-специфического адаптивного иммунного ответа и высвобождение воспалительных цитокинов.[2][5]
Распознанные молекулы
Специфические для микробов молекулы, которые распознаются данной PRR, называются патоген-ассоциированные молекулярные паттерны (PAMP) и включают бактериальные углеводы (такие как липополисахарид или LPS, манноза ), нуклеиновые кислоты (такие как бактериальная или вирусная ДНК или РНК), бактериальные пептиды (флагеллин, факторы удлинения микротрубочек), пептидогликаны и липотейхоевые кислоты (от грамположительных бактерий), N-формилметионин, липопротеины и грибковые глюканы и хитин.
Сигналы эндогенного стресса называются молекулярные паттерны, связанные с повреждениями (DAMPs) и включают мочевая кислота и внеклеточный АТФ, среди многих других соединений.[2]
Классификация
Есть несколько подгрупп PRR. Они классифицируются по их лиганд специфичность, функция, локализация и / или эволюционные отношения. В зависимости от их локализации PRR можно разделить на PRR, связанные с мембраной, и PRR в цитоплазме.
- Связанные с мембраной PRR включают Толл-подобные рецепторы (TLR) и Лектиновые рецепторы С-типа (CLR).
- Цитоплазматические PRR включают NOD-подобные рецепторы (NLR) и RIG-I-подобные рецепторы (RLR).
Типы и локализация PRR
Связанные с мембраной PRR
Рецепторные киназы
PRR были впервые обнаружены у растений.[6] С того времени многие PRR растений были предсказаны с помощью геномного анализа (370 для риса; 47 для Arabidopsis). В отличие от PRR животных, которые связаны с внутриклеточными киназами через адаптерные белки (см. Ниже киназы, не относящиеся к RD), PRR растений состоят из внеклеточного домена, трансмембранного домена, юкстамембранного домена и внутриклеточного домена киназы как части одного белка.
Толл-подобные рецепторы (TLR)
Распознавание внеклеточных или эндосомных молекулярных паттернов, связанных с патогенами, обеспечивается трансмембранными белками, известными как толл-подобные рецепторы (TLR).[7] TLR имеют типичный структурный мотив: Богатые лейцином повторы (LRR), которые придают им особый вид, а также отвечают за функциональность TLR.[8] Толл-подобные рецепторы были впервые обнаружены в Дрозофила и запускают синтез и секрецию цитокины и активация других программ защиты хозяина, которые необходимы как для врожденного, так и для адаптивного иммунного ответа. К настоящему времени у человека описано 10 функциональных членов семейства TLR.[5] Исследования проводились на TLR11 также, и было показано, что он распознает флагеллин и профилин-подобные белки у мышей.[9] Тем не менее, TLR11 - это всего лишь псевдоген у людей без прямой функции или функциональной экспрессии белка. Было показано, что каждый из TLR взаимодействует с определенным PAMP.[5][10][11]
Сигнализация TLR
TLR имеют тенденцию к димеризации, TLR4 формы гомодимеры, и TLR6 может димеризоваться либо TLR1 или же TLR2.[10] Взаимодействие TLR с их специфическими PAMP опосредуется либо через MyD88 - зависимый путь и запускает передачу сигналов через NF-κB и MAP киназа путь и, следовательно, секреция провоспалительных цитокины и костимулирующие молекулы или TRIF - зависимый сигнальный путь.[2][5][10] MyD88-зависимый путь индуцируется различными PAMP, стимулирующими TLR на макрофагах и дендритных клетках. MyD88 привлекает молекулу IRAK4, IRAK4 рекрутирует IRAK1 и IRAK2 для образования сигнального комплекса. Сигнальный комплекс реагирует с TRAF6, что приводит к активации TAK1 и, следовательно, к индукции воспалительных цитокинов. TRIF-зависимый путь индуцируется макрофагами и DC после TLR3 и стимуляция TLR4.[2] Молекулы, высвобождаемые после сигнала активации TLR в другие клетки иммунной системы, делают TLR ключевыми элементами врожденный иммунитет и адаптивный иммунитет.[2][12][13]
Лектиновые рецепторы С-типа (CLR)
Многие разные клетки врожденной иммунной системы экспрессируют множество CLR, которые формируют врожденный иммунитет благодаря своей способности распознавать образы.[14] Несмотря на то, что большинство классов патогенов человека охватываются CLR, CLR являются основным рецептором для распознавания грибов:[15][16] тем не менее, другие PAMP были идентифицированы в исследованиях как мишени для CLR, например манноза является мотивом распознавания многих вирусов, грибов и микобактерий; аналогично фукоза представляет собой то же самое для некоторых бактерий и гельминтов; а глюканы присутствуют на микобактериях и грибах. Кроме того, многие из приобретенных несамостоятельных поверхностей, например неоантигены карциноэмбрионального / онкофетального типа, несущие патоген «внутренний источник опасности» / «самовозвращающийся несамостоятельный» патоген, также идентифицируются и уничтожаются (например, путем фиксации комплемента или других цитотоксических атак) или секвестрируются (фагоцитируются или заключаются в оболочку) иммунной системой благодаря CLR. Название лектин немного вводит в заблуждение, потому что это семейство включает белки, по крайней мере, с одним лектиновым доменом С-типа (CTLD), который является специфическим типом домена распознавания углеводов. CTLD - это лиганд-связывающий мотив, обнаруженный в более чем 1000 известных белков (более 100 у человека), и лиганды часто не являются сахарами.[17] Если и когда лигандом является сахар, им нужен Ca2 + - отсюда и название «C-тип», но многие из них даже не имеют известного сахарного лиганда, поэтому, несмотря на наличие складчатой структуры лектинового типа, некоторые из них технически не являются «лектином». " в функции.
Сигнализация CLR
Существует несколько типов передачи сигналов, участвующих в иммунном ответе, индуцированном CLR, основная связь была идентифицирована между передачей сигналов TLR и CLR, поэтому мы различаем TLR-зависимую и TLR-независимую передачу сигналов. DC-SIGN, ведущий к каскаду RAF1-MEK-ERK, передача сигналов BDCA2 через ITAM и передача сигналов через ITIM относятся к TLR-зависимой передаче сигналов. TLR-независимая передача сигналов, таких как Dectin 1 и Dectin 2 - mincle, приводит к MAP киназа и NFkB активация.[18][15]
CLR мембранных рецепторов были разделены на 17 групп в зависимости от структуры и филогенетического происхождения.[19] Обычно существует большая группа, которая распознает и связывает углеводы, так называемые домены узнавания углеводов (CRD) и ранее упомянутые CTLD.
Другой потенциальной характеристикой CLR могут быть рецепторы маннозы и рецепторы асиалогликопротеинов.[18]
Группа I CLR: рецепторы маннозы.
В рецептор маннозы (МИСТЕР)[20] PRR в основном присутствует на поверхности макрофаги и дендритные клетки. Он принадлежит к группе кальций-зависимых множественных CRD.[15] MR принадлежит к группе белков рецептора мультилектина и, как и TLR, обеспечивает связь между врожденным и адаптивным иммунитетом.[21][22] Он распознает и связывается с повторяющимися единицами маннозы на поверхности инфекционных агентов, и его активация запускает эндоцитоз и фагоцитоз микроба через систему комплемента. В частности, связывание маннозы запускает рекрутирование MBL-ассоциированных сериновых протеаз (MASP). Сериновые протеазы активируются каскадом, усиливая иммунный ответ: MBL взаимодействует с C4, связывая субъединицу C4b и высвобождая C4a в кровоток; аналогично, связывание C2 вызывает высвобождение C2b. Вместе MBL, C4b и C2a известны как конвертаза C3. C3 расщепляется на субъединицы a и b, а C3b связывает конвертазу. Все вместе они называются конвертазой C5. Точно так же C5b связывается, а C5a высвобождается. C5b нанимает C6, C7, C8 и несколько C9. C5, C6, C7, C8 и C9 образуют комплекс мембранной атаки (MAC).
CLR группы II: асиалогликопротеин семейство рецепторов
Это еще одно большое суперсемейство CLR, которое включает
- Классический рецептор асиалогликопротеина лектин типа макрофагов галактозы (МГЛ)
- DC-SIGN (CLEC4L)
- Лангерин (CLEC4K)
- Миелоидный DAP12-ассоциированный лектин (MDL) ‑1 (CLEC5A )
- DC-ассоциированный лектин 1 C-типа (Dectin1) подсемейство, которое включает
- Иммунорецептор постоянного тока (DCIR ) подсемейство, в которое входят:
Номенклатура (манноза против асиалогликопротеина) немного вводит в заблуждение, поскольку эти рецепторы асиалогликопротеина не обязательно галактоза (один из наиболее распространенных внешних остатков асиало-гликопротеина) специфические рецепторы, и даже многие из членов этого семейства также могут связываться с манноза после чего названа другая группа.
Цитоплазматические PRR
NOD-подобные рецепторы (NLR)
Подробнее см. NOD-подобный рецептор.
NOD-подобные рецепторы (NLR) представляют собой цитоплазматические белки, которые распознают бактериальные пептидогликаны и вызывают провоспалительный и противомикробный иммунный ответ.[23] Примерно 20 из этих белков были обнаружены в геноме млекопитающих и включают нуклеотид-связывающий домен олигомеризации (NOD), который связывает нуклеозидтрифосфат. Среди других белков наиболее важными являются: MHC Класс II трансактиватор (CIITA ), IPAF, BIRC1 и т. Д.[24]
NLR сигнализация
Некоторые из этих белков распознают эндогенные или микробные молекулы или реакции на стресс и образуют олигомеры, которые у животных активируют воспалительные каспазы (например, каспаза 1 ) вызывая расщепление и активацию важных воспалительных цитокины Такие как Ил-1, и / или активировать NF-κB сигнальный путь для индукции образования воспалительных молекул.
Семейство NLR известно под несколькими разными названиями, включая семейство CATERPILLER (или CLR) или NOD-LRR.[24][25] Наиболее значимыми членами NLR являются NOD1 и NOD2. Они ощущают консервативные микробные пептидогликаны в цитоплазме клетки и, следовательно, представляют другой уровень иммунного ответа после мембраносвязанных рецепторов, таких как TLR и CLR.[23] Это семейство белков значительно расширилось у растений и составляет основной компонент иммунная система растений.[26]
Узлы
- Лиганды в настоящее время известны NOD1 и NOD2. NOD1 распознает молекулу под названием мезо-DAP, которая является пептидогликан составляющий только из Грамотрицательный бактерии. Белки NOD2 распознают внутриклеточный MDP (мурамилдипептид), который является пептидогликаном, составляющим как грамположительные, так и грамотрицательные бактерии. В неактивном состоянии NOD находятся в цитозоле в мономерном состоянии и претерпевают конформационные изменения только после распознавания лиганда, что приводит к их активации.[23] NOD передают сигналы на пути NF-κB и Киназы MAP через серин-треонинкиназа называется RIP2. Сигнал NODs через N-терминал CARD домены для активации событий индукции последующих генов и взаимодействия с микробными молекулами посредством C-терминал богатый лейцином повтор (LRR) регион.[27]
- Установлено взаимодействие и кооперация между различными типами рецепторов, характерными для системы врожденного иммунитета. Было обнаружено интересное сотрудничество между TLR и NLR, особенно между TLR4 и NOD1 в ответ на кишечная палочка инфекционное заболевание.[28] Другое доказательство сотрудничества и интеграции всей иммунной системы было показано in vivo, когда передача сигналов TLR была ингибирована или отключена, рецепторы NOD брали на себя роль TLR.[29]
NLRP
- Как и NOD, эти белки содержат C-концевые LRR, которые, по-видимому, действуют как регуляторный домен и могут участвовать в распознавании микробных патогенов. Также как и NOD, эти белки содержат сайт связывания нуклеотидов (NBS) для нуклеозидтрифосфатов. Взаимодействие с другими белками (например, с адаптерной молекулой ASC ) опосредуется через N-концевой пириновый (PYD) домен. У людей 14 членов этого подсемейства белков (называемых от NLRP1 до NLRP14). NLRP3 и NLRP4 несут ответственность за воспаление активация.[30] NLRP3 может активироваться и вызывать воспаление NLRP3 под действием АТФ, бактериальных порообразующих токсинов, квасцов и кристаллов. Наряду с перечисленными молекулами, которые приводят к активации инфламмасомы NLRP3, сборка и активация также могут быть индуцированы K+ отток, Ca2+ приток, нарушение работы лизосом и АФК, происходящих из митохондрий.[30] Инфламмасома NLRP3 необходима для индукции эффективного иммунного ответа. Инфламмасома NLRP3 может быть индуцирована широким спектром стимулов в отличие от инфламмасомы NLRP4, которая связывает более ограниченное количество и разнообразие лигандов и работает в комплексе с белком NAIP.[31]
Другие NLR
- Также было показано, что другие NLR, такие как IPAF и NAIP5 / Birc1e, активируют каспазу-1 в ответ на Сальмонелла и Легионелла.
RIG-I-подобные рецепторы (RLR)
К настоящему времени описаны три геликазы RLR: RIG-I и MDA5 (узнавая 5'трифосфат-РНК и дцРНК, соответственно), которые активируют противовирусную передачу сигналов, и LGP2, который, по-видимому, действует как доминантно-отрицательный ингибитор. RLR инициируют высвобождение воспалительных цитокинов и интерферона I типа (IFN I).[2]
RLR сигнализация
RLR, являются РНК-геликазы, которые, как было показано, участвуют во внутриклеточном распознавании вирусных двухцепочечных (ds) и одноцепочечных РНК которые привлекают факторы через двойной N-концевой CARD домены для активации антивирусных генных программ, которые могут быть использованы в терапии вирусных инфекций.[32][33] Было высказано предположение, что основная антивирусная программа, вызванная RLR, основана на АТФаза Мероприятия.[34] RLR часто взаимодействуют и создают перекрестную связь с TLR при врожденном иммунном ответе и в регуляции адаптивного иммунного ответа.[35]
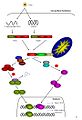
Сигнальный путь, опосредованный RIG-I и Mda5.
Заводские PRR
Растения содержат значительное количество PRR, которые обладают замечательным структурным и функциональным сходством с TOLL дрозофилы и TLR млекопитающих. Первым PRR, идентифицированным у растений или животных, был белок Xa21, придающий устойчивость к грамотрицательному бактериальному патогену Xanthomonas oryzae pv. oryzae.[6][36] С тех пор были выделены PRR двух других растений, Arabidopsis FLS2 (флагеллин) и EFR (рецептор Tu фактора элонгации).[37] Соответствующие PAMP для FLS2 и EFR были идентифицированы.[37] После распознавания лиганда PRR растения трансдуцируют «иммунитет, запускаемый PAMP» (PTI).[38] Иммунная система растений также кодируют белки устойчивости, которые напоминают NOD-подобные рецепторы (см. выше), которые содержат NBS и LRR домены и может также нести другие консервативные домены взаимодействия, такие как цитоплазматический домен TIR, обнаруженный в рецепторах Toll и интерлейкина.[39] Белки NBS-LRR необходимы для иммунитета, запускаемого эффектором (ETI).
Киназы nonRD
PRR обычно ассоциируются или содержат членов монофилетической группы киназ, называемой семейством киназ, ассоциированных с рецептором интерлейкина-1 (IRAK), которая включает Drosophila Pelle, человеческие IRAK, рисовый XA21 и Arabidopsis FLS2. У млекопитающих PRR могут также ассоциироваться с членами семейства киназ, взаимодействующих с рецепторами (RIP), дальними родственниками семейства IRAK. Некоторые киназы семейств IRAK и RIP попадают в небольшой функциональный класс киназ, называемых не-RD, многие из которых не аутофосфорилируют петлю активации. Исследование киномов дрожжей, мух, червей, человека, арабидопсиса и риса (3723 киназы) показало, что, несмотря на небольшое количество киназ, не относящихся к RD, в этих геномах (9–29%), 12 из 15 известных или предсказанных киназ для работы в сигнализации PRR попадают в класс не-RD. У растений все охарактеризованные PRR относятся к классу не-RD. Эти данные показывают, что киназы, ассоциированные с PRR, могут быть в значительной степени предсказаны по отсутствию единственного консервативного остатка и выявляют новые потенциальные подсемейства PRR растений.[40][41]
Секретные PRR
Некоторые PRR не остаются связанными с клеткой, которая их производит. Рецепторы комплемента, Colleins, фиколины, пентраксины например, сыворотка амилоид и С-реактивный белок, липидные трансферазы, белки распознавания пептидогликана (PGRP)[42] и LRR, XA21D[43] все секретируемые белки. Один очень важный сбор: маннан-связывающий лектин (MBL), основной PRR врожденной иммунной системы, которая связывается с широким спектром бактерий, вирусов, грибов и простейших. MBL преимущественно распознает определенные группы сахаров на поверхности микроорганизмов, но также связывает фосфолипиды, нуклеиновые кислоты и негликозилированный белки.[44] После связывания с лигандами олигомеры MBL и фиколина рекрутируют MASP1 и MASP2 и инициировать лектиновый путь активации комплемента, который чем-то похож на классический путь комплемента.
PRR в медицине человека
Исследовательские группы недавно провели обширное исследование участия и потенциального использования иммунной системы пациента в терапии различных заболеваний, так называемой иммунотерапии, включая моноклональные антитела, неспецифическую иммунотерапию, терапию онколитическими вирусами, Т-клеточную терапию и противораковые вакцины. .[45] NOD2 был связан через потерю и увеличение функции с развитием болезни Крона и раннего саркоидоза.[23][46] Мутации в NOD2 в сочетании с факторами окружающей среды приводят к развитию хронического воспаления в кишечнике.[23][47] Поэтому было предложено лечить заболевание путем ингибирования малых молекул, которые способны модулировать передачу сигналов NOD2, особенно RIP2. На данный момент FDA одобрило два терапевтических препарата, ингибирующих фосфорилирование RIP2, что необходимо для правильного функционирования NOD2, гефитиниб и эрлотиниб.[48][49] Кроме того, были проведены исследования GSK583, высокоспецифичного ингибитора RIP2, который кажется очень многообещающим для ингибирования передачи сигналов NOD1 и NOD2 и, следовательно, ограничения воспаления, вызванного сигнальными путями NOD1, NOD2.[50] Другая возможность состоит в том, чтобы удалить датчик для NOD2, который доказал свою эффективность на мышиных моделях в попытке подавить симптомы болезни Крона.[51] Ингибиторы киназы типа II, которые являются высокоспецифичными, показали многообещающие результаты в блокировании TNF, возникающего из NOD-зависимых путей, что демонстрирует высокий потенциал в лечении опухолей, связанных с воспалением.[52]
Другое возможное использование PRR в медицине также связано со злокачественными опухолями кишечника. Helicobacter pylori Исследования показали, что он значительно коррелирует с развитием опухолей желудочно-кишечного тракта. У здорового человека Helicobacter pylori Инфекция нацелена на комбинацию PRR, а именно TLR, NLR, RLR и CLR DC-SIGN. В случае их неисправности эти рецепторы также связаны с канцерогенезом. Когда Helicobacter pylori Инфекция продолжает развиваться в кишечнике, она перерастает в хроническое воспаление, атрофию и, в конечном итоге, дисплазию, ведущую к развитию рака. Поскольку все типы PRR играют роль в идентификации и искоренении инфекции, их специфические агонисты создают сильный иммунный ответ на рак и другие заболевания, связанные с PRR. Было показано, что ингибирование TLR2 в значительной степени коррелирует с улучшением состояния пациента и подавлением аденокарциномы желудка.[53]
PRR также тесно связаны с правильным функционированием нейронных сетей и тканей, особенно из-за их участия в процессах воспаления, которые необходимы для правильного функционирования, но могут вызвать непоправимый ущерб, если не находятся под контролем. TLR экспрессируются в большинстве клеток центральной нервной системы (ЦНС) и играют решающую роль в стерильном воспалении. После травмы они приводят к нарушению роста аксонов и замедляют или даже останавливают восстановление. Другой важной структурой, участвующей и потенциально используемой в терапии после травм, является инфламмасома. Было высказано предположение, что благодаря индукции провоспалительных цитокинов, IL-1β и IL-18, ингибирование инфламмасом также может служить эффективным терапевтическим методом.[54] Участие инфламмасомы также было исследовано в нескольких других заболеваниях, включая экспериментальный аутоиммунный энцефаломиелит (EAE), болезни Альцгеймера и Паркинсона, а также при атеросклерозе, связанном с диабетом типа II у пациентов. Предлагаемые методы лечения включают деградацию NLRP3 или ингибирование провоспалительных цитокинов.[54]
Рекомендации
- ^ Махла Р.С., Редди М.С., Прасад Д.В., Кумар Х. (сентябрь 2013 г.). «Подслащенные PAMP: роль сахарных комплексов PAMP в врожденном иммунитете и биологии вакцины». Границы иммунологии. 4: 248. Дои:10.3389 / fimmu.2013.00248. ЧВК 3759294. PMID 24032031.
- ^ а б c d е ж грамм Кумар Х., Каваи Т., Акира С. (февраль 2011 г.). «Распознавание патогенов врожденной иммунной системой». Международные обзоры иммунологии. 30 (1): 16–34. Дои:10.3109/08830185.2010.529976. PMID 21235323.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). "Врожденный иммунитет". Цитировать журнал требует
| журнал =(помощь) - ^ Шредер К., Чопп Дж. (Март 2010 г.). «Инфламмасомы». Клетка. 140 (6): 821–32. Дои:10.1016 / j.cell.2010.01.040. PMID 20303873.
- ^ а б c d Такеда К., Кайшо Т., Акира С. (2003). «Толл-подобные рецепторы». Ежегодный обзор иммунологии. 21: 335–76. Дои:10.1146 / annurev.immunol.21.120601.141126. PMID 12524386.
- ^ а б Сонг В.Й., Ван Г.Л., Чен Л.Л., Ким Х.С., Пи Л.Й., Холстен Т., Гарднер Дж., Ван Б., Чжай В.X., Чжу Л.Х., Фоке С., Рональд П. (декабрь 1995 г.) «Рецепторный киназоподобный белок, кодируемый геном устойчивости к болезням риса, Xa21». Наука. 270 (5243): 1804–6. Bibcode:1995Научный ... 270.1804S. Дои:10.1126 / science.270.5243.1804. PMID 8525370.
- ^ Beutler B, Jiang Z, Georgel P, Crozat K, Croker B, Rutschmann S, Du X, Hoebe K (2006). «Генетический анализ устойчивости хозяина: передача сигналов толл-подобных рецепторов и иммунитет в целом». Ежегодный обзор иммунологии. 24: 353–89. Дои:10.1146 / annurev.immunol.24.021605.090552. PMID 16551253.
- ^ Ботос И., Сегал Д.М., Дэвис Д.Р. (апрель 2011 г.). «Структурная биология Toll-подобных рецепторов». Структура. 19 (4): 447–59. Дои:10.1016 / j.str.2011.02.004. ЧВК 3075535. PMID 21481769.
- ^ Хатаи Х, Лепелли А., Цзэн В., Хайден М.С., Гош С. (09.02.2016). «Толл-подобный рецептор 11 (TLR11) взаимодействует с флагеллином и профилином через различные механизмы». PLOS ONE. 11 (2): e0148987. Bibcode:2016PLoSO..1148987H. Дои:10.1371 / journal.pone.0148987. ЧВК 4747465. PMID 26859749.
- ^ а б c Озинский А., Андерхилл Д.М., Фонтенот Д.Д., Хаджар А.М., Смит К.Д., Уилсон С.Б., Шредер Л., Адерем А. (декабрь 2000 г.). «Репертуар распознавания патогенов врожденной иммунной системой определяется взаимодействием между толл-подобными рецепторами». Труды Национальной академии наук Соединенных Штатов Америки. 97 (25): 13766–71. Bibcode:2000PNAS ... 9713766O. Дои:10.1073 / pnas.250476497. ЧВК 17650. PMID 11095740.
- ^ Лиен Э., Селлати Т.Дж., Йошимура А., Фло Т.Х., Равади Дж., Финберг Р.В., Кэрролл Д.Д., Эспевик Т., Ингаллс Р.Р., Радольф Д.Д., Голенбок Д.Т. (ноябрь 1999 г.). «Toll-подобный рецептор 2 функционирует как рецептор распознавания образов для различных бактериальных продуктов». Журнал биологической химии. 274 (47): 33419–25. Дои:10.1074 / jbc.274.47.33419. PMID 10559223.
- ^ Акира С., Такеда К. (июль 2004 г.). «Передача сигналов Toll-подобного рецептора». Обзоры природы. Иммунология. 4 (7): 499–511. Дои:10.1038 / nri1391. PMID 15229469.
- ^ Дойл С.Л., О'Нил Л.А. (октябрь 2006 г.). «Толл-подобные рецепторы: от открытия NFkappaB до нового понимания регуляции транскрипции врожденного иммунитета». Биохимическая фармакология. 72 (9): 1102–13. Дои:10.1016 / j.bcp.2006.07.010. PMID 16930560.
- ^ Nat Rev Immunol. 2009 Июль; 9 (7): 465-79. Передача сигналов через рецепторы лектина С-типа: формирование иммунных ответов. Geijtenbeek TB, Gringhuis SI. http://www.mh-hannover.de/fileadmin/mhh/bilder/international/hbrs_mdphd/ZIB/Vorlesungen/Paper_09-10/Rev_IM_Geijtenbeek.pdf В архиве 2016-08-21 в Wayback Machine
- ^ а б c Ховинг Дж. К., Уилсон Дж. Дж., Браун Дж. Д. (февраль 2014 г.). «Сигнальные рецепторы лектина С-типа, распознавание микробов и иммунитет». Клеточная микробиология. 16 (2): 185–94. Дои:10,1111 / см. 12249. ЧВК 4016756. PMID 24330199.
- ^ Hardison SE, Brown GD (сентябрь 2012 г.). «Лектиновые рецепторы С-типа регулируют противогрибковый иммунитет». Иммунология природы. 13 (9): 817–22. Дои:10.1038 / ni.2369. ЧВК 3432564. PMID 22910394.
- ^ Каммингс Р.Д., МакЭвер Р.П. Лектины С-типа. В: Варки А., Каммингс Р.Д., Эско Дж. Д. и др., Редакторы. Основы гликобиологии. 2-е издание. Колд-Спринг-Харбор (Нью-Йорк): Лаборатория Колд-Спринг-Харбор; 2009 г. https://www.ncbi.nlm.nih.gov/books/NBK1943/
- ^ а б Geijtenbeek TB, Gringhuis SI (июль 2009 г.). «Передача сигналов через рецепторы лектина С-типа: формирование иммунных ответов». Обзоры природы. Иммунология. 9 (7): 465–79. Дои:10.1038 / nri2569. ЧВК 7097056. PMID 19521399.
- ^ Зеленский А.Н., Греди Дж. Э. (декабрь 2005 г.). «Суперсемейство лектинподобных доменов С-типа». Журнал FEBS. 272 (24): 6179–217. Дои:10.1111 / j.1742-4658.2005.05031.x. PMID 16336259.
- ^ Ист Л., Исак К.М. (сентябрь 2002 г.). «Семейство рецепторов маннозы». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1572 (2–3): 364–86. Дои:10.1016 / s0304-4165 (02) 00319-7. PMID 12223280.
- ^ Апостолопулос V, Маккензи И.Ф. (сентябрь 2001 г.). «Роль рецептора маннозы в иммунном ответе». Современная молекулярная медицина. 1 (4): 469–74. Дои:10.2174/1566524013363645. PMID 11899091.
- ^ Вукман К.В., Равида А., Олдридж А.М., О'Нил С.М. (сентябрь 2013 г.). «Рецептор маннозы и лектин макрофагального галактозного типа участвуют во взаимодействии тучных клеток Bordetella pertussis». Журнал биологии лейкоцитов. 94 (3): 439–48. Дои:10.1189 / jlb.0313130. PMID 23794711.
- ^ а б c d е Карузо Р., Уорнер Н., Инохара Н., Нуньес Дж. (Декабрь 2014 г.). «NOD1 и NOD2: передача сигналов, защита хозяина и воспалительное заболевание». Иммунитет. 41 (6): 898–908. Дои:10.1016 / j.immuni.2014.12.010. ЧВК 4272446. PMID 25526305.
- ^ а б Тинг Дж. П., Уильямс К. Л. (апрель 2005 г.). «Семейство CATERPILLER: древнее семейство иммунных / апоптотических белков». Клиническая иммунология. 115 (1): 33–7. Дои:10.1016 / j.clim.2005.02.007. PMID 15870018.
- ^ Макдональд С., Нуньес Дж. (2005). «Белки NOD-LRR: роль в микробных взаимодействиях хозяина и воспалительных заболеваниях». Ежегодный обзор биохимии. 74: 355–83. Дои:10.1146 / annurev.biochem.74.082803.133347. PMID 15952891.
- ^ Джонс Дж. Д., Дангл Дж. Л. (ноябрь 2006 г.). «Иммунная система растений». Природа. 444 (7117): 323–9. Bibcode:2006Натура.444..323J. Дои:10.1038 / природа05286. PMID 17108957.
- ^ Стробер В., Мюррей П.Дж., Китани А., Ватанабе Т. (январь 2006 г.). «Сигнальные пути и молекулярные взаимодействия NOD1 и NOD2». Обзоры природы. Иммунология. 6 (1): 9–20. Дои:10.1038 / nri1747. PMID 16493424.
- ^ Burberry A, Zeng MY, Ding L, Wicks I, Inohara N, Morrison SJ, Núñez G (июнь 2014 г.). «Инфекция мобилизует гематопоэтические стволовые клетки посредством совместной передачи сигналов NOD-подобного рецептора и Toll-подобного рецептора». Клеточный хозяин и микроб. 15 (6): 779–91. Дои:10.1016 / j.chom.2014.05.004. ЧВК 4085166. PMID 24882704.
- ^ Ким Ю. Г., Пак Дж. Х., Шоу М. Х., Франки Л., Инохара Н., Нуньес Дж. (Февраль 2008 г.). «Цитозольные сенсоры Nod1 и Nod2 имеют решающее значение для распознавания бактерий и защиты хозяина после воздействия лигандов Toll-подобных рецепторов». Иммунитет. 28 (2): 246–57. Дои:10.1016 / j.immuni.2007.12.012. PMID 18261938.
- ^ а б ИП В.К., Меджитов Р. (май 2015 г.). «Макрофаги контролируют осмолярность тканей и вызывают воспалительную реакцию за счет активации инфламмасом NLRP3 и NLRC4». Nature Communications. 6: 6931. Bibcode:2015 НатКо ... 6.6931I. Дои:10.1038 / ncomms7931. ЧВК 4430126. PMID 25959047.
- ^ Гуо Х, Каллавей Дж. Б., Тинг Дж. П. (июль 2015 г.). «Инфламмасомы: механизм действия, роль в заболевании и лечение». Природа Медицина. 21 (7): 677–87. Дои:10,1038 / нм.3893. ЧВК 4519035. PMID 26121197.
- ^ Паттабхи С., Уилкинс С.Р., Донг Р., Кнолл М.Л., Посакони Дж., Кайзер С., Майре С.Е., Ван М.Л., Иретон Р.К., Гейсберт Т.В., Бедард К.М., Иадонато С.П., Луи Ю. «Нацеливание на врожденный иммунитет для противовирусной терапии с помощью агонистов малых молекул пути RLR». Журнал вирусологии. 90 (5): 2372–87. Дои:10.1128 / jvi.02202-15. ЧВК 4810700. PMID 26676770.
- ^ Eisenächer K, Krug A (январь 2012 г.). «Регуляция передачи сигналов врожденного иммунитета, опосредованной RLR - все дело в поддержании баланса». Европейский журнал клеточной биологии. 91 (1): 36–47. Дои:10.1016 / j.ejcb.2011.01.011. PMID 21481967.
- ^ Сато Т., Като Х., Кумагаи Й., Йонеяма М., Сато С., Мацусита К., Цудзимура Т., Фудзита Т., Акира С., Такеучи О. (январь 2010 г.). «LGP2 является позитивным регулятором противовирусных реакций, опосредованных RIG-I и MDA5». Труды Национальной академии наук Соединенных Штатов Америки. 107 (4): 1512–7. Bibcode:2010ПНАС..107.1512С. Дои:10.1073 / pnas.0912986107. ЧВК 2824407. PMID 20080593.
- ^ Лоо Ю.М., Гейл М. (май 2011 г.). «Иммунная передача сигналов через RIG-I-подобные рецепторы». Иммунитет. 34 (5): 680–92. Дои:10.1016 / j.immuni.2011.05.003. ЧВК 3177755. PMID 21616437.
- ^ Бахар О., Прюитт Р., Луу Д.Д., Швессингер Б., Дауди А., Лю Ф., Руан Р., Фонтейн-Бодин Л., Коебник Р., Рональд П. (2014). «Белок Xanthomonas Ax21 обрабатывается общей секреторной системой и секретируется вместе с везикулами внешней мембраны». PeerJ. 2: e242. Дои:10.7717 / peerj.242. ЧВК 3897388. PMID 24482761.
- ^ а б Боллер Т., Феликс Дж. (2009). «Возрождение элиситоров: восприятие связанных с микробами молекулярных паттернов и сигналов опасности рецепторами распознавания образов». Ежегодный обзор биологии растений. 60: 379–406. Дои:10.1146 / annurev.arplant.57.032905.105346. PMID 19400727.
- ^ Chisholm ST, Coaker G, Day B, Staskawicz BJ (февраль 2006 г.). «Взаимодействие микробов и хозяев: формирование эволюции иммунного ответа растений». Клетка. 124 (4): 803–14. Дои:10.1016 / j.cell.2006.02.008. PMID 16497589.
- ^ Макхейл Л., Тан X, Кель П., Мишельмор Р. В. (2006). «Растительные белки NBS-LRR: адаптируемые охранники». Геномная биология. 7 (4): 212. Дои:10.1186 / gb-2006-7-4-212. ЧВК 1557992. PMID 16677430.
- ^ Дардик С., Швессингер Б., Рональд П. (август 2012 г.). «Неаргинин-аспартатные (не-RD) киназы связаны с рецепторами врожденного иммунитета, которые распознают консервативные микробные сигнатуры». Текущее мнение в области биологии растений. 15 (4): 358–66. Дои:10.1016 / j.pbi.2012.05.002. PMID 22658367.
- ^ Дардик С., Рональд П. (январь 2006 г.). "Рецепторы распознавания патогенов растений и животных передают сигнал через не-RD киназы". Патогены PLOS. 2 (1): e2. Дои:10.1371 / journal.ppat.0020002. ЧВК 1331981. PMID 16424920.
- ^ Дзярский, Роман; Ройет, Жюльен; Гупта, Дипика (01.01.2016), Рэтклифф, Майкл Дж. Х. (редактор), «Белки распознавания пептидогликанов и лизоцим», Энциклопедия иммунобиологии, Oxford: Academic Press, стр. 389–403, Дои:10.1016 / b978-0-12-374279-7.02022-1, ISBN 978-0-08-092152-5, получено 2020-11-11
- ^ Ван Г.Л., Руан Д.Л., Сонг В.Й., Сидерис С., Чен Л., Пи Л.Й., Чжан С., Чжан З., Фоке С., Гаут Б.С., Уэлен М.С., Рональд П.С. (май 1998 г.). «Xa21D кодирует рецептороподобную молекулу с богатым лейцином повторяющимся доменом, который определяет расово-специфическое распознавание и подвергается адаптивной эволюции». Растительная клетка. 10 (5): 765–79. Дои:10.2307/3870663. JSTOR 3870663. ЧВК 144027. PMID 9596635.
- ^ Домметт Р.М., Кляйн Н., Тернер М.В. (сентябрь 2006 г.). «Маннозосвязывающий лектин при врожденном иммунитете: прошлое, настоящее и будущее». Тканевые антигены. 68 (3): 193–209. Дои:10.1111 / j.1399-0039.2006.00649.x. ЧВК 7169806. PMID 16948640.
- ^ «Понимание иммунотерапии». Cancer.Net. 2013-03-25. Получено 2017-07-31.
- ^ Чен Е.С. (сентябрь 2016 г.). «Врожденный иммунитет в патобиологии саркоидоза». Текущее мнение в области легочной медицины. 22 (5): 469–75. Дои:10.1097 / mcp.0000000000000305. PMID 27387100.
- ^ Philpott DJ, Sorbara MT, Robertson SJ, Croitoru K, Girardin SE (январь 2014 г.). «Белки NOD: регуляторы воспаления при здоровье и болезни». Обзоры природы. Иммунология. 14 (1): 9–23. Дои:10.1038 / nri3565. PMID 24336102.
- ^ Джун Дж. К., Коминелли Ф., Эбботт Д. В. (ноябрь 2013 г.). «Активность RIP2 при воспалительном заболевании и значение для новой терапии». Журнал биологии лейкоцитов. 94 (5): 927–32. Дои:10.1189 / jlb.0213109. ЧВК 3800061. PMID 23794710.
- ^ Тиньо-Аранхуэс Дж. Т., Бендеритер П., Ромбоут Ф, Деруз Ф, Бай Х, Маттиоли Б., Коминелли Ф., Писарро Т. Т., Хофлак Дж., Эбботт DW (октябрь 2014 г.). «Ингибирование киназы RIPK2 in vivo облегчает воспалительное заболевание». Журнал биологической химии. 289 (43): 29651–64. Дои:10.1074 / jbc.m114.591388. ЧВК 4207980. PMID 25213858.
- ^ Хайле П.А., Вотта Б.Дж., Маркиз Р.В., Бери М.Дж., Мельманн Дж.Ф., Сингхаус Р., Чарнли А.К., Лакдавала А.С., Конвери М.А., Липшутц ДБ, Десаи Б.М., Свифт Б., Каприотти, Калифорния, Бергер С.Б., Махаджан М.К., Рейли М.А., Ривера Э. , Sun HH, Nagilla R, Beal AM, Finger JN, Cook MN, King BW, Ouellette MT, Totoritis RD, Pierdomenico M, Negroni A, Stronati L, Cucchiara S, Ziółkowski B, Vossenkämper A, MacDonald TT, Gough PJ, Bertin Дж., Касильяс Л.Н. (май 2016 г.). «Идентификация и фармакологическая характеристика 6- (трет-бутилсульфонил) -N- (5-фтор-1H-индазол-3-ил) хинолин-4-амина (GSK583), высокоэффективного и селективного ингибитора киназы RIP2». Журнал медицинской химии. 59 (10): 4867–80. Дои:10.1021 / acs.jmedchem.6b00211. PMID 27109867.
- ^ Корридони Д., Родригес-Паласиос А., Ди Стефано Дж., Ди Мартино Л., Антонопулос Д.А., Чанг Э.Б., Арсено К.О., Писарро Т.Т., Коминелли Ф. (июль 2017 г.). «Генетическая делеция бактериального сенсора NOD2 улучшает илеит, напоминающий болезнь Крона у мышей, независимо от функционального дисбиоза». Иммунология слизистой оболочки. 10 (4): 971–982. Дои:10.1038 / миль.2016.98. ЧВК 5433921. PMID 27848951.
- ^ Каннинг П., Руан К., Шверд Т., Хрдинка М., Маки Дж. Л., Салех Д., Суэбсувонг С., Рэй С., Бреннан П. Е., Куни Г. Д., Улиг Г. Х., Гирд-Хансен М., Дегтерев А., Баллок А. Н. (сентябрь 2015 г.). «Воспалительная передача сигналов с помощью NOD-RIPK2 ингибируется клинически значимыми ингибиторами киназы типа II». Химия и биология. 22 (9): 1174–84. Дои:10.1016 / j.chembiol.2015.07.017. ЧВК 4579271. PMID 26320862.
- ^ Кастаньо-Родригес Н., Каакуш Н.О., Митчелл Х.М. (2014). «Рецепторы распознавания образов и рак желудка». Границы иммунологии. 5: 336. Дои:10.3389 / fimmu.2014.00336. ЧВК 4105827. PMID 25101079.
- ^ а б Кигерл К.А., де Риверо Ваккари Дж. П., Дитрих В. Д., Попович П. Г., Кин Р. В. (август 2014 г.). «Рецепторы распознавания образов и восстановление центральной нервной системы». Экспериментальная неврология. 258: 5–16. Дои:10.1016 / j.expneurol.2014.01.001. ЧВК 4974939. PMID 25017883.
внешняя ссылка
- Паттерн + Распознавание + Рецепторы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)

