Толл-подобный рецептор - Toll-like receptor
| Толл-подобный рецептор | |
|---|---|
 Изогнутый богатый лейцином повтор область толл-подобных рецепторов, представленная здесь TLR3 | |
| Идентификаторы | |
| Символ | Толл-подобный рецептор |
| Мембранома | 7 |
| PIRSF037595 | |
Толл-подобные рецепторы (TLR) являются классом белки которые играют ключевую роль в врожденная иммунная система. Они есть однопроходный мембранный рецепторы обычно выражается на дозорные клетки Такие как макрофаги и дендритные клетки, которые распознают структурно консервативные молекулы, происходящие из микробы. Как только эти микробы преодолеют физические барьеры, такие как кожа или же кишечного тракта слизистая оболочка, они распознаются TLR, которые активируют иммунная клетка ответы. TLR включают TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 и TLR13, хотя последние три не встречаются у людей.[1]
TLR получили свое название из-за их сходства с белком, кодируемым платный ген идентифицировано в Дрозофила в 1985 г. Кристиан Нюсслейн-Фольхард и Эрик Вишаус.[2]
Функция
Способность иммунной системы распознавать молекулы которые широко разделяют патогены частично из-за наличия иммунные рецепторы так называемые toll-подобные рецепторы (TLR), которые экспрессируются на мембраны из лейкоциты включая дендритные клетки, макрофаги, естественные клетки-киллеры, клетки адаптивного иммунитета Т-клетки, и В-клетки, и неиммунные клетки (эпителиальный и эндотелиальные клетки, и фибробласты ).[3]
Связывание лиганды - либо в виде адъюванта, используемого в прививки или в форме инвазивных компонентов во время естественного заражения - TLR отмечает ключ молекулярный события, которые в конечном итоге приводят к врожденным иммунным ответам и развитию антиген-специфического приобретенного иммунитета.[4][5]
После активации TLR набирают адаптерные белки (белки, которые опосредуют другие белок-белковые взаимодействия) внутри цитозоль из иммунная клетка для размножения индуцированного антигеном путь передачи сигнала. Эти набранные белки затем несут ответственность за последующую активацию других вниз по течению белки, в том числе протеинкиназы (ИККи, ИРАК1, ИРАК4, и TBK1 ), которые еще больше усиливают сигнал и в конечном итоге приводят к усилению или подавлению гены это оркестровка воспалительный ответы и другие транскрипционный События. Некоторые из этих событий приводят к цитокин производство, распространение, и выживаемость, в то время как другие приводят к повышению адаптивного иммунитета.[5] Если лиганд является бактериальным фактором, патоген может быть фагоцитированный и переваривается, и его антигены представлены CD4 + Т-клетки В случае вирусного фактора инфицированная клетка может отключить синтез белка и может подвергнуться запрограммированной гибели клетки (апоптоз ). Иммунные клетки, обнаружившие вирус, также могут выделять противовирусные факторы, такие как интерфероны.
Также было показано, что Toll-подобные рецепторы являются важным звеном между врожденным и адаптивным иммунитетом благодаря их присутствию в дендритные клетки.[6] Флагеллин, лиганд TLR5, индуцирует секрецию цитокинов при взаимодействии с TLR5 на Т-клетках человека.[6]
Надсемейство
TLR - это тип рецептор распознавания образов (PRR) и распознают молекулы, которые широко используются патогены но отличимые от молекул хозяина, вместе именуемые патоген-ассоциированные молекулярные паттерны (PAMP). TLR вместе с Рецепторы интерлейкина-1 формировать рецептор надсемейство, известные как «суперсемейство рецепторов интерлейкина-1 / толл-подобных рецепторов»; Все члены этого семейства имеют общий так называемый домен TIR (рецептор toll-IL-1).
Существуют три подгруппы доменов TIR. Белки с доменами TIR подгруппы 1 являются рецепторами для интерлейкины которые производятся макрофаги, моноциты, и дендритные клетки и у всех есть внеклеточные Иммуноглобулин (Ig) домены. Белки с доменами TIR подгруппы 2 являются классическими TLR и связываются прямо или косвенно с молекулами микробного происхождения. Третья подгруппа белков, содержащих TIR-домены, состоит из адаптерные белки которые исключительно цитозольный и опосредуют передачу сигналов от белков подгрупп 1 и 2.
Большая семья
Эта секция отсутствует информация о кладах / подгруппах позвоночных (pmid15976025). (Август 2019 г.) |
TLR присутствуют в позвоночные а также беспозвоночные. Молекулярные строительные блоки TLR представлены в бактериях и растениях, и рецепторы распознавания образов растений хорошо известно, что они необходимы для защиты хозяина от инфекции. Таким образом, TLR, по-видимому, являются одним из самых древних консервативных компонентов иммунная система.
В последние годы TLR были идентифицированы также в нервной системе млекопитающих. Члены семейства TLR были обнаружены на глии, нейронах и клетках-предшественниках нейронов, в которых они регулируют решение клеточной судьбы.[7]
Было подсчитано, что большинство видов млекопитающих имеют от десяти до пятнадцати типов толл-подобных рецепторов. Тринадцать TLR (названные просто TLR1 - TLR13) были идентифицированы у людей и мышей вместе, и эквивалентные формы многих из них были обнаружены у других видов млекопитающих.[8][9][10] Однако эквиваленты некоторых TLR, обнаруженных у людей, присутствуют не у всех млекопитающих. Например, ген, кодирующий белок, аналогичный TLR10 у человека, присутствует в мышей, но, похоже, в какой-то момент в прошлом был поврежден ретровирус. С другой стороны, мыши экспрессируют TLR 11, 12 и 13, ни один из которых не представлен у людей. Другие млекопитающие могут экспрессировать TLR, которые не обнаруживаются у людей. Другие виды, не относящиеся к млекопитающим, могут иметь TLR, отличные от млекопитающих, что демонстрируется антиклеточной стенкой. TLR14, который находится в Такифугу рыба фугу.[11] Это может усложнить процесс использования экспериментальных животных в качестве моделей врожденного иммунитета человека.
TLR позвоночных делятся по сходству на семейства TLR 1/2/6/10/14/15, TLR 3, TLR 4, TLR 5, TLR 7/8/9 и TLR 11/12/13/16/21. / 22/23.[11]
TLR в Дрозофила иммунитет
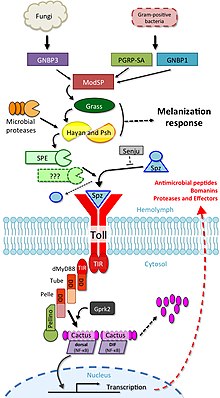
Участие передачи сигналов Toll в иммунитете было впервые продемонстрировано на плодовой мушке, Drosophila melanogaster.[16] У плодовых мушек есть только врожденные иммунные реакции, что позволяет избежать вмешательства адаптивных иммунных механизмов на передачу сигнала. Реакция мух на грибковую или бактериальную инфекцию происходит посредством двух отдельных сигнальных каскадов, один из которых является Toll-путем, а другой - сигнальным. путь иммунодефицита (IMD). Путь Toll подобен передаче сигналов TLR млекопитающих, но в отличие от TLR млекопитающих, Toll не активируется напрямую связанными с патогенами молекулярными паттернами (PAMPs ). Его рецепторный эктодомен распознает расщепленную форму цитокина Spätzle, который секретируется в гемолимфа как неактивный димерный предшественник. Toll-рецептор имеет общий цитоплазматический TIR-домен с TLR млекопитающих, но эктодомен и интрацитоплазматический хвост отличаются. Это различие может отражать функцию этих рецепторов как рецепторов цитокинов, а не PRR.
Путь Toll активируется различными стимулами, такими как Грамположительные бактерии, грибы и факторы вирулентности.[14][17] Во-первых, фермент процессинга Spätzle (SPE) активируется в ответ на инфекцию и расщепляет Spätzle (spz). Затем расщепленный Spätzle связывается с рецептором Toll и сшивает его эктодомены. Это запускает конформационные изменения в рецепторе, приводящие к передаче сигналов через Toll. С этого момента сигнальный каскад очень похож на сигнальный каскад млекопитающих через TLR. Toll-индуцированный сигнальный комплекс (TICS) состоит из MyD88, Tube и Pelle (ортолог IRAK млекопитающих). Затем сигнал от TICS передается кактусу (гомологу млекопитающих IκB ), фосфорилированный кактус полиубиквитилирован и деградирован, что делает возможным ядерную транслокацию DIF (дорсальный фактор иммунитета; гомолог млекопитающих NF-κB ) и индукция транскрипции генов антимикробные пептиды (AMP), например Дросомицин.[18]
Дрозофилия иметь в общей сложности 9 потери семья и 6 spz семейные гены, которые в разной степени взаимодействуют друг с другом.[19]
TLR2
TLR2 также был обозначен как CD282 (кластер дифференцировки 282).
TLR3
TLR3 не использует MyD88 зависимый путь. Его лиганд - ретровирусная двухцепочечная РНК (дцРНК ), что активирует TRIF зависимый сигнальный путь. Чтобы исследовать роль этого пути в репрограммировании ретровирусов, были подготовлены методы нокдауна TLR3 или TRIF, и результаты показали, что только путь TLR3 необходим для полной индукции экспрессии целевого гена вектором экспрессии ретровируса. Эта ретровирусная экспрессия четырех факторов транскрипции (4 октября, Sox2, Klf4 и c-Myc; OSKM) вызывает плюрипотентность в соматических клетках. Это подтверждается исследованием, которое показывает, что эффективность и количество генерации ИПСК человека с использованием ретровирусных векторов снижается за счет нокдауна пути пептидными ингибиторами или shRNA нокдаун TLR3 или его адапторного белка TRIF. Взятые вместе, стимуляция TLR3 вызывает большие изменения в ремоделировании хроматина и ядерном репрограммировании, и для этих изменений требуется активация воспалительных путей, индукция генов плюрипотентности и образование индуцированных человеком колоний плюрипотентных стволовых клеток (ИПСК).[20]
TLR11
Как отмечалось выше, клетки человека не экспрессируют TLR11, но мышиные клетки делают. Специфичный для мыши TLR11 распознает уропатогенные Кишечная палочка и апикомлексный паразит Toxoplasma gondii. С Токсоплазма его лиганд - это протеин профилин, но лиганд для Кишечная палочка до сих пор не известно. Недавно энтеропатоген Сальмонелла виды было обнаружено, что лиганд связан с TLR11. Сальмонелла - это грамотрицательная жгутиковая бактерия, вызывающая гастроэнтерит, передаваемый через пищу и воду, и брюшной тиф в людях. TLR11 в кишечнике мыши распознает белок флагеллун флагеллин, вызывая димеризацию рецептора, активацию NF-κB и продукцию воспалительных цитокинов. TLR11-дефицитные мыши (нокаутирующая мышь ) эффективно инфицированы перорально введенными Сальмонелла Тиф. С. Тиф обычно не заражает мышей, это обязательный патоген человека, вызывающий брюшной тиф, от которого страдают более 20 миллионов человек и ежегодно умирает более 220 тысяч человек. В связи с этим были проведены исследования, и было обнаружено, что мышей tlr - / - можно иммунизировать против С. Тиф и они используются в качестве модели на животных для изучения иммунных ответов против этого патогена и для разработки вакцин, которые, возможно, могут быть использованы в будущем.[21]
Резюме известных TLR млекопитающих
Toll-подобные рецепторы связываются и активируются разными лигандами, которые, в свою очередь, расположены на разных типах организмов или структур. У них также есть разные адаптеры для ответа на активацию, и они расположены иногда на поверхности клетки, а иногда на внутренней стороне. клеточные отсеки. Кроме того, они выражаются разными типами лейкоциты или другой типы клеток:
| Рецептор | Лиганд (ы)[22] | Расположение лиганда[22] | Адаптер (ы) | Место расположения | Типы клеток[22] |
|---|---|---|---|---|---|
| TLR 1 | множественный триацил липопептиды | Бактериальный липопротеин | MyD88 / MAL | поверхность клетки |
|
| TLR 2 | несколько гликолипиды | Бактериальные пептидогликаны | MyD88 / MAL | поверхность клетки |
|
| множественные липопептиды и протеолипиды | Бактериальные пептидогликаны | ||||
| липотейхоевая кислота | Грамположительные бактерии | ||||
| HSP70 | Клетки-хозяева | ||||
| зимозан (Бета-глюкан ) | Грибы | ||||
| Многочисленные другие | |||||
| TLR 3 | двухцепочечная РНК, поли I: C | вирусы | TRIF | отсек для кювет |
|
| TLR 4 | липополисахарид | Грамотрицательные бактерии | MyD88 / MAL /TRIF / ТРАМВАЙ | поверхность клетки |
|
| несколько белки теплового шока | Бактерии и клетки-хозяева | ||||
| фибриноген | клетки-хозяева | ||||
| гепарансульфат фрагменты | клетки-хозяева | ||||
| гиалуроновая кислота фрагменты | клетки-хозяева | ||||
| никель[27] | |||||
| Разные опиоид наркотики | |||||
| TLR 5 | Бактериальный флагеллин | Бактерии | MyD88 | поверхность клетки |
|
| Профилин[28] | Toxoplasma gondii | ||||
| TLR 6 | множественные диациллипопептиды | Микоплазма | MyD88 / MAL | поверхность клетки |
|
| TLR 7 | имидазохинолин | небольшие синтетические соединения | MyD88 | отсек для кювет |
|
| локсорибин (а гуанозин аналог) | |||||
| бропиримин | |||||
| Resiquimod | |||||
| одноцепочечная РНК | РНК-вирусы | ||||
| TLR 8 | небольшие синтетические соединения; одноцепочечная вирусная РНК, фагоцитированная бактериальная РНК (24) | MyD88 | отсек для кювет |
| |
| TLR 9 | неметилированный CpG Олигодезоксинуклеотид ДНК | Бактерии, ДНК-вирусы | MyD88 | отсек для кювет |
|
| TLR 10 | триацилированные липопептиды [29] | неизвестный | поверхность клетки | ||
| TLR 11 | Профилин | Toxoplasma gondii[33] | MyD88 | отсек для кювет[34] |
|
| TLR 12 | Профилин | Toxoplasma gondii[35] | MyD88 | отсек для кювет |
|
| TLR 13[37][38] | последовательность бактериальной рибосомной РНК «CGGAAAGACC» (но не метилированная версия)[39] | Вирус, бактерии | MyD88, ТАК-1 | отсек для кювет |
|
Лиганды
Из-за специфичности толл-подобных рецепторов (и других рецепторов врожденного иммунитета) их нелегко изменить в ходе эволюции, эти рецепторы распознают молекулы, которые постоянно связаны с угрозами (например, с патогенами или клеточным стрессом), и очень специфичны для эти угрозы (т. е. не могут быть приняты за собственные молекулы, которые обычно экспрессируются в физиологических условиях). Считается, что ассоциированные с патогеном молекулы, отвечающие этому требованию, имеют решающее значение для функции патогена и их трудно изменить в результате мутации; говорят, что они эволюционно сохраняются. Некоторые консервативные особенности патогенов включают: бактериальный клеточная поверхность липополисахариды (LPS), липопротеины, липопептиды и липоарабиноманнан; белки, такие как флагеллин из бактериальных жгутики; двухцепочечный РНК из вирусы; или неметилированные CpG островки бактериальных и вирусных ДНК; а также островков CpG, обнаруженных в промоторах эукариотической ДНК; а также некоторые другие молекулы РНК и ДНК. Для большинства TLR лиганд Специфичность распознавания теперь установлена путем нацеливания на гены (также известного как «нокаут гена»): метод, с помощью которого отдельные гены могут быть выборочно удалены у мышей.[40][41] См. Таблицу ниже для обзора известных лигандов TLR.
Эндогенные лиганды
Стереотипный воспалительный ответ, вызванный активацией толл-подобных рецепторов, вызвал предположения о том, что эндогенные активаторы толл-подобных рецепторов могут участвовать в аутоиммунных заболеваниях. Предполагается, что TLR связываются с молекулами хозяина, включая фибриноген (участвует в свертывание крови ), белки теплового шока (HSP), HMGB1 компоненты внеклеточного матрикса и собственная ДНК (обычно она разрушается нуклеазами, но при воспалительных и аутоиммунных условиях она может образовывать комплекс с эндогенными белками, становиться устойчивой к этим нуклеазам и получать доступ к эндосомным TLR как TLR7 или TLR9). Эти эндогенные лиганды обычно образуются в результате нефизиологической гибели клеток.[42]
Сигнализация

Считается, что TLR действуют как димеры. Хотя большинство TLR, похоже, функционируют как гомодимеры, Формы TLR2 гетеродимеры с TLR1 или TLR6, каждый димер имеет различную лигандную специфичность. TLR могут также зависеть от других корецепторов для полной чувствительности к лигандам, например, в случае распознавания TLR4 LPS, для чего требуется МД-2. CD14 и LPS-связывающий белок (LBP ), как известно, облегчают представление LPS в MD-2.
Набор эндосомных TLR, включающий TLR3, TLR7, TLR8 и TLR9, распознает нуклеиновая кислота полученные из вирусов, а также эндогенные нуклеиновые кислоты в контексте патогенных явлений. Активация этих рецепторов приводит к образованию воспалительного цитокины а также интерфероны I типа (интерферон I типа ), чтобы помочь бороться с вирусной инфекцией.
Адаптерные белки и киназы, которые обеспечивают передачу сигналов TLR, также являются мишенью. Кроме того, случайный мутагенез зародышевой линии с ЕНУ был использован для расшифровки сигнальных путей TLR. При активации TLR привлекают адапторные молекулы в цитоплазму клеток для распространения сигнала. Известно, что в передаче сигналов участвуют четыре адапторные молекулы. Эти белки известны как MyD88, ТИРАП (также называемый Мал), TRIF и TRAM (молекула адаптера, связанная с TRIF).[43][44][45]
Передача сигналов TLR делится на два различных сигнальных пути: MyD88-зависимый и TRIF-зависимый путь.
MyD88-зависимый путь
MyD88-зависимый ответ возникает при димеризации рецептора TLR и используется всеми TLR, кроме TLR3. Его основной эффект - активация NFκB и Митоген-активированная протеинкиназа. Связывание лиганда и конформационные изменения, происходящие в рецепторе, привлекают адаптерный белок MyD88, член МДП семья. MyD88 набирает ИРАК4, ИРАК1 и ИРАК2. Затем киназы IRAK фосфорилируют и активируют белок. TRAF6, который, в свою очередь, полиубихинирует белок TAK1, а также сам себя, чтобы облегчить связывание с ИКК-β. При связывании TAK1 фосфорилирует IKK-β, который затем фосфорилирует IκB, вызывая его деградацию и позволяя NFκB диффундировать в ядро клетки и активировать транскрипцию и последующую индукцию воспалительных цитокинов.[42]
TRIF-зависимый путь
И TLR3, и TLR4 используют TRIF-зависимый путь, который запускается дцРНК и ЛПС соответственно. Для TLR3 дцРНК приводит к активации рецептора, рекрутируя адаптер TRIF. TRIF активирует киназы TBK1 и РИПК1, который создает ответвление в сигнальном пути. Сигнальный комплекс TRIF / TBK1 фосфорилирует IRF3 позволяя его транслокацию в ядро и производство Интерферон I типа. Между тем, активация RIPK1 вызывает полиубиквитинирование и активацию транскрипции TAK1 и NFκB таким же образом, как и MyD88-зависимый путь.[42]
Передача сигналов TLR в конечном итоге приводит к индукции или подавлению генов, которые регулируют воспалительную реакцию. В целом, тысячи генов активируются передачей сигналов TLR, и в совокупности TLR составляют один из самых плейотропный но жестко регулируемые шлюзы для модуляции генов.
TLR4 - единственный TLR, использующий все четыре адаптера. Комплекс, состоящий из TLR4, MD2 и LPS, привлекает TIR-домен-содержащие адаптеры TIRAP и MyD88 и, таким образом, инициирует активацию NFκB (ранняя фаза) и MAPK. Комплекс TLR4-MD2-LPS затем претерпевает эндоцитоз и в эндосоме образует сигнальный комплекс с адаптерами TRAM и TRIF. Этот TRIF-зависимый путь снова приводит к активации IRF3 и продукции интерферонов типа I, но он также активирует позднюю фазу активации NFκB. Активация как поздней, так и ранней фазы NFκB необходима для продукции воспалительных цитокинов.[42]
Медицинское значение
Имиквимод (кардинально используется в дерматология ) является агонистом TLR7, а его преемник Resiquimod, является агонистом TLR7 и TLR8.[46] Недавно резиквимод был исследован как средство иммунотерапии рака,[47] действует через стимуляцию связанных с опухолью макрофагов.
Несколько лигандов TLR находятся в стадии клинической разработки или тестируются на животных моделях как адъюванты вакцины,[48] с первым клиническим применением на людях рекомбинантного вакцина против опоясывающего герпеса в 2017 году, который содержит компонент монофосфориллипида А.
Сообщалось об уровнях экспрессии матричной РНК TLR7 у молочных животных во время естественной вспышки ящура.[49]
Открытие
Когда микробы впервые были признаны причиной инфекционных заболеваний, сразу стало ясно, что многоклеточные организмы должны быть способны распознавать их при заражении и, следовательно, способны распознавать молекулы, уникальные для микробов. Большое количество литературы, охватывающей большую часть прошлого века, свидетельствует о поиске ключевых молекул и их рецепторов. Более 100 лет назад Ричард Пфайффер, студент Роберт Кох, ввел термин "эндотоксин "для описания вещества, производимого Грамотрицательные бактерии это могло спровоцировать высокая температура и шок в экспериментальные животные. В последующие десятилетия эндотоксин был химически охарактеризован и идентифицирован как липополисахарид (ЛПС), продуцируемый большинством грамотрицательных бактерий. Этот липополисахарид является неотъемлемой частью грамотрицательной мембраны и высвобождается при уничтожении бактерии. Другие молекулы (бактериальные липопептиды, флагеллин, и неметилированные ДНК ), в свою очередь, провоцируют ответ хозяина, который обычно носит защитный характер. Однако эти ответы могут быть вредными, если они чрезмерно продолжительны или интенсивны. Из этого логически следовало, что для таких молекул должны быть рецепторы, способные предупреждать хозяина о наличии инфекции, но они оставались неуловимыми в течение многих лет. Толл-подобные рецепторы теперь считаются ключевыми молекулами, которые предупреждают иммунная система на наличие микробных инфекции.
Прототипный член семьи, потери рецептор (P08953; Tl) у плодовой мушки Drosophila melanogaster, был открыт в 1985 году нобелевскими лауреатами 1995 года. Кристиан Нюсслейн-Фольхард и Эрик Вишаус и коллеги. Он был известен своей развивающей функцией в эмбриогенез путем создания спинной -вентральный ось. Он был назван в честь восклицания Кристиан Нюсслейн-Фольхард 1985 года: "Das ist ja потери!"(" Это потрясающе! ") В отношении недоразвитой брюшной части личинки плодовой мухи.[2] Он был клонирован лабораторией Кэтрин Андерсон в 1988 году.[50] В 1996 г. потери был найден Жюль А. Хоффманн и его коллеги, чтобы сыграть важную роль в иммунитете мухи к грибковые инфекции, что достигается за счет активации синтеза антимикробных пептидов.[16]
Первый зарегистрированный толл-подобный рецептор человека был описан Номурой и его коллегами в 1994 г.[51] сопоставлен с хромосомой Тагучи и его коллегами в 1996 году.[52] Потому что иммунная функция платных Дрозофила тогда еще не было известно, предполагалось, что TIL (теперь известный как TLR1) может участвовать в развитии млекопитающих. Однако в 1991 году (до открытия TIL) было обнаружено, что молекула, играющая четкую роль в иммунной функции у млекопитающих, интерлейкин-1 (ИЛ-1) рецептор, также гомологичный толле дрозофилы; цитоплазматические части обеих молекул были подобны.[53]
В 1997 г. Чарльз Джейнвей и Руслан Меджитов показали, что толл-подобный рецептор, ныне известный как TLR4, может, при искусственном лигировании с использованием антител, индуцировать активацию определенных генов, необходимых для инициирования адаптивный иммунный ответ.[5] Функция TLR 4 как рецептора, воспринимающего ЛПС, была обнаружена Брюс А. Бейтлер и коллеги.[54] Эти рабочие использовали позиционное клонирование чтобы доказать, что у мышей, которые не могли отвечать на LPS, были мутации, отменяющие функцию TLR4. Это позволило идентифицировать TLR4 как один из ключевых компонентов рецептора LPS.

В свою очередь, другие гены TLR были удалены у мышей путем нацеливания на гены, в основном в лаборатории Шизуо Акира и коллеги. В настоящее время считается, что каждый TLR обнаруживает дискретный набор молекул - некоторые из них микробного происхождения, а некоторые продукты повреждения клеток - и сигнализируют о наличии инфекций.[55]
Растительные гомологи потери были обнаружены Памелой Рональд в 1995 году (рис XA21)[56] и Томас Боллер в 2000 г. (Арабидопсис FLS2).[57]
В 2011 году Бойтлер и Хоффманн были удостоены Нобелевской премии по медицине и физиологии за свою работу.[58] Хоффманн и Акира получили международную премию Канады Гэрднер в 2011 году.[59]
Примечания и ссылки
- ^ Махла Р.С., Редди М.С., Прасад Д.В., Кумар Х. (сентябрь 2013 г.). «Подслащенные PAMP: роль сахарных комплексов PAMP в врожденном иммунитете и биологии вакцины». Границы иммунологии. 4: 248. Дои:10.3389 / fimmu.2013.00248. ЧВК 3759294. PMID 24032031.
- ^ а б Ханссон Г.К., Эдфельдт К. (июнь 2005 г.). «Плата за проезд у выхода на стенку судна». Артериосклероз, тромбоз и биология сосудов. 25 (6): 1085–7. Дои:10.1161 / 01.ATV.0000168894.43759.47. PMID 15923538.
- ^ Делнест Y, Бовийан С., Жаннин П. (январь 2007 г.). «[Врожденный иммунитет: структура и функция TLR]». Médecine / Науки. 23 (1): 67–73. Дои:10.1051 / medsci / 200723167. PMID 17212934.
- ^ Такеда К., Акира С. (январь 2005 г.). «Толл-подобные рецепторы врожденного иммунитета». Международная иммунология. 17 (1): 1–14. Дои:10.1093 / intimm / dxh186. PMID 15585605.
- ^ а б c Меджитов Р., Престон-Херлберт П., Джейнвей, Калифорния (июль 1997 г.). «Человеческий гомолог белка Toll дрозофилы сигнализирует об активации адаптивного иммунитета». Природа. 388 (6640): 394–7. Bibcode:1997Натура.388..394М. Дои:10.1038/41131. PMID 9237759.
- ^ а б Шарма Н., Ахаде А.С., Кадри А. (апрель 2013 г.). «Сфингозин-1-фосфат подавляет индуцированную TLR секрецию CXCL8 из человеческих Т-клеток». Журнал биологии лейкоцитов. 93 (4): 521–8. Дои:10.1189 / jlb.0712328. PMID 23345392.
- ^ Rolls A, Shechter R, London A, Ziv Y, Ronen A, Levy R, Schwartz M (сентябрь 2007 г.). «Толл-подобные рецепторы модулируют нейрогенез гиппокампа взрослых». Природа клеточной биологии. 9 (9): 1081–8. Дои:10.1038 / ncb1629. PMID 17704767.
- ^ Du X, Poltorak A, Wei Y, Beutler B (сентябрь 2000 г.). «Три новых толл-подобных рецептора млекопитающих: структура гена, экспрессия и эволюция». Европейская сеть цитокинов. 11 (3): 362–71. PMID 11022119.
- ^ Чжуан Т.Х., Улевич Р.Дж. (сентябрь 2000 г.). «Клонирование и характеристика подсемейства человеческих toll-подобных рецепторов: hTLR7, hTLR8 и hTLR9». Европейская сеть цитокинов. 11 (3): 372–8. PMID 11022120.
- ^ Табета К., Георгель П., Янссен Э., Ду Х, Хобе К., Крозат К. и др. (Март 2004 г.). «Toll-подобные рецепторы 9 и 3 как важнейшие компоненты врожденной иммунной защиты против цитомегаловирусной инфекции мышей». Труды Национальной академии наук Соединенных Штатов Америки. 101 (10): 3516–21. Bibcode:2004ПНАС..101.3516Т. Дои:10.1073 / pnas.0400525101. ЧВК 373494. PMID 14993594.
- ^ а б Roach JC, Glusman G, Rowen L., Kaur A, Purcell MK, Smith KD, et al. (Июль 2005 г.). «Эволюция Toll-подобных рецепторов позвоночных». Труды Национальной академии наук Соединенных Штатов Америки. 102 (27): 9577–82. Bibcode:2005ПНАС..102.9577Р. Дои:10.1073 / pnas.0502272102. ЧВК 1172252. PMID 15976025.
- ^ Леметр Б, Хоффманн Дж (2007). «Хозяин защиты Drosophila melanogaster». Ежегодный обзор иммунологии. 25: 697–743. Дои:10.1146 / annurev.immunol.25.022106.141615. PMID 17201680.
- ^ Валанн С., Ван Дж. Х., Рэмет М. (январь 2011 г.). "Путь передачи сигналов Toll Drosophila". Журнал иммунологии. 186 (2): 649–56. Дои:10.4049 / jimmunol.1002302. PMID 21209287.
- ^ а б Дудзич Дж. П., Хансон М. А., Яценко И., Кондо С., Леметр Б. (апрель 2019 г.). "Больше, чем черное или белое: сериновые протеазы, регулирующие меланизацию и долю потерь у дрозофилы". Отчеты по ячейкам. 27 (4): 1050–1061.e3. Дои:10.1016 / j.celrep.2019.03.101. PMID 31018123.
- ^ Hanson MA, Hamilton PT, Perlman SJ (октябрь 2016 г.). «Иммунные гены и дивергентные антимикробные пептиды у мух подрода Drosophila». BMC Эволюционная биология. 16 (1): 228. Дои:10.1186 / s12862-016-0805-у. ЧВК 5078906. PMID 27776480.
- ^ а б Леметр Б, Николя Э, Мишо Л., Райххарт Дж. М., Хоффманн Дж. А. (сентябрь 1996 г.). «Кассета дорсовентральных регуляторных генов spätzle / Toll / cactus контролирует мощный противогрибковый ответ у взрослых особей дрозофилы». Клетка. 86 (6): 973–83. Дои:10.1016 / s0092-8674 (00) 80172-5. PMID 8808632.
- ^ Issa N, Guillaumot N, Lauret E, Matt N, Schaeffer-Reiss C., Van Dorsselaer A, et al. (Февраль 2018). «Циркулирующая протеаза персефона является иммунным сенсором для микробной протеолитической активности, предшествующей толлинговому пути дрозофилы». Молекулярная клетка. 69 (4): 539–550.e6. Дои:10.1016 / j.molcel.2018.01.029. ЧВК 5823974. PMID 29452635.
- ^ Феррандон Д., Имлер Дж. Л., Хетру С., Хоффманн Дж. А. (ноябрь 2007 г.). «Системный иммунный ответ Drosophila: зондирование и передача сигналов при бактериальных и грибковых инфекциях». Обзоры природы. Иммунология. 7 (11): 862–74. Дои:10.1038 / nri2194. PMID 17948019.
- ^ Чоудхури М., Ли К.Ф., Хе З, Лу И, Лю XS, Ван Ю.Ф. и др. (Июнь 2019). «Дрозофила». Журнал биологической химии. 294 (26): 10172–10181. Дои:10.1074 / jbc.RA118.006804. ЧВК 6664172. PMID 31088910.
- ^ Ли Дж., Сайед Н., Хантер А., Ау К.Ф., Вонг У.Х., Мокарски Э.С. и др. (Октябрь 2012 г.). «Активация врожденного иммунитета необходима для эффективного перепрограммирования ядер». Клетка. 151 (3): 547–58. Дои:10.1016 / j.cell.2012.09.034. ЧВК 3506423. PMID 23101625.
- ^ Матур Р., О Х, Чжан Д., Пак С. Г., Сео Дж., Коблански А. и др. (Октябрь 2012 г.). «Мышиная модель инфекции Salmonella typhi». Клетка. 151 (3): 590–602. Дои:10.1016 / j.cell.2012.08.042. ЧВК 3500584. PMID 23101627.
- ^ а б c Если иное не указано в полях, то исх .: Уолтенбо С., Доан Т., Мелволд Р., Визелли С. (2008). Иммунология. Иллюстрированные обзоры Липпинкотта. Филадельфия: Wolters Kluwer Health / Lippincott Williams & Wilkins. п. 17. ISBN 978-0-7817-9543-2.
- ^ а б Сабро И., Дауэр С. К., Уайт М.К. (ноябрь 2005 г.). «Роль Toll-подобных рецепторов в регуляции миграции, активации и апоптоза нейтрофилов». Клинические инфекционные болезни. 41 Приложение 7: S421-6. Дои:10.1086/431992. PMID 16237641.
- ^ а б c d Саллусто Ф, Ланзавеккья А (2002). «Поучительная роль дендритных клеток в ответах Т-клеток». Исследования артрита. 4 Приложение 3: S127-32. Дои:10.1186 / ar567. ЧВК 3240143. PMID 12110131.
- ^ Герондакис С., Грумонт Р. Дж., Банерджи А. (2007). «Регулирование активации и выживания B-клеток в ответ на сигналы TLR». Иммунология и клеточная биология. 85 (6): 471–5. Дои:10.1038 / sj.icb.7100097. PMID 17637697.
- ^ Карио Э., Розенберг И.М., Брандвайн С.Л., Бек П.Л., Райнекер Х.С., Подольский, ДК (январь 2000 г.). «Липополисахарид активирует различные сигнальные пути в линиях кишечных эпителиальных клеток, экспрессирующих Toll-подобные рецепторы». Журнал иммунологии. 164 (2): 966–72. Дои:10.4049 / jimmunol.164.2.966. PMID 10623846.
- ^ Peana M, Zdyb K, Medici S, Pelucelli A, Simula G, Gumienna-Kontecka E, Zoroddu MA (декабрь 2017 г.). «Взаимодействие Ni (II) с пептидной моделью эктодомена TLR4 человека». Журнал микроэлементов в медицине и биологии. 44: 151–160. Дои:10.1016 / j.jtemb.2017.07.006. PMID 28965571.
- ^ Салазар Гонсалес Р.М., Шехата Х., О'Коннелл М.Дж., Ян Й., Морено-Фернандес М.Э., Шугнет Калифорния, Алиберти Дж. (2014). «Профилин, производный от Toxoplasma gondii, запускает человеческий toll-подобный рецептор 5-зависимой продукции цитокинов». Журнал врожденного иммунитета. 6 (5): 685–94. Дои:10.1159/000362367. ЧВК 4141014. PMID 24861338.
- ^ Гуан И, Раноа Д.Р., Цзян С., Мута С.К., Ли Х, Бодри Дж., Таппинг Р.И. (май 2010 г.). «Человеческие TLR 10 и 1 имеют общие механизмы врожденного иммунного восприятия, но не передачи сигналов». Журнал иммунологии. 184 (9): 5094–103. Дои:10.4049 / jimmunol.0901888. PMID 20348427.
- ^ Чуанг Т., Улевич Р.Дж. (март 2001 г.). «Идентификация hTLR10: нового человеческого Toll-подобного рецептора, предпочтительно экспрессируемого в иммунных клетках». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 1518 (1–2): 157–61. Дои:10.1016 / s0167-4781 (00) 00289-x. PMID 11267672.
- ^ Хорнунг В., Ротенфуссер С., Брич С., Круг А., Ярсдёрфер Б., Гизе Т., Эндрес С., Хартманн Г. (май 2002 г.). «Количественная экспрессия мРНК толл-подобного рецептора 1-10 в клеточных субпопуляциях мононуклеарных клеток периферической крови человека и чувствительность к олигодезоксинуклеотидам CpG». Журнал иммунологии. Балтимор, штат Мэриленд: 1950. 168 (9): 4531–7. Дои:10.4049 / jimmunol.168.9.4531. PMID 11970999.CS1 maint: location (связь)
- ^ а б Риган Т., Налли К., Кармоди Р., Хьюстон А., Шанахан Ф., Макшарри Дж., Бринт Е. (декабрь 2013 г.). «Идентификация TLR10 в качестве ключевого медиатора воспалительного ответа на Listeria monocytogenes в эпителиальных клетках кишечника и макрофагах». Журнал иммунологии. 191 (12): 6084–92. Дои:10.4049 / jimmunol.1203245. PMID 24198280.
- ^ Яровинский Ф., Чжан Д., Андерсен Дж. Ф., Банненберг Г.Л., Серхан С.Н., Хайден М.С. и др. (Июнь 2005 г.). «Активация TLR11 дендритных клеток простейшим профилин-подобным белком». Наука. 308 (5728): 1626–9. Bibcode:2005Наука ... 308.1626Y. Дои:10.1126 / science.1109893. PMID 15860593.
- ^ Пайфер Р., Бенсон А., Стердж С. Р., Яровинский Ф. (февраль 2011 г.). «UNC93B1 необходим для активации TLR11 и IL-12-зависимой устойчивости хозяина к Toxoplasma gondii». Журнал биологической химии. 286 (5): 3307–14. Дои:10.1074 / jbc.M110.171025. ЧВК 3030336. PMID 21097503.
- ^ Кобланский А.А., Янкович Д., О Х, Хиени С., Сунгнак В., Матур Р. и др. (Январь 2013). «Распознавание профилина Toll-подобным рецептором 12 имеет решающее значение для устойчивости хозяина к Toxoplasma gondii». Иммунитет. 38 (1): 119–30. Дои:10.1016 / j.immuni.2012.09.016. ЧВК 3601573. PMID 23246311.
- ^ Мишра ББ, Гундра У.М., Тил Дж. М. (декабрь 2008 г.). «Экспрессия и распределение Toll-подобных рецепторов 11-13 в головном мозге при нейроцистицеркозе мышей». Журнал нейровоспаления. 5: 53. Дои:10.1186/1742-2094-5-53. ЧВК 2631477. PMID 19077284.
- ^ Shi Z, Cai Z, Sanchez A, Zhang T, Wen S, Wang J и др. (Февраль 2011 г.). «Новый Toll-подобный рецептор, распознающий вирус везикулярного стоматита». Журнал биологической химии. 286 (6): 4517–24. Дои:10.1074 / jbc.M110.159590. ЧВК 3039399. PMID 21131352.
- ^ Ольденбург М., Крюгер А., Ферстл Р., Кауфманн А., Нис Г., Зигмунд А. и др. (Август 2012 г.). «TLR13 распознает бактериальную 23S рРНК, лишенную модификаций, формирующих устойчивость к эритромицину». Наука. 337 (6098): 1111–5. Bibcode:2012Научный ... 337.1111O. Дои:10.1126 / наука.1220363. PMID 22821982.
- ^ Хохрайн Х., Киршнинг С.Дж. (март 2013 г.). «Бактерии уклоняются от иммунного распознавания через TLR13 и связывания своей 23S рРНК с помощью антибиотиков MLS с помощью тех же механизмов». Онкоиммунология. 2 (3): e23141. Дои:10.4161 / onci.23141. ЧВК 3661153. PMID 23802068.
- ^ Hoebe K, Du X, Georgel P, Janssen E, Tabeta K, Kim SO и др. (Август 2003 г.). «Идентификация Lps2 в качестве ключевого преобразователя MyD88-независимой сигнализации МДП». Природа. 424 (6950): 743–8. Bibcode:2003Натура.424..743H. Дои:10.1038 / природа01889. PMID 12872135.
- ^ Hemmi H, Takeuchi O, Kawai T, Kaisho T, Sato S, Sanjo H и др. (Декабрь 2000 г.). «Toll-подобный рецептор распознает бактериальную ДНК». Природа. 408 (6813): 740–5. Bibcode:2000Натура.408..740H. Дои:10.1038/35047123. PMID 11130078.
- ^ а б c d Каваи Т., Акира С. (май 2010 г.). «Роль рецепторов распознавания образов в врожденном иммунитете: обновленная информация о Toll-подобных рецепторах». Иммунология природы. 11 (5): 373–84. Дои:10.1038 / ni.1863. PMID 20404851.
- ^ Шигеока А.А., Хольшер Т.Д., Кинг А.Дж., Холл Ф.В., Киосес ВБ, Тобиас П.С. и др. (Май 2007 г.). «TLR2 конститутивно экспрессируется в почках и участвует в ишемическом повреждении почек через MyD88-зависимые и независимые пути». Журнал иммунологии. 178 (10): 6252–8. Дои:10.4049 / jimmunol.178.10.6252. PMID 17475853.
- ^ Ямамото М., Сато С., Хемми Х., Уэмацу С., Хосино К., Кайсё Т. и др. (Ноябрь 2003 г.). «TRAM специфически участвует в опосредованном Toll-подобным рецептором 4 MyD88-независимом сигнальном пути». Иммунология природы. 4 (11): 1144–50. Дои:10.1038 / ni986. PMID 14556004.
- ^ Ямамото М., Сато С., Хемми Х., Санджо Х., Уэмацу С., Кайсё Т. и др. (Ноябрь 2002 г.). «Важная роль TIRAP в активации сигнального каскада, разделяемого TLR2 и TLR4». Природа. 420 (6913): 324–9. Bibcode:2002Натура.420..324л. Дои:10.1038 / природа01182. PMID 12447441.
- ^ Питер Фрич (2004). Dermatologie Venerologie: Grundlagen. Клиника. Атлас (на немецком). Берлин: Springer. ISBN 3-540-00332-0.
- ^ Rodell CB, Arlauckas SP, Cuccarese MF, Garris CS, Li R, Ahmed MS и др. (Август 2018 г.). «Наночастицы, нагруженные агонистами TLR7 / 8, способствуют поляризации связанных с опухолью макрофагов для усиления иммунотерапии рака». Природа Биомедицинская инженерия. 2 (8): 578–588. Дои:10.1038 / s41551-018-0236-8. PMID 31015631.
- ^ Тусси Д. Н., Массари П. (апрель 2014 г.). «Иммунный адъювантный эффект лигандов толл-подобных рецепторов, определенных на молекулярном уровне». Вакцина. 2 (2): 323–53. Дои:10.3390 / вакцины2020323. ЧВК 4494261. PMID 26344622.
- ^ http://ibic.lib.ku.ac.th/e-bulletin/IBBU201703005.pdf
- ^ Хашимото С., Хадсон К.Л., Андерсон К.В. (январь 1988 г.). «Ген Toll Drosophila, необходимый для дорсально-вентральной эмбриональной полярности, по-видимому, кодирует трансмембранный белок». Клетка. 52 (2): 269–79. Дои:10.1016/0092-8674(88)90516-8. PMID 2449285.
- ^ Номура Н., Миядзима Н., Сазука Т., Танака А., Каварабаяси Ю., Сато С. и др. (1994). «Прогнозирование кодирующих последовательностей неидентифицированных генов человека. I. Кодирующие последовательности 40 новых генов (KIAA0001-KIAA0040), выведенные путем анализа случайно выбранных клонов кДНК из незрелых миелоидных клеток человека линии KG-1». ДНК исследования. 1 (1): 27–35. Дои:10.1093 / dnares / 1.1.27. PMID 7584026.
- ^ Тагучи Т., Митчем Дж. Л., Дауэр С. К., Симс Дж. Э., Теста Дж. Р. (март 1996 г.). «Хромосомная локализация TIL, гена, кодирующего белок, связанный с трансмембранным рецептором Toll дрозофилы, в хромосоме 4p14 человека». Геномика. 32 (3): 486–8. Дои:10.1006 / geno.1996.0150. PMID 8838819.
- ^ Гей Нью-Джерси, Кейт Ф.Дж. (май 1991 г.). «Toll и рецептор IL-1 дрозофилы». Природа. 351 (6325): 355–6. Bibcode:1991Натура.351..355Г. Дои:10.1038 / 351355b0. PMID 1851964.
- ^ Полторак А., Хе Икс, Смирнова И., Лю М.Ю., Ван Хаффель С., Ду Х и др. (Декабрь 1998 г.). «Нарушение передачи сигналов LPS у мышей C3H / HeJ и C57BL / 10ScCr: мутации в гене Tlr4». Наука. 282 (5396): 2085–8. Bibcode:1998Научный ... 282.2085П. Дои:10.1126 / science.282.5396.2085. PMID 9851930.
- ^ Хосино К., Такеучи О, Каваи Т., Санджо Х., Огава Т., Такеда Ю. и др. (Апрель 1999 г.). «Передний край: мыши с дефицитом Toll-подобного рецептора 4 (TLR4) гипореактивны к липополисахариду: данные о TLR4 как продукте гена Lps». Журнал иммунологии. 162 (7): 3749–52. PMID 10201887.
- ^ Song WY, Wang GL, Chen LL, Kim HS, Pi LY, Holsten T. и др. (Декабрь 1995 г.). «Рецепторный киназоподобный белок, кодируемый геном устойчивости к болезням риса, Xa21». Наука. 270 (5243): 1804–6. Bibcode:1995Научный ... 270.1804S. Дои:10.1126 / science.270.5243.1804. PMID 8525370.
- ^ Гомес-Гомес Л., Боллер Т. (июнь 2000 г.). «FLS2: киназа, подобная рецептору LRR, участвующая в восприятии бактериального элиситора флагеллина у Arabidopsis». Молекулярная клетка. 5 (6): 1003–11. Дои:10.1016 / S1097-2765 (00) 80265-8. PMID 10911994.
- ^ «Нобелевская премия по физиологии и медицине 2011 г.». Nobel Media AB. 3 октября 2011 г.
- ^ Митчелл Б. (23 марта 2011 г.). «Доктор Британской Колумбии получил престижную медицинскую премию». Звезда.
Смотрите также
внешняя ссылка
- Toll-Like + рецепторы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Толл + белок, + дрозофила в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- TollML: база данных Toll-подобных рецепторов и лигандов в Мюнхенский университет
- Семейство Toll-Like рецепторов врожденных иммунных рецепторов (pdf)
- Путь толл-подобных рецепторов
- [1]
