Каспаза 1 - Caspase 1 - Wikipedia

Каспаза-1/ Фермент, превращающий интерлейкин-1 (ICE), является эволюционно консервативным фермент который протеолитически расщепляет другие белки, такие как предшественники воспалительного цитокины интерлейкин 1β и интерлейкин 18 так же хорошо как пироптоз индуктор Гасдермин Д, в активные зрелые пептиды.[5][6][7] Он играет центральную роль в клеточном иммунитете как инициатор воспалительного ответа. После активации через формирование воспаление комплекса, он инициирует провоспалительную реакцию через расщепление и, таким образом, активацию двух воспалительных цитокины, интерлейкин 1β (IL-1β) и интерлейкин 18 (Ил-18), а также пироптоз, программный литический смерть клетки Путь через расщепление Гасдермина D. Два воспалительных цитокина, активируемых каспазой-1, выводятся из клетки, чтобы дополнительно индуцировать воспалительный ответ в соседних клетках.[8]
Клеточная экспрессия
Каспаза-1 эволюционно консервативна во многих эукариоты из Королевство Animalia. Благодаря своей роли в воспалительном иммунном ответе, он сильно выражается в иммунных органах, таких как печень, почка, селезенка, и кровь (нейтрофилы ).[9][10] После инфекции воспалительная реакция увеличивает экспрессию каспазы-1 за счет положительный отзыв механизм, усиливающий реакцию.[10]
Структура
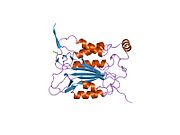
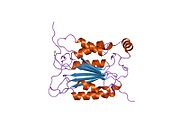
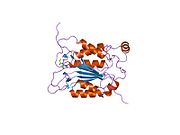
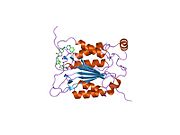
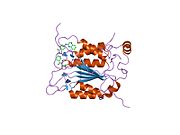
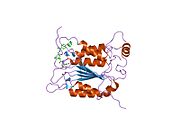
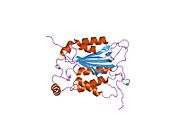
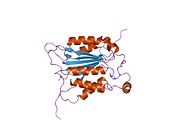
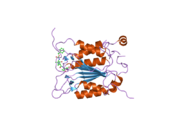
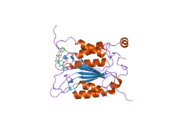
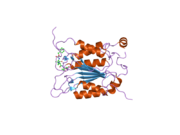
Каспаза-1 продуцируется как зимоген которые затем могут быть расщеплены на субъединицы 20 кДа (p20) и 10 кДа (p10), которые становятся частью активного фермента. Активная каспаза 1 содержит два гетеродимеры из p20 и p10. Он содержит каталитический домен с активным сайтом, который охватывает субъединицы p20 и p10,[11] а также некаталитический домен активации и рекрутирования каспаз (КАРТА ). Он взаимодействует с другими КАРТА содержащие белки, такие как связанный с апоптозом спек-подобный белок, содержащий CARD (ASC ) и узелковидный рецептор (NLR ) Семейство CARD Домен-содержащий белок 4 (NLRC4 ) через взаимодействия CARD-CARD в образовании инфламмасом.[7][12]
Регулирование


Активация

Каспаза-1, обычно в своей физиологически неактивной зимогенной форме, автоматически активируется, когда собирается в нитчатую воспаление комплекс путем автопротеолиза на субъединицы p10 и p20.[13][14] Инфламмасомный комплекс представляет собой кольцевой комплекс, состоящий из тримеров сигнального специфического сенсорного белка, такого как белки NLR семейство и рецепторы, подобные AIM-1 (отсутствующие в меланоме), адаптерный белок, такой как ASC, и каспаза, в данном случае каспаза-1. В некоторых случаях, когда сигнальные белки содержат свои собственные CARD, как в NLRP1 и NLRC4, взаимодействие CARD –CARD является прямым, что означает, что в комплексе нет адапторного белка. Существует множество сенсорных и адапторных белков, различные комбинации которых обеспечивают ответ инфламмасом на определенные сигналы. Это позволяет клетке иметь различную степень воспалительной реакции в зависимости от тяжести полученного сигнала опасности.[15][16]
Торможение
CARD only белки (COP), как следует из их названия, являются белками, которые содержат только некаталитические CARD. Из-за важности взаимодействий CARD-CARD в образовании инфламмасом многие COP являются известными ингибиторами активации каспаз. Для Caspase-1 гены конкретных COPs - ICEBERG, COP1 (ICE / Pseudo-ICE) и INCA (Inhibitory Card) - все обнаруживаются рядом с его локусом, и, таким образом, считается, что они возникли в результате событий дупликации генов и последующих делеций каталитические домены. Хотя все они взаимодействуют с инфламмасомами, используя взаимодействия КАРТА – КАРТА, они различаются по способу выполнения своих ингибирующих функций, а также по своей эффективности при этом.[14][17][18]
Например, ICEBERG инициирует образование филаментов каспазы-1 и, таким образом, включается в филаменты, но не обладает способностью ингибировать активацию инфламмасом. Вместо этого считается, что он ингибирует активацию каспазы-1, препятствуя взаимодействию каспазы-1 с другими важными белками, содержащими CARD.[14][17][18]
INCA, с другой стороны, напрямую блокирует сборку инфламмасом, закрывая карту Caspase-1. олигомеры, тем самым блокируя дальнейшую полимеризацию в филаментах воспаления.[17][18][19][12]
Точно так же известно, что некоторые СОЗ (белки, содержащие только пирин) регулируют активацию каспазы-1 за счет ингибирования активации инфламмасом путем связывания и блокирования взаимодействий с PYD, которые также играют роль в образовании инфламмасом, хотя точные механизмы еще не установлены. хорошо установлено.[18][20]
- Ингибиторы
- Belnacasan (VX-765) [21]
- Пралнакасан (VX-740) [22]
Функция
Протеолитическое расщепление
Активированная каспаза 1 протеолитически расщепляет про IL-1β и про IL-18 до их активных форм, IL-1β и IL-18. Активные цитокины вызывают последующий воспалительный ответ. Он также расщепляет Гастермин D до его активной формы, что приводит к пироптозу.[12]
Воспалительная реакция
После созревания цитокины инициируют нижестоящие сигнальные события, чтобы вызвать провоспалительный ответ, а также активировать выражение противовирусное средство гены. Скорость, специфичность и типы ответа зависят от полученного сигнала, а также от сенсорного белка, который его получил. Сигналы, которые могут быть получены инфламмасомами, включают: вирусная двухцепочечная РНК, мочевина, свободные радикалы и другие сигналы, связанные с опасностью для клеток, даже побочные продукты других путей иммунного ответа.[23]
Сами зрелые цитокины не содержат необходимых сортировочных последовательностей для попадания в Секреторный путь ER-Golgi, и, таким образом, не выводятся из клетки обычными методами. Однако предполагается, что выпуск этих провоспалительные цитокины не зависит от клеточного разрыва через пироптоз, и фактически является активным процессом. Существуют доказательства как за, так и против этой гипотезы. Тот факт, что для многих типов клеток цитокины секретируются, несмотря на то, что у них нет абсолютно никаких признаков пироптоза, подтверждает эту гипотезу.[16][24] Однако некоторые эксперименты показывают, что нефункциональные мутанты Gasdermin D все еще имели нормальное расщепление цитокинов, но не обладали способностью их секретировать, что указывает на то, что пироптоз действительно может быть необходим для секреции каким-либо образом.[25]
Реакция пироптоза
После воспалительного ответа активированная каспаза-1 может вызывать пироптоз, литическую форму гибели клеток, в зависимости от полученного сигнала, а также от специфического белка сенсорного домена инфламмасомы, который его получил. Хотя пироптоз может потребоваться, а может и не потребоваться для полного воспалительного ответа, воспалительный ответ полностью необходим до того, как может возникнуть пироптоз.[16] Чтобы вызвать пироптоз, каспаза-1 расщепляет газдермин D, который либо напрямую, либо через какой-либо сигнальный каскад приводит к пироптозу. Точный механизм неизвестен.[16]
Другие роли
Также было показано, что каспаза-1 вызывает некроз а также может функционировать на различных стадиях развития. Исследования аналогичного белка на мышах предполагают роль в патогенезе болезнь Хантингтона. Альтернативная сварка гена приводит к пяти вариантам транскрипта, кодирующим различные изоформы.[26] Недавние исследования показали, что каспаза-1 способствует смерти и воспалению CD4-лимфоцитов, вызываемых ВИЧ, - двум характерным событиям, которые способствуют прогрессированию ВИЧ-инфекции в СПИД.[27][28] Активность каспазы-1 также участвует в закислении лизосом после фагоцитоза бактерий.[29] и иммунные комплексы.[30]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000137752 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000025888 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Торнберри Н.А., Булл Х.Г., Калайчай Дж. Р., Чепмен К. Т., Ховард А. Д., Костура М. Дж., Миллер Д. К., Молино С. М., Вейднер Дж. Р., Онинс Дж. (Апрель 1992 г.). «Для процессинга бета интерлейкина-1 в моноцитах требуется новая гетеродимерная цистеиновая протеаза». Природа. 356 (6372): 768–74. Дои:10.1038 / 356768a0. PMID 1574116. S2CID 4310923.
- ^ Черретти Д.П., Козлоски С.Дж., Мосли Б., Нельсон Н., Ван Несс К., Гринстрит Т.А., Марч С.Дж., Кронхейм С.Р., Драк Т., Канниццаро, Лос-Анджелес (апрель 1992 г.). «Молекулярное клонирование фермента, превращающего бета интерлейкин-1». Наука. 256 (5053): 97–100. Дои:10.1126 / science.1373520. PMID 1373520.
- ^ а б Mariathasan S, Newton K, Monack DM, Vucic D, French DM, Lee WP, Roose-Girma M, Erickson S, Dixit VM (июль 2004 г.). «Дифференциальная активация инфламмасомы адаптерами каспазы-1 ASC и Ipaf». Природа. 430 (6996): 213–8. Дои:10.1038 / природа02664. PMID 15190255. S2CID 4317409.
- ^ Йоргенсен И., Мяо Э.А. (май 2015 г.). «Пироптозная гибель клеток защищает от внутриклеточных патогенов». Иммунологические обзоры. 265 (1): 130–42. Дои:10.1111 / imr.12287. ЧВК 4400865. PMID 25879289.
- ^ Бакеле М., Джоос М., Бурди С., Алльгайер Н., Пешель С., Ференбахер Б., Шаллер М., Маркос В., Кюммерле-Дешнер Дж., Рибер Н., Боррегаард Н., Язди А., Гектор А., Хартл Д. (февраль 2014 г.). «Локализация и функциональность инфламмасомы в нейтрофилах». Журнал биологической химии. 289 (8): 5320–9. Дои:10.1074 / jbc.M113.505636. ЧВК 3931087. PMID 24398679.
- ^ а б Кумаресан В., Равичандран Г., Низам Ф., Даянити Н.Б., Арасу М.В., Аль-Даби Н.А., Харикришнан Р., Арокиарадж Дж. (Февраль 2016 г.). «Многофункциональная каспаза рябины 1, 2, 3, 8 и 9: сохранение, уникальность и патоген-индуцированный паттерн экспрессии». Иммунология рыб и моллюсков. 49: 493–504. Дои:10.1016 / j.fsi.2016.01.008. PMID 26777895.
- ^ Уилсон К.П., Блэк Дж. А., Томсон Дж. А., Ким Е. Е., Гриффит Дж. П., Навиа М. А., Мурко М. А., Чемберс С. П., Алдапе Р. А., Рейбак С. А. (июль 1994 г.). «Структура и механизм бета-превращающего фермента интерлейкин-1». Природа. 370 (6487): 270–5. Дои:10.1038 / 370270a0. PMID 8035875. S2CID 4281700.
- ^ а б c Лу А, Ли И, Шмидт Ф.И., Инь Кью, Чен С., Фу ТМ, Тонг А.Б., Плоег Х.Л., Мао Й., Ву Х. (май 2016 г.). «Молекулярные основы полимеризации каспазы-1 и ее ингибирование новым кэппинговым механизмом». Структурная и молекулярная биология природы. 23 (5): 416–25. Дои:10.1038 / nsmb.3199. ЧВК 4856535. PMID 27043298.
- ^ Эллиотт Дж. М., Руж Л., Висманн С., Шеер Дж. М. (март 2009 г.). «Кристаллическая структура домена зимогена прокаспазы-1 раскрывает понимание воспалительной аутоактивации каспазы». Журнал биологической химии. 284 (10): 6546–53. Дои:10.1074 / jbc.M806121200. ЧВК 2649088. PMID 19117953.
- ^ а б c Хамке Э. У., Шрайвер С. К., Старовасник М. А., Фэйрбротер В. Дж., Диксит В. М. (2000). «ICEBERG: новый ингибитор поколения интерлейкина-1бета». Клетка. 103 (1): 99–111. Дои:10.1016 / S0092-8674 (00) 00108-2. PMID 11051551. S2CID 15886378.
- ^ Самарани С., Аллам О, Сагала П., Алдаба З., Дженабиан М.А., Мехрадж В., Тремблей С., Роути Дж. П., Амре Д., Ахмад А. (июнь 2016 г.). «Несбалансированное производство IL-18 и его антагониста при заболеваниях человека и его последствия для инфекции ВИЧ-1». Цитокин. Цитокины при воспалении, старении, раке и ожирении. 82: 38–51. Дои:10.1016 / j.cyto.2016.01.006. PMID 26898120.
- ^ а б c d Винс Дж. Э., Силке Дж. (2016). «Пересечение гибели клеток и активации инфламмасом». Клеточные и молекулярные науки о жизни. 73 (11–12): 2349–67. Дои:10.1007 / s00018-016-2205-2. PMID 27066895. S2CID 16281016.
- ^ а б c Druilhe A, Srinivasula SM, Razmara M, Ahmad M, Alnemri ES (июнь 2001 г.). «Регулирование генерации IL-1beta с помощью Pseudo-ICE и ICEBERG, двух доминантных белков домена рекрутирования отрицательных каспаз». Гибель клеток и дифференциация. 8 (6): 649–57. Дои:10.1038 / sj.cdd.4400881. PMID 11536016.
- ^ а б c d Ле HT, Хартон Дж. А. (01.01.2013). "Белки, содержащие только пирин и CARD, как регуляторы функций NLR". Границы иммунологии. 4: 275. Дои:10.3389 / fimmu.2013.00275. ЧВК 3775265. PMID 24062743.
- ^ Ламканфи М., Денекер Дж., Калаи М., Д'ондт К., Миус А., Деклерк В., Селенс Х, Ванденабеле П. (декабрь 2004 г.). «INCA, новый белок домена рекрутирования каспаз человека, который ингибирует образование интерлейкина-1бета». Журнал биологической химии. 279 (50): 51729–38. Дои:10.1074 / jbc.M407891200. PMID 15383541.
- ^ Dorfleutner A, Talbott SJ, Bryan NB, Funya KN, Rellick SL, Reed JC, Shi X, Rojanasakul Y, Flynn DC, Stehlik C (декабрь 2007 г.). «Белок PYRIN-only вируса фибромы Shope модулирует иммунный ответ хозяина». Гены вирусов. 35 (3): 685–94. Дои:10.1007 / s11262-007-0141-9. ЧВК 4257706. PMID 17676277.
- ^ Флорес Дж., Ноэль А., Фово Б., Линхэм Дж., Лекрук С., Леблан А.С. (сентябрь 2018 г.). «Ингибирование каспазы-1 облегчает когнитивные нарушения и невропатологию на мышиной модели болезни Альцгеймера». Nat Commun. 9 (1): 3916. Дои:10.1038 / с41467-018-06449-х. ЧВК 6156230. PMID 30254377.
- ^ Боксер М.Б., Куинн А.М., Шен М., Джадхав А., Лейстер В., Симеонов А., Олд Д.С., Томас С.Дж. (май 2010 г.). «Высокоэффективный и селективный ингибитор каспазы 1, в котором используется ключевой фрагмент 3-цианопропановой кислоты». ChemMedChem. 5 (5): 730–8. Дои:10.1002 / cmdc.200900531. ЧВК 3062473. PMID 20229566.
- ^ Веццани А., Маросо М., Балоссо С., Санчес М.А., Бартфай Т. (октябрь 2011 г.). «Передача сигналов рецептора IL-1 / Toll-подобного рецептора при инфекции, воспалении, стрессе и нейродегенерации сочетает повышенную возбудимость и судороги». Мозг, поведение и иммунитет. 25 (7): 1281–9. Дои:10.1016 / j.bbi.2011.03.018. PMID 21473909. S2CID 3383795.
- ^ Ainscough JS, Gerberick GF, Kimber I, Dearman RJ (декабрь 2015 г.). «Процессинг интерлейкина-1β зависит от опосредованного кальцием взаимодействия с кальмодулином». Журнал биологической химии. 290 (52): 31151–61. Дои:10.1074 / jbc.M115.680694. ЧВК 4692238. PMID 26559977.
- ^ He WT, Wan H, Hu L, Chen P, Wang X, Huang Z, Yang ZH, Zhong CQ, Han J (декабрь 2015 г.). «Гастермин D является возбудителем пироптоза и необходим для секреции интерлейкина-1β». Клеточные исследования. 25 (12): 1285–98. Дои:10.1038 / cr.2015.139. ЧВК 4670995. PMID 26611636.
- ^ «Ген Entrez: каспаза 1 CASP1, связанная с апоптозом цистеинпептидаза (интерлейкин 1, бета, конвертаза)».
- ^ Дойч Г., Галлоуэй Н.Л., Гэн Х, Ян З., Монро К.М., Зепеда О., Хант П.В., Хатано Х., Совински С., Муньос-Ариас I, Грин В.К. (январь 2014 г.). «Гибель клеток в результате пироптоза приводит к истощению Т-лимфоцитов CD4 при инфекции ВИЧ-1». Природа. 505 (7484): 509–14. Дои:10.1038 / природа12940. ЧВК 4047036. PMID 24356306.
- ^ Монро К.М., Ян З., Джонсон-младший, Гэн Х, Дойш Дж., Кроган Нью-Джерси, Грин WC (январь 2014 г.). «Датчик ДНК IFI16 необходим для гибели лимфоидных CD4 T-клеток, абортивно инфицированных ВИЧ». Наука. 343 (6169): 428–32. Дои:10.1126 / science.1243640. ЧВК 3976200. PMID 24356113.
- ^ Соколовска А., Беккер С.Е., ИП В.К., Ратинам В.А., Бруднер М., Пакетт Н., Танне А., Ваная С.К., Мур К.Дж., Фицджеральд К.А., Лейси-Халберт А., Стюарт Л.М. (июнь 2013 г.). «Активация каспазы-1 инфламмасомой NLRP3 регулирует NADPH-оксидазу NOX2, чтобы контролировать функцию фагосом». Иммунология природы. 14 (6): 543–53. Дои:10.1038 / ni.2595. ЧВК 3708594. PMID 23644505.
- ^ Монтейт А.Дж., Винсент Х.А., Кан С., Ли П., Клэйборн Т.М., Райфур З., Якобсон К., Мурман Н.Дж., Вилен Б.Дж. (июль 2018 г.). «Активность mTORC2 нарушает подкисление лизосом при системной красной волчанке, нарушая расщепление Rab39a каспазой-1». Журнал иммунологии. 201 (2): 371–382. Дои:10.4049 / jimmunol.1701712. ЧВК 6039264. PMID 29866702.