Арбускулярная микориза - Arbuscular mycorrhiza


An арбускулярная микориза (множественное число микориза, a.k.a. эндомикориза) является разновидностью микориза в которой симбионт грибок (AM грибы, или AMF) проникает корковые клетки из корни из сосудистое растение формирование арбускулы. (Не путать с эктомикориза или же эрикоидная микориза.)
Для арбускулярной микоризы характерно образование уникальных структур, арбускул и пузырьки грибами типа Гломеромикота. AM-грибы помогают растениям улавливать питательные вещества Такие как фосфор, сера, азот и микроэлементы из почвы. Считается, что развитие арбускулярного микоризного симбиоза сыграло решающую роль в первоначальном заселении земли растениями и в эволюции сосудистых растений.[1] Было сказано, что быстрее перечислить растения, не образующие эндомикоризы, чем те, которые это делают.[2] Этот симбиоз - это высокоразвитые взаимоотношения между грибами и растениями, наиболее распространенный из известных симбиозов растений,[3] и AMF обнаруживается в 80% сосудистое растение семьи, существующие сегодня.[4]
Огромные успехи в исследованиях микоризного физиология и экология за последние 40 лет[когда? ] привели к лучшему пониманию множества ролей AMF в экосистеме. Примером может служить важный вклад клеевидного белка. гломалин к структуре почвы (см. ниже). Это знание применимо к человеческим усилиям управление экосистемой, восстановление экосистемы, и сельское хозяйство.
Эволюция микоризного симбиоза
Палеобиология
Обе палеобиологический и молекулярные данные указывают на то, что AM - это древний симбиоз, возникший по крайней мере 460 миллионов лет назад. Симбиоз AM распространен среди наземных растений, что позволяет предположить, что микоризы присутствовали у ранних предков современных наземных растений. Эта положительная связь с растениями, возможно, способствовала развитию наземных растений.[3]
В Рини черт нижнего Девонский дал окаменелости самых ранних наземных растений, в которых наблюдались грибы AM.[6] Окаменелые растения, содержащие микоризные грибы, сохраняли в кремнеземе.
В Ранний девон увидел развитие наземной флоры. В растениях кремня Rhynie из нижнего девона (400 млн лет назад) обнаружены структуры, напоминающие везикулы и споры современных растений. Гломус разновидность. Колонизированные ископаемые корни наблюдались в Аглаофитон крупный и Риния, которые являются древними растениями, обладающими характеристиками сосудистых растений и мохообразные с примитивным протостелический корневища.[6]
Внутрирадикальный мицелий наблюдались во внутриклеточных пространствах корней, а арбускулы - в слое тонкостенных клеток, похожих на палисад паренхима. Ископаемые арбускулы очень похожи на таковые из существующих AMF.[6] Клетки, содержащие арбускулы, имеют утолщенные стенки, что также наблюдается у сохранившихся колонизированных клеток.
Микоризы из Миоцен имеют везикулярную морфологию, очень напоминающую современную Гломералы. Эта консервативная морфология может отражать доступность питательных веществ, обеспечиваемых растениями-хозяевами как в современном, так и в миоценовом мутуализме.[7] Однако можно утверждать, что эффективность сигнальных процессов, вероятно, увеличилась с миоцена, и это не может быть обнаружено в летописи окаменелостей. Точная настройка сигнальных процессов улучшит координацию и обмен питательными веществами между симбионты увеличивая приспособленность как грибов, так и растений-симбионтов.
Спорный характер взаимоотношений растений и предков арбускулярных микоризных грибов. Две гипотезы:
- Микоризный симбиоз произошел от паразитический взаимодействие, переросшее во взаимовыгодные отношения.
- Микоризные грибы развились из сапробный грибки, ставшие эндосимбиотическими.[6]
И сапротрофы, и биотрофы были обнаружены в Райни Черте, но существует мало доказательств, подтверждающих любую гипотезу.
Есть некоторые ископаемые свидетельства, которые позволяют предположить, что паразитические грибы не убивали клетки-хозяева сразу после инвазии, хотя в клетках-хозяевах наблюдалась реакция на инвазию. Этот ответ мог развиться в химические сигнальные процессы, необходимые для симбиоза.[6]
В обоих случаях считается, что симбиотическое взаимодействие растения и грибов развилось из отношений, в которых грибы брали питательные вещества из растения, в симбиотические отношения, при которых растение и грибы обмениваются питательными веществами.
Молекулярные доказательства
Повышенный интерес к микоризному симбиозу и разработка сложных молекулярных методов привели к быстрому развитию генетических доказательств. Ван и другие. (2010) исследовали гены растений, участвующие в коммуникации с порядком. Glomales грибковые партнеры (DMI1, DMI3, IPD3).[8][9] Эти три гена можно секвенировать из всех основных клад современных наземных растений, включая печеночники, самая базальная группа, и филогения трех генов согласуются с нынешней филогенезом наземных растений. Это означает, что гены микориз должны присутствовать у общего предка наземных растений, и что они должны были наследоваться вертикально с тех пор, как растения колонизировали землю.[8]
Симбиоз AM грибов и цианобактерий?
Было обнаружено, что AM-грибы обладают основным ферментом бактериального типа (рибонуклеазой III) механизма процессинга мРНК, возможно, связанным с симбиозом, в результате горизонтальный перенос генов от предка цианобактерий.[10] Это открытие генетических окаменелостей внутри AM-грибов поднимает гипотезу о тесной связи между AM-грибами и предками цианобактерий. В то же время ранее сообщалось о симбиозе Геосифон-Носток.[11]
Эволюция циркадных часов у AM грибов?
Удивительно, но, несмотря на долгую эволюцию в качестве подземного партнера корня растения, окружающая среда которого далека от света или колебаний температуры, AMF все еще сохраняют циркадные часы с активацией циркадного осциллятора грибов (frq) синим светом, аналогично случаю модельного циркадного гриба Neurospora crassa.[12] Доказано сохранение циркадных часов и генов продукции у R. irregulare открывает дверь к изучению циркадных часов у грибкового партнера симбиоза AM. Охарактеризованный AMF frq ген по тому же исследованию [12] это первый frq ген идентифицировал внешнюю группу Дикари, что предполагает frq эволюция генов в царстве грибов намного старше, чем исследовалось ранее.
Физиология
Пресимбиоз
Развитие AM-грибов до корневой колонизации, известное как пресимбиоз, состоит из трех стадий: прорастание спор, рост гиф, распознавание хозяина и аппрессориум формирование.
Прорастание спор
Споры AM-грибов представляют собой толстостенные, многоядерные покоящиеся структуры.[14] Прорастание спор не зависит от растения, поскольку споры прорастали в экспериментальных условиях при отсутствии растений и in vitro и в почве. Однако скорость прорастания может быть увеличена за счет корня хозяина. экссудаты.[15] Споры AM грибов прорастают при подходящих условиях почвенной матрицы, температуры, концентрации углекислого газа, pH и концентрации фосфора.[14]
Рост гиф
Рост AM гифы через почву контролируется экссудатом корня хозяина, известным как стриголактоны и концентрация фосфора в почве.[16]Низкие концентрации фосфора в почве увеличивают рост и ветвление гиф, а также вызывают выделение растениями соединений, контролирующих интенсивность ветвления гиф.[15][17]
Ветвление грибковых гиф AM, выращенных в фосфорной среде с концентрацией 1 мМ, значительно снижается, но не влияет на длину зародышевой трубки и общий рост гиф. Фосфор в концентрации 10 мМ подавлял как рост гиф, так и ветвление. Эта концентрация фосфора наблюдается в естественных почвенных условиях и, таким образом, может способствовать уменьшению микоризной колонизации.[17]
Признание хозяина
Было показано, что корневые экссудаты от растений-хозяев AMF, выращенных в жидкой среде с фосфором и без него, влияют на рост гиф. Споры Gigaspora margarita были выращены в экссудатах растений-хозяев. Гифы грибов, выращенных в экссудатах из корней, лишенных фосфора, росли больше и давали третичные ответвления по сравнению с грибами, выращенными в экссудатах из растений, получавших достаточное количество фосфора. Когда стимулирующие рост корневые экссудаты добавляли в низкой концентрации, AM-грибы образовывали разбросанные длинные ветви. По мере увеличения концентрации экссудатов у грибов образовывались более плотные ветви. При наибольшей концентрации арбускул образовывались АМФ-структуры фосфорного обмена.[17]
Считается, что этот хемотаксический ответ грибов на экссудаты растений-хозяев увеличивает эффективность колонизации корней хозяина в почвах с низким содержанием фосфора.[15] Это приспособление для грибов, позволяющее эффективно исследовать почву в поисках подходящего растения-хозяина.[17]
Еще одно свидетельство того, что арбускулярные микоризные грибы проявляют специфические для хозяина хемотаксис, которые обеспечивают рост гиф к корням потенциального растения-хозяина: Споры Glomus mosseae были отделены от корней растения-хозяина, растений-хозяев и мертвых растений-хозяев мембраной, проницаемой только для гиф. При обработке растением-хозяином грибы пересекали мембрану и всегда появлялись в пределах 800 мкм от корня, но не при обработке растениями-хозяевами и мертвыми растениями.[18]
Для понимания сигнальных путей между арбускулярной микоризой и корнями растений использовались молекулярные методы. В 2003 году было показано, как AM претерпевает физиологические изменения в присутствии экссудатов из корней потенциальных растений-хозяев, чтобы колонизировать их. Экссудаты корней растений-хозяев запускают и включают гены грибов AM, необходимые для дыхания углеродных соединений спор. В экспериментах скорость транскрипции 10 генов увеличивалась через полчаса после воздействия и с еще большей скоростью через 1 час. через 4 часа воздействия AM отвечает морфологическим ростом. Выделенные с того времени гены участвуют в митохондриальной активности и производстве ферментов. Частота дыхания грибов, измеренная O2 скорость потребления увеличилась на 30% через 3 часа после воздействия корневых экссудатов, что указывает на то, что экссудаты корней растений-хозяев стимулируют митохондриальную активность спор AMF. Это может быть частью механизма регуляции грибов, который сохраняет энергию спор для эффективного роста и ветвления гиф при получении сигналов от потенциального растения-хозяина.[19]
Аппрессориум
Когда гифы гриба арбускулярной микоризы встречаются с корнем растения-хозяина, аппрессориум или на корневом эпидермисе образуется «инфекционная структура». Из этой структуры гифы могут проникать в организм хозяина. паренхима кора.[20] AM не нужны химические сигналы от растений для образования аппрессорий. AM-грибы могли образовывать аппрессории на клеточных стенках «призрачных» клеток, в которых протопласт был удален, чтобы устранить передачу сигналов между грибами и растением-хозяином. Однако гифы не проникают дальше в клетки и не растут по направлению к коре корня, что указывает на то, что передача сигналов между симбионтами необходима для дальнейшего роста после формирования аппрессорий.[15]
Симбиоз
Попадая внутрь паренхимы, гриб образует сильно разветвленные структуры для обмена питательными веществами с растением, называемым арбускулы.[20] Это отличительные структуры арбускулярного микоризного гриба. Арбускулы - это места обмена фосфора, углерода, воды и других питательных веществ.[14] Есть две формы: Париж тип характеризуется ростом гифы из одной клетки в другую; и Арум тип характеризуется ростом гиф в пространстве между растительными клетками.[21] Выбор между Париж тип и Арум Тип в первую очередь определяется семейством растений-хозяев, хотя некоторые семейства или виды могут иметь любой из этих типов.[22][23]
Растение-хозяин контролирует пролиферацию межклеточных гиф и образование арбускул. Происходит деконденсация заводских хроматин, что указывает на повышенную транскрипцию растительного ДНК в клетках, содержащих арбускул.[20] Для размещения арбускул в клетке-хозяине растения требуются серьезные модификации. В вакуоли термоусадочная и прочая сотовая органеллы размножаться. Растительная клетка цитоскелет реорганизуется вокруг арбускул.
Есть два других типа гиф, которые происходят из колонизированного корня растения-хозяина. После колонизации короткоживущие гифы бегунов прорастают от корня растения в почву. Это гифы, которые поглощают фосфор и микроэлементы, которые передаются растению. Гифы грибов AM имеют высокое отношение поверхности к объему, что делает их абсорбционную способность выше, чем у корней растений.[24] Гифы AMF также более мелкие, чем корни, и могут проникать в поры почвы, недоступные для корней.[25] Четвертый тип гифов AMF растет из корней и колонизирует корни других растений-хозяев. Четыре типа гиф морфологически различны.[14]
Поглощение и обмен питательных веществ
AM грибки облигатные симбионты. Они ограничили сапробный способности и зависят от растения для их углеродного питания.[26] AM-грибы поглощают продукты фотосинтеза растения-хозяина как гексозы.
Перенос углерода от растения к грибам может происходить через арбускулы или внутрирадикальные гифы.[27] Вторичный синтез гексоз под действием АМ происходит во внутрирадикальном мицелий. Внутри мицелия гексоза превращается в трегалоза и гликоген. Трегалоза и гликоген представляют собой формы хранения углерода, которые могут быстро синтезироваться и расщепляться и могут буферизовать внутриклеточные концентрации сахара.[27] Внутрирадикальная гексоза переходит в окислительную пентозофосфатный путь, который производит пентоза для нуклеиновых кислот.
Липид биосинтез также происходит во внутрирадикальном мицелии. Затем липиды сохраняются или экспортируются в экстрарадикальные гифы, где они могут накапливаться или метаболизироваться. Распад липидов на гексозы, известные как глюконеогенез, встречается в экстрарадикальном мицелии.[27] Примерно 25% углерода, перемещенного от растения к грибам, хранится во внерадикальных гифах.[28] До 20% углерода растения-хозяина может передаваться AM-грибам.[27] Это свидетельствует о значительных вложениях основного растения в углеродные микоризная сеть и вклад в подземный резервуар органического углерода.
Увеличение поступления углерода в растения AM-грибам увеличивает поглощение и перенос фосфора от грибов к растению. [29] Точно так же поглощение и перенос фосфора снижается, когда фотосинтез поступление к грибам уменьшается. Виды AMF различаются по способности снабжать растение фосфором.[30] В некоторых случаях арбускулярные микоризы - плохие симбионты, производящие мало фосфора и потребляющие относительно большое количество углерода.[30]
Основное преимущество микоризы для растений связано с повышенным потреблением питательных веществ, особенно фосфора. Это может быть связано с увеличением площади поверхности, контактирующей с почвой, повышенным перемещением питательных веществ в микоризу, измененной корневой средой и увеличенным запасом.[25] Микориза может быть намного эффективнее, чем корни растений, поглощать фосфор. Фосфор перемещается к корню или через диффузию, а гифы сокращают расстояние, необходимое для диффузии, тем самым увеличивая поглощение. Скорость поступления фосфора в микоризу может быть в шесть раз выше, чем в корневых волосках.[25] В некоторых случаях роль поглощения фосфора может быть полностью взята на себя микоризной сетью, и весь фосфор растения может иметь гифальное происхождение.[30] Меньше известно о роли азотное питание в арбускулярной микоризной системе и его влияние на симбиоз и сообщество. Хотя в выяснении механизмов этого сложного взаимодействия были достигнуты значительные успехи, предстоит еще много исследований.
Микоризная активность увеличивает концентрацию фосфора, доступного в ризосфера. Микориза ниже корневой зоны pH путем избирательного поглощения NH4+ (аммоний -ions) и отпустив H+ ионы. Пониженный pH почвы увеличивает растворимость осадков фосфора. Гифа NH4+ поглощение также увеличивает азот поступают к растению, поскольку внутренние поверхности почвы поглощают аммоний и распределяют его путем диффузии.[28]
Экология
Биогеография
Арбускулярные микоризные грибы чаще всего встречаются в растениях, растущих на минеральных почвах, и имеют чрезвычайно важное значение для растений, растущих на субстратах с дефицитом питательных веществ, таких как вулканическая почва и среда песчаных дюн. Популяции AM-грибов больше всего в растительных сообществах с большим разнообразием, таких как тропические леса и пастбища умеренного климата, где есть много потенциальных растений-хозяев, и они могут воспользоваться своей способностью колонизировать широкий круг растений-хозяев.[31] В очень засушливых или богатых питательными веществами почвах наблюдается меньшая частота микоризной колонизации. Микоризы наблюдались у водные среды обитания; однако было показано, что заболоченные почвы снижают колонизацию некоторых видов.[31]Арбускулярные микоризные грибы встречаются у 80% видов растений. [32] и были обследованы на всех континентах, кроме Антарктиды.[33][34] Биогеография гломеромикота зависит от ограничения рассеивания,[35] факторы окружающей среды, такие как климат,[33] ряды почвы и pH почвы,[34] питательные вещества почвы [36] и растительное сообщество.[33][37] Хотя данные 2000 года свидетельствуют о том, что AM-грибы не являются специалистами по видам-хозяевам,[38] исследования 2002 г. показали, что по крайней мере некоторые таксоны грибов являются специалистами-хозяевами.[39]
Ответ на растительные сообщества
Специфичность, диапазон хозяев и степень колонизации микоризных грибов трудно анализировать в полевых условиях из-за сложности взаимодействий между грибами внутри корня и внутри системы. Нет четких доказательств того, что арбускулярные микоризные грибы проявляют специфичность к колонизации потенциальных видов растений-хозяев AM, как и грибковые. патогены для растений-хозяев.[31] Это может быть связано с противоположным давлением отбора.
В патогенных отношениях растение-хозяин извлекает выгоду из мутаций, предотвращающих колонизацию, тогда как в мутуалистических симбиотических отношениях растение выигрывает от мутации, которая допускает колонизацию AMF.[31] Однако виды растений различаются по степени и зависимости от колонизации определенными грибами AM, и некоторые растения могут быть факультативными. микотрофы, а другие могут быть облигатными микотрофами.[31] В последнее время микоризный статус был связан с распределением растений,[40] с облигатными микоризными растениями, занимающими более теплые и сухие места обитания, в то время как факультативные микоризные растения занимают более широкие ареалы.
Способность одних и тех же грибов AM колонизировать многие виды растений имеет экологические последствия. Под землей растения разных видов могут быть связаны в общую мицелиальную сеть.[31] Одно растение может обеспечивать фотосинтетический углерод для создания мицелиальной сети, которую другое растение другого вида может использовать для поглощения минералов. Это означает, что арбускулярные микоризы способны уравновешивать подземные внутри- и межвидовые взаимодействия растений.[31]
Поскольку грибы Glomeromycota живут внутри корней растений, они могут существенно влиять на них со стороны своего растения-хозяина и, в свою очередь, также влияют на сообщества растений. Растения могут выделять до 30% фотосинтетического углерода AM-грибам. [41] а взамен AM-грибы могут усваивать до 80% растительного фосфора и азота.[32] Разнообразие сообществ грибов AM положительно связано с разнообразием растений,[42] продуктивность растений[43] и травоядные.[44] На арбускулярные микоризные грибы могут влиять небольшие взаимодействия с местным растительным сообществом. Например, окружение растений вокруг основного растения может изменить грибковые сообщества AM.[45] как и порядок создания заводов на участках.[46]
AM грибки и инвазия растений
Во время вторжений видов растений сообщество грибов AM и их биомасса могут резко измениться. В большинстве случаев биомасса и разнообразие АМ грибов уменьшаются при инвазии.[47][48][49] Однако некоторые виды микотрофных растений могут фактически увеличивать разнообразие грибов AM во время инвазии.[50]
Микоризный статус инвазивных видов растений часто варьируется в зависимости от региона. Например, в Соединенном Королевстве и Центральной Европе недавно инвазивные растения чаще имеют облигоризонтальную микоризность, чем ожидалось,[40][51] в то время как инвазивные растения в Калифорнии оказались менее часто микоризными, чем ожидалось.[52]
Взаимодействие AM-грибов с другими растительными симбионтами
Все симбионты внутри растения-хозяина взаимодействуют, часто непредсказуемым образом. Мета-анализ 2010 года показал, что растения, колонизированные как AM-грибами, так и вертикально передающимися эндофитами, часто больше, чем растения, независимо колонизированные этими симбионтами.[53] Однако эта взаимосвязь зависит от контекста, поскольку AM-грибы могут взаимодействовать синергетически с грибными эндофитами, населяющими листья их растения-хозяина,[54][55] или антагонистично.[56][57][58] Подобные диапазоны взаимодействий могут иметь место между грибами AM и эктомикоризные грибы и темные перегородчатые эндофиты.[59]
Реакция на градиенты окружающей среды
Арбускулярные микоризные грибы различаются по многим экологические градиенты. Известно, что их устойчивость к замораживанию и сушке изменяется между таксонами грибов AM.[60] AM-грибы становятся менее распространенными и разнообразными при более высоких концентрациях питательных веществ и влаги в почве,[61] предположительно потому, что оба растения выделяют меньше углерода AM-грибам, а AM-грибы перераспределяют свои ресурсы на внутрирадикальные гифы в этих условиях окружающей среды.[62] В долгосрочной перспективе эти условия окружающей среды могут даже вызвать локальную адаптацию между растениями-хозяевами, грибами AM и местными концентрациями питательных веществ в почве.[63] Состав AM часто становится менее разнообразным на горных вершинах, чем на более низких высотах, что обусловлено составом видов растений.[64]
Было показано, что AM-грибы улучшают устойчивость растений к абиотическим факторам окружающей среды, таким как соленость. Они снимают солевой стресс и способствуют росту и продуктивности растений.[65]
Экология ризосферы
В ризосфера - почвенная зона в непосредственной близости от корневой системы.
Симбиоз арбускулярной микоризы влияет на сообщество и разнообразие других организмов в почве. Это можно увидеть прямо по выделению экссудатов или косвенно по изменению видов растений и типа и количества растительных экссудатов.[66]
Было показано, что разнообразие микоризы увеличивает видовое разнообразие растений по мере увеличения потенциального числа ассоциаций. Доминирующие арбускулярные микоризные грибы могут предотвращать вторжение немикоризных растений на сушу, где они установили симбиоз, и способствовать развитию своего микоризного хозяина.[67]
Недавние исследования показали, что AM-грибы выделяют неопознанный диффузионный фактор, известный как фактор myc, что активирует фактор клубеньков индуцибельный ген MtEnod11. Это тот же ген, который участвует в установлении симбиоза с фиксация азота, ризобиальные бактерии (Косута и другие. 2003 г.). Когда в почве присутствуют бактерии ризобий, колонизация микоризой увеличивается из-за увеличения концентрации химических сигналов, участвующих в установлении симбиоза (Xie и другие. 2003 г.). Молекулы, подобные факторам Nod, были выделены из AM-грибов и, как было показано, индуцируют MtEnod11, образование боковых корней и усиливают микоризацию.[68] Эффективная микоризная колонизация также может увеличить кивки и симбиотическая азотфиксация в микоризных бобовых.[28]
Степень колонизации арбускулярной микоризой и видов влияет на бактериальную популяцию в ризосфере.[69] Виды бактерий различаются по своей способности бороться за экссудаты из углеродных соединений. Изменение количества или состава корневых экссудатов и грибковых экссудатов вследствие существующей микоризной колонизации AM определяет разнообразие и численность бактериального сообщества в ризосфере.[66]
Влияние AM-грибов на рост корней и побегов растений также может иметь косвенное влияние на ризосферные бактерии. AMF вносит значительное количество углерода в ризосферу посредством роста и дегенерации сети гиф. Имеются также данные, позволяющие предположить, что AM-грибы могут играть важную роль в опосредовании специфического воздействия видов растений на бактериальный состав ризосферы.[66]
Гломеромикоты и глобальное изменение климата
Глобальное изменение климата влияет на сообщества грибов AM и взаимодействия между грибами AM и их растениями-хозяевами. Хотя общепризнано, что взаимодействия между организмами будут влиять на их реакцию на глобальное изменение климата, у нас все еще нет возможности предсказать результат этих взаимодействий в будущем климате.[70] В недавних метаанализах было обнаружено, что AM-грибы увеличивают биомассу растений в условиях засухи и уменьшают биомассу растений в исследованиях моделирования осаждения азота.[71][72] Было показано, что сами арбускулярные микоризные грибы увеличивают свою биомассу в ответ на повышенное содержание CO2 в атмосфере. [73]
Растения без арбускулярной микоризы
Члены семейства горчичных (Brassicaceae ), таких как капуста, цветная капуста, канола и крамбе, не устанавливайте арбускулярные микоризные грибы на их корнях.[74]
Молекулярно-генетический анализ грибов арбускулярной микориз
За последние десять лет произошел впечатляющий прогресс в области молекулярно-генетических технологий и инструментов. Эти достижения позволяют микробным и микоризным экологам задавать новые интересные вопросы об экологической и эволюционной роли арбускулярных микоризных (AM) грибов как индивидуумов, в сообществах и экосистемах. Генетический анализ AM-грибов был использован для изучения генетической структуры отдельных спор с использованием мультилокусного генотипирования,[75] Разнообразие грибов AM и адаптация в нескольких сообществах пастбищ,[76] вплоть до глобального исследования разнообразия грибов AM, которое значительно увеличило описанное молекулярное разнообразие внутри филума Glomeromycota.[77]
Все последние достижения в области молекулярной генетики явно позволяют анализировать микробные сообщества в гораздо более тонких и функциональных масштабах и потенциально с большей уверенностью, чем предыдущие методы. Классический метод идентификации грибков AM: извлечение спор из почвы и последующий морфологический анализ спор.[78] чревато осложняющими проблемами из-за различных стратегий и форм AM-грибов, например, отсутствие споруляции у определенных видов, сезонность, высокая некультурируемость, возможная неправильная идентификация (человеческая ошибка) и новые свидетельства наличия многоядерных спор[79] и высокая генетическая изменчивость внутри клональных видов AM.[80] Из-за этих различных проблем в прошлом исследователи, вероятно, неверно представляли истинный состав грибных сообществ AM, присутствующих в любой момент времени или в любом месте. Кроме того, следуя традиционным методам экстракции, культивирования и микроскопической идентификации, невозможно определить активные / функционирующие популяции AM-грибов, которые, вероятно, являются наиболее важными при попытке связать симбиотические взаимодействия и механизмы между растением и AM с экологической или экосистемной функцией. Это особенно верно в случае анализа колонизации корней, который может определить процент корней, колонизированных AM-грибами. Основная проблема с этим анализом связана с полевыми почвами, которые содержат несколько видов грибов AM в сочетании с целевым растением одновременно (см. Экология AM). Идентификация ассоциированных симбионтов грибов невозможна без использования молекулярных методов. Хотя генетический анализ сообществ грибов AM значительно продвинулся за последнее десятилетие, методология еще не полностью усовершенствована. Ниже приводится обзор методов, используемых в молекулярно-генетическом анализе AM-грибов, а также их приложения к исследованиям, будущие направления и некоторые их проблемы.
Обзор методов
ДНК / РНК
Генетические анализы грибов AM из образцов почвы и корней различаются по своей применимости для ответа на экологические или филогенетические вопросы. В анализах ДНК используются различные ядерные маркеры для описания AM-грибов и представлены различные области ядерного рибосомальный оперон (18S рРНК ) обнаружен во всех эукариотических организмах. Анализ ДНК грибов AM с использованием этих маркеров начался в начале 1990-х годов.[81] и продолжают развиваться сегодня. Ген рРНК малой субъединицы (SSU), внутренний транскрибируемый спейсер (ЭТО ) ген и ген рРНК большой субъединицы (LSU) в настоящее время являются наиболее распространенными ДНК-маркерами. Регион СумГУ чаще всего использовался в экологических исследованиях,[82] в то время как регионы ITS и LSU преимущественно использовались в таксономических конструкциях филума Glomeromycota.[83]
Общая процедура
Первый шаг всех молекулярно-генетических анализов - это подготовка и / или сохранение образца. В случае грибов AM образцы обычно поступают в виде почвы или корней, которые будут содержать споры AM, гифы и / или различные структуры колонизации AM. Сохранение образца будет зависеть от желаемого анализа (ДНК или РНК). Для анализа ДНК образцы должны быть обработаны немедленно или заморожены до экстракции нуклеиновой кислоты. Для анализа РНК образцы должны быть криогенно замороженный (-196 ° C) почти сразу после сбора или хранятся в реагенте для стабилизации и сохранения РНК (например, RNAlater). Следующим шагом является извлечение требуемых нуклеиновых кислот из образца, которое может быть выполнено вручную с использованием различных опубликованных методов экстракции или с помощью одного из многих коммерчески доступных наборов для экстракции ДНК / РНК. Из-за лабильного характера РНК синтез комплементарной ДНК (кДНК ) с использованием извлеченной РНК в качестве матрицы для дальнейшего анализа. Для большинства методов молекулярно-генетического секвенирования AM-грибов требуется стадия ПЦР для увеличения общего количества целевой ДНК / РНК / кДНК. Для анализа AM-грибов предлагается множество условий ПЦР, некоторые из наиболее доступных кратко описаны ниже.
Методы ПЦР
От Öpik et al. 2009 г.:[84]
- Реакционная смесь:
- 20 мкл Qiagen HotStarTaq Мастер-микс
- 0,23 мкМ каждого праймера (NS31 и AM1, подробнее о праймерах для грибков AM ниже)
- 2 мкл матричной ДНК
- ПЦР:
- Запуск на термоциклере MWG AG Biotech Primus 96 Plus
- 15 минут при 99 ° C
- 5 циклов по 30 секунд при 42 ° C
- 60 секунд при 72 ° C
- 45 секунд при 92 ° C
- 35 циклов по 30 секунд при 65 ° C
- 60 секунд при 72 ° C
- 45 секунд при 92 ° C
- 30 секунд при 65 ° C
- 10 минут при 72 ° C
- Затем продукты ПЦР разделены гель-электрофорез на 1,5% агарозном геле в 0,5 раза TBE
- Затем разделенные продукты ПЦР очищали с использованием набора для экстракции геля Qiagen QIAquick.
Из Krüger et al. 2009 г.:[85]
- Реакционная смесь:
- 0,02 Ед мкл−1 Фьюжн-полимераза
- 1X буфер Phusion с 1,5 мМ MgCl2
- 200 мкМ каждого dNTP
- 0,5 мкМ каждого праймера: SSUmAf-LSUmAr и SSUmCf-LSUmBr
- ПЦР:
- Термоциклирование выполнялось в Eppendorf Mastercycler Gradient.
- Начальная денатурация 5 минут при 99 ° C
- 40 циклов 10-секундной денатурации при 99 ° C
- 30 секунд отжиг при 60 ° C
- Удлинение за 1 минуту при 72 ° C
- 10-минутное окончательное удлинение
- Чтобы визуализировать продукт ПЦР, загрузите 1%агарозный гель с 1x натриево-боратным буфером при 220 В и окрашивать этидиум бромид (1 мкг мл−1)
Выбор праймера для грибов арбускулярной микориз
Одной из трудностей генетического анализа арбускулярных микоризных грибов является выбор идеальных, всеобъемлющих и повторяемых праймеров или наборов праймеров.[86] В настоящее время существует четыре общих специфичных для AM-грибов маркера / праймера, используемых в генетическом секвенировании для описания сообществ AM-грибов в образце, в идеале для идентификации на уровне видов. Эти маркеры последовательности разработаны для ядерной рибосомной РНК (рРНК) в области 18S и используются либо по отдельности, либо в некоторой комбинации.[87] Частичная малая субъединица (SSU), частичная большая субъединица (LSU) и внутренний транскрибируемый спейсер (ITS1, 5.8S, ITS2) являются областями, используемыми для генетического секвенирования AMF. Кроме того, существуют «наборы праймеров», которые включают комбинацию этих различных областей в один праймер-мишень для AMF, они включают «Krüger[85] "и" Редеккер[88]«Праймеры». Праймер «Крюгер» использует частичные SSU, ITS и частичные LSU области, в то время как праймер «Redecker» использует частичные SSU и ITS.
В настоящее время нет единого мнения о том, какие праймеры или наборы праймеров, используемые с разной степенью успеха, повторяемости и разрешения на уровне видов, лучше всего подходят для молекулярно-генетического анализа AMF. Кроме того, текущие достижения и предстоящие изменения в технологии генетического секвенирования, например Sanger, к 454 пиросеквенирование, к Иллюмина HiSeq / MiSeq может заставить исследователей использовать только определенные праймеры. Большой размер наборов праймеров «Krüger» (~ 1500 пар оснований) и «Redecker» (~ 900 пар оснований) запрещает использование с новой технологией секвенирования (например, Illumina MiSeq), в отличие от пиросеквенирования 454, способного выполнять такие длинные считывания. Хотя компания Roche Diagnostics объявила о прекращении выпуска платформы 454 в 2016 году,[89] он по-прежнему широко используется в генетическом анализе. Возможно, следует создать новые «всеохватывающие» специфические праймеры для AM для поддержки новых технологий для описательного молекулярного анализа из набора праймеров «Крюгера» с использованием пироанализа 454, как показано ниже. Обратное также может быть верным, когда молекулярные технологии должны разрабатываться как с большими длинами считывания (что позволило бы использовать большие наборы праймеров), так и с глубина секвенирования.
Kohout et al.[86] представить исследование с использованием всех вышеупомянутых праймеров / наборов праймеров на идентичных образцах растений с использованием анализа секвенирования 454. Ниже приведены результаты их эксперимента.
- Праймеры «Крюгера» показали относительно более высокие параметры разнообразия, чем другие сопоставимые праймеры (LSU, ITS2).
- Праймеры «Крюгера» показали значительно более высокие показатели разнообразия Шеннона, чем праймер SSU.
- Праймеры "Redecker" дали самый разный, но, возможно, наиболее описательный состав сообщества из всех протестированных праймеров. Это может быть объяснено способностью праймеров "Redecker" находить менее многочисленные линии AMF, такие как Claroideoglomeraceae или Paraglomeraceae.
- Праймеры LSU имели сильную предвзятость в отношении Glomeraceae, за исключением других семейств.
- Праймеры SSU имели смещение в сторону Glomeraceae и недооценивали присутствие различных семейств в пределах Glomeromycota, включая Claroideoglomeraceae, Diversisporaceae и Paraglomeraceae.
| Семья | MOTU из СумГУ | MOTU из LSU | MOTU из ITS2 | MOTU от "Крюгера" | MOTU от "Redecker" |
|---|---|---|---|---|---|
| Glomeraceae | 14 | 19 | 17 | 21 | 8 |
| Claroideoglomeraceae | 1 | 2 | 2 | 3 | 5 |
| Археоспоралес | 1 | 1 | 1 | 1 | 2 |
| Diversisporaceae | 1 | 0 | 2 | 3 | 2 |
| Paraglomeraceae | 0 | 0 | 0 | 0 | 2 |
| Acaulosproraceae | 0 | 0 | 1 | 1 | 1 |
MOTU = молекулярная операционная таксономическая единица, синоним OTU или филотипа.
qPCR и qRT-PCR
ПЦР в реальном времени или количественная ПЦР (qPCR), становится хорошо зарекомендовавшим себя методом быстрой амплификации и одновременного количественного определения ДНК грибов-мишеней AM из биологических образцов (корней растений или почвы). Сравнительно недавние разработки маркеров КПЦР позволяют исследователям исследовать относительную численность видов грибов AM в корнях в тепличных экспериментах, а также в полевых условиях для выявления местных сообществ грибов AM.
Маркеры количественной ПЦР для грибов арбускулярной микоризы будут состоять из праймеров, специфичных для AM, и флуоресцентно меченных зондов гидролиза. Эти специфические для AM праймеры (обсуждаемые выше) могут быть выбраны исследователем, и это решение обычно руководствуется поставленным вопросом, доступными ресурсами и готовностью устранять неполадки в лаборатории.
Микрочип
ДНК-микрочип Анализ в настоящее время используется в исследованиях грибков AM для одновременного измерения экспрессии многих генов целевых видов или экспериментальных образцов. Наиболее распространенным инструментом или методом является использование технологии функционального массива генов (FGA), специализированного микроматрицы, которая содержит зонды для генов, которые функционально важны в микробных процессах, таких как круговорот углерода, азота или фосфора. FGA могут одновременно исследовать множество функциональных генов.[90] Этот метод обычно используется для общего анализа функциональных микробных генов, но в сочетании с генетическим секвенированием можно сделать выводы о связи между составом грибкового сообщества и микробной функциональностью.
PLFA / NLFA
Конкретные химические сигнатуры организма можно использовать для обнаружения биомассы более загадочных организмов, таких как AM-грибы или почвенные бактерии. Липиды, в частности фосфолипиды и нейтральные липиды, содержат жирные кислоты, связанные с глицериновым остовом. Состав жирных кислот организмов варьируется, и пропорции конкретных жирных кислот могут быть специфичными для организма. Например, в грибах AM доля жирных кислот, 16: 1ω5 и 18: 1ω7, в фосфолипидной части составляет приблизительно 58% от общего состава жирных кислот.[91] Жирная кислота 16: 1ω5 является наиболее часто используемой кислотой для характеристики грибов AM в почвах и может использоваться в качестве надежного индикатора мицелиальной биомассы в образце почвы.[91]
Анализ нейтральных липидов и жирных кислот грибов AM обычно рассматривается как метод определения накопления энергии, но, что наиболее важно, соотношение NLFA (16: 1ω5) к PLFA (16: 1ω5) потенциально может использоваться для определения статуса питания AM грибы в почвах. Энергия в основном хранится в AM-грибах в виде нейтральных липидов в таких хранилищах, как споры и везикулы. Из-за этого NLFA довольно хорошо коррелирует с количеством спор в данном объеме почвы.[91] Отношение концентрации NLFA к концентрации PLFA (активный мицелий) может затем дать долю углерода, выделенного на структуры хранения (споры, измеряемые как NLFA).
Проблемы с анализами липидов и жирных кислот включают неполную специфичность жирных кислот к AM-грибам, видовые или родовые вариации в составе жирных кислот могут усложнить анализ в системах с несколькими видами AM-грибов (например, полевой почвой), высокие фоновые уровни определенная концентрация жирных кислот в почве и что фосфолипиды коррелируют с площадью мембраны организма, а соотношение поверхности к объему может широко варьироваться между такими организмами, как бактерии и грибы.[92] Необходимо провести дополнительную работу, чтобы определить эффективность этого метода в полевых почвах с множеством родов и видов грибов AM, чтобы выявить способность методов различать различные составы жирных кислот.
Будущие направления исследований AM грибов
Интересной перспективой для будущего анализа AM-грибов является использование зондов стабильных изотопов. Зондирование стабильных изотопов (ГЛОТОК ) - это метод, который можно использовать для определения активной метаболической функции отдельных таксонов в сложной системе микробов. Такой уровень специфичности, связывающий микробную функцию и филогенетику, ранее не был достигнут в микробной экологии. Этот метод также может использоваться независимо от классических методов культивирования в микробной экологии, что позволяет на месте анализ функциональных микробов. Применение секвенирования одного ядра из спор грибов AM также было разработано в последнее время, и оно также позволяет избежать использования методов культивирования.[93]
Зондирование стабильных изотопов (SIP)
SIP, более конкретно SIP на основе ДНК / РНК, использует субстраты, обогащенные стабильными изотопами, такие как 13C, 15N или H218O, а затем анализирует «меченые» маркеры с использованием видоспецифических маркеров ДНК или РНК.[94] Анализ меченой ДНК выполняется путем разделения немеченой и меченой ДНК в градиенте хлорида цезия, сформированном на ультрацентрифуге.[95] Поскольку все микробные организмы способны импортировать воду в свои клетки, использование H218Исследование стабильных изотопов - это очень интересный новый метод, который может пролить свет на вопросы, над которыми экологи-микробиологи и биологи боролись в течение многих лет, в частности, каковы активный микробные организмы в моей системе? H218Метод O, или тяжелая вода, воздействует на все активно растущие организмы и оказывает незначительное влияние на сам рост. Это особенно верно в отношении большинства тепличных экспериментов с арбускулярной микоризой, потому что растения все равно нужно поливать, а вода напрямую не влияет на организмы со специфическими метаболическими путями.[95] как это случилось бы при использовании 13C и15Н.
Немногое было сделано с этим методом в экспериментах с арбускулярной микоризой, но, если будет доказано, что он работает в контролируемом эксперименте и с дальнейшим усовершенствованием методов анализа ДНК / РНК грибкового сообщества, это может быть жизнеспособным вариантом для очень конкретного определения активно растущей части Виды грибов AM в разные сезоны вегетации, с разными растениями-хозяевами или обработками, а также в условиях изменения климата.
Механизм обработки sRNA и sRNA для понимания симбиоза AM
Сообщается, что мРНК играют решающую роль в перекрестном взаимодействии между хозяином и симбионтом.[96] Таким образом, механизм процессинга мРНК важен для понимания симбиоза AM. Похоже, что у AM-грибов есть свои уникальные особенности, заключающиеся в наличии основного фермента бактериального типа, а также в большом количестве белков Argonaute в их системе обработки мРНК (или системе РНКи).[10] Исследование механизмов процессинга мРНК и мРНК также является интересной темой для понимания симбиоза AM-грибов.
Фиторемедиация
Нарушение местных растительных сообществ в опустынивание - опасные зоны часто сопровождаются ухудшением физических и биологических свойств почвы, структуры почвы, доступности питательных веществ и органических веществ. При восстановлении нарушенных земель важно заменить не только наземную растительность, но также биологические и физические свойства почвы.[97]
Относительно новый подход к восстановлению земель - инокуляция почвы грибами AM при повторном внедрении растительности в проекты экологического восстановления (фиторемедиация). Это позволило растениям-хозяевам прижиться на деградированной почве и улучшить ее качество и здоровье.[98] Параметры качества почв были значительно улучшены в долгосрочной перспективе, когда была введена смесь местных видов арбускулярных микоризных грибов по сравнению с неинокулированной почвой и почвой, инокулированной одним экзотическим видом AM-грибов.[97] Преимущества заключались в увеличении роста растений, повышенном поглощении фосфора. [99] и содержание азота в почве, выше органическое вещество почвы содержание и агрегация почвы, приписываемые более высокой клубенке бобовых в присутствии грибов AM, лучшей инфильтрации воды и аэрации почвы из-за агрегации почвы.[97] Нативные штаммы грибов AM усиливают извлечение тяжелых металлов из загрязненных почв и делают почву здоровой и пригодной для выращивания сельскохозяйственных культур.[100]
сельское хозяйство
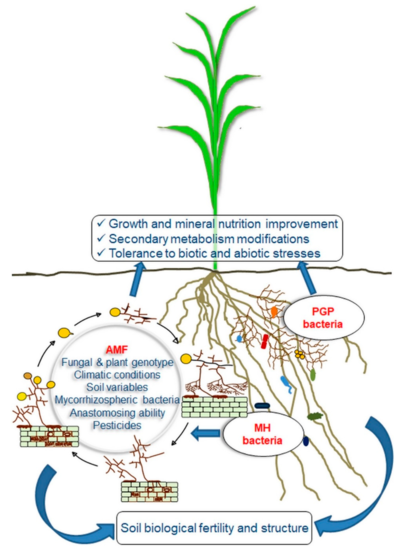
на продуктивность растений и плодородие почвы
Справа: микоризные помощники (MH) и бактерии, способствующие росту растений (PGP), синергетически взаимодействующие с AMF.[101]
Многие современные агрономические методы подрывают микоризный симбиоз. У низкозатратного сельского хозяйства есть большой потенциал для управления системой таким образом, чтобы способствовать микоризному симбиозу.
Обычные методы ведения сельского хозяйства, такие как обработка почвы, тяжелые удобрения и фунгициды, плохие севообороты и отбор растений, которые выживают в этих условиях, препятствуют способности растений формировать симбиоз с арбускулярными микоризными грибами.
Большинство сельскохозяйственных культур могут быть лучше и продуктивнее, если они хорошо заселены грибами AM. Симбиоз AM увеличивает поглощение фосфора и питательных микроэлементов и рост растения-хозяина (Джордж и другие. 1992).
Борьба с AM-грибами особенно важна для органических и низкозатратных сельскохозяйственных систем, где содержание фосфора в почве, как правило, низкое, хотя все агроэкосистемы может принести пользу, способствуя укоренению арбускулярной микоризы.
Некоторые культуры, которые плохо усваивают питательные вещества в почве, очень зависят от грибов AM в плане поглощения фосфора. Например, лен, который обладает плохой хемотаксической способностью, сильно зависит от AM-опосредованного поглощения фосфора при низких и средних концентрациях фосфора в почве (Thingstrup и другие. 1998).
Правильное управление AMF в агроэкосистемах может улучшить качество почвы и продуктивность земли. Такие методы ведения сельского хозяйства, как уменьшенная обработка почвы, низкое использование фосфорных удобрений и системы выращивания многолетних культур, способствуют функциональному микоризному симбиозу.
Обработка почвы
Обработка почвы снижает инокуляционный потенциал почвы и эффективность микориз за счет разрушения экстрарадикальной сети гиф (Miller и другие. 1995, МакГонигл и Миллер, 1999, Мозафар и другие. 2000).
Разбивая макроструктуру почвы, сеть гиф становится неинфекционной (Миллер и другие. 1995, МакГонигл и Миллер 1999). Нарушение сети гиф снижает абсорбционную способность микоризы, поскольку площадь поверхности, охватываемая гифами, значительно уменьшается. Это, в свою очередь, снижает поступление фосфора в растения, подключенные к сети гиф (рис. 3, McGonigle & Miller, 1999).
В системе уменьшенной обработки почвы может не потребоваться внесение тяжелых фосфорных удобрений по сравнению с системами обработки почвы. Это связано с увеличением микоризной сети, которая позволяет микоризе обеспечивать растение достаточным количеством фосфора (Miller и другие. 1995).
Фосфорное удобрение
Преимущества AMF наиболее заметны в системах с низкими затратами. Интенсивное использование фосфорных удобрений может подавить колонизацию и рост микоризы.
По мере того как уровень фосфора в почве, доступного для растений, увеличивается, количество фосфора также увеличивается в тканях растений, и утечка углерода на растение симбиозом AM-грибов становится для него невыгодной (Grant 2005).
Уменьшение микоризной колонизации из-за высокого уровня фосфора в почве может привести к дефициту в растениях других питательных микроэлементов, усваиваемых микоризой, таких как медь (Timmer & Leyden 1980).
Системы многолетних культур
Покровные культуры выращивают осенью, зимой и весной, покрывая почву в периоды, когда она обычно остается без покрытия растущих растений.
Покровные культуры микориз могут быть использованы для улучшения посевного потенциала микоризы и сети гиф (Kabir and Koide 2000, Boswell и другие.1998 г., Соренсен и др. 2005).
Поскольку AM-грибы биотрофны, рост их сетей гиф зависит от растений. Выращивание покровных культур продлевает время роста AM до осени, зимы и весны. Поощрение роста гиф создает более обширную сеть гиф. Увеличение микоризной колонизации, обнаруженное в системах покровных культур, может быть в значительной степени связано с увеличением экстрарадикальной сети гиф, которая может колонизировать корни новой культуры (Boswell и другие. 1998). Внерадикальный мицелий способен пережить зиму, обеспечивая быструю весеннюю колонизацию и симбиоз в начале сезона (McGonigle and Miller 1999). Этот ранний симбиоз позволяет растениям подключаться к хорошо налаженной сети гиф и получать адекватное фосфорное питание во время раннего роста, что значительно повышает урожайность сельскохозяйственных культур.
Качество почвы
Восстановление естественных грибов AM увеличивает успех проекта восстановления окружающей среды и скорость восстановления почвы.[97] AM грибы усиливают агрегативная устойчивость почвы происходит из-за производства экстрарадикальных гиф и почвенного белка, известного как гломалин.
Связанные с гломалином почвенные белки (GRSP) были идентифицированы с использованием моноклональный антитело (Mab32B11), выращенный против измельченных спор AMF. Это определяется условиями его экстракции и реакцией с антителом Mab32B11.
Есть и другие косвенные доказательства того, что гломалин имеет грибковое происхождение AM. Когда AM-грибы удаляются из почвы путем инкубации почвы без растений-хозяев, концентрация GRSP снижается. Аналогичное снижение GRSP также наблюдалось в инкубированных почвах с лесных, лесных и сельскохозяйственных угодий.[102] и луга, обработанные фунгицидами.[103]
Предполагается, что гломалин улучшает водостойкость почвенных агрегатов и снижает эрозия почвы. Была обнаружена сильная корреляция между GRSP и водостойкостью почвенных агрегатов в широком спектре почв, где органический материал является основным связующим агентом, хотя механизм не известен.[103] Белок гломалин еще не выделен и не описан, и связь между гломалином, GRSP и арбускулярными микоризными грибами еще не ясна.[103]
Смотрите также
- Микориза
- Эктомикориза
- Эрикоидная микориза
- Микориза и изменение климата
- Микоризные грибы и накопление углерода в почве
- Прототакситы
Рекомендации
- ^ Брундретт, М. (2002). «Коэволюция корней и микориз наземных растений». Новый Фитолог. 154 (2): 275–304. Дои:10.1046 / j.1469-8137.2002.00397.x.
- ^ Barbour, M.G .; Burk, J.H .; Питтс, W.D. (1980). Экология наземных растений. Границы физики. Бенджамин / Издательство Каммингс. п.118. ISBN 978-0-8053-0540-1.
- ^ а б Саймон, L .; Bousquet, J .; Levesque, C .; Лалонд, М. (1993). «Происхождение и разнообразие эндомикоризных грибов и совпадение с сосудистыми наземными растениями». Природа. 363 (6424): 67–69. Bibcode:1993Натура 363 ... 67С. Дои:10.1038 / 363067a0. S2CID 4319766.
- ^ Schüßler, A .; и другие. (2001). "Новый грибной тип, Гломеромикота: филогения и эволюция ». Mycol. Res. 105 (12): 1413–1421. Дои:10.1017 / S0953756201005196.
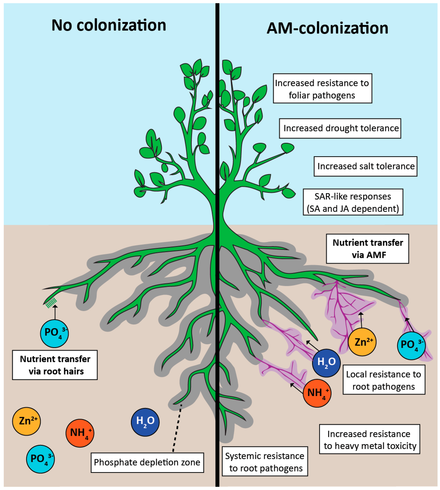
- ^ Jacott, C.N., Murray, J.D. и Ridout, C.J. (2017) «Компромиссы в симбиозе арбускулярной микориз: устойчивость к болезням, реакции роста и перспективы селекции сельскохозяйственных культур». Агрономия, 7(4): 75. Дои:10.3390 / агрономия7040075.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ а б c d е Реми, В .; Тейлор, Т .; Hass, H .; Керп, Х. (1994). «Везикулярная арбускулярная микориза возрастом четыреста миллионов лет». Труды Национальной академии наук Соединенных Штатов Америки. 91 (25): 11841–11843. Bibcode:1994PNAS ... 9111841R. Дои:10.1073 / пнас.91.25.11841. ЧВК 45331. PMID 11607500.
- ^ Kar, R.K .; Mandaokar, B.D .; Кар Р. (2005). «Микоризные ископаемые грибы из миоценовых отложений Мирозама, Северо-Восточная Индия». Текущая наука. 89: 257–259.
- ^ а б Ван, Б .; Yeun, L.H .; Xue, Y .; Liu, Y .; Ane, J.M .; Цю, Ю.Л. (2010). «Наличие трех генов микоризы у общего предка наземных растений предполагает ключевую роль микоризы в заселении земли растениями». Новый Фитолог. 186 (2): 514–525. Дои:10.1111 / j.1469-8137.2009.03137.x. HDL:2027.42/78704. PMID 20059702.
- ^ Ané, JM; и другие. (Ноябрь 2002 г.). «Генетическое и цитогенетическое картирование генов DMI1, DMI2 и DMI3 Medicago truncatula, участвующих в трансдукции, нодуляции и микоризации фактора Nod». Молекулярные взаимодействия растений и микробов. 15 (11): 1108–18. Дои:10.1094 / MPMI.2002.15.11.1108. PMID 12423016.
- ^ а б Ли, Сун-Джэ; Конг, Мэнсюань; Харрисон, Пол; Хиджри, Мохамед (2018), «Консервированные белки системы интерференции РНК в арбускулярном микоризном грибке Rhizoglomus irregulare обеспечивают новый взгляд на эволюционную историю гломеромикотов», Геномная биология и эволюция, 10 (1): 328–343, Дои:10.1093 / gbe / evy002, ЧВК 5786227, PMID 29329439
- ^ Alexopolous C, Mims C, Blackwell M. 2004. Вводная микология, 4-е изд. Хобокен (Нью-Джерси): Джон Уайли и сыновья.
- ^ а б Ли, С.Дж., Конг, М., Морс, Д. и др. Экспрессия предполагаемых компонентов циркадных часов у арбускулярного микоризного гриба Rhizoglomus irregulare. Микориза (2018) https://doi.org/10.1007/s00572-018-0843-y
- ^ Марло Дж., Дальпе Й., Сен-Арно М., Хиджри М. (2011). «Развитие спор и ядерная наследственность у арбускулярных микоризных грибов». BMC Эволюционная биология. 11: 51. Дои:10.1186/1471-2148-11-51. ЧВК 3060866. PMID 21349193.CS1 maint: несколько имен: список авторов (связь)
- ^ а б c d Райт С.Ф. (2005). «Управление арбускулярными микоризными грибами». В R.W. Zobel; С.Ф. Райт (ред.). Корни и обработка почвы: взаимодействие между корнями и почвой. США: Американское агрономическое общество. С. 183–197.
- ^ а б c d Доудс, Д. и Нагахаши, Г. 2000. События передачи сигналов и распознавания до колонизации корней арбускулярными микоризными грибами. В текущих достижениях в области исследования микоризы. Эд. Подила, Г., Даудс, Д. Миннесота: APS Press. Стр. 11–18.
- ^ Akiyama K; Matsuzaki K; Хаяси Х (2005). «Сесквитерпены растений вызывают ветвление гиф в арбускулярных микоризных грибах». Природа. 435 (7043): 824–827. Bibcode:2005Натура.435..824А. Дои:10.1038 / природа03608. PMID 15944706. S2CID 4343708.
- ^ а б c d Нагахаши, G; Douds, D. D .; Абни, Г.Д. (1996). «Поправка с фосфором прямо и косвенно подавляет ветвление гиф гриба ВАМ Gigaspora margarita, воздействуя на экссудацию корней». Микориза. 6 (5): 403–408. Дои:10.1007 / s005720050139. S2CID 36014515.
- ^ Sbrana, C .; Джованнетти, М. (2005). «Хемотропизм в арбускулярном микоризном грибе Glomus mosseae». Микориза. 15 (7): 539–545. Дои:10.1007 / s00572-005-0362-5. PMID 16133246. S2CID 23648484.
- ^ Тамаслоухт, М .; Sejalon-Delmas, N .; Kluever, A .; Jauneau, A .; Roux., C .; Бекард, G .; Франкен, П. (2003). «Корневые факторы индуцируют экспрессию генов, связанных с митохондриями, и грибковое дыхание во время перехода от асимбиоза к пресимбиозу в арбускулярном микоризном грибке Gigaspora rosea». Физиология растений. 131 (3): 1468–1478. Дои:10.1104 / стр.012898. ЧВК 166906. PMID 12644696.
- ^ а б c Джанинацци-Пирсон, В. (1996). «Ответы растительных клеток на арбускулярные микоризные грибы: добраться до корней симбиоза». Растительная клетка. 8 (10): 1871–1883. Дои:10.1105 / tpc.8.10.1871. JSTOR 3870236. ЧВК 161321. PMID 12239368.
- ^ Лара Армстронг; Р. Ларри Петерсон; Лара Армстронг; Р. Ларри Петерсон (2002). "Взаимодействие между арбускулярным микоризным грибом Glomus intraradices и корневыми клетками Panax quinquefolius: ассоциация микоризных грибов парижского типа". Микология. 94 (4): 587–595. Дои:10.2307/3761710. JSTOR 3761710. PMID 21156532.
- ^ Ямато, Масахиде (2005). «Морфологические типы арбускулярной микоризы в первых древесных растениях, растущих на ферме масличных пальм на Суматре, Индонезия». Миконаука. 46: 66–68. Дои:10.1007 / s10267-004-0212-х. S2CID 83767351.
- ^ Matekwor, Ahulu E; Наката, М; Нонака, М. (март 2005 г.). «Арбускулярные микоризы типа Arum и Paris в смешанном сосновом лесу на почве песчаных дюн в префектуре Ниигата, центральный Хонсю, Япония». Микориза. 15 (2): 129–36. Дои:10.1007 / s00572-004-0310-9. ISSN 0940-6360. PMID 15290409. S2CID 25476630.
- ^ Tuomi, J .; Китайта, М .; Хардлинг, Р. (2001). «Экономическая эффективность приобретения питательных веществ микоризного симбиоза для растения-хозяина». Ойкос. 92: 62–70. Дои:10.1034 / j.1600-0706.2001.920108.x.
- ^ а б c Болан, Н. (1991). «Критический обзор роли микоризных грибов в поглощении фосфора растениями». Растение и почва. 134 (2): 189–207. Дои:10.1007 / BF00012037. S2CID 44215263.
- ^ Харли, Дж. Л., Смит, С. Е., 1983. Микоризный симбиоз. Академическая пресса: Лондон.
- ^ а б c d Pfeffer, P .; Douds D .; Бекард, G .; Шахар-Хилл Ю. (1999). «Поглощение углерода, метаболизм и транспорт липидов в арбускулярной микоризе». Физиология растений. 120 (2): 587–598. Дои:10.1104 / стр.120.2.587. ЧВК 59298. PMID 10364411.
- ^ а б c Хамель, К. (2004). «Влияние грибов арбускулярной микоризы на круговорот азота и фосфора в корневой зоне». Канадский журнал почвоведения. 84 (4): 383–395. Дои:10.4141 / S04-004.
- ^ Х. Бюкинг и Я. Шахар-Хилл (2005). Поглощение, транспорт и перенос фосфатов арбускулярным микоризным грибом Glomus intraradices стимулируется повышенной доступностью углеводов Новый фитолог 165: 899–912
- ^ а б c Smith, S .; Smith, A .; Якобсен, И. (2003). «Микоризные грибы могут доминировать в снабжении растений фосфатом независимо от реакции роста». Физиология растений. 133 (1): 16–20. Дои:10.1104 / стр.103.024380. ЧВК 1540331. PMID 12970469.
- ^ а б c d е ж грамм Смит, С.Э., Рид Д.Дж. Микоризный симбиоз. 2002. Academic Press: Лондон.
- ^ а б Смит, чтение, Салли, ди-джей (2008). Микоризный симбиоз. Нью-Йорк: Academic Press.
- ^ а б c Опик, М; Vanatoa A; Vanatoa E; Moora M; Дэвидсон Дж; Kalwij JM; Reier U; Зобель М (2010). «Онлайн-база данных MaarjAM раскрывает глобальные и экосистемные закономерности распространения арбускулярных микоризных грибов (Glomeromycota)». Новый Фитолог. 188 (1): 233–241. Дои:10.1111 / j.1469-8137.2010.03334.x. PMID 20561207.
- ^ а б Кивлин, Стефани; Кристин В. Хоукс; Кэтлин К. Треседер (2011). «Мировое разнообразие и распространение арбускулярных микоризных грибов». Биология и биохимия почвы. 43 (11): 2294–2303. Дои:10.1016 / j.soilbio.2011.07.012.
- ^ Лекберг, Y; Koide RT; Рор-младший; Aldirch-Wolfe L; Мортон Дж. Б. (2007). «Роль нишевых ограничений и расселения в составе сообществ арбускулярных микоризных грибов». Журнал экологии. 95: 95–100. Дои:10.1111 / j.1365-2745.2006.01193.x.
- ^ Лефф, Джонатан В .; Джонс, Стюарт Э .; Пробер, Сюзанна М .; Барберан, Альберт; Бурер, Элизабет Т .; Фирн, Дженнифер Л .; Харпол, У. Стэнли; Хобби, Сара Э .; Хофмокель, Кирстен С. (01.09.2015). «Последовательная реакция почвенных микробных сообществ на повышенное поступление питательных веществ на пастбищах по всему миру». Труды Национальной академии наук. 112 (35): 10967–10972. Bibcode:2015ПНАС..11210967Л. Дои:10.1073 / pnas.1508382112. ISSN 0027-8424. ЧВК 4568213. PMID 26283343.
- ^ Allen, EB; Аллен М.Ф .; Helm DJ; Trappe JM; Molina R; Ринкон Э (1995). «Модели и регуляция микоризного разнообразия растений и грибов». Растение и почва. 170: 47–62. Дои:10.1007 / bf02183054. S2CID 25097125.
- ^ Клирономос, Джон (2000). Хозяин-специфичность и функциональное разнообразие арбускулярных микоризных грибов. Галифакс, Канада: Microbial Biosystems: New Frontiers. Материалы 8-го Международного симпозиума по микробной экологии. Атлантическое Канадское общество микробной экологии. С. 845–851.
- ^ Муж, Р; Herre EA; Turner SL; Галерея R; Молодой JPW (2002). «Молекулярное разнообразие арбускулярных микоризных грибов и закономерности ассоциаций во времени и пространстве в тропическом лесу» (PDF). Молекулярная экология. 11 (12): 2669–2678. Дои:10.1046 / j.1365-294x.2002.01647.x. PMID 12453249.
- ^ а б Хемпель, Стефан; Gotzenberger L; Kuhn I; Михальский С.Г .; Риллиг М; Zobel M; Мура М (2013). «Микоризы во флоре Центральной Европы - связь с особенностями жизнедеятельности растений и экологией». Экология. 94 (6): 1389–1399. Дои:10.1890/12-1700.1. PMID 23923502.
- ^ Дриго, Б; Pijl, AS; Duyts, H; Келак, AM; Гампер, штат Гавайи; Houtekamer, MJ; Boschker, HTS; Боделье, PLE; Whiteley, AS; Вин, JAV; Ковальчук, Г.А. (2010). «Перемещение потока углерода от корней к связанным микробным сообществам в ответ на повышенный уровень CO2 в атмосфере». Труды Национальной академии наук Соединенных Штатов Америки. 107 (24): 10938–10942. Bibcode:2010PNAS..10710938D. Дои:10.1073 / pnas.0912421107. ЧВК 2890735. PMID 20534474.
- ^ ван дер Хейден, MG; Boller AT; Wiemken A; Сандерс И.Р. (1998). «Различные виды арбускулярных микоризных грибов являются потенциальными детерминантами структуры растительного сообщества». Экология. 79 (6): 2082–2091. Дои:10.1890 / 0012-9658 (1998) 079 [2082: damfsa] 2.0.co; 2.
- ^ ван дер Хейден, MGA; Bardgett RD; Ван Страален Н.М. (2008). «Невидимое большинство: почвенные микробы как движущие силы разнообразия растений и продуктивности наземных экосистем». Письма об экологии. 11 (3): 296–310. Дои:10.1111 / j.1461-0248.2007.01139.x. PMID 18047587.
- ^ Vannette, RL; Расманн С (2012). «Арбускулярные микоризные грибы опосредуют подземные взаимодействия растений и травоядных: филогенетическое исследование». Функциональная экология. 26 (5): 1033–1042. Дои:10.1111 / j.1365-2435.2012.02046.x.
- ^ Haumann, N; Резюме Хокса (2009 г.). «Контроль соседства растений составом сообщества арбускулярной микоризы». Новый Фитолог. 183 (4): 1188–1200. Дои:10.1111 / j.1469-8137.2009.02882.x. PMID 19496954.
- ^ Хаусманн, Н. Резюме Хоукса (2010 г.). «Порядок посадки растений-хозяев изменяет состав сообществ арбускулярной микоризы». Экология. 91 (8): 2333–23343. Дои:10.1890/09-0924.1. PMID 20836455.
- ^ Баттен, км; Skow KM; Дэвис К.Ф. Харрисон SP (2006). «Два инвазивных растения изменяют состав микробного сообщества почвы на серпантинных лугах». Биологические вторжения. 8 (2): 217–230. Дои:10.1007 / s10530-004-3856-8. S2CID 24969103.
- ^ Хоукс, резюме; Belnap J; Д'Антонио С; Файерстоун М (2006). «Арбускулярные микоризные сообщества в корнях местных растений изменяются в присутствии инвазивных экзотических трав». Растение и почва. 281 (1–2): 369–380. Дои:10.1007 / s11104-005-4826-3. S2CID 16801874.
- ^ Кивлин, Стефани; Кристин В. Хоукс (2011). «Дифференциация эффектов инвазии и разнообразия: воздействие наземных растительных сообществ на подземные грибные сообщества». Новый Фитолог. 189 (2): 526–535. Дои:10.1111 / j.1469-8137.2010.03494.x. PMID 20958304.
- ^ Лекберг, Y; Гиббонс С.М.; Rosendahl S; Рэмси П.В. (2013). «Серьезные инвазии растений могут увеличить численность и разнообразие микоризных грибов». Журнал ISME. 7 (7): 1424–1433. Дои:10.1038 / ismej.2013.41. ЧВК 3695300. PMID 23486251.
- ^ Монтажник, AH (2005). «Зримая тьма: размышления о подземной экологии» (PDF). Журнал экологии. 93 (2): 231–243. Дои:10.1111 / j.0022-0477.2005.00990.x.
- ^ Прингл, А; Бевер, JD; Гардес, М; Паррент, JL; Риллиг, MC; Клирономос, Дж. Н. (2009). «Микоризные симбиозы и инвазии растений». Ежегодный обзор экологии, эволюции и систематики. 40: 699–715. Дои:10.1146 / annurev.ecolsys.39.110707.173454.
- ^ Лаример, А.Л .; Bever JD; Клей К (2010). «Интерактивные эффекты растительных микробных симбионтов: обзор и метаанализ». Симбиоз. 51 (2): 139–148. Дои:10.1007 / s13199-010-0083-1. S2CID 11569239.
- ^ Новас, М.В. Iannone LJ; Годеас AM; Кабрал Д. (2009). «Положительная связь между микоризой и эндофитами листьев у Poa bonariensis». Микологический прогресс. 8: 75–81. Дои:10.1007 / s11557-008-0579-8. S2CID 2206235.
- ^ Лаример, А.Л .; Bever JD; Клей К (2012). «Последствия одновременного взаимодействия грибковых эндофитов и арбускулярных микоризных грибов с общей травой-хозяином». Ойкос. 121 (12): 2090–2096. Дои:10.1111 / j.1600-0706.2012.20153.x.
- ^ Омачини, М; Эггерс Т; Bonkowski M; Gange AC; Джонс TH (2006). «Эндофиты листьев влияют на микоризный статус и рост коинфицированных и соседних растений». Функциональная экология. 20 (2): 226–232. Дои:10.1111 / j.1365-2435.2006.01099.x.
- ^ Мак, KML; Руджерс JA (2008). «Уравновешивание нескольких мутуалистов: асимметричные взаимодействия между растениями, арбускулярными микоризными грибами и грибковыми эндофитами». Ойкос. 117 (2): 310–320. CiteSeerX 10.1.1.722.4169. Дои:10.1111 / j.2007.0030-1299.15973.x.
- ^ Лю, QH; Парсонс AJ; Сюэ Х; Фрейзер К; Райан Г.Д .; Newman JA; Расмуссен S (2011). «Конкуренция между листовыми эндофитами Neotyphodium lolii и микоризными грибами Glomus spp. В Lolium perenne зависит от ресурсного обеспечения и содержания углеводов в организме хозяина». Функциональная экология. 25 (4): 910–920. Дои:10.1111 / j.1365-2435.2011.01853.x. HDL:10214/3316.
- ^ Рейнингер, В; Зибер Т.Н. (2012). «Микориза снижает неблагоприятное воздействие эндофитов темной перегородки (DSE) на рост хвойных деревьев». PLOS ONE. 7 (8): 1–10. Bibcode:2012PLoSO ... 742865R. Дои:10.1371 / journal.pone.0042865. ЧВК 3416760. PMID 22900058.
- ^ Klironomos, JN; Hart MM; Gurney JE; Moutoglis P (2001). «Межвидовые различия в толерантности арбускулярных микоризных грибов к замораживанию и сушке». Канадский журнал ботаники. 79 (10): 1161–1166. Дои:10.1139 / cjb-79-10-1161.
- ^ Ог, РМ (2001). «Водные отношения, засуха и везикулярно-арбускулярный микоризный симбиоз». Микориза. 11: 3–42. Дои:10.1007 / s005720100097. S2CID 29379395.
- ^ Джонсон, Северная Каролина; Роуленд DL; Коркиди L; Эгертон-Уорбертон Л.М.; Аллен Е.Б. (2003). «Обогащение азотом изменяет распределение микориз от пяти мезо до полузасушливых лугов». Экология. 84 (7): 1895–1908. Дои:10.1890 / 0012-9658 (2003) 084 [1895: neamaa] 2.0.co; 2.
- ^ Джонсон, Северная Каролина; Wilson GWT; Bowker MA; Wilson JA; Миллер Р.М. (2010). «Ограничение ресурсов является драйвером локальной адаптации микоризных симбиозов». Труды Национальной академии наук Соединенных Штатов Америки. 107 (5): 2093–2098. Bibcode:2010PNAS..107.2093J. Дои:10.1073 / pnas.0906710107. ЧВК 2836645. PMID 20133855.
- ^ Gai, JP; Tian H; Ян Ф.Й .; Кристи П; Li XL; Клирономос Ю.Н. (2012). «Разнообразие арбускулярных микоризных грибов вдоль тибетского градиента высот». Педобиология. 55 (3): 145–151. Дои:10.1016 / j.pedobi.2011.12.004.
- ^ Porcel, R; Aroca, R; Руис-Лозано, JM (2012). «Снятие стресса с помощью арбускулярных микоризных грибов. Обзор». Агрономия в интересах устойчивого развития. 32: 181–200. Дои:10.1007 / s13593-011-0029-х. S2CID 8572482.
- ^ а б c Marschner, P .; Тимонен, С. (2004). «Взаимодействие между видами растений и микоризной колонизацией на состав бактериального сообщества в ризосфере». Прикладная экология почвы. 28: 23–36. Дои:10.1016 / j.apsoil.2004.06.007.
- ^ Эрикссон, А. (2001). «Арбускулярная микориза в связи с историей хозяйствования, питательными веществами почвы и разнообразием растений». Экология растений. 155 (2): 129–137. Дои:10.1023 / А: 1013204803560. S2CID 42097761.
- ^ «Липохитоолигосахариды, стимулирующие арбускулярный микоризный симбиоз». Архивировано из оригинал на 2012-08-05.
- ^ Schrey, Silvia D .; и другие. (2012). «Производство грибковых и бактериальных вторичных метаболитов, модулирующих рост, широко распространено среди стрептомицетов, ассоциированных с микоризой». BMC Microbiology. 12 (1): 164. Дои:10.1186/1471-2180-12-164. ЧВК 3487804. PMID 22852578.
- ^ Ван дер Путтен, WH (2012). «Изменение климата, взаимодействие над землей и подземный мир и смещение ареала видов». Ежегодный обзор экологии, эволюции и систематики. 43: 365–383. Дои:10.1146 / annurev-ecolsys-110411-160423. HDL:20.500.11755 / 0f7d61b9-e435-4da3-b3d6-3ca115bdbdb5.
- ^ Уорчел, Элиза; Giauque, Hannah E .; Кивлин, Стефани Н. (2013). «Грибные симбионты изменяют реакцию растений на засуху». Микробная экология. 65 (3): 671–678. Дои:10.1007 / s00248-012-0151-6. PMID 23250115. S2CID 122731.
- ^ Кивлин С.Н.; Эмери С.М.; Руджерс JA (2013). «Грибные симбионты изменяют реакцию растений на глобальные изменения». Американский журнал ботаники. 100 (7): 1445–1457. Дои:10.3732 / ajb.1200558. PMID 23757444.
- ^ Треседер, К.К. (2004). «Мета-анализ микоризных реакций на азот, фосфор и атмосферный CO2 в полевых исследованиях». Новый Фитолог. 164 (2): 347–355. Дои:10.1111 / j.1469-8137.2004.01159.x.
- ^ Гломалин. «Тайник для одной трети мировых запасов углерода в почве». Журнал сельскохозяйственных исследований.
- ^ Стукенброк, Ева; Розендаль, Сорен (2005). «Клональное разнообразие и популяционно-генетическая структура арбускулярных микоризных грибов (Glomus spp.), Изученных с помощью мультилокусного генотипирования отдельных спор». Молекулярная экология. 14 (3): 743–752. Дои:10.1111 / j.1365-294x.2005.02453.x. PMID 15723666.
- ^ Баомин, Цзи; и другие. (2013). «Модели разнообразия и адаптации Glomeromycota из трех лугов прерий». Молекулярная экология. 22 (9): 2573–2587. Дои:10.1111 / mec.12268. PMID 23458035.
- ^ Опик, Маарья; и другие. (2013). «Глобальный отбор проб корней растений расширяет описанное молекулярное разнообразие арбускулярных микоризных грибов». Микориза. 23 (5): 411–430. Дои:10.1007 / s00572-013-0482-2. PMID 23422950. S2CID 17162006.
- ^ Джонсон, Нэнси; Zak, D.R .; Tilman, D .; Пфлегер, Ф.Л. (1991). «Динамика везикулярной арбускулярной микоризы при старой сукцессии». Oecologia. 86 (3): 349–358. Bibcode:1991Oecol..86..349J. Дои:10.1007 / bf00317600. PMID 28312920. S2CID 31539360.
- ^ Марло, Джули; Далпе, Ю.; Сен-Арно, М .; Хиджри, М. (2011). «Развитие спор и ядерная наследственность у арбускулярных микоризных грибов». BMC Эволюционная биология. 11 (1): 51. Дои:10.1186/1471-2148-11-51. ЧВК 3060866. PMID 21349193.
- ^ Ehinger, Martine O .; Дэниел Кролл; Александр М. Кох; Ян Р. Сандерс (2012). «Значительные генетические и фенотипические изменения, возникающие в результате клонального роста одной споры арбускулярного микоризного гриба в течение нескольких поколений». Новый Фитолог. 196 (3): 853–861. Дои:10.1111 / j.1469-8137.2012.04278.x. PMID 22931497.
- ^ Саймон, L; Lalonde, M .; Брунс, Т.Д. (1992). «Специфическая амплификация грибковых рибосомных генов 18S из везикулярно-арбускулярных эндомикоризных грибов, колонизирующих корни». Appl. Environ. Микробиол. 58 (1): 291–295. Дои:10.1128 / AEM.58.1.291-295.1992. ЧВК 195206. PMID 1339260.
- ^ Хельгасон, Торнн; Слесарь, A.H .; Янг, J.P.W (1999). «Молекулярное разнообразие арбускулярных микоризных грибов, колонизирующих Hyacinthoides non-scripta (колокольчик) в полуестественных лесах» (PDF). Молекулярная экология. 8 (4): 659–666. Дои:10.1046 / j.1365-294x.1999.00604.x.
- ^ Редеккер, Дирк; Артур Шюсслер; Герберт Стокингер; Сидни Л. Штюрмер; Джозеф Б. Мортон; Кристофер Уокер (2013). «Доказательный консенсус по классификации арбускулярных микоризных грибов (Glomeromycota)». Микориза. 23 (7): 515–531. Дои:10.1007 / s00572-013-0486-y. PMID 23558516. S2CID 16495856.
- ^ Опик, Маарья; Metsis, M .; Daniell, T. J .; Zobel, M .; Мура, М. (2009). «Крупномасштабное параллельное секвенирование 454 показывает специфичность экологической группы хозяев арбускулярных микоризных грибов в бореонеморальном лесу». Новый Фитолог. 184 (2): 424–437. Дои:10.1111 / j.1469-8137.2009.02920.x. PMID 19558424.
- ^ а б Крюгер, Мануэла; Стокингер, Герберт; Крюгер, Клаудиа; Шюсслер, Артур (2009). «Определение видового уровня Glomeromycota на основе ДНК: один набор праймеров для ПЦР для всех арбускулярных микоризных грибов». Новый Фитолог. 183 (1): 212–223. Дои:10.1111 / j.1469-8137.2009.02835.x. PMID 19368665.
- ^ а б Когоут, Петр; и другие. (Январь 2014). «Сравнение обычно используемых наборов праймеров для оценки сообществ арбускулярных микоризных грибов: есть ли универсальное решение?». Биология и биохимия почвы. 68: 482–493. Дои:10.1016 / j.soilbio.2013.08.027.
- ^ Стокингер, Герберт; Крюгер, Мануэла; Шюсслер, Артур (2010). «Штрих-кодирование ДНК арбускулярных микоризных грибов». Новый Фитолог. 187 (2): 461–474. Дои:10.1111 / j.1469-8137.2010.03262.x. PMID 20456046.
- ^ Редеккер, Дирк (2000). «Специфические праймеры ПЦР для идентификации арбускулярных микоризных грибов в колонизированных корнях». Микориза. 10 (2): 73–80. Дои:10.1007 / s005720000061. S2CID 11726603.
- ^ «Спустя шесть лет после приобретения Roche Quietly Shutters 454». Биотехнологический мир. 16 октября 2013 г.. Получено 13 марта 2014.
- ^ Он, Жили; Джой Д. ВАН НОСТРАНД; Ye DENG; Цзичжун ЧЖОУ (2011). «Разработка и применение функциональных микромассивов генов в анализе функционального разнообразия, состава и структуры микробных сообществ». Передний. Environ. Sci. Англ. Китай. 5 (1): 1–20. Дои:10.1007 / s11783-011-0301-y.
- ^ а б c Олссон, Пал Аксель (1999). «Фирменные жирные кислоты предоставляют инструменты для определения распространения и взаимодействия микоризных грибов в почве». FEMS Microbiology Ecology. 29 (4): 303–310. Дои:10.1111 / j.1574-6941.1999.tb00621.x.
- ^ J., Schnürer; Clarholm, M .; Россвалл, Т. (1985). «Микробная биомасса и активность в сельскохозяйственных почвах с различным содержанием органических веществ». Биология и биохимия почвы. 17 (5): 611–618. Дои:10.1016/0038-0717(85)90036-7.
- ^ Монтолиу-Нерин, Мерс; Санчес-Гарсия, Марисоль; Бергин, Клаудиа; Грабхерр, Манфред; Эллис, Барбара; Кучера, Верена Эстер; Керчак, Марцин; Йоханнессон, Ханна; Рослинг, Анна (28.01.2020). «Построение референсных сборок генома de novo сложных эукариотических микроорганизмов из единичных ядер». Научные отчеты. 10 (1): 1303. Дои:10.1038 / с41598-020-58025-3. ISSN 2045-2322. ЧВК 6987183. PMID 31992756.
- ^ Dumont, Marc G .; Мюррелл, Колин Дж. (2005). «Зондирование стабильных изотопов - связь микробной идентичности с функцией». Обзоры природы Микробиология. 3 (6): 499–504. Дои:10.1038 / nrmicro1162. PMID 15886694. S2CID 24051877.
- ^ а б Шварц, Эгберт (2007). «Характеристика растущих в почве микроорганизмов с помощью зондирования стабильных изотопов H218O». Прикладная и экологическая микробиология. 73 (8): 2541–2546. Дои:10.1128 / AEM.02021-06. ЧВК 1855593. PMID 17322324.
- ^ Форми Д. и др. 2016. Регулирование малых РНК и соответствующих мишеней в клетках корневых волосков Phaseolus vulgaris, индуцированных фактором Nod. Int J Mol Sci. 176: 887.
- ^ а б c d Джеффрис, П .; Gianinazzi, S .; Perotto, S .; Turnau, K .; Бареа, Дж. (2003). «Вклад арбускулярных микоризных грибов в устойчивое поддержание здоровья растений и плодородия почвы». Биология и плодородие почв. 37: 1–16. Дои:10.1007 / s00374-002-0546-5. S2CID 20792333.
- ^ Ахтар, Оваид; Мишра, Рани; Кехри, Харбанс Каур (01.03.2019). «Ассоциация арбускулярной микоризы способствует накоплению Cr и толерантности растений, растущих на почвах, загрязненных хромом». Труды Национальной академии наук Индии Раздел B: Биологические науки. 89 (1): 63–70. Дои:10.1007 / s40011-017-0914-4. ISSN 2250-1746. S2CID 46007322.
- ^ Fillion, M .; Brisson, J .; Guidi W .; Лабрек, М. (2011). «Повышение выведения фосфора из растительности ивы и тополя фильтрует с помощью арбускулярных микоризных грибов». Экологическая инженерия. 37 (2): 199–205. Дои:10.1016 / j.ecoleng.2010.09.002.
- ^ Ахтар, Оваид; Кехри, Харбанс Каур; Зуми, Ифра (15.09.2020). «Инокуляция арбускулярной микоризы и Aspergillus terreus вместе с улучшением компоста усиливает фиторемедиацию технозоля, богатого хромом, с помощью Solanum lycopersicum в полевых условиях». Экотоксикология и экологическая безопасность. 201: 110869. Дои:10.1016 / j.ecoenv.2020.110869. ISSN 0147-6513. PMID 32585490.
- ^ Джованнини, Л., Палла, М., Аньолуччи, М., Авио, Л., Сбрана, К., Туррини, А. и Джованнетти, М. (2020) «Арбускулярные микоризные грибы и связанная с ними микробиота как биостимуляторы растений: стратегии исследования. для выбора наиболее эффективных инокулятов ». Агрономия, 10(1): 106. Дои:10.3390 / agronomy10010106.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Риллиг, М .; Ramsey, P .; Morris, S .; Пол, Э. (2003). «Гломалин, арбускулярно-микоризный грибковый почвенный белок, реагирует на изменения в землепользовании». Растение и почва. 253 (2): 293–299. Дои:10.1023 / А: 1024807820579. S2CID 11007821.
- ^ а б c Риллиг, М. (2004). «Арбускулярная микориза, гломалин и почвенная агрегация». Канадский журнал почвоведения. 84 (4): 355–363. Дои:10.4141 / S04-003.
Примечания
- Boswell, E. P .; R.T. Коидэ; D.L. Шамуэй; H.D. Адди. (1998). «Посевы озимой пшеницы, рост и урожайность микоризных грибов VA, кукурузы». Сельское хозяйство, экосистемы и окружающая среда. 67: 55–65. Дои:10.1016 / S0167-8809 (97) 00094-7.
- Bücking H .; Шахар-Хилл Ю. (2005). «Поглощение, транспорт и перенос фосфатов арбускулярными микоризными грибами увеличиваются за счет доступности углеводов». Новый Фитолог. 165 (3): 889–912. Дои:10.1111 / j.1469-8137.2004.01274.x. PMID 15720701.
- Джордж Э., К. Хаусслер, С.К. Котари, X.L. Ли и Х. Маршнер, 1992 г. Вклад микоризных гиф в питательные вещества и поглощение воды растениями. В микоризах в экосистемах, под ред. Д.Дж. Рид, Д. Х. Льюис, А. Х. Фиттер, И. Дж. Александр. Соединенное Королевство: C.A.B. International, стр. 42–47.
- Grant, C .; Bitman, S .; Монреаль, М .; Plenchette, C .; Морел, К. (2005). «Фосфор почвы и удобрений: влияние на питание растений и развитие микориз». Канадский журнал растениеводства. 85: 3–14. Дои:10.4141 / P03-182.
- Kosuta, S .; Chabaud, M .; Lougnon, G .; Gough, C .; Denarie, J .; Barker, D .; Бакард, Г. (2003). "Диффузионный фактор из арбускулярных микоризных грибов индуцирует специфичную для симбиоза экспрессию MtENOD11 в корнях Medicago truncatula". Физиология растений. 131 (3): 952–962. Дои:10.1104 / стр.011882. ЧВК 166861. PMID 12644648.
- Кабир, З .; R.T. Коидэ (2000). «Влияние одуванчика или покровной культуры на инокуляционный потенциал микоризы, агрегацию почвы и урожай кукурузы». Сельское хозяйство, экосистемы и окружающая среда. 78 (2): 167–174. Дои:10.1016 / S0167-8809 (99) 00121-8.
- McGonigle, T.P .; M.H. Миллер (1999). «Зимняя выживаемость экстрарадикальных гиф и спор арбускулярных микоризных грибов в полевых условиях». Прикладная экология почвы. 12: 41–50. Дои:10.1016 / S0929-1393 (98) 00165-6.
- Miller, M.H .; McGonigle T.P .; Эдди, Х. (1995). «Функциональная экология везикулярной арбускулярной микоризы под влиянием фосфорных удобрений и обработки почвы в сельскохозяйственной экосистеме». Критические обзоры в биотехнологии. 15 (3–4): 241–255. Дои:10.3109/07388559509147411.
- Mozafar, A .; Анкен, Т .; Ruh, R .; Фроссар, Э. (2000). «Интенсивность обработки почвы, микоризные и немикоризные грибы и концентрация питательных веществ в кукурузе, пшенице и каноле». Агрономический журнал. 92 (6): 1117–1124. Дои:10.2134 / agronj2000.9261117x.
- Соренсен, J.N .; Дж. Ларсен; И. Якобсен (2005). «Образование микоризы и концентрация питательных веществ в луке-порее (Allium porrum) по отношению к предыдущему управлению культурными и покровными культурами на почвах с высоким содержанием P ». Растение и почва. 273 (1–2): 101–114. Дои:10.1007 / s11104-004-6960-8. S2CID 30777851.
- Thingstrup, I .; Г. Рубаек; Э. Сиббенсен; И. Якобсен (1999). «Лен (Linum usitatissimum L.) зависит от арбускулярных микоризных грибов для роста и поглощения фосфора при средних, но не высоких уровнях фосфора в почве в поле ". Растение и почва. 203: 37–46. Дои:10.1023 / А: 1004362310788. S2CID 27345855.
- Тиммер, Л .; Лейден, Р. (1980). «Связь микоризной инфекции с фосфор-индуцированным дефицитом меди в проростках кислого апельсина». Новый Фитолог. 85: 15–23. Дои:10.1111 / j.1469-8137.1980.tb04443.x.
- Xie, Z .; Staehelin, C .; Vierheilig, H .; Weimken, A .; Jabbouri, S .; Broughton W .; Vogeli-Lange, R .; Томас Б. (1995). «Факторы клубеньков ризобий стимулируют микоризную колонизацию клубеньков сои и без клубеньков». Физиология растений. 108 (4): 1519–1525. Дои:10.1104 / pp.108.4.1519. ЧВК 157531. PMID 12228558.
