Вирус герпеса человека 6 - Human herpesvirus 6
| Вирус герпеса человека 6 | |
|---|---|
 | |
| Электронная микрофотография одного из видов HHV6 | |
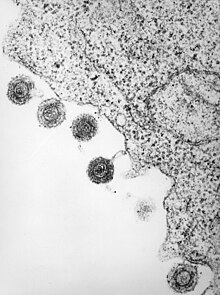 | |
| HHV-6 высвобождается из инфицированного лимфоцита | |
| Научная классификация | |
| (без рейтинга): | Вирус |
| Область: | Дуплоднавирия |
| Королевство: | Heunggongvirae |
| Тип: | Пепловирикота |
| Учебный класс: | Herviviricetes |
| Заказ: | Herpesvirales |
| Семья: | Herpesviridae |
| Подсемейство: | Betaherpesvirinae |
| Род: | Розеоловирус |
| Включенные группы | |
| Кладистски включены, но традиционно исключены таксоны | |
Все остальные Розеоловирус spp .: | |
Вирус герпеса человека 6 (HHV-6) - общее собирательное название для человеческий бета-герпесвирус 6A (HHV-6A) и бета-герпесвирус человека 6B (HHV-6B). Эти близкородственные вирусы являются двумя из девяти герпесвирусов, основным хозяином которых является человек.[1]
HHV-6A и HHV-6B представляют собой двухцепочечные ДНК-вирусы внутри Betaherpesvirinae подсемейство и род Розеоловирус. HHV-6A и HHV-6B инфицируют почти все протестированные человеческие популяции.[2]
HHV-6A был описан как более нейровирулентный,[3] и как таковой чаще встречается у пациентов с нейровоспалительными заболеваниями, такими как рассеянный склероз.[4] Уровни HHV-6 (и HHV-7) в мозге также повышены у людей с Болезнь Альцгеймера.[5]
Первичная инфекция HHV-6B является причиной распространенного детского заболевания. субитумная экзантема (также известная как детская розеола или шестая болезнь). Он передается от ребенка к ребенку. Взрослые редко заражаются этой болезнью, так как большинство людей заразились ею в детском саду, и после заражения образуются антитела, которые помогают предотвратить повторное заражение в будущем. Кроме того, реактивация HHV-6B часто встречается у реципиентов трансплантата, что может вызывать несколько клинических проявлений, таких как энцефалит, подавление костного мозга и пневмонит.[6]
Для обнаружения HHV-6 используются различные тесты, некоторые из которых не позволяют дифференцировать эти два вида.[7]
История
В 1986 г. Сайед Заки Салахуддин, Дхарам Аблаши, и Роберт Галло культивировали мононуклеарные клетки периферической крови пациентов со СПИДом и лимфопролиферативные заболевания. Были зарегистрированы короткоживущие, большие, рефрактильные клетки, которые часто содержали внутриядерные и / или внутрицитоплазматические тельца включения. Электронная микроскопия выявили новый вирус, который они назвали В-лимфотрофным вирусом человека (HBLV).[8][9]
Вскоре после его открытия Ablashi et al. описали пять клеточных линий, которые могут быть инфицированы недавно обнаруженным HBLV. Они опубликовали это HSB-2, конкретная линия Т-клеток, очень восприимчива к инфекции. Новаторское исследование Аблаши завершилось предложением изменить название вируса с HBLV на HHV-6 в соответствии с опубликованной предварительной классификацией вирусов герпеса.[10][11]
Спустя годы HHV-6 был разделен на подтипы. Раннее исследование (1992) описало два очень похожих, но уникальных варианта: HHV-6A и HHV-6B. Это различие было оправдано благодаря уникальным расщеплениям рестрикционной эндонуклеазой, реакциям с моноклональными антителами,[12] и модели роста.[13]
HHV-6A включает несколько штаммов, происходящих от взрослых, и спектр его заболеваний не определен, хотя некоторые считают его более нейровирулентным.[14][15] HHV-6B обычно выявляется у детей с розеола младенческая, поскольку он является этиологическим агентом этого состояния. Внутри этих двух вирусов гомология последовательностей составляет 95%.[16]
В 2012 году HHV-6A и HHV-6B были официально признаны отдельными видами.[1]
Таксономия
HHV-6A и HHV-6B были признаны Международный комитет по таксономии вирусов (ICTV) в качестве отдельных видов в 2012 году. Розеоловирусы человека включают HHV-6A, HHV-6B и HHV-7.[1]
Герпесвирус был установлен как род в 1971 году в первом отчете ICTV. Этот род состоял из 23 вирусов из 4 групп.[17] В 1976 году был выпущен второй отчет ICTV, в котором этот род был повышен до уровня семейства - herpetoviridae. Из-за возможной путаницы с вирусами, полученными от рептилий, фамилия была изменена в третьем отчете (1979) на герпесвирусы. В этом отчете семья Herpesviridae был разделен на 3 подсемейства (альфогерпесвирины, бета-герпесвирины и гаммагерпесвирины) и 5 безымянных родов; 21 вирус был признан членом семейства.[18]
В 2009 году приказ Herpesvirales был создан. Это было вызвано открытием того факта, что вирусы герпеса рыб и моллюсков лишь отдаленно родственны вирусам птиц и млекопитающих. Заказ Herpesvirales содержит три семейства, Herpesviridae, который содержит давно известные герпесвирусы млекопитающих, птиц и рептилий, а также два новых семейства - семейство Аллохерпесвириды который включает вирусы герпеса костистых рыб и лягушек, а также семейства Malacoherpesviridae который содержит вирусы моллюсков.[19]
По состоянию на 2012 год в этом отряде в настоящее время насчитывается 3 семейства, 4 подсемейства (1 не присвоено), 18 родов (4 не присвоено) и 97 видов.[1]
Структура
Диаметр вириона HHV-6 составляет около 2000 ангстрем.[9] Внешняя часть вириона состоит из двухслойной липидной мембраны, содержащей вирусные гликопротеины и происходит от хоста. Под этой мембранной оболочкой находится оболочка который окружает икосаэдр капсид, в составе 162 капсомеры. Защитный капсид HHV-6 содержит двухцепочечную линейную ДНК.
Во время созревания вирионов HHV-6 мембраны клеток человека используются для формирования вирусных липидных оболочек (что характерно для всех оболочечных вирусов). В этом процессе HHV-6 использует липидные рафты, которые представляют собой мембранные микродомены, обогащенные холестерин, сфинголипиды, и гликозилфосфатидилинозитол заякоренные белки.[20] Ранние исследователи подозревали, что вирионы HHV-6 созревают в ядре; некоторые даже неправильно опубликовали это, поскольку они обобщили и применили к HHV-6 то, что было известно о других вирусах. Однако исследование, опубликованное в 2009 году, предполагает, что вирус HHV-6 использует для сборки везикулы, происходящие из сети Гольджи.[20]
Геном
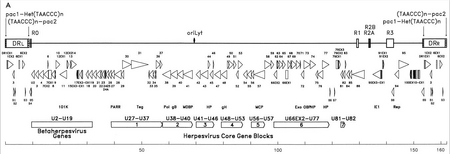
Генетический материал HHV-6 состоит из линейной (кольцевой во время активной инфекции), двухцепочечной ДНК, содержащей начало репликации, два левых и правых конца прямого повтора длиной 8–10 т.п.н., а также уникальный сегмент размером 143–145 т.п.н.[22]
Источник репликации (часто обозначаемый в литературе как «oriLyt») - это место, где начинается репликация ДНК.[21] Концы прямого повтора (DRL и DRр) обладают повторяющейся последовательностью TTAGGG, идентичной последовательности человеческого теломеры. Вариабельность количества теломерных повторов наблюдается в диапазоне 15–180.[23][24] Эти концы также содержат сигналы расщепления и упаковки pac-1 и pac-2, которые консервативны среди герпесвирусов.
Уникальный сегмент содержит семь основных основных блоков генов (U27-U37, U38-U40, U41-U46, U48-U53, U56-U57, U66EX2-U77 и U81-U82),[21] что также характерно для герпесвирусов. Эти консервативные гены кодируют белки, которые участвуют в репликации, расщеплении и упаковке вирусного генома в зрелый вирион.[23] Кроме того, они кодируют ряд иммуномодулирующих белков. Уникальный сегмент также содержит блок генов (U2-U19), консервативных среди вирусов HHV-6, HHV-7 и цитомегаловирусов (бета-герпесвирусов). Ряд уникальных сегментных генов связан, например, с семейством HCMV US22 (ИнтерПро: IPR003360 ). В таблице ниже перечислены некоторые из их известных свойств.[21]
Гены
| Ген | Этап | Характеристики |
|---|---|---|
| IE-A (IE1? U89?) | Немедленно рано | Часть локуса IE [25] - снижает экспрессию гена интерферона, чтобы ограничить развитие клеточных противовирусных мер, способствуя успешному заражению - не в мембране - активирует вирусные ДНК-полимеразы, участвующие в репликации по кругу - экспрессия этого гена может модулироваться микро РНК [26] |
| IE-B | Немедленно рано | Часть локуса IE [25] Активирует вирусные ДНК-полимеразы, участвующие в репликации по катящемуся кругу |
| DR1 | Семейство генов HCMV US22 | |
| DR6 | Семейство генов HCMV US22, трансактиватор, онкоген | |
| DR7 / U1 | Домен SR, злокачественная трансформирующая активность, связывается с p53 | |
| U2 | Семейство генов HCMV US22 - белок тегумента | |
| U3 | Гомолог UL24 HCMV, семейство генов US22 HCMV, белок тегумента - трансактивирующая активность [25] | |
| U4 | HCMV устойчивость к марибавиру | |
| U7 | Семейство генов HCMV US22 | |
| U10 | семейство dUTPase | |
| U11 | Сильно иммунореактивный белок вириона [21] - антигенный белок тегумента | |
| U12 | Хемокин G-рецептор, связанный с белком | |
| U13 | CMV: подавляет транскрипцию US3 | |
| U14 | Связывает и включает p53 в вирусные частицы - семейство генов UL25 HCMV - антигенный белок тегумента | |
| U15 | Семейство генов UL25 HCMV | |
| U17 | Семейство генов UL25 HCMV - белок тегумента | |
| U18 | IE-B | Мембранный гликопротеин |
| U19 | Белок IE-B | Гликопротеин |
| U20 | Гликопротеин (специфический для Розеоловирус) предсказанная структура иммуноглобулина | |
| U21 | Связывается с молекулами MHC-1 и предотвращает представление антигенпрезентирующими клетками пептидов HHV-6 - гликопротеина, подавляет HLA I (специфичный для Розеоловирус) | |
| U22 | Поздний ген | Гликопротеин (отсутствует у HHV-7, специфичные для Розеоловирус) |
| U23 | Гликопротеин (специфический для Розеоловирус ) | |
| U24 | Подавляет правильную активацию Т-клеток, уменьшая секрецию цитокинов в месте инфекции - мишень фосфорилирования для киназ - гликопротеин M (gM) (специфичный для Розеоловирус ) | |
| U25 | Семейство генов UL22 HCMV, белок тегумента | |
| U26 | Предполагаемый множественный трансмембранный белок | |
| U27 | Фабрика процессивности ДНК-полимеразы | |
| U28 | Большая субъединица рибонуклеотидредуктазы, белок тегумента | |
| U29 | Сборка капсида и созревание ДНК | |
| U30 | Белок тегумента | |
| U31 | Большой белок тегумента | |
| U32 | Белок капсида, гексон чаевые | |
| U33 | Белок вириона | |
| U34 | Мембранно-ассоциированный фосфопротеин, первичная оболочка | |
| U35 | Компонент терминазы, упаковка ДНК | |
| U36 | Упаковка ДНК | |
| U37 | Белок тегумента, первичная оболочка, фосфопротеин | |
| U38 | ДНК-полимераза | |
| U39 (GB, GP116) | Гликопротеин | |
| U40 | Транспорт, сборка капсида | |
| U41 | Ранний ген | Главный ДНК-связывающий белок |
| U42 | Белок тегумента, блок клеточного цикла, трансактиватор | |
| U43 | ДНК Комплекс геликаза-примаза | |
| U44 | Белок тегумента | |
| U45 | dUTPase | |
| U46 | Гликопротеин N, мембранный белок | |
| U47 (gO, O) | Гликопротеин О, ассоциированный с липидными рафтами, существует в двух формах, gO-120K и gO-80K, а gO-80K содержит N-связанные олигосахариды сложного типа, которые включены в вирусные частицы. | |
| U48 (gH, gp100) | Гликопротеин gH, составляющая вириона, часть лигандного комплекса CD46 gQ1 / gQ2 / gL / gH, ассоциирует с липидными рафтами | |
| U49 | Связанный с вирионом регуляторный белок, гибридный белок | |
| U50 | Упаковка ДНК | |
| U51 | Ранний ген | Хемокиновый рецептор, связанный с G-белком, предотвращая экспрессию, значительно снижает репликацию - увеличивает внутриклеточные уровни вторичного мессенджера инозитолфосфата, способствует хемотаксису - ранний ген, наряду с U41 и U69 [7] |
| U52 | ||
| U53 | Протеаза,[25] белок сборки капсида | |
| U54 | Белок тегумента, трансактиватор вириона | |
| U55 | Роль в синтезе РНК, dUTPase | |
| U56 | Капсидный белок | |
| U57 | Основной белок капсида | |
| U58 | ||
| U59 | Белок тегумента | |
| U61 | ||
| U62 | ||
| U63 | ||
| U64 | Упаковка ДНК: белок тегумента | |
| U65 | Белок тегумента | |
| U66 | Компонент Terminase | |
| U69 | Ранний ген | Тегументная протеинкиназа (ганцикловиркиназа) участвует в репликации [25] |
| U70 | Щелочная экзонуклеаза | |
| U71 | Миристилированный белок вириона | |
| U72 (gM) | Гликопротеин М | |
| U73 | Связывающий белок | |
| U74 | ДНК-геликаза-примаза комплекс | |
| U75 | Белок тегумента | |
| U76 | Упаковка ДНК, вирионный белок | |
| U77 | Комплекс геликаза-примаза | |
| U79 | Активация транскрипции | |
| U80 | Прогнозируемая структура иммуноглобулина | |
| U81 | Урацил-ДНК гликозилаза | |
| U82 (gL, gp80) | Гликопротеин L, составляющая вириона, часть лигандного комплекса CD46 gQ1 / gQ2 / gL / gH, ассоциирует с липидными рафтами | |
| U83 | Секретируемый хемотаксический (хемоаттрактант) гликопротеин, связывается с рецепторами хемокинов, рекрутирует клетки-хозяева, которые секретируют хемокины, специфичные для U51 | |
| U85 | Гликопротеин (специфический для Розеоловирус) | |
| U86 | IE-2 | Трансактиватор ИЭ-2 |
| U88 | IE-A | |
| U90 | IE-A (IE 1) | Трансактиватор |
| U91 | IE-A, гликопротеин | |
| U94 | Латентность (немедленный или ранний ген) | Участвует в репрессии транскрипции литических генов - способствует специфической интеграции HHV-6A / HHV-6B в теломеры - высоко экспрессируется в латентный период - гомолог реповируса парвовируса (отсутствует в HHV-7) |
| U95 | Семейство генов CMV US22 - колокализуется и взаимодействует с митохондриальным белком GRIM-19, важным компонентом системы окислительного фосфорилирования [7] - связывается с ядерным фактором-каппа B (NF-κB), нарушение регуляции которого, как постулируется, способствует развитию рака [14] | |
| U100 (Gp82-105) | Поздний ген | Гликопротеин Q, составляющий вирион, ассоциирует с липидными рафтами |
| gQ1 | Гликопротеин, комплексы с gH и gL с образованием вирусного лиганда рецептора CD46 - модифицированные N-гликозилированием - экспрессируются только в двух различных формах: форме 80 кДа (gQ1-80K) и форме 74 кДа (gQ1-74K) - только gQ1-80K, но не gQ1-74K, образует комплекс лиганда CD46 с gQ2, gH и gL [27] Ассоциирует с липидными рафтами. | |
| gM1 | Ганглиозид, специфичный для липидных рафтов, включен в вирион | |
| gQ2 | Гликопротеин, образует комплекс gH / gL / gQ1 / gQ2, часть рецепторного лиганда, необходимого для роста вируса, ассоциируется с липидными рафтами - существует в двух формах: gQ2-34K и gQ2-37K. | |
| Микро РНК | hhv6b-miR-Ro6-1, -Ro6-2, -Ro6-3 и -Ro6-4. Может регулировать раннюю транскрипцию | |
| P100 он же p101 | Иммуногенный, входящий в состав тегумента | |
| ORF-1 (DR7) | Связывает и подавляет транскрипционную активность p53 - может трансформировать эпидермальные кератиноциты человека и клетки NIH 3T3 in vitro - клетки, экспрессирующие белок ORF-1, вызывают фибросаркомы при введении голым мышам |
Вирусный вход
Рецептор HHV-6
Когда внеклеточный вирион HHV-6 встречается с клетками человека, он сталкивается с дифференцированным кластером рецепторных белков человека 46 (CD46 ), который играет роль в регулировании системы комплемента. Белок CD46 обладает единственной вариабельной областью в результате альтернативное сращивание. Таким образом, существует по крайней мере четырнадцать изоформ CD46, каждая из которых связывает HHV-6a.[28]
Внеклеточная область CD46 содержит четыре коротких консенсусных повтора примерно из 60 аминокислот, которые складываются в компактную форму. бета-баррель домен окружен гибкими петлями.[23] Как было продемонстрировано для CD46 с другими лигандами, структура белка CD46 линеаризуется при связывании HHV-6. Хотя их точное взаимодействие еще не определено, было продемонстрировано, что второй и третий домены SCR необходимы для связывания рецептора HHV-6 и входа в клетку.
Лиганд рецептора HHV-6
Mori et al. впервые идентифицировали продукт гена gQ1, гликопротеин, уникальный для HHV-6, и обнаружили, что он образует комплекс с гликопротеинами gH и gL.[12][29] Они полагали, что этот комплекс гетеротримеров служит вирусным лигандом для CD46.[22] Вскоре после этого был идентифицирован другой гликопротеин, названный gQ2, и было обнаружено, что он является частью комплекса лиганд gH / gL / gQ1, образуя гетеротетрамер который был положительно идентифицирован как вирусный лиганд CD46.[29] Точный процесс входа еще не совсем понятен.
Слюнные железы
Слюнные железы были описаны как резервуар in vivo для инфекции HHV-6.[23]
Лейкоциты
Исследователи[30] показали, что Т-клетки очень инфицируются HHV-6.
Нервная система
В 2011 году исследователи Национальные институты здоровья попытался выяснить неизвестный тогда метод, посредством которого HHV-6a проникает в нервную систему. Таким образом, они вскрыли мозг около 150 человек. Когда различные анатомические области были проанализированы на их вирусную нагрузку, обонятельный в тканях обнаружено самое высокое содержание HHV-6. Они пришли к выводу, что эти ткани являются отправной точкой для HHV-6a.[16]
Приведенные выше результаты согласуются с результатами предыдущих исследований, в которых участвовали HSV-1 (и ряд других вирусов), который также распространяется в ЦНС через обонятельную ткань.[31]
Исследователи также предположили, что клетки обонятельной оболочки (OECs), группа специализированных глиальные клетки обнаруженный в полости носа, может играть роль в инфекционности HHV-6.[16] Они подозревали, что эта связь связана с тем, что объекты OEC имеют свойства, аналогичные свойствам астроциты, другой тип глиальных клеток, которые ранее были идентифицированы как чувствительные к инфекции HHV-6.[32] Исследования продолжались путем заражения OEC in vitro обоими типами HHV-6. В конечном счете, только OEC, в которых использовался HHV-6a, дали положительный результат на признаки вирусного синтеза de novo, что также характерно для астроцитов.[32]
Клеточная активность
Оказавшись внутри, были описаны два исхода: активные и неактивные инфекции.
Активная инфекция
Активные инфекции включают циркуляризацию линейного генома дцДНК из конца в конец. ковалентный связи. Впервые об этом процессе сообщили Вирус простого герпеса.[24] После циркуляризации HHV-6 начинает экспрессировать так называемые «немедленные» гены. Эти генные продукты считаются активаторами транскрипции.[7] и может регулироваться экспрессией вирусного микро РНК.[26] Затем происходит последующая экспрессия «ранних генов», которая активирует, например, вирусную ДНК-полимеразы. Ранние гены также участвуют в репликация катящегося круга что следует.[23]
Репликация HHV-6 приводит к образованию конкатемеры, которые представляют собой длинные молекулы, содержащие несколько повторов последовательности ДНК.[33] Эти длинные конкатемеры затем расщепляются между областями pac-1 и pac-2 посредством рибозимы для упаковки генома в отдельные вирионы.[24]
Неактивная инфекция
Не все вновь инфицированные клетки начинают репликацию по катящемуся кругу. Фактически, герпес происходит от греческого слова herpein, что означает «ползать». Герпесвирусы должны «ползать», поскольку они могут войти в латентную стадию, неактивно заражая своего человеческого хозяина. С момента своего открытия в 1993 году это явление было обнаружено среди всех бета-герпесвирусы.[34]
Другие бета-герпесвирусы определяют задержку как ядерную эписома, который представляет собой кольцевую молекулу ДНК (аналог плазмиды ). Считается, что для HHV-6 латентный период происходит исключительно за счет интеграции теломерных повторов вируса в человеческий организм. субтеломерные регионы.[15] Только еще один вирус, Болезнь Марека вирус, как известно, таким образом достигает задержки.[7] Это явление возможно в результате наличия теломерных повторов на концах прямых повторов генома HHV-6.
Правый конец прямого повтора интегрируется в пределах от 5 до 41 повтора теломер человека, и предпочтительно делает это в проксимальном конце.[35] хромосом 9, 17, 18, 19 и 22, но также иногда обнаруживается в хромосомах 10 и 11.[33] Предполагается, что почти 70 миллионов человек являются носителями хромосомно интегрированного HHV-6.[15][33]
Ряд генов, экспрессируемых HHV-6, уникален для его неактивной латентной стадии. Эти гены включают поддержание генома и предотвращение разрушения клетки-хозяина.[35] Например, считается, что белок U94 подавляет гены, которые участвуют в клеточном лизисе (апоптозе), а также может способствовать интеграции теломеров.[23] После того, как вирус сохраняется в теломерах человека, он периодически реактивируется.[35]
Реактивация
Конкретные триггеры реактивации не совсем понятны. Некоторые исследователи предположили, что могут быть связаны травмы, физический или эмоциональный стресс и гормональный дисбаланс.[36]
В 2011 году исследователи обнаружили, что реактивация может быть положительно вызвана in vitro: гистоновая деацетилаза ингибиторы. Как только начинается реактивация, начинается процесс катящегося круга, и конкатемеры образуются, как описано выше.[23]
Взаимодействия
Человеческий герпесвирус 6 живет главным образом на людях и, хотя варианты вируса могут вызывать легкие или смертельные заболевания, могут жить. соразмерно на своем хосте.[13] Было продемонстрировано, что HHV-6 способствует прогрессированию ВИЧ-1 при коинфекции в Т-клетках.[37] HHV-6 усиливает экспрессию CD4 первичного рецептора ВИЧ, таким образом расширяя диапазон чувствительных к ВИЧ клеток. Несколько исследований также показали, что инфекция HHV-6 увеличивает выработку воспалительных цитокинов, которые усиливают экспрессию ВИЧ-1 in vitro, таких как TNF-альфа,[38] ИЛ-1 бета и ИЛ-8.[39] Более недавнее исследование in vivo показывает, что коинфекция HHV-6A резко ускоряет прогрессирование от ВИЧ к СПИДу у макак с косичками.[40]
Также было продемонстрировано, что HHV-6 трансактивирует вирус Эпштейна-Барра.[31]
Эпидемиология
Возраст
Люди заражаются вирусом в раннем возрасте, некоторые даже в возрасте менее одного месяца. На первичные инфекции HHV-6 приходится до 20% обращений в отделения неотложной помощи новорожденным по поводу лихорадки в Соединенных Штатах.[41][42] и связаны с несколькими более серьезными осложнениями, такими как энцефалит, лимфаденопатия, миокардит и миелосупрессия. Распространенность вируса в организме увеличивается с возрастом (уровень инфицирования наиболее высок среди детей в возрасте от 6 до 12 месяцев), и предполагается, что это происходит из-за потери у ребенка материнских антител, которые защищают его или ее от инфекций. .[13]
Существуют несоответствия в отношении корреляции между возрастом и серопозитивностью: по некоторым данным, наблюдается снижение серопозитивность с увеличением возраста, в то время как некоторые указывают на отсутствие значительного снижения, а другие сообщают о повышении уровня серопозитивности у лиц в возрасте 62 лет и старше. После первичного заражения устанавливается латентный период в слюнных железах, гемопоэтические стволовые клетки, и другие клетки, и существует в течение всей жизни хозяина.
Географическое распределение
Известно, что вирус широко распространен по всему миру. Сообщается о том, что уровень инфицирования HHV-6 составляет 64–83% к возрасту 13 месяцев в таких странах, как США, Великобритания, Япония и Тайвань.[13][43] Исследования показали, что серологическая распространенность колеблется «примерно от 39 до 80% среди этнически разнообразного взрослого населения из Танзании, Малайзии, Таиланда и Бразилии».[13] Нет значительных различий между этническими группами, проживающими в одном географическом районе, или между полами. В то время как HHV-6B присутствует почти во всех популяциях мира, HHV-6A, по-видимому, реже встречается в Японии, Северной Америке и Европе.[13]
Передача инфекции
Считается, что передача вируса чаще всего происходит через попадание вирусных частиц в слюну. И HHV-6B, и HHV-7 обнаруживаются в слюне человека, причем первый встречается с меньшей частотой. Исследования сообщают о различных уровнях распространенности HHV-6 в слюне (от 3 до 90%),[13] и также описали слюнные железы как резервуар in vivo для HHV-6. Вирус поражает слюнные железы, устанавливает латентный период и периодически реактивируется, чтобы передать инфекцию другим хозяевам.[23]
Вертикальная передача также был описан и встречается примерно у 1% рождений в США.[7][44] Эту форму легко идентифицировать, поскольку вирусный геном содержится в каждой клетке инфицированного человека.
Диагностика
Диагностика инфекции HHV-6 проводится как серологическими, так и прямыми методами. Наиболее известным методом является количественное определение вирусной ДНК в крови, других жидкостях организма и органах с помощью ПЦР в реальном времени.[45]
Клиническое значение
Классическая картина первичной инфекции HHV-6b выглядит так: субитумная экзантема (ES) или «розеола», характеризующаяся высокой температурой, за которой следует сыпь. Однако одно исследование (1997) показало, что сыпь не является отличительной чертой инфекции HHV-6, с частотой, аналогичной инфекциям, не связанным с HHV-6 (10–20% детей с лихорадкой в обеих группах). Инфекции HHV-6 чаще проявляются при высоких температурах (более 40 ° C) - около двух третей по сравнению с менее чем половиной у пациентов, не инфицированных HHV-6. Столь же значимые различия наблюдались в отношении недомогания, раздражительности и воспаления барабанной перепонки.[13]
Первичная инфекция у взрослых, как правило, протекает тяжелее.[13]
Диагностика вируса, особенно HHV-6B, жизненно важна для пациента из-за побочных эффектов инфекции. Симптомы, указывающие на эту инфекцию, такие как сыпь, остаются незамеченными у пациентов, получающих антибиотики, потому что их можно ошибочно интерпретировать как побочный эффект лекарства.[13] Известно, что HHV-6B связан с детской болезнью roseola infantum, а также с другими заболеваниями, вызванными этой инфекцией. К ним относятся гепатит, фебрильные судороги и энцефалит. У детей, страдающих экзантемой, вызванной инфекцией HHV-6B, лихорадка сохраняется от 3 до 5 дней; высыпания на туловище, шее и лице; а иногда и фебрильные судороги, однако симптомы не всегда присутствуют вместе. Первичные инфекции у взрослых редки, поскольку чаще всего встречаются у детей. Когда инфекция возникает впервые у взрослого, симптомы могут быть серьезными.
Вирус периодически повторно активируется из своего латентного состояния, при этом ДНК HHV-6 выявляется у 20–25% здоровых взрослых людей в США. В иммунокомпетентных условиях эти реактивации часто протекают бессимптомно, но у лиц с ослабленным иммунитетом могут возникнуть серьезные осложнения. Повторная активация HHV-6 вызывает тяжелое заболевание у пересадить реципиентов и может привести к отторжению трансплантата, часто совместно с другими betaherpesviridae. Точно так же в ВИЧ / СПИД, Реактивация HHV-6 вызывает диссеминированные инфекции, ведущие к заболеванию органов-мишеней и смерти. Несмотря на то, что до 100% населения подвержено воздействию вируса HHV-6 (серопозитивно), чаще всего к 3 годам, у взрослых наблюдаются редкие случаи первичных инфекций. В Соединенных Штатах они были больше связаны с HHV-6a, который считается более патогенным и более опасным. нейротропный и был связан с несколькими Центральная нервная система -связанные расстройства.
HHV-6 был зарегистрирован в рассеянный склероз пациенты[46] и был вовлечен в качестве кофактора в несколько других заболеваний, включая Синдром хронической усталости,[47] фибромиалгия, СПИД,[48] оптический неврит, рак, и височная эпилепсия.[49]
Рассеянный склероз
Рассеянный склероз (РС) - это аутоиммунное и воспалительное заболевание нервной системы, которое приводит к демиелинизации аксонов в головном и спинном мозге. История РС в контексте HHV-6 началась в 1995 году, когда Питер Чаллонер, ученый из Корпорация PathoGenesis из Сиэтл, начали искать нечеловеческие генетические последовательности в головном мозге пациентов с РС. Он обнаружил необычно высокую экспрессию ДНК HHV-6 в олигодендроциты. Он также заметил более высокую концентрацию инфицированных клеток в областях, где произошла демиелинизация.[50] Его исследование, вероятно, было первым опубликованным исследованием, предполагающим связь между HHV-6 и MS.
Эпидемиологические данные
Распространенность рассеянного склероза увеличивается в популяциях по мере того, как они удаляются от Экватор.[51][52] Заболеваемость в три раза выше среди рожденных 42 градуса северной широты и выше, чем у рожденных 37 градус северной широты и ниже.Люди также с меньшей вероятностью заболеют РС во взрослом возрасте, если их детство прошло в регионе с низкой заболеваемостью. Возможность возникновения инфекционного агента, вызывающего РС, оценивалась через призму этих эпидемиологических данных.
Для объяснения приведенных выше данных были предложены две гипотезы.[53] Первая из них известна как гипотеза полиомиелита и предполагает, что инфекция в молодом возрасте дает иммунитет, а инфицирование взрослых увеличивает риск РС. Вторая, известная как гипотеза распространенности, предполагает, что РС вызывается патогеном, который чаще встречается в регионах с высокими показателями РС. Этот патоген может быть широко распространенным и вызывать бессимптомную (латентную) инфекцию у большинства людей. Лишь изредка и спустя годы после первичного инфицирования этот гипотетический агент вызывает неврологические симптомы РС. Третья гипотеза по существу объединяет эти две гипотезы, а также предполагает участие нескольких патогенов. Третий вариант лучше всего относится к эпидемиологическим данным.[53][54]
Возможное вирусное поражение
Парадокс вируса Эпштейна-Барра (EBV) также заслуживает внимания, поскольку сообщалось, что HHV-6 трансактивирует EBV.[31] Люди имеют в 10 раз меньший риск РС, если они серонегативны по ВЭБ. Однако среди людей с положительным диагнозом те, кто заражается ВЭБ в более позднем возрасте, имеют в 3 раза больший риск РС.
Исследования показывают, что вирусные инфекции могут быть еще более связаны с РС. Антитела к ВЭБ у здоровых людей остаются постоянными, тогда как уровни антител у лиц, у которых позже развивается рассеянный склероз, начинают расти и выходить на плато в возрасте от 20 до 30 лет, независимо от возраста начала.
Более конкретно в отношении HHV-6, исследователи в 2004 году обнаружили, что начальные стадии рассеянного склероза связаны с высоким уровнем активного вируса.[55] Вскоре после этого исследователи обнаружили, что уровни активного HHV-6 также повышаются во время рецидивов / обострений РС.[4]
Исследователи продемонстрировали, что уровни антител IgG1 и IgM к HHV-6 повышены у пациентов с РС по сравнению с контрольной группой.[23] Фактически, исследование, опубликованное в 2014 году, показало, что повышение титров IgG и IgM к HHV-6A / B является прогностическим фактором рецидива РС.[56]
Анализ эпидемиологических, серологических и иммунологических данных выше подтверждает связь между инфекционным агентом и РС. Однако точный механизм возможного вирусного влияния на проявление РС менее ясен. Хотя было предложено несколько механизмов: молекулярная мимикрия, пути фосфорилирования и цитокины.[16][57][58][59][60]
Молекулярная мимикрия
Первое исследование, специально посвященное изучению демиелинизации, связанной с HHV-6, появилось в литературе в 1996 году, когда у ранее здорового 19-месячного ребенка развился острый синдром. энцефалопатия. Уровни основной белок миелина были подняты в его спинномозговая жидкость, что свидетельствует о демиелинизации.[57] Об этой связи почти забыли, пока четыре года спустя не было опубликовано исследование, связанное с РС, которое показало, что распространенность HHV-6 среди демиелинизированных тканей мозга составляет 90%. Для сравнения, вирус был обнаружен лишь в 13% здоровых тканей мозга.[61]
Гипотеза молекулярной мимикрии, в которой Т-клетки по существу путают вирусный белок HHV-6 с основным белком миелина, впервые появившимся примерно в это время. В начале разработки этой гипотезы (2002 г.) итальянские исследователи использовали вариант HHV-6a вместе с основным белком бычьего миелина для создания перекрестно-реактивных Т-клеточных линий. Их сравнивали с Т-клетками людей с РС, а также с клетками контрольной группы, и между ними не было обнаружено значительных различий. Их ранние исследования показали, что молекулярная мимикрия не может быть механизмом, участвующим в РС.[58]
Спустя несколько месяцев исследователи из США создали синтетический пептид с последовательностью, идентичной пептиду HHV-6. Им удалось показать, что Т-клетки активировались этим пептидом. Эти активированные Т-клетки также распознают и инициируют иммунный ответ против синтетически созданной пептидной последовательности, которая идентична части основного белка миелина человека. В ходе своего исследования они обнаружили, что уровни этих перекрестно-реактивных Т-клеток значительно повышены у пациентов с РС.[59] Их исследование завершилось предположением, что HHV-6 действительно может быть возбудителем рассеянного склероза.
Последовало несколько подобных исследований. Исследование, проведенное в октябре 2014 года, подтвердило роль долгосрочной инфекции HHV-6 с демиелинизацией в прогрессирующих неврологических заболеваниях.[62]
Пути фосфорилирования
Основной белок миелина (MBP) регулярно обменивает фосфатные группы с окружающей средой, и его способность делать это имеет значение для надлежащего миелиновой оболочки честность. Более конкретно, два остатка треонина на MBP были идентифицированы как мишени фосфорилирования киназа гликогенсинтазы и митоген-активированная протеинкиназа. Считается, что их действие на MBP способствует его способности полимеризовать и связывать миелин. Фосфорилированный МВР также более устойчив к нескольким протеазам.[60]
Было обнаружено, что среди людей с РС эти целевые треонины фосфорилируются реже. Фактически, HHV-6 продуцирует трансмембранный белок, известный как U24, который также является мишенью фосфорилирования киназ, упомянутых ранее. Наши киназы действуют на белок HHV-6 благодаря общей последовательности из семи аминокислот (MBP92–104= IVTPRTPPPSQGK; U241–13= MDPPRTPPPSYSE). В результате существенные посттрансляционные модификации могут не происходить для MBP у людей с активными инфекциями HHV-6.[60]
- Рассеянный склероз - прямое повреждение клеток и измененные цитокины
Было показано, что HHV-6 может инфицировать клетки обонятельной оболочки (ОИК). OEC были тщательно исследованы в отношении травм спинного мозга, боковой амиотрофический склероз, и другие нейродегенеративные заболевания. Исследователи предполагают, что эти клетки обладают уникальной способностью ремиелинизировать поврежденные нейроны.[16]
Некоторые из генов, экспрессируемых HHV-6, влияют на уровни хозяина различных цитокины (см. раздел о генных продуктах). Например, инфицированные клетки имеют повышенный уровень интерлейкин-8, который, как полагают, вызывает ММП-9 репрессии. Повышенные уровни MMP-9 были обнаружены среди людей с РС.[63]
Реактивация HHV-6 также вовлечена в обострение MS через сдвиг в субпопуляциях Th-лимфоцитов.[64]
Синдром хронической усталости
Синдром хронической усталости (CFS) - изнурительное заболевание,[65] причина неизвестна. Пациенты с CFS имеют ненормальные неврологические, иммунологические и метаболические признаки.
У многих, но не у всех пациентов, соответствующих критериям СХУ, болезнь начинается с острого инфекционного синдрома. Случаи CFS могут следовать за хорошо задокументированными инфекциями, вызванными несколькими инфекционными агентами.[66] В исследовании 259 пациентов с «CFS-подобным» заболеванием, опубликованном вскоре после обнаружения HHV-6, использовались культуры первичных лимфоцитов для идентификации людей с активной репликацией HHV-6. Такая активная репликация была обнаружена у 70% пациентов по сравнению с 20% контрольных субъектов ().[67] Вопрос, поставленный, но не получивший ответа в этом исследовании, заключался в том, вызывает ли заболевание тонкий иммунный дефицит, который привел к реактивации HHV-6, или реактивация HHV-6 привела к симптомам болезни.
Последующие исследования с использованием только серологических методов, которые не позволяют отличить активную инфекцию от латентной, дали смешанные результаты: большинство, но не все, обнаружили связь между CFS и инфекцией HHV-6.[66][68][69]
В других исследованиях использовались анализы, которые могут обнаружить активную инфекцию: первичная клеточная культура, ПЦР сыворотки или плазмы или анализы ранних антигенных антител IgM. Большинство этих исследований показали связь между CFS и активной инфекцией HHV-6,[68][70][71][72][73][74] хотя некоторые этого не сделали.[69][75]
Таким образом, активная инфекция HHV-6 присутствует у значительной части пациентов с CFS. Кроме того, известно, что HHV-6 инфицирует клетки нервной системы и иммунной системы, системы органов с явными нарушениями при CFS. Несмотря на эту связь, остается недоказанным, что реактивированная инфекция HHV-6 является причиной CFS.
Тиреоидит Хашимото
Тиреоидит Хашимото самый распространенный щитовидная железа заболевание и характеризуется обильным лимфоцит инфильтрат и нарушение щитовидной железы. Недавние исследования предполагают потенциальную роль HHV-6 (возможно, варианта A) в развитии или запуске тиреоидита Хашимото.[76]
Беременность
Роль HHV-6 во время беременности, приводящей к воспалению в амниотическая полость был изучен.[77]
Бесплодие
ДНК HHV-6A была обнаружена в эндометрий почти у половины группы бесплодных женщин, но ни у одной из контрольной группы фертильности. Естественные клетки-киллеры специфичен для HHV-6A, и высокие уровни определенных цитокины, были также обнаружены в эндометрии бесплодных женщин с положительным результатом на HHV-6A. Авторы предполагают, что HHV-6A может оказаться важным фактором в женское бесплодие.[78]
Рак
Идентифицировано множество онкогенных вирусов человека. Например, HHV-8 связан с Саркома Капоши,[79] то Вирус Эпштейна-Барра к Лимфома Беркитта, и ВПЧ к рак шейки матки. Фактически, Всемирная организация здоровья по оценкам (2002), 17,8% случаев рака у человека были вызваны инфекцией.[80] Типичные методы, с помощью которых вирусы инициируют онкогенез, включают подавление иммунной системы хозяина, вызывая воспаление или изменяя гены.
HHV-6 был обнаружен в лимфомы, лейкемии, рак шейки матки, и опухоли головного мозга.[14] Разные медуллобластома линии клеток, а также клетки других опухолей головного мозга, как было показано, экспрессируют рецептор CD46. Вирусная ДНК также была обнаружена во многих других непатологических тканях мозга, но уровни ниже.[14]
Человек P53 белок действует как супрессор опухолей. Люди, которые не вырабатывают этот белок должным образом, чаще заболевают раком - феноменом, известным как Синдром Ли-Фраумени. Один из продуктов гена HHV-6, белок U14, связывает P53 и включает его в вирионы. Другой продукт гена, белок ORF-1, также может связывать и инактивировать P53. Было даже показано, что клетки, экспрессирующие ген ORF-1, производят фибросаркомы при введении мышам.[14]
Другой продукт HHV-6, немедленный ранний белок U95, как было показано, связывает ядерный фактор-каппа B. Нарушение регуляции этого фактора связано с раком.[14]
Оптический неврит
О глазном воспалении, вызванном HHV-6, сообщалось трижды. Все три случая были зарегистрированы у пожилых людей, двое в 2007 году и один в 2011 году. Первые два были зарегистрированы в Японии и Франции, последний - в Японии.[81][82][83]
Считалось, что это произошло в результате реактивации, поскольку уровни антител IgM к HHV-6 были низкими.[83]
Височная эпилепсия
Эпилепсия мезиальной височной доли связана с инфекцией HHV-6. В этой области мозга существуют три структуры: миндалина, гиппокамп, и парагиппокампальная извилина. Мезиальная височная эпилепсия (MTLE) является наиболее распространенной формой хронической эпилепсии, и ее основной механизм до конца не изучен.[84]
Исследователи постоянно сообщают об обнаружении ДНК HHV-6 в тканях, удаленных от пациентов с MTLE. Исследования показали склонность HHV-6 к агрегации в височной доле,[85] с наибольшими концентрациями в астроцитах гиппокампа.[84]
Однако одна группа исследователей в конечном итоге пришла к выводу, что HHV-6 может не участвовать в MTLE, связанном с мезиальным височным склерозом.[86]
Отказ печени
Вирус является частой причиной дисфункции печени и острой печеночной недостаточности, а недавно его связали с перипортальным сливным некрозом. Более того, ДНК HHV-6 часто обнаруживается только в тканях биопсии, поскольку в устойчивых случаях уровни ДНК опускаются ниже уровня обнаружения в крови.[87]
Уход
Не существует фармацевтических препаратов, одобренных специально для лечения инфекции HHV-6, хотя использование Цитомегаловирус лечение (валганцикловир, ганцикловир,[88] цидофовир, и фоскарнет ) показали некоторый успех.[7] Эти препараты вводятся с целью ингибирования правильной полимеризации ДНК путем конкуренции с дезокситрифосфатными нуклеотидами.[88] или специально инактивируя вирусные ДНК-полимеразы.[2]
Поиск лечения может быть затруднен, если после операции по трансплантации происходит реактивация HHV-6, поскольку лекарства для трансплантации включают иммунодепрессанты.[89]
Рекомендации
- ^ а б c d Adams, M. J .; Карстенс, Э. Б. (2012). «Голосование по ратификации таксономических предложений в Международный комитет по таксономии вирусов (2012 г.)». Архив вирусологии. 157 (7): 1411–1422. Дои:10.1007 / s00705-012-1299-6. PMID 22481600.
- ^ а б Jaworska, J .; Гравий, А .; Фламанд, Л. (2010). «Дивергентная восприимчивость вариантов 6-го герпесвируса человека к интерферонам I типа». Труды Национальной академии наук. 107 (18): 8369–74. Bibcode:2010PNAS..107.8369J. Дои:10.1073 / pnas.0909951107. ЧВК 2889514. PMID 20404187.
- ^ De Bolle, L .; Van Loon, J .; De Clercq, E .; Наесенс, Л. (2005). «Количественный анализ тропизма 6 клеток герпесвируса человека». Журнал медицинской вирусологии. 75 (1): 76–85. Дои:10.1002 / jmv.20240. PMID 15543581.
- ^ а б Альварес-Лафуэнте, Роберто; Гарсия-Монтохо, Марта; Де-лас-Эрас, Вирджиния; Бартоломе, Мануэль; Арройо, Рафаэль (2006). «Клинические параметры и активная репликация HHV-6 у пациентов с рецидивирующим рассеянным склерозом». Журнал клинической вирусологии. 37: S24–6. Дои:10.1016 / S1386-6532 (06) 70007-5. PMID 17276363.
- ^ Ридхед, Бен; Haure-Mirande, Жан-Вианне; Funk, Cory C .; Ричардс, Мэтью А .; Шеннон, Пол; Арутюнян, Ваграм; Сано, Мэри; Лян, Винни С .; Бекманн, Ноам Д.; Прайс, Натан Д.; Рейман, Эрик М .; Schadt, Eric E .; Эрлих, Мишель Э .; Ганди, Сэм; Дадли, Джоэл Т. (июнь 2018 г.). «Многоуровневый анализ независимых когорт болезни Альцгеймера обнаруживает нарушение молекулярных, генетических и клинических сетей вирусом герпеса человека». Нейрон. 99 (1): 64–82.e7. Дои:10.1016 / j.neuron.2018.05.023. ЧВК 6551233. PMID 29937276.
- ^ Йошикава, Тетсуши (2004). «Инфекция вируса герпеса 6 человека у пациентов с трансплантацией гемопоэтических стволовых клеток». Британский журнал гематологии. 124 (4): 421–32. Дои:10.1046 / j.1365-2141.2003.04788.x. PMID 14984492.
- ^ а б c d е ж грамм Фламанд, Луи; Komaroff, Anthony L .; Арбакл, Джесси Х .; Medveczky, Peter G .; Аблаши, Дхарам В. (2010). «Обзор, часть 1: Основы биологии вируса герпеса человека-6, диагностические тесты и противовирусная эффективность». Журнал медицинской вирусологии. 82 (9): 1560–8. Дои:10.1002 / jmv.21839. PMID 20648610.
- ^ Андерсон, Л. (1988). "Семейство ретровирусов человека: рак, заболевание центральной нервной системы и СПИД". Журнал JNCI Национального института рака. 80 (13): 987–9. Дои:10.1093 / jnci / 80.13.987. PMID 2842514.
- ^ а б Salahuddin, S .; Аблаши, Д .; Markham, P .; Josephs, S .; Штурценеггер, S; Каплан, М; Халлиган, G; Биберфельд, П; и другие. (1986). «Выделение нового вируса HBLV у пациентов с лимфопролиферативными заболеваниями». Наука. 234 (4776): 596–601. Bibcode:1986Научный ... 234..596Z. Дои:10.1126 / science.2876520. PMID 2876520.
- ^ Аблаши, ДВ; Салахуддин, С.З.; Джозефс, Сан-Франциско; Имам, Ж; Lusso, P; Галло, RC; Hung, C; Лемп, Дж; Маркхэм, PD (1987). «HBLV (или HHV-6) в линиях клеток человека». Природа. 329 (6136): 207. Bibcode:1987Натура.329..207А. Дои:10.1038 / 329207a0. PMID 3627265.
- ^ Аблаши, Дхарам; Крюгер, Герхард (2006). Общая вирусология, эпидемиология и клиническая патология вируса герпеса-6 человека (2-е изд.). Берлингтон: Эльзевир. п.7. ISBN 9780080461281.
- ^ а б Кавабата, А .; Oyaizu, H .; Maeki, T .; Tang, H .; Yamanishi, K .; Мори, Ю. (2011). «Анализ нейтрализующего антитела к вирусу герпеса человека 6B показывает роль гликопротеина Q1 в проникновении вируса». Журнал вирусологии. 85 (24): 12962–71. Дои:10.1128 / JVI.05622-11. ЧВК 3233151. PMID 21957287.
- ^ а б c d е ж грамм час я j Браун, ДК; Домингес, G; Пеллетт, ЧП (1997). «Вирус герпеса человека 6». Обзоры клинической микробиологии. 10 (3): 521–67. Дои:10.1128 / CMR.10.3.521. ЧВК 172933. PMID 9227865.
- ^ а б c d е ж Кофман, Александр; Марцинкевич, Лукас; Дюпар, Эван; Лищев, Антон; Мартынов, Борис; Рындин, Анатолий; Котелевская, Елена; Браун, Джей; и другие. (2011). «Роль вирусов в инициации опухоли головного мозга и онкомодуляции». Журнал нейроонкологии. 105 (3): 451–66. Дои:10.1007 / s11060-011-0658-6. ЧВК 3278219. PMID 21720806.
- ^ а б c Arbuckle, J. H .; Medveczky, M. M .; Лука, Дж .; Hadley, S.H .; Luegmayr, A .; Аблаши, Д .; Lund, T. C .; Tolar, J .; и другие. (2010). «Скрытый геном герпесвируса-6A человека специфически интегрируется в теломеры хромосом человека in vivo и in vitro». Труды Национальной академии наук. 107 (12): 5563–5568. Bibcode:2010PNAS..107.5563A. Дои:10.1073 / pnas.0913586107. ЧВК 2851814. PMID 20212114.
- ^ а б c d е Harberts, E .; Yao, K .; Wohler, J. E .; Maric, D .; Ohayon, J .; Хенкин, Р .; Якобсон, С. (2011). «Попадание вируса герпеса-6 в центральную нервную систему по обонятельному пути». Труды Национальной академии наук. 108 (33): 13734–9. Bibcode:2011PNAS..10813734H. Дои:10.1073 / pnas.1105143108. ЧВК 3158203. PMID 21825120.
- ^ Феннер, Ф. (1971). «Номенклатура и классификация вирусов Международного комитета по номенклатуре вирусов». Вирусология. 46 (3): 979–980. Дои:10.1016/0042-6822(71)90102-4. PMID 18619371.
- ^ Феннер, Ф. (1976). «Классификация и номенклатура вирусов. Второй доклад Международного комитета по таксономии вирусов». Интервирология. 7 (1–2): 1–115. Дои:10.1159/000149938. PMID 826499.
- ^ Дэвисон А.Дж. (2010) Систематика вирусов герпеса. Вет. Microbiol. 143 (1–2): 52–69
- ^ а б Кавабата, Акико; Тан, Хуамин; Хуанг, Хунлань; Яманиши, Коичи; Мори, Ясуко (2009). «Y Компоненты оболочки вируса герпеса человека 6, обогащенные липидными рафтами: данные о липидных рафтах, связанных с вирионом». Журнал вирусологии. 6: 127. Дои:10.1186 / 1743-422X-6-127. ЧВК 2743664. PMID 19689819.
- ^ а б c d е Dominguez, G .; Dambaugh, T. R .; Stamey, F. R .; Dewhurst, S .; Inoue, N .; Пеллетт П. Э. (1999). «Последовательность генома вируса герпеса человека 6B: кодирующее содержание и сравнение с вирусом герпеса человека 6A». Журнал вирусологии. 73 (10): 8040–8052. Дои:10.1128 / JVI.73.10.8040-8052.1999. ЧВК 112820. PMID 10482553.
- ^ а б Тан, Хуамин; Кавабата, Акико; Ёсида, Маюми; Ояйдзу, Хироко; Маэки, Такахиро; Яманиши, Коичи; Мори, Ясуко (2010). «Ген гликопротеина Q1, кодируемый вирусом герпеса 6 человека, необходим для роста вируса». Вирусология. 407 (2): 360–7. Дои:10.1016 / j.virol.2010.08.018. PMID 20863544.
- ^ а б c d е ж грамм час я Арбакл, Джесси Х .; Медвецкий, Петр Г. (2011). «Молекулярная биология латентного периода вируса герпеса-6 человека и интеграции теломер». Микробы и инфекции. 13 (8–9): 731–41. Дои:10.1016 / j.micinf.2011.03.006. ЧВК 3130849. PMID 21458587.
- ^ а б c Borenstein, R .; Френкель, Н. (2009). «Клонирование генома вируса герпеса человека 6A в бактериальные искусственные хромосомы и исследование промежуточных продуктов репликации ДНК». Труды Национальной академии наук. 106 (45): 19138–19143. Bibcode:2009PNAS..10619138B. Дои:10.1073 / pnas.0908504106. ЧВК 2767366. PMID 19858479.
- ^ а б c d е Ёсикава, Тетсуши; Асано, Йошизо; Акимото, Шихо; Одзаки, Такао; Ивасаки, Такуя; Курата, Такеши; Госима, Фуми; Нисияма, Юкихиро (2002). «Скрытая инфекция вируса герпеса человека 6 в клеточной линии астроцитомы и изменение синтеза цитокинов». Журнал медицинской вирусологии. 66 (4): 497–505. Дои:10.1002 / jmv.2172. PMID 11857528.
- ^ а б Tuddenham, L .; Jung, J. S .; Chane-Woon-Ming, B .; Dolken, L .; Пфеффер, С. (2011). «Глубокое секвенирование малых РНК выявляет микроРНК и другие небольшие некодирующие РНК из вируса герпеса человека 6B». Журнал вирусологии. 86 (3): 1638–49. Дои:10.1128 / JVI.05911-11. ЧВК 3264354. PMID 22114334.
- ^ Tang, H .; Hayashi, M .; Maeki, T .; Yamanishi, K .; Мори, Ю. (2011). «Образование гликопротеинового комплекса вируса герпеса 6 человека необходимо для сворачивания и перемещения комплекса gH / gL / gQ1 / gQ2 и его связывания с клеточным рецептором». Журнал вирусологии. 85 (21): 11121–30. Дои:10.1128 / JVI.05251-11. ЧВК 3194968. PMID 21849437.
- ^ Greenstone, H.L .; Санторо, Ф; Lusso, P; Бергер, EA (2002). «Человеческий герпесвирус 6 и вирус кори используют разные домены CD46 для рецепторной функции». Журнал биологической химии. 277 (42): 39112–8. Дои:10.1074 / jbc.M206488200. PMID 12171934.
- ^ а б Мори, Ясуко (2009). «Последние темы, связанные с тропизмом 6 клеток герпеса человека». Клеточная микробиология. 11 (7): 1001–6. Дои:10.1111 / j.1462-5822.2009.01312.x. PMID 19290911.
- ^ J Exp Med. 1995 г., 1 апреля; 181 (4): 1303–10. Заражение гамма / дельта Т-лимфоцитов вирусом герпеса человека 6: индукция транскрипции CD4 и восприимчивость к ВИЧ-инфекции. Луссо П., Гарзино-Демо А, Кроули Р.В., Малнати М.С.
- ^ а б c Liedtke, W .; Опалка, Б .; Zimmermann, C.W .; Лигниц, Э. (1993). «Возрастное распределение латентного вируса простого герпеса 1 и генома вируса ветряной оспы в нервной ткани человека». Журнал неврологических наук. 116 (1): 6–11. Дои:10.1016 / 0022-510X (93) 90082-А. PMID 8389816.
- ^ а б Кассиани-Ингони, Риккардо; Greenstone, Heather L .; Донати, Донателла; Фогделл-Хан, Анна; Мартинелли, Елена; Рефаи, Даниэль; Мартин, Роланд; Бергер, Эдвард А .; Джейкобсон, Стивен (2005). «CD46 на глиальных клетках может функционировать как рецептор для вирусного гликопротеина-опосредованного слияния клеток и клеток». Глия. 52 (3): 252–8. Дои:10.1002 / glia.20219. PMID 15920733.
- ^ а б c Morissette, G .; Фламанд, Л. (2010). «Герпесвирусы и хромосомная интеграция». Журнал вирусологии. 84 (23): 12100–9. Дои:10.1128 / JVI.01169-10. ЧВК 2976420. PMID 20844040.
- ^ Потенца, Леонардо; Бароцци, Патриция; Торелли, Джузеппе; Луппи, Марио (2010). «Трансляционные проблемы хромосомной интеграции вируса герпеса человека 6». Будущая микробиология. 5 (7): 993–5. Дои:10.2217 / fmb.10.74. HDL:11380/704738. PMID 20632798.
- ^ а б c Kaufer, B. B .; Jarosinski, K. W .; Остерридер, Н. (2011). «Теломерные повторы герпесвируса способствуют геномной интеграции в теломеры хозяина и мобилизации вирусной ДНК во время реактивации». Журнал экспериментальной медицины. 208 (3): 605–15. Дои:10.1084 / jem.20101402. ЧВК 3058580. PMID 21383055.
- ^ Исэгава, Юдзи; Мацумото, Чиса; Нисинака, Кадзуко; Накано, Казуши; Танака, Тацуя; Сугимото, Накаба; Охшима, Ацуши (2010). «ПЦР с тушащими зондами позволяет быстро обнаруживать и идентифицировать мутации гена U69, вызывающие устойчивость к ганцикловиру, в герпесвирусе человека 6». Молекулярные и клеточные зонды. 24 (4): 167–77. Дои:10.1016 / j.mcp.2010.01.002. PMID 20083192.
- ^ Луссо, Паоло; Де Мария, Андреа; Малнати, Мауро; Лори, Франко; Derocco, Susan E .; Базелер, Майкл; Галло, Роберт С. (1991). «Индукция CD4 и восприимчивость к ВИЧ-1 инфекции в человеческих CD8 + Т-лимфоцитах вирусом герпеса человека 6». Природа. 349 (6309): 533–5. Bibcode:1991Натура.349..533L. Дои:10.1038 / 349533a0. PMID 1846951.
- ^ Арена, А; Liberto, MC; Capozza, AB; Фока, А (1997). «Продуктивная инфекция HHV-6 в дифференцированных клетках U937: роль TNF-альфа в регуляции HHV-6». Новая микробиология. 20 (1): 13–20. PMID 9037664.
- ^ Инаги, Рэйко; Гунтапонг, Ратигорн; Накао, Масаюки; Ишино, Йошизуми; Каваниси, Казунобу; Исегава, Юдзи; Яманиши, Коичи (1996). «Человеческий герпесвирус 6 индуцирует экспрессию гена IL-8 в клеточной линии гепатомы человека, Hep G2». Журнал медицинской вирусологии. 49 (1): 34–40. Дои:10.1002 / (SICI) 1096-9071 (199605) 49: 1 <34 :: AID-JMV6> 3.0.CO; 2-L. PMID 8732869.
- ^ Lusso, P .; Crowley, R.W .; Малнати, М. С .; Di Serio, C .; Ponzoni, M .; Biancotto, A .; Markham, P.D .; Галло, Р. К. (2007). «Вирус герпеса человека 6A ускоряет прогрессирование СПИДа у макак». Труды Национальной академии наук. 104 (12): 5067–72. Bibcode:2007PNAS..104.5067L. Дои:10.1073 / pnas.0700929104. JSTOR 25427145. ЧВК 1829265. PMID 17360322.
- ^ Холл, Кэролайн Бриз; Лонг, Кристин Э .; Schnabel, Kenneth C .; Казерта, Мэри Т .; Макинтайр, Ким М .; Костанцо, Мария А .; Нотт, Энн; Дьюхерст, Стивен; и другие. (1994). «Инфекция герпесвирусом-6 у детей - проспективное исследование осложнений и реактивации». Медицинский журнал Новой Англии. 331 (7): 432–8. Дои:10.1056 / NEJM199408183310703. PMID 8035839.
- ^ Недавно обнаруженный вирус герпеса назван основной причиной болезней молодых, Нью-Йорк Таймс
- ^ Окуно, Т; Такахаши, К. Balachandra, K; Шираки, К; Яманиши, К; Такахаши, М; Баба, К. (1989). «Сероэпидемиология инфекции вируса герпеса 6 человека у здоровых детей и взрослых». Журнал клинической микробиологии. 27 (4): 651–3. Дои:10.1128 / JCM.27.4.651-653.1989. ЧВК 267390. PMID 2542358.
- ^ Araujo, A .; Pagnier, A .; Frange, P .; Wroblewski, I .; Stasia, M.-J .; Morand, P .; Плантаз, Д. (2011). «Синдром активации лимфогистиоцитов, ассоциированный с инфекцией. Burkholderia cepacia комплекс, вызванный nourrisson révélant une granulomatose septique et une intégration génomique du вируса HHV-6 "[синдром активации лимфогистиоцитов и инфекция комплекса Burkholderia cepacia у ребенка, выявляющая хроническое гранулематозное заболевание и хромосомную интеграцию генома HHV-6]. Archives de Pédiatrie (На французском). 18 (4): 416–9. Дои:10.1016 / j.arcped.2011.01.006. PMID 21397473.
- ^ Агут Анри, Боннафус Паскаль, Готере-Дежан Аньес (2015). «Лабораторные и клинические аспекты инфекций, вызванных вирусом герпеса человека 6». Обзоры клинической микробиологии. 28: 313–335. Дои:10.1128 / CMR.00122-14.CS1 maint: несколько имен: список авторов (связь)
- ^ Alvarez-Lafuente, R .; Martin-Estefania, C .; De Las Heras, V .; Castrillo, C .; Cour, I .; Picazo, J.J .; Varela De Seijas, E .; Арройо, Р. (2002). «Распространенность ДНК герпесвируса у больных РС и здоровых доноров крови». Acta Neurologica Scandinavica. 105 (2): 95–9. Дои:10.1034 / j.1600-0404.2002.1o050.x. PMID 11903118.
- ^ Комаров, Энтони Л. (2006). «Является ли вирус герпеса-6 спусковым крючком для синдрома хронической усталости?». Журнал клинической вирусологии. 37: S39–46. Дои:10.1016 / S1386-6532 (06) 70010-5. PMID 17276367.
- ^ HHV-6 и СПИД В архиве 8 февраля 2007 г. Wayback Machine, Висконсинская группа вирусных исследований
- ^ Фотерингем, Джули; Донати, Донателла; Ахьяни, Нахид; Фогделл-Хан, Анна; Вортмейер, Александр; Heiss, John D .; Уильямс, Элизабет; Вайнштейн, Стивен; и другие. (2007). "Ассоциация вируса герпеса человека-6B с мезиальной височной эпилепсией". PLOS Медицина. 4 (5): e180. Дои:10.1371 / journal.pmed.0040180. ЧВК 1880851. PMID 17535102.[ненадежный медицинский источник? ]
- ^ Чаллонер, Питер Б .; Смит, Кирстен Т .; Паркер, Джей Д.; MacLeod, David L .; Coulter, Silvija N .; Роза, Тимоти М .; Шульц, Эмили Р .; Линдсли Беннетт, Дж .; и другие. (1995). «Связанная с бляшками экспрессия вируса герпеса 6 человека при рассеянном склерозе». Труды Национальной академии наук Соединенных Штатов Америки. 92 (16): 7440–4. Bibcode:1995PNAS ... 92.7440C. Дои:10.1073 / пнас.92.16.7440. ЧВК 41355. PMID 7638210.
- ^ Компстон, Аластер; Коулз, Аласдер (2008). "Рассеянный склероз". Ланцет. 372 (9648): 1502–17. Дои:10.1016 / S0140-6736 (08) 61620-7. PMID 18970977.
- ^ Компстон, Аластер; Коулз, Аласдер (2002). "Рассеянный склероз". Ланцет. 359 (9313): 1221–31. Дои:10.1016 / S0140-6736 (02) 08220-X. PMID 11955556.
- ^ а б Эрнан, Мигель А .; Zhang, Shumin M .; Липуорт, Лорен; Олек, Майкл Дж .; Аскерио, Альберто (2001). «Рассеянный склероз и возраст при заражении распространенными вирусами». Эпидемиология. 12 (3): 301–6. Дои:10.1097/00001648-200105000-00009. PMID 11337603.
- ^ Дельбу, Серена; Карлуччио, Сильвия; Ферранте, Паскуале (2012). «Долгая и развивающаяся связь между вирусами и рассеянным склерозом». Будущая вирусология. 7 (9): 871–83. Дои:10.2217 / fvl.12.78.
- ^ Ротола, А; Мерлотти, я; Каниатти, L; Caselli, E; Granieri, E; Тола, MR; Ди Лука, Д; Кассай, Э (2004). «Человеческий герпесвирус 6 поражает центральную нервную систему больных рассеянным склерозом на ранних стадиях заболевания». Рассеянный склероз. 10 (4): 348–54. Дои:10.1191 / 1352458504ms1045oa. PMID 15327028.
- ^ Ортега-Мадуэно, I .; Гарсия-Монтохо, М .; Домингес-Мозо, М .; Ариас-Лил, А .; Казанова, И. (2014). «IgG к вирусу герпеса человека 6A / B коррелирует с рецидивами и прогрессированием рассеянного склероза». PLOS One. 9 (8): e104836. Bibcode:2014PLoSO ... 9j4836O. Дои:10.1371 / journal.pone.0104836. ЧВК 4128748. PMID 25110949.
- ^ а б Kamei, A .; Ichinohe, S .; Onuma, R .; Hiraga, S .; Фудзивара, Т. (1997). «Острая диссеминированная демиелинизация вследствие первичной инфекции вируса герпеса-6 человека». Европейский журнал педиатрии. 156 (9): 709–12. Дои:10.1007 / s004310050695. PMID 9296535.
- ^ а б Чироне, Мара; Куомо, Лаура; Зомпетта, Клаудиа; Руджери, Стефано; Фрати, Луиджи; Фаджони, Альберто; Рагона, Джузеппе (2002). «Человеческий герпесвирус 6 и рассеянный склероз: исследование перекрестной реактивности Т-клеток на вирусные и основные белковые антигены миелина». Журнал медицинской вирусологии. 68 (2): 268–72. Дои:10.1002 / jmv.10190. ЧВК 7167112. PMID 12210418.
- ^ а б Техада-Симон, Мария В .; Zang, Ying C.Q .; Хун, Цзянь; Ривера, Виктор М .; Чжан, Цзинву З. (2003). «Перекрестная реактивность с основным белком миелина и вирусом герпеса-6 человека при рассеянном склерозе». Анналы неврологии. 53 (2): 189–97. Дои:10.1002 / ana.10425. PMID 12557285.
- ^ а б c Tait, A; Страус, S (2008). «Фосфорилирование U24 из вируса герпеса человека типа 6 (HHV-6) и его потенциальная роль в имитации основного белка миелина (MBP) при рассеянном склерозе». Письма FEBS. 582 (18): 2685–8. Дои:10.1016 / j.febslet.2008.06.050. PMID 18616943.
- ^ Knox, Konstance K .; Брюэр, Джозеф Х .; Генри, Джеймс М .; Харрингтон, Дэниел Дж .; Карриган, Дональд Р. (2000). «Человеческий герпесвирус 6 и рассеянный склероз: системные активные инфекции у пациентов с ранним заболеванием». Клинические инфекционные болезни. 31 (4): 894–903. Дои:10.1086/318141. PMID 11049767.
- ^ Pietilainen-Nicklen, J .; Виртанен, Дж (2014). «HHV-6-позитивность при заболеваниях с демиелинизацией». Журнал клинической вирусологии. 61 (2): 216–9. Дои:10.1016 / j.jcv.2014.07.006. PMID 25088617.
- ^ Кавамура, Йошики; Сугата, Кен; Ихира, Масару; Михара, Такатеру; Муто, Тацуро; Асано, Йошизо; Ёсикава, Тетсуши (2011). «Различные характеристики герпесвирусного энцефалита человека 6 между первичной инфекцией и реактивацией вируса». Журнал клинической вирусологии. 51 (1): 12–9. Дои:10.1016 / j.jcv.2011.02.002. PMID 21376661.
- ^ Нора-Крукле, З; Чапенко, С; Логина, I; Миллерс, А; Platkajis, A; Муровская, М (2011). «Реактивация вируса герпеса человека 6 и 7 и активность заболевания при рассеянном склерозе». Medicina. 47 (10): 527–31. Дои:10.3390 / medicina47100075. PMID 22186115.
- ^ Фукуда, К; Straus, SE; Хики, я; Шарп, MC; Доббинс, JG; Комаров, А (1994). «Синдром хронической усталости: комплексный подход к его определению и изучению. Международная исследовательская группа по синдрому хронической усталости». Анналы внутренней медицины. 121 (12): 953–9. Дои:10.7326/0003-4819-121-12-199412150-00009. PMID 7978722.
- ^ а б Hickie, I .; Давенпорт, Т; Уэйкфилд, Д; Vollmer-Conna, U; Кэмерон, B; Вернон, SD; Ривз, WC; Ллойд, А; Группа изучения исходов инфекции Даббо (2006). «Постинфекционные синдромы и синдромы хронической усталости, вызванные вирусными и невирусными патогенами: проспективное когортное исследование». BMJ. 333 (7568): 575. Дои:10.1136 / bmj.38933.585764.AE. ЧВК 1569956. PMID 16950834.
- ^ Бухвальд, Д; Чейни, PR; Петерсон, Д.Л .; Генри, B; Wormsley, SB; Гейгер, А; Аблаши, ДВ; Салахуддин, С.З.; и другие. (1992). «Хроническое заболевание, характеризующееся утомляемостью, неврологическими и иммунологическими расстройствами и активной инфекцией, вызванной вирусом герпеса человека 6 типа». Анналы внутренней медицины. 116 (2): 103–13. Дои:10.7326/0003-4819-116-2-103. PMID 1309285.
- ^ а б Аблаши, Д.В.; Eastman, H.B; Оуэн, Си-Би; Роман, M.M; Фридман, Дж; Забриски, J.B; Петерсон, Д.Л .; Пирсон, Г. Р.; Уитмен, Дж. Э. (2000). «Частая реактивация HHV-6 у пациентов с рассеянным склерозом (MS) и синдромом хронической усталости (CFS)». Журнал клинической вирусологии. 16 (3): 179–91. Дои:10.1016 / S1386-6532 (99) 00079-7. PMID 10738137.
- ^ а б Ривз, В. С .; Stamey, F. R .; Black, J. B .; Mawle, A.C .; Стюарт, Дж. А .; Пеллетт П. Э. (2000). «Человеческие герпесвирусы 6 и 7 при синдроме хронической усталости: исследование случай-контроль». Клинические инфекционные болезни. 31 (1): 48–52. Дои:10.1086/313908. PMID 10913395.
- ^ Nicolson, G.L .; Gan, R .; Хайер, Дж. (2003). «Множественные сопутствующие инфекции (микоплазма, хламидиоз, вирус герпеса человека-6) в крови пациентов с синдромом хронической усталости: связь с признаками и симптомами». APMIS. 111 (5): 557–66. Дои:10.1034 / j.1600-0463.2003.1110504.x. PMID 12887507.
- ^ Патнаик, М .; Komaroff, A. L .; Conley, E .; Ojo-Amaize, E. A .; Питер, Дж. Б. (1995). «Распространенность антител IgM к раннему антигену вируса герпеса 6 человека (p41 / 38) у пациентов с синдромом хронической усталости». Журнал инфекционных болезней. 172 (5): 1364–7. Дои:10.1093 / infdis / 172.5.1364. PMID 7594679.
- ^ Secchiero, P .; Carrigan, D. R .; Asano, Y .; Бенедетти, Л .; Crowley, R.W .; Komaroff, A. L .; Gallo, R.C .; Луссо, П. (1995). «Обнаружение вируса герпеса человека 6 в плазме детей с первичной инфекцией и пациентов с ослабленным иммунитетом с помощью полимеразной цепной реакции». Журнал инфекционных болезней. 171 (2): 273–80. Дои:10.1093 / infdis / 171.2.273. PMID 7844362.
- ^ Вагнер, Матиас; Крюгер, Герхард; Аблаши, Дхарам; Уитмен, Джеймс (1996). «Синдром хронической усталости (CFS): критическая оценка тестирования на наличие активной инфекции вируса герпеса человека-6 (HHV-6)». Журнал синдрома хронической усталости. 2 (4): 3–16. Дои:10.1300 / J092v02n04_02.
- ^ Зорзенон, Марселла; Рух, Чайка; Ботта, Джузеппе; Колле, Роберто; Барсанти, Лаура; Чекерини-Нелли, Лука (1996). «Активная инфекция HHV-6 у пациентов с синдромом хронической усталости из Италии». Журнал синдрома хронической усталости. 2: 3–12. Дои:10.1300 / J092v02n01_02.
- ^ Koelle, Дэвид М .; Барси, Серж; Хуанг, Мей-Ли; Ashley, Rhoda L .; Кори, Лоуренс; Зех, Джуди; Эштон, Сюзанна; Бухвальд, Дедра (2002). «Маркеры вирусной инфекции у монозиготных близнецов, несовместимых с синдромом хронической усталости». Клинические инфекционные болезни. 35 (5): 518–25. Дои:10.1086/341774. PMID 12173124.
- ^ Казелли, Элизабетта; Зателли, Мария Кьяра; Риццо, Роберта; Бенедетти, Сабрина; Марторелли, Дебора; Трасфорини, Джорджио; Кассай, Энцо; Degli Uberti, Ettore C .; и другие. (Октябрь 2012 г.). Мур, Патрик С. (ред.). «Вирусологические и иммунологические данные, подтверждающие связь между HHV-6 и тиреоидитом Хашимото». Патогены PLOS. 8 (10): e1002951. Дои:10.1371 / journal.ppat.1002951. ЧВК 3464215. PMID 23055929.
- ^ Силаси, Мишель (март 2013 г.). «Вирусная инвазия амниотической полости (VIAC) в середине беременности». Американский журнал репродуктивной иммунологии. 69 (3): 195–196. Дои:10.1111 / aji.12073. PMID 23384234.
- ^ Марси Роберто, Джентили Валентина, Бортолотти Дарья, Ло Монте Джузеппе, Казелли Элизабетта, Больцани Сильвия, Ротола Антонелла, Ди Лука Дарио, Риццо Роберта (2016). «Присутствие HHV-6A в эпителиальных клетках эндометрия от женщин с первичным необъяснимым бесплодием». PLOS One. 11 (7): e0158304. Bibcode:2016PLoSO..1158304M. Дои:10.1371 / journal.pone.0158304. ЧВК 4930213. PMID 27367597.CS1 maint: несколько имен: список авторов (связь)
- ^ Тамбурро, Кристен; Ян, Дунмэй; Пуассон, Джессика; Федорив, Юрий; Рой, Дебасмита; Лукас, Эми; Син, Санг-Хун; Малуф, Надя; и другие. (10 ноября 2012 г.). «Вироном ассоциированного с саркомой Капоши герпесвирусно-воспалительного цитокинового синдрома у пациента со СПИДом выявляет коинфекцию вируса герпеса человека 8 и вируса герпеса человека 6А». Вирусология. 433 (1): 220–225. Дои:10.1016 / j.virol.2012.08.014. ЧВК 3505605. PMID 22925337.
- ^ Паркин, Дональд Максвелл (2006). «Глобальное бремя рака, связанного с инфекциями, для здоровья в 2002 году». Международный журнал рака. 118 (12): 3030–44. Дои:10.1002 / ijc.21731. PMID 16404738.
- ^ Оберахер-Фельтен, Изабель М .; Йонас, Йост Б .; Юнеманн, Ансельм; Шмидт, Барбара (2004). «Двусторонняя оптическая нейропатия и односторонний тонический зрачок, связанные с острой инфекцией вируса герпеса человека 6: отчет о болезни». Архив клинической и экспериментальной офтальмологии Грефе. 243 (2): 175–7. Дои:10.1007 / s00417-004-0986-8. PMID 15742213.
- ^ Маслин, Жером; Бигайон, Кристина; Фруссар, Франсуаза; Энуф, Винсент; Никанд, Элизабет (2007). «Острый двусторонний увеит, связанный с активной инфекцией вируса герпеса-6 человека». Журнал инфекции. 54 (4): e237–40. Дои:10.1016 / j.jinf.2006.12.012. PMID 17303245.
- ^ а б Огата, Нахоко; Коике, Наоко; Йошикава, Таданобу; Такахаши, кандзи (2011). «Увеит, связанный с вирусом герпеса 6 человека с невритом зрительного нерва, диагностированный с помощью мультиплексной ПЦР». Японский журнал офтальмологии. 55 (5): 502–5. Дои:10.1007 / s10384-011-0069-4. PMID 21814813.
- ^ а б Ли, Цзинь-Мэй; Лей, Дин; Пэн, Фанг; Цзэн И-Цзюнь; Ли, Лян; Ся, Цзэн-Лян; Ся, Сяо-Цян; Чжоу, Донг (2011). «Обнаружение вируса герпеса человека 6B у пациентов с мезиальной височной эпилепсией в Западном Китае и возможная связь с повышенной экспрессией NF-κB». Исследования эпилепсии. 94 (1–2): 1–9. Дои:10.1016 / j.eplepsyres.2010.11.001. PMID 21256714.
- ^ Noguchi, T .; Yoshiura, T .; Hiwatashi, A .; Togao, O .; Yamashita, K .; Nagao, E .; Учино, А .; Hasuo, K .; и другие. (2010). «Результаты КТ и МРТ энцефалопатии, связанной с вирусом герпеса 6 человека: сравнение с результатами энцефалита, вызванного вирусом простого герпеса». Американский журнал рентгенологии. 194 (3): 754–60. Дои:10.2214 / AJR.09.2548. PMID 20173155.
- ^ Нихусманн, Питт; Миттельштадт, Тобиас; Bien, Christian G .; Дрекслер, Ян Ф .; Гроте, Александр; Шох, Сюзанна; Беккер, Альберт Дж. (2010). «Присутствие ДНК вируса герпеса 6 человека исключительно в ткани головного мозга височной эпилепсии у пациентов с энцефалитом в анамнезе». Эпилепсия. 51 (12): 2478–83. Дои:10.1111 / j.1528-1167.2010.02741.x. PMID 21204811.
- ^ Буйсе, С .; Роке-Афонсу, А.-М .; Vaghefi, P .; Gigou, M .; Dussaix, E .; Duclos-Vallee, J.C .; Samuel, D .; Геттье, К. (2013). «Острый гепатит с перипортальным сливным некрозом, связанный с инфекцией вируса герпеса человека 6 у пациентов с трансплантатом печени». Американский журнал клинической патологии. 140 (3): 403–9. Дои:10.1309 / AJCP0FWI2XAHECBJ. PMID 23955460.
- ^ а б Накано, Казуши; Нисинака, Кадзуко; Танака, Тацуя; Осима, Ацуши; Сугимото, Накаба; Исегава, Юдзи (2009). «Обнаружение и идентификация мутаций гена U69, кодируемых устойчивым к ганцикловиру вирусом герпеса человека 6, с использованием денатурирующей высокоэффективной жидкостной хроматографии». Журнал вирусологических методов. 161 (2): 223–30. Дои:10.1016 / j.jviromet.2009.06.016. PMID 19559728.
- ^ Шайли, Кевин; Блумберг, Эмили (2010). «Вирусы герпеса в реципиентах трансплантата: HSV, VZV, вирусы герпеса человека и EBV». Клиники инфекционных болезней Северной Америки. 24 (2): 373–93. Дои:10.1016 / j.idc.2010.01.003. PMID 20466275.
внешняя ссылка
 СМИ, связанные с Вирус герпеса человека 6 в Wikimedia Commons
СМИ, связанные с Вирус герпеса человека 6 в Wikimedia Commons Данные, относящиеся к Вирус герпеса человека 6 в Wikispecies
Данные, относящиеся к Вирус герпеса человека 6 в Wikispecies

