Кинетопласт - Kinetoplast

А кинетопласт сеть круговых ДНК (называемая кДНК) внутри большого митохондрия который содержит множество копий митохондриальный геном.[1][2] Наиболее распространенной структурой кинетопластов является диск, но они наблюдались и в других структурах. Кинетопласты встречаются только в Экскавата класса Кинетопластида. Различия в структуре кинетопластов могут отражать филогенетические взаимоотношения между кинетопластидами.[3] Кинетопласт обычно прилегает к организму. жгутиковый базальное тело, предполагая, что он прочно привязан к цитоскелет. В Trypanosoma brucei это цитоскелетное соединение называется трехкомпонентным соединительным комплексом и включает в себя белок p166.[4]
Трипаносома
В трипаносомы, группа жгутиковых простейших, кинетопласт существует как плотная гранула ДНК внутри большой митохондрии. Trypanosoma brucei, паразит, вызывающий Африканский трипаносомоз (Африканская сонная болезнь) - пример трипаносомы с кинетопластом. Его кинетопласт хорошо виден в образцах, окрашенных DAPI, а флуоресцентный ДНК пятно, или с помощью флуоресцентная гибридизация in situ (FISH) с BrdU, a тимидин аналог.[5]
Структура
Кинетопласт содержит кольцевую ДНК в двух формах: макицикла и миникруги. Максимальные круги имеют размер от 20 до 40 килобайт, и их несколько десятков на кинетопласт. На кинетопласт приходится несколько тысяч миникольцов, размер которых составляет от 0,5 до 1 КБ. Maxicircles кодирует типичные белковые продукты, необходимые для зашифрованных митохондрий. В этом заключается единственная известная функция мини-кругов - создание направляющая РНК (gRNA) для декодирования этой зашифрованной информации максимального круга, обычно путем вставки или удаления уридин остатки. Сеть максициклов и миникольцов связанный сформировать планарную сеть, напоминающую кольчуга. Воспроизведение этой сети затем требует, чтобы эти кольца были отсоединены от родительского кинетопласта и впоследствии повторно соединены в дочернем кинетопласте.[5][6] Этот уникальный способ репликации ДНК может вдохновить потенциальных мишени для наркотиков.
Наиболее изученной структурой кДНК является структура Crithidia fasciculata, цепной диск из кольцевых максициклов и миникольцов кДНК, большинство из которых не являются суперскрученный.[3] Снаружи от диска кДНК, но непосредственно рядом находятся два комплекса белков, расположенных на 180 ° друг от друга и участвующих в репликации миникольца.[1][2][5][6]
Вариации
Также наблюдались вариации сетей кинетопластов, которые описываются расположением и расположением их кДНК.
- А про-кДНК кинетопласт представляет собой пучковидную структуру, обнаруженную в митохондриальном матриксе проксимальнее базального тела жгутика. В отличие от обычной сети кДНК, кинетопласт про-кДНК содержит очень небольшую катенацию, а его максициклы и миникольца расслаблены вместо суперспирали. Про-кДНК наблюдалась в Бодо Сальтанс, Bodo designis, Procryptobia sorokini син. Бодо Сорокини, Rhynchomonas nasuta, и Цефалотамний циклопи.[3]
- А поли-кДНК кинетопласт подобен по структуре кДНК кинетопласту про-кДНК. Он содержит небольшую цепочку и не содержит суперспирали. Отличительная особенность поли-кДНК состоит в том, что вместо того, чтобы состоять из одного глобулярного пучка, как в про-кДНК, поли-кДНК распределена между различными дискретными фокусы по всему просвету митохондрий. Поли-кДНК наблюдалась в Dimastigella trypaniformis (а комменсальный в кишечнике термит ), Dismastigella mimosa (свободноживущий кинетопластид), и Крузелла Марина (а паразит кишечника морской брызг ).[3]
- А пан-кДНК кинетопласт, как поли-кДНК и про-кДНК, содержит меньшую степень катенации, но он действительно содержит сверхспиральные миникольцы. Кинетопласты пан-кДНК заполняют большую часть митохондриального матрикса и не ограничиваются отдельными очагами, такими как поли-кДНК. Пан-кДНК наблюдалась в Криптобия спираль (паразит половой сосуд из улитки ), Bodo caudatus, и Криптобия жаберная (паразит рыбы ).[3]
- А мега-кДНК кинетопласт довольно равномерно распределен по митохондриальному матриксу, но не содержит миникольцов. Вместо этого последовательности кДНК, сходные по последовательности с другими миникольцами кинетопластов, соединяются тандемно в более крупные молекулы длиной примерно 200 килобайт. Мега-кДНК (или структуры, подобные мега-кДНК) наблюдались в Трипаноплазма боррели (рыбный паразит) и Джарреллия sp. (а КИТ паразит).[3]
Присутствие этого разнообразия структур кДНК усиливает эволюционные отношения между видами кинетопластид. Поскольку пан-кДНК наиболее похожа на ДНК плазмида, это может быть предковая форма кДНК.[3]
Репликация

Репликация кинетопласта происходит одновременно с удвоением соседнего жгутика и непосредственно перед репликация ядерной ДНК. В традиционном Crithidia fasciculata сеть кДНК, инициации репликации способствует отсоединение миникольцов кДНК через топоизомераза II. Свободные миникольца высвобождаются в область между кинетопластом и митохондриальной мембраной, называемую кинетофлагеллярной зоной (KFZ).[2][3][6] После репликации миникольца по неизвестным механизмам перемещаются в антиподные белковые комплексы, которые содержат несколько репликационных белков, включая эндонуклеаза, геликаза, ДНК-полимераза, ДНК-примаза, и ДНК-лигаза, которые инициируют ремонт оставшихся разрывов во вновь реплицированных миникольцах.[5]
Этот процесс происходит по одному мини-кругу за раз, и только небольшое количество мини-кругов не связаны в любой данный момент. Чтобы отслеживать, какие миникольца были реплицированы, при повторном присоединении к сети кДНК остается небольшой промежуток в возникающих миникольцах, который идентифицирует их как уже реплицированные. Миникруги, которые еще не воспроизведены, все еще ковалентно замкнуты. Сразу после репликации каждое потомство прикрепляется к сети кДНК проксимальнее антиподальных белковых комплексов, и промежутки частично восстанавливаются.[1][6]
По мере того как репликация миникольца прогрессирует, чтобы предотвратить наращивание новых миникольцов, вся сеть кДНК будет вращаться вокруг центральной оси диска. Считается, что вращение напрямую связано с репликацией соседнего жгутика, поскольку дочернее базальное тело также будет вращаться вокруг материнского базального тела по времени и способом, аналогичным вращению кинетопласта. Вращаясь, миникольца дочернего кинетопласта собираются по спирали и начинают двигаться внутрь к центру диска, поскольку новые миникольца отсоединяются и перемещаются в KFZ для репликации.[2][5][6]
Хотя точные механизмы кДНК максицикла еще предстоит определить с той же детальностью, что и кДНК миникольца, структура, называемая Набельшнур (Немецкий за "пуповина "), которая связывает дочерние сети кДНК, но в конечном итоге разрывается во время разделения. Используя зонды FISH для нацеливания на набелшнур, было обнаружено, что она содержит кДНК максимального круга.[5]
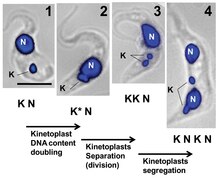
Репликация кинетопластов описывается как происходящая в пять стадий, каждая из которых связана с репликацией соседнего жгутика.
- I этап: Кинетопласт еще не инициировал репликацию, не содержит антиподальных белковых комплексов и расположен относительно одного базального тельца жгутика.
- II этап: Кинетопласт начинает проявлять антиподные белковые комплексы. Базальное тело жгутика начинает репликацию, как и кинетопласт. Ассоциация реплицирующегося кинетопласта с двумя базальными тельцами приводит к тому, что он приобретает куполообразный вид.
- III стадия: Новый жгутик начинает отделяться, и кинетопласт принимает двулопастную форму.
- IV этап: Кинетопласты выглядят как отдельные диски, но остаются связанными набелшнуром.
- V этап: Дочерние кинетопласты полностью разделены, так как набелшнур нарушен. Их структура идентична той, что видна на этапе I.[5]
Ремонт ДНК
Trypanosoma cruzi способен восстанавливать нуклеотиды в своем геноме или кинетопласте ДНК которые были повреждены активные формы кислорода вырабатывается хозяином паразита во время заражения.[7] ДНК-полимераза бета выражено в T. cruzi используется для удаления окислительных Повреждения ДНК в процессе базовая эксцизионная пластика. Похоже, что ДНК-полимераза бета действует во время кинетопласта. Репликация ДНК для восстановления окислительных повреждений ДНК, вызванных генотоксический стресс в этой органелле.[7]
Рекомендации
- ^ а б c Шапиро Т.А.; Englund PT (1995). «Структура и репликация кинетопластной ДНК». Анну. Rev. Microbiol. 49: 117–43. Дои:10.1146 / annurev.mi.49.100195.001001. PMID 8561456.
- ^ а б c d Шломай Дж (2004). «Структура и репликация кинетопластной ДНК». Curr. Мол. Med. 4 (6): 623–47. Дои:10.2174/1566524043360096. PMID 15357213.
- ^ а б c d е ж грамм час Lukes J, et al. (2002). «Сеть ДНК кинетопластов: эволюция невероятной структуры». Эукариотическая клетка. 1 (4): 495–502. Дои:10.1128 / ec.1.4.495-502.2002. ЧВК 117999. PMID 12455998.
- ^ Чжао, Z; Линдси, М. Э .; Рой Чоудхури, А; Робинсон, Д. Р .; Энглунд, П. Т. (2008). «P166, связь между митохондриальной ДНК трипаносомы и жгутиком, опосредует сегрегацию генома». Журнал EMBO. 27 (1): 143–54. Дои:10.1038 / sj.emboj.7601956. ЧВК 2206137. PMID 18059470.
- ^ а б c d е ж грамм Gluenz E, et al. (Март 2011 г.). "Цикл репликации кинетопластов в Trypanosoma brucei управляется клеточным морфогенезом, опосредованным цитоскелетом ". Молекулярная клеточная биология. 31 (5): 1012–1021. Дои:10.1128 / MCB.01176-10. ЧВК 3067821. PMID 21173163.
- ^ а б c d е Торри, А., и другие. Репликация ДНК в эукариотических клетках. Лабораторный пресс Колд-Спринг-Харбор. 1996. pages = 1029–42. ISBN 0-87969-459-9
- ^ а б Schamber-Reis BL, Nardelli S, Régis-Silva CG, Campos PC, Cerqueira PG, Lima SA, Franco GR, Macedo AM, Pena SD, Cazaux C, Hoffmann JS, Motta MC, Schenkman S, Teixeira SM, Machado CR (2012 г. ). «Бета-ДНК-полимераза из Trypanosoma cruzi участвует в репликации кинетопластной ДНК и восстановлении окислительных повреждений». Мол. Biochem. Паразитол. 183 (2): 122–31. Дои:10.1016 / j.molbiopara.2012.02.007. PMID 22369885.
