Эпигенетическая наследственность между поколениями - Transgenerational epigenetic inheritance
Эта статья должна быть обновлено. (Март 2020 г.) |

Эпигенетическая наследственность между поколениями, (TEI) - это передача эпигенетических маркеров от одного организма к другому (то есть передача от родителей к ребенку), которая влияет на черты потомства без изменения первичная структура из ДНК (т.е. последовательность нуклеотидов)[2]:168[3]-другими словами, эпигенетически. Менее точный термин «эпигенетическая наследственность» может охватывать передачу информации как клетка-клетка, так и организм-организм. Хотя эти два уровня эпигенетической наследственности эквивалентны в одноклеточные организмы, они могут иметь различные механизмы и эволюционные различия в многоклеточные организмы.
Факторы окружающей среды могут вызывать эпигенетические метки (эпигенетические метки) для некоторых эпигенетически влияющих черт,[2] в то время как некоторые знаки передаются по наследству,[2] таким образом заставляя некоторых пересмотреть предыдущее отвержение большинством биологов наследование приобретенных характеристик (ламаркизм) .[3]
Эпигенетические категории
Известны четыре общие категории эпигенетических модификаций:[4]
- самоподдерживающиеся метаболические петли, в которых мРНК или же белок продукт гена стимулирует транскрипция гена; например Wor1 ген в грибковые микроорганизмы албиканс[5]
- структурный шаблон, в котором структуры реплицируются с использованием шаблона или структуры каркаса на родительском элементе; например ориентация и архитектура цитоскелетных структур, ресничек и жгутиков,[6] прионы, белки, которые реплицируются, изменяя структуру нормальных белков, чтобы соответствовать своей собственной[7]
- хроматин метки, в которых метильные или ацетильные группы связываются с ДНК нуклеотиды или же гистоны тем самым изменяя паттерны экспрессии генов; например Lcyc ген в Linaria vulgaris описано ниже
- Подавление РНК, в котором небольшие нити РНК мешают (РНКи ) с транскрипцией ДНК или трансляцией мРНК; известно лишь из нескольких исследований, в основном в Caenorhabditis elegans[8]
Наследование эпигенетических меток
Хотя существуют различные формы наследования эпигенетических маркеров, наследование эпигенетических маркеров можно резюмировать как распространение эпигенетической информации посредством зародышевой линии.[9] Кроме того, эпигенетическая изменчивость обычно принимает одну из четырех общих форм, хотя есть и другие формы, которые еще предстоит выяснить. В настоящее время самоподдерживающиеся петли обратной связи, пространственный шаблон, маркировка хроматина и РНК-опосредованные пути модифицируют эпигены отдельных клеток. Эпигенетическая изменчивость внутри многоклеточных организмов бывает эндогенной или экзогенной. Эндогенный генерируется межклеточной передачей сигналов (например, во время дифференцировки клеток на ранней стадии развития), а экзогенный - это клеточный ответ на сигналы окружающей среды.
Удаление против удержания
У организмов, размножающихся половым путем, большая часть эпигенетических модификаций внутри клеток сбрасывается во время мейоза (например, метки в локусе FLC, контролирующие яровизацию растений[10]), хотя было показано, что некоторые эпигенетические ответы сохраняются (например, метилирование транспозонов в растениях[10]). Дифференциальное наследование эпигенетических меток из-за лежащих в основе материнских или отцовских предубеждений в механизмах удаления или удержания может привести к отнесению эпигенетической причинности к некоторым родительским эффектам происхождения у животных.[11] и растения.[12]
Перепрограммирование
У млекопитающих эпигенетические метки стираются в течение двух фаз жизненного цикла. Во-первых, сразу после оплодотворения, а во-вторых, в развивающихся примордиальных половых клетках, предшественниках будущих гамет.[2] Во время оплодотворения мужские и женские гаметы соединяются в разных состояниях клеточного цикла и с различной конфигурацией генома. Эпигенетические признаки самца быстро стираются. Во-первых, протамины, связанные с мужской ДНК, заменяются гистонами из женской ДНК. цитоплазма, большинство из которых ацетилированы либо из-за более высокого содержания ацетилированных гистонов в цитоплазме самок, либо из-за преимущественного связывания мужской ДНК с ацетилированными гистонами.[13][14] Во-вторых, мужская ДНК систематически деметилируется во многих организмах,[15][16] возможно через 5-гидроксиметилцитозин. Однако некоторые эпигенетические метки, особенно метилирование материнской ДНК, могут ускользать от этого перепрограммирования; приводящий к родительскому импринтингу.
В исконном стволовые клетки (PGC) происходит более обширное стирание эпигенетической информации. Однако некоторые редкие сайты также могут избегать стирания метилирования ДНК.[17] Если эпигенетические метки ускользают от стирания во время как зиготических событий, так и событий репрограммирования PGC, это может сделать возможным эпигенетическое наследование между поколениями.
Признание важности эпигенетического программирования для установления и фиксации идентичности клеточной линии во время раннего эмбриогенеза недавно стимулировало интерес к искусственному устранению эпигенетического программирования.[18] Эпигенетические манипуляции могут позволить восстановить тотипотентность в стволовые клетки или клетки в более общем смысле, таким образом обобщая регенеративная медицина.
Удержание
Клеточные механизмы могут допускать совместную передачу некоторых эпигенетических меток. Во время репликации ДНК-полимеразы, работающие на ведущей и отстающей цепях, соединяются фактором процессивности ДНК. ядерный антиген пролиферирующих клеток (PCNA), который также участвует в формировании паттерна и перекрестных помехах цепей, что обеспечивает точность копирования эпигенетических меток.[19][20] Работа над верностью копий модификаций гистонов осталась в фазе модели, но ранние попытки предполагают, что модификации новых гистонов формируются по образцу модификаций старых гистонов и что новые и старые гистоны случайным образом распределяются между двумя дочерними цепями ДНК.[21] Что касается перехода к следующему поколению, многие метки удаляются, как описано выше. Новые исследования находят закономерности эпигенетической консервации в разных поколениях. Например, центромерный сателлиты сопротивляются деметилированию.[22] Механизм, ответственный за эту консервацию, неизвестен, хотя некоторые данные свидетельствуют о том, что метилирование гистонов может вносить свой вклад.[22][23] Также было выявлено нарушение регуляции времени метилирования промотора, связанное с нарушением регуляции экспрессии генов в эмбрионе.[24]
Разлагаться
В то время как скорость мутации в данном 100-базовом гене может быть 10−7 за поколение эпигены могут «мутировать» несколько раз за поколение или могут фиксироваться на протяжении многих поколений.[25] Возникает вопрос: составляют ли изменения в частотах эпигена эволюцию? Быстро затухающие эпигенетические эффекты на фенотипы (т.е. длящиеся менее трех поколений) могут объяснять некоторые остаточные вариации фенотипов после учета генотипа и окружающей среды. Однако отличая эти краткосрочные эффекты от воздействия материнской среды на раннее онтогенез остается проблемой.
Вклад в фенотипы
Относительная важность генетического и эпигенетического наследования является предметом споров.[26][27] Хотя были опубликованы сотни примеров эпигенетической модификации фенотипов,[28][29] мало исследований было проведено вне лабораторных условий.[30] Следовательно, невозможно сделать вывод о взаимодействии генов и эпигенов с окружающей средой, несмотря на центральную роль среды в естественном отборе. Экспериментальные методологии манипулирования эпигенетическими механизмами только зарождаются (например,[31]) и потребует строгой демонстрации, прежде чем станут возможными исследования, явно проверяющие относительный вклад генотипа, окружающей среды и эпигенотипа.
В растениях

Об исследованиях, касающихся трансгенерационной эпигенетической наследственности у растений, сообщалось еще в 1950-х годах.[32] Один из самых ранних и наиболее хорошо охарактеризованных примеров этого - b1 парамутация в кукурузе.[32][33][34][35][36][37][38][39] Ген b1 кодирует основная спираль-петля-спираль фактор транскрипции который участвует в антоциан производственный путь. Когда ген b1 экспрессируется, растение накапливает антоциан в своих тканях, что приводит к пурпурной окраске этих тканей. Аллель B-I (для B-Intense) имеет высокую экспрессию b1, что приводит к темной пигментации тканей оболочки и оболочки, в то время как аллель B '(произносится как B-prime) имеет низкую экспрессию b1, что приводит к низкой пигментации в этих тканях.[40] Когда гомозиготный Родители B-I скрещиваются с гомозиготными B ', в результате Потомство F1 все имеют низкую пигментацию, что связано с подавление гена из b1.[32][40] Неожиданно, когда растения F1 подвергаются самокрещению, все полученное поколение F2 демонстрирует низкую пигментацию и низкие уровни экспрессии b1. Кроме того, когда любое растение F2 (включая те, которые генетически гомозиготны по B-I) скрещивают с гомозиготным B-I, все потомство будет демонстрировать низкую пигментацию и экспрессию b1.[32][40] Отсутствие темно-пигментированных особей в потомстве F2 является примером неменделирующее наследование и дальнейшие исследования показали, что аллель B-I превращается в B 'посредством эпигенетических механизмов.[34][35] Аллели B 'и B-I считаются эпиаллели потому что они идентичны на уровне последовательностей ДНК, но различаются на уровне Метилирование ДНК, миРНК производство и хромосомные взаимодействия в ядре.[38][41][37][36] Кроме того, растения с дефектом компонентов РНК-направленный путь метилирования ДНК демонстрируют повышенную экспрессию b1 у B 'индивидуумов, аналогичную экспрессии B-I, однако, как только эти компоненты восстанавливаются, растение возвращается в состояние низкой экспрессии.[39][42][43][44] Хотя спонтанное преобразование из B-I в B 'наблюдалось, обратное преобразование из B' в B-I (от зеленого к пурпурному) никогда не наблюдалось в течение 50 лет и тысяч растений как в тепличных, так и в полевых экспериментах.[45]
Также сообщалось о примерах трансгенерационного эпигенетического наследования растений, вызванного воздействием окружающей среды.[46][47][48] В одном случае растения риса, подвергшиеся обработке имитацией засухи, показали повышенную устойчивость к засухе после 11 поколений воздействия и размножения односемянным спуском по сравнению с растениями, не обработанными засухой.[46] Различия в устойчивость к засухе был связан с направленными изменениями уровней метилирования ДНК по всему геному, предполагая, что вызванные стрессом наследственные изменения в паттернах метилирования ДНК могут быть важны для адаптации к повторяющимся стрессам.[46] В другом исследовании растения, которые подвергались умеренной травоядности гусениц в течение нескольких поколений, показали повышенную устойчивость к травоядным в последующих поколениях (измеряемую по сухой массе гусениц) по сравнению с растениями, лишенными давления травоядных.[47] Это увеличение устойчивости травоядных сохранялось после поколения роста без какого-либо воздействия на травоядных, что позволяет предположить, что реакция передавалась из поколения в поколение.[47] В отчете сделан вывод о том, что компоненты пути РНК-направленного метилирования ДНК участвуют в увеличении устойчивости в разных поколениях.[47]
В людях
Хотя генетическая наследственность важна при описании фенотипический результаты, это не может полностью объяснить, почему потомство похоже на своих родителей. Помимо генов, потомство наследует схожие культурные факторы и факторы окружающей среды, установленные предыдущими поколениями.[9] Необходимо учитывать как культурные факторы, так и факторы окружающей среды, потому что каждый фактор может влиять на другой (т.е.культурные нормы могут влиять на условия окружающей среды, а условия окружающей среды могут влиять на культурные нормы) и, следовательно, могут влиять на здоровье последующих поколений.[9] Среда, в которой все человеческое потомство обычно живет в течение девяти месяцев, - это среда их матери. матка. Учитывая продолжительность стадии развития плода окружающая среда в утробе матери может иметь длительные последствия для здоровья потомства.[9] Пример того, как среда в утробе матери может влиять на здоровье потомства, можно объяснить, рассмотрев последствия голландской голодной зимы и роль индуцированных трансгенерационных эпигенетических наследственных заболеваний.[9] Ряд исследований предполагает существование эпигенетической наследственности между поколениями у людей,[2] который включает голландский голод 1944–45. Во время голодной зимы в Голландии потомство, рожденное во время голода, было меньше, чем потомство, родившееся за год до голода, и последствия могли длиться до двух поколений. Более того, было обнаружено, что у этих потомков повышенный риск непереносимость глюкозы в зрелом возрасте.[49] Дифференциальное метилирование ДНК было обнаружено у взрослых потомков женского пола, подвергшихся голоду внутриутробно, но неизвестно, присутствуют ли эти различия в их зародышевой линии.[49] Предполагается, что подавление PIM3 ген мог вызвать более медленный метаболизм в последующих поколениях, но причинно-следственная связь не была доказана, только корреляция.[50] Это явление иногда называют Голландский голодный зимний синдром. Кроме того, повышенные показатели метаболические заболевания, сердечно-сосудистые заболевания, и другие факторы повышенного риска для здоровья поколений F1 и F2 во время голодной зимы в Голландии - это известный феномен, называемый «программирование плода, »Что вызвано воздействием вредных факторов окружающей среды в утробе матери.[9] Другое исследование выдвигает гипотезу об эпигенетических изменениях Y-хромосома для объяснения различий в продолжительности жизни среди потомков мужского пола военнопленные в американская гражданская война.[51]
В Överkalix исследование отмеченные половые эффекты; больший индекс массы тела (ИМТ) в 9 лет у сыновей, но не дочерей отцов, рано начавших курить. Продовольствие деда по отцовской линии было связано только с уровнем смертности внуков, но не внучек. Продовольствие бабушки по отцовской линии было связано только с коэффициентом риска смертности внучек. Когда у бабушки был хороший запас пищи, это было связано с двукратным повышением смертности (RR). Эта передача между поколениями наблюдалась при воздействии в течение периода медленного роста (SGP). SGP - это время до начала половое созревание, когда факторы окружающей среды оказывают большее влияние на организм. SGP предков в этом исследовании был установлен в возрасте 9–12 лет для мальчиков и 8–10 лет для девочек. Это произошло в SGP обоих дедушек и бабушек или во время беременность период / младенческая жизнь бабушек, но не в период полового созревания бабушек и дедушек. Плохое питание отца и хорошее питание матери были связаны с меньшим риском сердечно-сосудистый смерть.[49][52]
Потеря генетической экспрессии, которая приводит к Синдром Прадера – Вилли или же Синдром ангельмана в некоторых случаях было обнаружено, что это вызвано эпигенетическими изменениями (или «эпимутациями») как аллели, а не с участием каких-либо генетических мутация. Во всех 19 информативных случаях эпимутации, которые вместе с физиологическим импринтингом и, следовательно, замалчиванием другого аллель, вызывающие эти синдромы, были локализованы на хромосоме с конкретным родительским и дедовским или дедовским происхождением. В частности, отцовская хромосома несла аномальную материнскую метку на SNURF-SNRPN, и эта аномальная отметка была унаследована от бабушки по отцовской линии.[49]
Аналогичным образом эпимутации на MLH1 ген был обнаружен у двух человек с фенотипом наследственный неполипозный колоректальный рак и без какой-либо явной мутации MLH1, которая в противном случае вызывает заболевание. Такие же эпимутации были обнаружены в сперматозоидах одного из особей, что указывает на возможность передачи потомству.[49]
В добавление к эпимутации к MLH1 ген, было установлено, что некоторые виды рака, такие как рак молочной железы, может возникнуть во время плод этапы в матка.[53] Кроме того, доказательства, собранные в различных исследованиях с использованием модельные системы (т.е. животные) обнаружили, что воздействие во время родительские поколения может привести к наследованию рака молочной железы из поколения в поколение.[53] Совсем недавно исследования обнаружили связь между адаптацией мужские половые клетки через до зачатия отцовский диеты и регулирование рака груди у развивающегося потомства.[53] В частности, исследования начали обнаруживать новые данные, которые подчеркивают взаимосвязь между эпигенетической наследственностью рака груди между поколениями и наследственный пищевые компоненты или связанные маркеры, например вес при рождении. [53] При использовании модельных систем, таких как мыши, исследования показали, что стимулированное отцовское ожирение во время зачатия может эпигенетически изменять отцовскую зародышевую линию. Отцовская зародышевая линия отвечает за регулирование веса дочерей при рождении и за возможность развития у их дочерей рака груди.[54] Кроме того, было обнаружено, что модификации miRNA выражение профиль мужской зародышевой линии сочетается с повышенной массой тела.[54] Кроме того, ожирение по отцовской линии привело к увеличению доли потомства женского пола, у которого развивались канцероген -индуцированный опухоли молочной железы, что вызвано изменениями экспрессии miRNA в молочных железах. [54]
Одно исследование показало, что жестокое обращение в детстве, которое определяется как «сексуальный контакт, тяжелое физическое насилие и / или серьезное пренебрежение», приводит к эпигенетическим модификациям экспрессии рецепторов глюкокортикоидов.[55][56] Экспрессия глюкокортикоидных рецепторов играет жизненно важную роль в активности гипоталамо-гипофизарно-надпочечников (HPA). Кроме того, эксперименты на животных показали, что эпигенетические изменения могут зависеть от взаимодействия матери и ребенка после рождения.[57] Кроме того, недавнее исследование корреляции между материнский стресс во время беременности и метилирование у подростков / их матерей обнаружило, что дети женщин, подвергшихся насилию во время беременности, с большей вероятностью имели метилированные гены глюкокортикоидных рецепторов.[58] Таким образом, дети с метилированными генами глюкокортикоидных рецепторов испытывают измененную реакцию на стресс, что в конечном итоге приводит к более высокой восприимчивости к тревоге. [58]
Дополнительные исследования, изучающие эффекты диэтилстильбестрол (DES), который является эндокринный разрушитель, обнаружили, что внуки (третье поколение) женщин, подвергшихся воздействию DES, значительно увеличили вероятность развития у их внуков. Синдром дефицита внимания и гиперактивности (СДВГ).[59] Это потому, что женщины подвергаются эндокринные разрушители, например DES, во время беременность могут быть связаны с несколькими поколениями неврологический дефицит.[59] Кроме того, исследования на животных показывают, что эндокринные разрушители оказывают сильное влияние на клетки зародышевой линии и нервное развитие.[59] Причина воздействия DES на несколько поколений постулируется как результат биологических процессов, связанных с эпигенетическое перепрограммирование из зародышевый, хотя это еще предстоит определить.[59]
Влияние на фитнес
Эпигенетическое наследование может влиять только на фитнес если это предсказуемо изменяет признак при выборе. Были получены доказательства того, что стимулы окружающей среды являются важными агентами в изменении эпигенов. По иронии судьбы, дарвиновская эволюция может воздействовать на эти неоламаркианские приобретенные характеристики, а также на клеточные механизмы, их производящие (например, гены метилтрансферазы). Эпигенетическое наследование может дать улучшение приспособленности организмам, которые имеют дело с изменениями окружающей среды в промежуточных временных масштабах.[60] Изменения с коротким циклом, вероятно, будут иметь процессы регуляции, закодированные в ДНК, так как высока вероятность того, что потомство будет вынуждено реагировать на изменения несколько раз в течение своей жизни. С другой стороны, естественный отбор будет воздействовать на популяции, испытывающие изменения в результате более продолжительных изменений окружающей среды. В этих случаях, если эпигенетический прайминг следующего поколения вредно для приспособленности в течение большей части интервала (например, дезинформация об окружающей среде), эти генотипы и эпигенотипы будут потеряны. Для промежуточных временных циклов вероятность того, что потомство встретит аналогичную среду, достаточно высока без существенного избирательного давления на индивидов, лишенных генетической архитектуры, способной реагировать на окружающую среду. Естественно, что абсолютная продолжительность коротких, промежуточных и длинных экологических циклов будет зависеть от признака, продолжительности эпигенетической памяти и времени генерации организма. Большая часть интерпретации эффектов эпигенетической приспособленности основана на гипотезе о важности эпигенов. вкладчиков в фенотипы, которые еще предстоит решить.
Вредные эффекты
Унаследованные эпигенетические метки могут быть важны для регулирования важных компонентов приспособленности. Например, у растений Lcyc ген в Linaria vulgaris контролирует симметрию цветка. Линней впервые описаны радиально-симметричные мутанты, возникающие при Lcyc сильно метилирован.[61] Учитывая важность формы цветков для опылителей,[62] метилирование Lcyc гомологи (например, ЦИКЛОИДЕЯ) может иметь пагубное влияние на приспособленность растений. На животных многочисленные исследования показали, что унаследованные эпигенетические метки могут повышать восприимчивость к болезням. Также предполагается, что трансгенерационные эпигенетические влияния способствуют развитию заболеваний, особенно рака, у людей. Было показано, что паттерны метилирования опухолей в промоторах генов положительно коррелируют с семейным анамнезом рака.[63] Кроме того, метилирование MSH2 ген коррелирует с ранним началом колоректального рака и рака эндометрия.[64]
Предположительно адаптивные эффекты
Экспериментально деметилированные семена модельный организм Arabidopsis thaliana имеют значительно более высокую смертность, задержку роста, задержку цветения и более низкое завязывание плодов,[65] что указывает на то, что эпигены могут повышать приспособленность. Кроме того, было показано, что эпигенетические реакции на стресс, вызванные окружающей средой, наследуются и положительно коррелируют с приспособленностью.[66] У животных совместное гнездование изменяет поведение мышей, увеличивая режим родительской заботы.[67] и социальные способности[68] которые, как предполагается, увеличивают выживаемость потомства и доступ к ресурсам (таким как еда и партнеры), соответственно.
Макроэволюционные закономерности
Унаследованные эпигенетические эффекты на фенотипы хорошо документированы у бактерий, простейших, грибов, растений, нематод и плодовых мух.[28][9] Хотя никаких систематических исследований эпигенетического наследования не проводилось (в основном сосредоточено на модельных организмах), есть предварительные доказательства того, что этот способ наследования более важен для растений, чем для животных.[28] Ранняя дифференциация животных зародышевые линии может препятствовать эпигенетической маркировке, возникающей на более поздних этапах развития, в то время как у растений и грибов соматический клетки могут быть включены в зародышевую линию.[69][70]
Считается, что трансгенерационное эпигенетическое наследование может позволить некоторым популяциям легко адаптироваться к изменчивой среде.[9] Хотя есть хорошо задокументированные случаи трансгенерационного эпигенетического наследования в определенных популяциях, есть вопросы о том, применима ли эта же форма адаптивности к млекопитающим.[9] В частности, возникает вопрос, применимо ли это к людям.[9] В последнее время в большинстве экспериментальных моделей с использованием мышей и ограниченных наблюдений на людях были обнаружены только эпигенетически унаследованные черты, вредные для здоровья обоих организмов.[9] Эти вредные черты варьируются от повышенного риска заболевания, например: сердечно-сосудистые заболевания, к преждевременной смерти.[9] Однако это может быть основано на предпосылке ограниченной систематической ошибки в отчетности, потому что легче обнаружить отрицательные экспериментальные эффекты, чем положительные экспериментальные эффекты.[9] Кроме того, значительный эпигенетическое перепрограммирование необходимо для эволюционный успех зародышевых линий и начальные фазы эмбриогенез у млекопитающих может быть потенциальной причиной, ограничивающей наследование меток хроматина между поколениями у млекопитающих.[9]
Кроме того, некоторая эпигенетическая изменчивость может быть полезной. пластичность, так что определенные организмы могут адаптироваться к меняющимся условиям окружающей среды, но обмен эпигенетической информацией между поколениями может привести к эпигенетическим аберрациям, которые являются эпигенетическими признаками, отклоняющимися от нормы.[9][71] Следовательно, потомство родительские поколения может быть предрасположен к определенным заболеваниям и сниженной пластичности из-за эпигенетических аберраций.[9][71] Хотя способность быстро адаптироваться к новой среде у видов, которые могут быстро воспроизводиться, может быть полезной для определенных популяций, виды с длительным разрывом между поколениями могут не получить пользу от такой способности.[9][71] Если вид с более длительным разрывом между поколениями не адаптируется должным образом к ожидаемой среде, то репродуктивная пригодность потомства этого вида будет уменьшаться.[9]
Кроме того, закономерности эпигенетического наследования и эволюционные последствия эпигенетические коды в живых организмах связаны с обоими Ламарка и Дарвина теории эволюции.[71] Например, Ламарк предположил, что факторы окружающей среды ответственны за изменение фенотипов. по наследству, который поддерживает конструкции, которые воздействие факторов окружающей среды на критических этапах разработки может привести к эпимутации в зародышевые линии, тем самым увеличивая фенотипическую дисперсию.[71] Напротив, теория Дарвина утверждала, что естественный отбор усиливает способность популяций выживать и оставаться в живых. репродуктивно подходящий отдавая предпочтение популяциям, которые могут легко адаптироваться.[71] Эта теория согласуется с межпоколенческой пластичностью и фенотипической вариативностью, являющейся результатом наследственной адаптивности.[71]
История жизни закономерности также могут способствовать возникновению эпигенетического наследования. Sessile Организмы, обладающие низкой способностью к расселению и обладающие простым поведением, могут получить наибольшую выгоду от передачи информации своему потомству через эпигенетические пути. Также могут возникать географические закономерности, при которых сильно изменчивая и высококонсервативная среда может содержать меньшее количество видов с важным эпигенетическим наследованием.
Споры
Люди давно осознали, что черты родителей часто проявляются в потомстве. Это понимание привело к практическому применению селективного разведения растений и животных, но не решило главный вопрос наследования: как эти черты сохраняются между поколениями и что вызывает вариации? В истории эволюционной мысли занимали несколько позиций.
Смешивание против наследования частиц
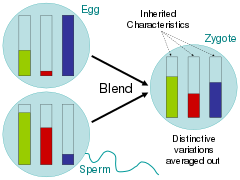
Обращаясь к этим связанным вопросам, ученые во времена Просвещения в основном отстаивали гипотезу смешения, в которой родительские черты гомогенизировались в потомстве, как ведра с краской разного цвета, смешанные вместе.[72] Критики Чарльза Дарвина О происхождении видов, указали, что при этой схеме наследования изменчивость быстро заменяется большинством фенотипа.[73] В аналогии с ведром с краской это можно увидеть, смешав два цвета вместе, а затем смешав полученный цвет только с одним из родительских цветов 20 раз; цвет редкого варианта быстро исчезнет.
Неизвестный большей части европейского научного сообщества монах по имени Грегор Мендель разрешили вопрос о том, как признаки сохраняются между поколениями, посредством селекционных экспериментов с растениями гороха.[74] Чарльз Дарвин таким образом, они не знали о предложенном Менделем «наследовании частиц», при котором признаки не смешивались, а передавались потомству в дискретных единицах, которые мы теперь называем генами. Дарвин отверг гипотезу смешения, хотя его идеи и идеи Менделя не были объединены до 1930-х годов, периода, известного как современный синтез.
Наследование врожденных и приобретенных характеристик
В своей книге 1809 г. Philosophie Zoologique,[75] Жан-Батист Ламарк признал, что каждый вид сталкивается с уникальным набором проблем из-за своей формы и окружающей среды. Таким образом, он предположил, что наиболее часто используемые символы будут накапливать «нервную жидкость». Такие приобретенные накопления затем передаются потомству индивидуума. Говоря современным языком, нервная жидкость, передаваемая потомству, была бы формой эпигенетического наследования.
Ламаркизм, как стали называть эти мысли, было стандартным объяснением изменения видов с течением времени, когда Чарльз Дарвин и Альфред Рассел Уоллес соавтором теории эволюции путем естественного отбора в 1859 году. В ответ на теорию Дарвина и Уоллеса пересмотренный неоламаркизм привлекла небольшую группу биологов,[76] хотя ламаркистское рвение было подавлено во многом благодаря Вейсмана[77] знаменитый эксперимент, в котором он отрезал хвосты мышей в течение нескольких последовательных поколений без какого-либо влияния на длину хвоста. Таким образом возникший консенсус о том, что приобретенные характеристики не могут быть унаследованы, стал каноническим.[2]
Пересмотр эволюционной теории
Однако негенетические вариации и наследование оказались довольно распространенными. Одновременно с развитием ХХ века современный эволюционный синтез (объединение менделевской генетики и естественного отбора), К. Х. Уоддингтон (1905-1975) работал над объединением биология развития и генетика. При этом он принял слово «эпигенетический».[78] для представления упорядоченной дифференцировки эмбриональных клеток в функционально различные типы клеток, несмотря на идентичную первичную структуру их ДНК.[79] Исследователи время от времени обсуждали эпигенетику Уоддингтона - она стала скорее универсальным средством для озадачивающих негенетических наследственных персонажей, а не концепцией, продвигающей круг исследований.[80][81] Следовательно, определение слова Уоддингтона эволюционировало, расширившись за пределы подмножества наследственной специализации клеток, сигнализируемой развитием.
Некоторые ученые задаются вопросом, не подрывает ли эпигенетическое наследование основы современного синтеза. Обрисовывая центральная догма молекулярной биологии, Фрэнсис Крик[82] лаконично сказано: «ДНК удерживается в конфигурации гистоном [ами], так что она может действовать как пассивная матрица для одновременного синтеза РНК и белка [ов]. Никто подробной «информации» находится в гистоне ». Однако он закрывает статью, утверждая, что« эта схема объясняет большинство настоящих экспериментальных результатов! »Действительно, появление эпигенетической наследственности (в дополнение к достижениям в изучении эволюционного развития, фенотипическая пластичность, эволюционируемость и системная биология) нарушили текущие рамки современного эволюционного синтеза и побудили пересмотреть ранее отвергнутые эволюционные механизмы.[83]
Было много[количественно оценить ] критическое обсуждение основной эволюционной теории Эдвард Дж Стил, Робин А. Линдли и его коллеги,[84][85][86][87][88] Фред Хойл и Н. Чандра Викрамасингхе,[89][90][91] Юншэн Лю[92][93] Денис Ноубл,[94][95] Джон Мэттик[96]и другие, что логические несоответствия, а также эффекты наследования Ламарка, включающие прямые модификации ДНК, а также только что описанные косвенные, а именно. эпигенетические передачи, бросают вызов традиционному мышлению в эволюционной биологии и смежных областях.
Смотрите также
- Вклад эпигенетических модификаций в эволюцию
- Överkalix исследование
- Голландский голод 1944–45 # Наследие
- Наследование стресса между поколениями
Рекомендации
- ^ Брэдбери Дж (декабрь 2003 г.). «Проект эпигенома человека - запущен». PLOS Биология. 1 (3): E82. Дои:10.1371 / journal.pbio.0000082. ЧВК 300691. PMID 14691553.
- ^ а б c d е ж Мур Д.С. (2015). Развивающийся геном. Издательство Оксфордского университета. ISBN 978-0-19-992234-5.[страницы необходимы ]
- ^ а б Слышал Э., Мартиенсен Р.А. (2014). «Эпигенетическая наследственность между поколениями: мифы и механизмы». Клетка. 157 (1): 95–109. Дои:10.1016 / j.cell.2014.02.045. ЧВК 4020004. PMID 24679529.CS1 maint: использует параметр авторов (связь)
- ^ Яблонька Е и MJ Lamb (2010). Эпигенетическая наследственность между поколениями. В: M Pigliucci и GB Müller Evolution, расширенный синтез
- ^ Зордан Р. Э., Галгоци Д. Д., Джонсон А. Д. (август 2006 г.). «Эпигенетические свойства переключения белого-непрозрачного цвета у Candida albicans основаны на самоподдерживающейся петле транскрипционной обратной связи». Труды Национальной академии наук Соединенных Штатов Америки. 103 (34): 12807–12. Дои:10.1073 / pnas.0605138103. ЧВК 1535343. PMID 16899543.
- ^ Бейссон Дж., Зоннеборн TM (февраль 1965 г.). "Цитоплазматическое наследование организации клеточной коры у Paramecium Aurelia". Труды Национальной академии наук Соединенных Штатов Америки. 53 (2): 275–82. Bibcode:1965ПНАС ... 53..275Б. Дои:10.1073 / pnas.53.2.275. ЧВК 219507. PMID 14294056.
- ^ Soto C, Castilla J (июль 2004 г.). «Спорная гипотеза о распространении прионов только на белках». Природа Медицина. 10 Дополнение (7): S63–7. Дои:10,1038 / нм 1069. PMID 15272271.
- ^ Vastenhouw NL, Brunschwig K, Okihara KL, Müller F, Tijsterman M, Plasterk RH (август 2006 г.). «Экспрессия гена: долгосрочное подавление гена с помощью РНКи». Природа. 442 (7105): 882. Bibcode:2006Натура.442..882В. Дои:10.1038 / 442882a. PMID 16929289.
- ^ а б c d е ж грамм час я j k л м п о п q р Хорстхемке, Б. Критический взгляд на трансгенерационную эпигенетическую наследственность у людей. Nat Commun 9, 2973 (2018). https://doi.org/10.1038/s41467-018-05445-5
- ^ а б Бонд ДМ, Finnegan EJ (2007). «Передача сообщения: наследование эпигенетических признаков». Тенденции в растениеводстве. 12 (5): 211–6. Дои:10.1016 / j.tplants.2007.03.010. PMID 17434332.
- ^ Морисон И.М., Рив А.Е. (1998). «Каталог импринтированных генов и эффектов родительского происхождения у людей и животных». Молекулярная генетика человека. 7 (10): 1599–609. Дои:10.1093 / hmg / 7.10.1599. PMID 9735381.
- ^ Скотт Р.Дж., Спилман М., Бейли Дж., Дикинсон Г.Г. (сентябрь 1998 г.). "Влияние исходного происхождения на развитие семян Arabidopsis thaliana". Разработка. 125 (17): 3329–41. PMID 9693137.
- ^ Аденот П.Г., Мерсье Ю., Ренард Дж. П., Томпсон Э.М. (1997). «Дифференциальное ацетилирование H4 отцовского и материнского хроматина предшествует репликации ДНК и дифференциальной транскрипционной активности в пронуклеусах одноклеточных эмбрионов мыши» (PDF). Разработка. 124 (22): 4615–25. PMID 9409678.
- ^ Сантос Ф., Хендрих Б., Рейк В., Дин В. (2002). «Динамическое перепрограммирование метилирования ДНК в раннем эмбрионе мыши». Биология развития. 241 (1): 172–82. Дои:10.1006 / dbio.2001.0501. PMID 11784103.
- ^ Освальд Дж., Энгеманн С., Лейн Н., Майер В., Олек А., Фундел Р., Дин В., Рейк В., Уолтер Дж. (Апрель 2000 г.). «Активное деметилирование отцовского генома в зиготе мыши». Текущая биология. 10 (8): 475–8. Дои:10.1016 / S0960-9822 (00) 00448-6. PMID 10801417.
- ^ Фулька Х, Мразек М, Тепла О, Фулька Дж (2004). «Паттерн метилирования ДНК в зиготах человека и развивающихся эмбрионах». Репродукция (Кембридж, Англия). 128 (6): 703–8. Дои:10.1530 / rep.1.00217. PMID 15579587.
- ^ Хакетт Дж. А., Сенгупта Р., Зилич Дж. Дж., Мураками К., Ли С., Даун Т. А., Сурани М. А. (январь 2013 г.). «Динамика деметилирования ДНК зародышевой линии и стирание отпечатка с помощью 5-гидроксиметилцитозина». Наука. 339 (6118): 448–52. Bibcode:2013Наука ... 339..448H. Дои:10.1126 / science.1229277. ЧВК 3847602. PMID 23223451.
- ^ Сурани М.А., Хайкова П. (2010). «Эпигенетическое перепрограммирование половых клеток мыши в сторону тотипотентности». Симпозиумы Колд-Спринг-Харбор по количественной биологии. 75: 211–8. Дои:10.1101 / sqb.2010.75.010. PMID 21139069.
- ^ Чжан З., Шибахара К., Стиллман Б. (ноябрь 2000 г.). «PCNA связывает репликацию ДНК с эпигенетическим наследованием у дрожжей». Природа. 408 (6809): 221–5. Bibcode:2000Натура.408..221Z. Дои:10.1038/35041601. PMID 11089978.
- ^ Хендерсон Д.С., Банга С.С., Грильятти Т.А., Бойд Дж. Б. (1994). «Чувствительность к мутагену и подавление вариэгации эффекта положения являются результатом мутаций в mus209, гене дрозофилы, кодирующем PCNA». Журнал EMBO. 13 (6): 1450–9. Дои:10.1002 / j.1460-2075.1994.tb06399.x. ЧВК 394963. PMID 7907981.
- ^ Пробст А.В., Данливи Э., Альмоузни Г. (2009). «Эпигенетическое наследование во время клеточного цикла». Обзоры природы Молекулярная клеточная биология. 10 (3): 192–206. Дои:10.1038 / nrm2640. PMID 19234478.
- ^ а б Морган HD, Сантос Ф, Грин К., Дин В., Рейк В. (2005). «Эпигенетическое репрограммирование у млекопитающих». Молекулярная генетика человека. 14 (Обзор выпуска 1): R47–58. Дои:10.1093 / hmg / ddi114. PMID 15809273.
- ^ Сантос Ф., Питерс А.Х., Отте А.П., Рейк В., Дин В. (2005). «Динамические модификации хроматина характеризуют первый клеточный цикл у эмбрионов мыши». Биология развития. 280 (1): 225–36. Дои:10.1016 / j.ydbio.2005.01.025. PMID 15766761.
- ^ Тагучи YH (2015). «Идентификация аберрантной экспрессии гена, связанной с аберрантным метилированием промотора в примордиальных половых клетках между линиями винклозолина поколения F3 крысы E13 и E16». BMC Bioinformatics. 16 Дополнение 18: S16. Дои:10.1186 / 1471-2105-16-S18-S16. ЧВК 4682393. PMID 26677731.
- ^ Ричардс EJ (2006). «Унаследованные эпигенетические вариации - возвращаясь к мягкому наследованию». Природа Обзоры Генетика. 7 (5): 395–401. Дои:10.1038 / nrg1834. PMID 16534512.
- ^ Яблонька Э, Ягненок MJ (1998). «Эпигенетическая наследственность в эволюции». Журнал эволюционной биологии. 11 (2): 159–183. Дои:10.1046 / j.1420-9101.1998.11020159.x.
- ^ Птица А., Киршнер М., Герхарт Дж., Мур Т., Воперт Л. (1998). «Комментарии к записи» Эпигенетическая наследственность в эволюции"". Журнал эволюционной биологии. 11 (2): 185–188, 213–217, 229–232, 239–240. Дои:10.1046 / j.1420-9101.1998.11020185.x.
- ^ а б c Яблонька Э, Раз Г (2009). «Трансгенерационное эпигенетическое наследование: распространенность, механизмы и последствия для изучения наследственности и эволюции». Ежеквартальный обзор биологии. 84 (2): 131–76. CiteSeerX 10.1.1.617.6333. Дои:10.1086/598822. PMID 19606595.
- ^ Расулзадеган М, Кузин Ф (2015). «Эпигенетическая наследственность: РНК-опосредованные способы фенотипической изменчивости». Ann N Y Acad Sci. 1341 (1): 172–5. Bibcode:2015НЯСА1341..172Р. Дои:10.1111 / nyas.12694. PMID 25726734.
- ^ Босдорф О., Ричардс К.Л., Пильуччи М. (2008). «Эпигенетика для экологов». Письма об экологии. 11 (2): 106–115. Дои:10.1111 / j.1461-0248.2007.01130.x. PMID 18021243.
- ^ Молинье Дж., Рис Дж., Зипфель С., Хон Б. (август 2006 г.). «Трансгенерационная память о стрессе у растений». Природа. 442 (7106): 1046–9. Bibcode:2006Натура 442.1046М. Дои:10.1038 / природа05022. PMID 16892047.
- ^ а б c d Коу, Э. Х. (июнь 1959 г.). «Регулярный и продолжающийся феномен конверсионного типа в локусе B кукурузы». Труды Национальной академии наук Соединенных Штатов Америки. 45 (6): 828–832. Bibcode:1959ПНАС ... 45..828С. Дои:10.1073 / пнас.45.6.828. ISSN 0027-8424. ЧВК 222644. PMID 16590451.
- ^ Чендлер, Вики Л. (23 февраля 2007 г.). «Парамутация: от кукурузы к мышам». Клетка. 128 (4): 641–645. Дои:10.1016 / j.cell.2007.02.007. ISSN 1097-4172. PMID 17320501.
- ^ а б Стам, Майке; Белеле, Кристиана; Рамакришна, Вусирика; Дорвейлер, Джейн Э; Беннетцен, Джеффри Л; Чендлер, Вики Л. (октябрь 2002 г.). «Регуляторные области, необходимые для парамутации и экспрессии B ', расположены далеко впереди транскрибируемых последовательностей b1 кукурузы». Генетика. 162 (2): 917–930. ISSN 0016-6731. ЧВК 1462281. PMID 12399399.
- ^ а б Чендлер, Вики Л .; Артеага-Васкес, Марио А .; Бадер, Речень; Стам, Майке; Сидоренко Людмила; Белеле, Кристиана Л. (17.10.2013). «Конкретных тандемных повторов достаточно для индуцированного парамутациями молчания между поколениями». PLOS Genetics. 9 (10): e1003773. Дои:10.1371 / journal.pgen.1003773. ISSN 1553-7404. ЧВК 3798267. PMID 24146624.
- ^ а б Артеага-Васкес, Марио; Сидоренко Людмила; Rabanal, Fernando A .; Шривистава, Роли; Нобута, Кан; Грин, Памела Дж .; Мейерс, Блейк С.; Чендлер, Вики Л. (20.07.2010). «РНК-опосредованная транс-коммуникация может установить парамутацию в локусе b1 кукурузы». Труды Национальной академии наук Соединенных Штатов Америки. 107 (29): 12986–12991. Bibcode:2010PNAS..10712986A. Дои:10.1073 / pnas.1007972107. ISSN 0027-8424. ЧВК 2919911. PMID 20616013.
- ^ а б Стам, Майке; Лаат, Воутер де; Дриэль, Роэл ван; Харинг, Макс; Бадер, Речень; Louwers, Мариеке (2009-03-01). «Тканевые и специфические уровни экспрессии хроматина, петля в эпиаллелях b1 кукурузы». Растительная клетка. 21 (3): 832–842. Дои:10.1105 / tpc.108.064329. ISSN 1532–298X. ЧВК 2671708. PMID 19336692.
- ^ а б Харинг, Макс; Бадер, Речень; Жалюзи, Мариеке; Швабе, Энн; Дриэль, Роэл ван; Стам, Майке (01.08.2010). «Роль метилирования ДНК, занятости нуклеосом и модификаций гистонов в парамутации». Журнал растений. 63 (3): 366–378. Дои:10.1111 / j.1365-313X.2010.04245.x. ISSN 1365-313X. PMID 20444233.
- ^ а б Чендлер, Вики Л .; Kermicle, Jerry L .; Холлик, Джей Б.; Кубо, Кеннет М .; Кэри, Чарльз С .; Дорвейлер, Джейн Э. (2000-11-01). «посредник парамутации1 необходим для установления и поддержания парамутации в нескольких локусах кукурузы». Растительная клетка. 12 (11): 2101–2118. Дои:10.1105 / tpc.12.11.2101. ISSN 1532–298X. ЧВК 150161. PMID 11090212.
- ^ а б c Аллеман, Мэри; Чендлер, Вики (2008-04-01). «Парамутация: эпигенетические инструкции, передаваемые из поколения в поколение». Генетика. 178 (4): 1839–1844. ISSN 1943-2631. ЧВК 2323780. PMID 18430919.
- ^ Мейерс, Блейк С.; Чендлер, Вики Л .; Грин, Памела Дж .; Йен, Ян; Чон, Донг-Хун; Сидоренко Людмила; Артеага-Васкес, Марио; Акчерби, Моника; Паоли, Эмануэле Де (30 сентября 2008 г.). «Отчетливое распределение эндогенных миРНК по размерам в кукурузе: данные глубокого секвенирования мутанта mop1-1». Труды Национальной академии наук. 105 (39): 14958–14963. Bibcode:2008ПНАС..10514958Н. Дои:10.1073 / pnas.0808066105. ISSN 1091-6490. ЧВК 2567475. PMID 18815367.
- ^ Чендлер, Вики Л .; Сиккинк, Кристин; Уайт, Джошуа; Дорвейлер, Джейн Э .; Сешадри, Вишвас; Макгиннис, Карен; Сидоренко Людмила; Аллеман, Мэри (июль 2006 г.). «РНК-зависимая РНК-полимераза необходима для парамутации кукурузы». Природа. 442 (7100): 295–298. Bibcode:2006Натура 442..295А. Дои:10.1038 / природа04884. ISSN 1476-4687. PMID 16855589.
- ^ Артеага-Васкес, Марио Альберто; Чендлер, Вики Линн (апрель 2010 г.). «Парамутация в кукурузе: РНК-опосредованное подавление генов между поколениями». Текущее мнение в области генетики и развития. 20 (2): 156–163. Дои:10.1016 / j.gde.2010.01.008. ISSN 0959-437X. ЧВК 2859986. PMID 20153628.
- ^ Huang, J .; Lynn, J.S .; Schulte, L .; Vendramin, S .; Макгиннис, К. (01.01.2017). Эпигенетический контроль экспрессии генов в кукурузе. Международный обзор клеточной и молекулярной биологии. 328. С. 25–48. Дои:10.1016 / bs.ircmb.2016.08.002. ISBN 9780128122204. ISSN 1937-6448. PMID 28069135.
- ^ Чендлер, Вики Л. (29 октября 2010 г.). «Свойства парамутации и загадки». Наука. 330 (6004): 628–629. Bibcode:2010Sci ... 330..628C. Дои:10.1126 / science.1191044. ISSN 1095-9203. PMID 21030647.
- ^ а б c Ло, Лицзюнь; Ли, Тиемей; Ли, Миншоу; Лу, Цяоцзюнь; Вэй, Хайбинь; Ся, Хуэй; Чен, Лян; Чжэн, Сяого (04.01.2017). «Трансгендерные эпимутации, вызванные наложением засухи из-за нескольких поколений, опосредуют адаптацию растений риса к условиям засухи». Научные отчеты. 7: 39843. Bibcode:2017НатСР ... 739843Z. Дои:10.1038 / srep39843. ISSN 2045-2322. ЧВК 5209664. PMID 28051176.
- ^ а б c d Джандер, Георг; Фелтон, Гэри У .; Agrawal, Anurag A .; Sun, Joel Y .; Халичке, Райко; Тиан, Донглань; Casteel, Clare L .; Вос, Мартин Де; Расманн, Серджио (01.02.2012). «Травоядность в предыдущем поколении способствует повышению устойчивости растений к насекомым». Физиология растений. 158 (2): 854–863. Дои:10.1104 / стр.111.187831. ISSN 1532-2548. ЧВК 3271773. PMID 22209873.
- ^ Квадрана, Леандро; Коло, Винсент (2016). «Эпигенетика трансгенерации растений». Ежегодный обзор генетики. 50 (1): 467–491. Дои:10.1146 / annurev-genet-120215-035254. PMID 27732791.
- ^ а б c d е Вэй Й, Шаттен Х, Сан QY (2014). «Экологическая эпигенетическая наследственность через гаметы и последствия для воспроизводства человека». Обновление репродукции человека. 21 (2): 194–208. Дои:10.1093 / humupd / dmu061. PMID 25416302.
- ^ Карл Циммер (31 января 2018 г.). «Голод закончился 70 лет назад, но голландские гены все еще несут шрамы». Нью-Йорк Таймс.
- ^ Кейт Баггейли (9 ноября 2018 г.). «Исследование гражданской войны показывает, что стресс отца влияет на продолжительность жизни сына».
- ^ Лаланд М (1996). «Родительский импринтинг и болезни человека». Ежегодный обзор генетики. 30: 173–95. Дои:10.1146 / annurev.genet.30.1.173. PMID 8982453.
- ^ а б c d да Круз, Р. С., Чен, Э., Смит, М., Бейтс, Дж., и де Ассис, С. (2020). Диета и трансгенерационное эпигенетическое наследование рака груди: роль отцовской зародышевой линии. Границы питания, 7, 93. https://doi.org/10.3389/fnut.2020.0009
- ^ а б c Фонтеллес, К., Карни, Э., Кларк, Дж. и другие. Избыточный вес отца связан с повышенным риском рака груди у дочерей на мышиной модели. Научный представитель 6, 28602 (2016). https://doi.org/10.1038/srep28602
- ^ Weaver IC, Cervoni N, Champagne FA, D'Alessio AC, Sharma S, Seckl JR, Dymov S, Szyf M, Meaney MJ (август 2004 г.). «Эпигенетическое программирование по материнскому поведению». Природа Неврология. 7 (8): 847–54. Дои:10.1038 / nn1276. PMID 15220929.
- ^ Макгоуэн П.О., Сасаки А., Д'Алессио А.С., Дымов С., Лабонте Б., Шиф М., Турецки Г., Мини М.Дж. (март 2009 г.). «Эпигенетическая регуляция глюкокортикоидных рецепторов в мозге человека связана с жестоким обращением в детстве». Природа Неврология. 12 (3): 342–8. Дои:10.1038 / нн.2270. ЧВК 2944040. PMID 19234457.
- ^ Мини MJ, Szyf M (2005). «Экологическое программирование стрессовых реакций через метилирование ДНК: жизнь на стыке динамической среды и фиксированного генома». Диалоги в клинической неврологии. 7 (2): 103–23. ЧВК 3181727. PMID 16262207.
- ^ а б Радтке К.М., Руф М., Гюнтер Х.М., Дорманн К., Шауэр М., Мейер А., Эльберт Т. (июль 2011 г.). «Влияние насилия со стороны интимного партнера на метилирование в промоторе рецептора глюкокортикоидов». Трансляционная психиатрия. 1 (19 июля): e21. Дои:10.1038 / tp.2011.21. ЧВК 3309516. PMID 22832523.
- ^ а б c d Kioumourtzoglou M, Coull BA, O’Reilly ÉJ, Ascherio A, Weisskopf MG. Связь воздействия диэтилстильбестрола во время беременности с нарушениями развития нервной системы у нескольких поколений. JAMA Pediatr. 2018; 172 (7): 670–677. DOI: 10.1001 / jamapediatrics.2018.0727
- ^ Яблонька Э, Ягненок MJ (2005). Эпигенетическое наследование и эволюция: ламарковское измерение (Перепечатано под ред.). Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-854063-2.
- ^ Кубас П., Винсент С., Коэн Э. (1999). «Эпигенетическая мутация, ответственная за естественные вариации в симметрии цветков». Природа. 401 (6749): 157–61. Bibcode:1999Натура 401..157С. Дои:10.1038/43657. PMID 10490023.
- ^ Дафни А., Кеван П. Г. (1997). «Размер и форма цветка: влияние на опыление». Израильский журнал растениеводства. 45 (2–3): 201–211. Дои:10.1080/07929978.1997.10676684.
- ^ Фрейзер М.Л., Си Л., Зонг Дж., Вискофски Н., Рашид А., Ву Э.Ф., Линч П.М., Амос К.И., Исса Дж. П. (август 2003 г.). «Связь фенотипа метилирования острова CpG с семейным анамнезом рака у пациентов с колоректальным раком». Исследования рака. 63 (16): 4805–8. PMID 12941799.
- ^ Чан Т.Л., Юэн С.Т., Конг С.К., Чан Ю.В., Чан А.С., Нг В.Ф., Цуй В.Й., Ло М.В., Там В.Й., Ли В.С., Люн С.И. (октябрь 2006 г.). «Наследственная эпимутация MSH2 в зародышевой линии в семье с наследственным неполипозным колоректальным раком». Природа Генетика. 38 (10): 1178–83. Дои:10,1038 / ng1866. ЧВК 7097088. PMID 16951683.
- ^ Босдорф О., Аркури Д., Ричардс К.Л., Пильуччи М. (2010). «Экспериментальное изменение метилирования ДНК влияет на фенотипическую пластичность экологически значимых признаков у Arabidopsis thaliana" (PDF). Эволюционная экология. 24 (3): 541–553. Дои:10.1007 / s10682-010-9372-7.
- ^ Whittle CA, Отто SP, Джонстон MO, Крочко JE (2009). «Адаптивная эпигенетическая память о температурном режиме предков в Arabidopsis thaliana". Ботаника. 87 (6): 650–657. Дои:10.1139 / b09-030.
- ^ Керли, Дж. П., Ф. А. Шампань и П. Бейтсон (2007) Совместное гнездование вызывает альтернативное эмоциональное, социальное и материнское поведение у потомства. 11-е Ежегодное собрание Общества поведенческой нейроэндокринологии, Пасифик Гроув, Калифорния, США. Цитируется в Бранчи I (апрель 2009 г.). «Общее гнездо мышей: исследование эпигенетических влияний ранней социальной среды на развитие мозга и поведения». Неврология и биоповеденческие обзоры. 33 (4): 551–9. Дои:10.1016 / j.neubiorev.2008.03.011. PMID 18471879.
- ^ Бранчи I, Д'Андреа I, Фиоре М., Ди Фаусто В., Алоэ Л., Аллева Э (октябрь 2006 г.). «Раннее социальное обогащение формирует социальное поведение и уровни факторов роста нервов и нейротрофических факторов мозга в мозге взрослых мышей». Биологическая психиатрия. 60 (7): 690–6. Дои:10.1016 / j.biopsych.2006.01.005. PMID 16533499.
- ^ Whitham TG, Слободчиков CN (1981). «Эволюция индивидуумов, взаимодействия растений и травоядных и мозаика генетической изменчивости: адаптивное значение соматических мутаций в растениях». Oecologia. 49 (3): 287–292. Bibcode:1981Oecol..49..287W. Дои:10.1007 / BF00347587. PMID 28309985.
- ^ Туриан Г (1979). «Спорогенез у грибов». Ежегодный обзор фитопатологии. 12: 129–137. Дои:10.1146 / annurev.py.12.090174.001021.
- ^ а б c d е ж грамм ван Оттердейк, С.Д. и Михельс, К. (2016), Эпигенетическая наследственность между поколениями у млекопитающих: насколько убедительны доказательства ?. Журнал FASEB, 30: 2457-2465. https://doi.org/10.1096/fj.201500083
- ^ Ворзиммер П. (1963). «Чарльз Дарвин и смешение наследования». Исида. 54 (3): 371–390. Дои:10.1086/349734.
- ^ Дженкин Ф (1867). "Обзор Происхождение видов". Обзор North British.
- ^ Мендель Г (1866). "Versuche über Plflanzenhybriden. Verhandlungen des naturforschenden Vereines в Брюнне" [Эксперименты по гибридизации растений] (PDF). Прочтите на собраниях Общества естественной истории Брюнна 8 февраля и 8 марта 1865 г. (на немецком).
- ^ Ламарк, Дж. Б. (1809). Philosophie zoologique: ou Exposition des considérations relative à l'histoire naturelle des animaux. Dentu et L'Auteur, Париж.
- ^ Bowler PJ (1989). Эволюция, история идеи. Беркли: Калифорнийский университет Press. ISBN 978-0-520-06386-0.
- ^ Вейсман А. (1891 г.). Поултон Е.Б., Шёнланд С., Шипли Э. (ред.). Очерки наследственности и родственных биологических проблем. Оксфорд: Clarendon Press. Дои:10.5962 / bhl.title.28066.
- ^ {{oed | эпигенетический
- ^ Waddington CH (2016) [1939]. «Развитие как эпигенетический процесс». Введение в современную генетику. Лондон: Аллен и Анвин. ISBN 9781317352037.
Одним из классических противоречий в эмбриологии был спор между преформистами и эпигенизистами [sic]. [...] взаимодействие этих составляющих порождает новые типы тканей и органов, которых изначально не было, и до сих пор их развитие следует рассматривать как «эпигенетическое».
- ^ Холлидей Р. (2006). «Эпигенетика: исторический обзор». Эпигенетика. 1 (2): 76–80. Дои:10.4161 / epi.1.2.2762. PMID 17998809.
- ^ Нэнни Д.Л. (июль 1958 г.). «Эпигенетические системы контроля». Труды Национальной академии наук Соединенных Штатов Америки. 44 (7): 712–7. Bibcode:1958ПНАС ... 44..712Н. Дои:10.1073 / пнас.44.7.712. ЧВК 528649. PMID 16590265.
- ^ Крик Ф.Х. (1958). «О синтезе белка» (PDF). Симпозиумы Общества экспериментальной биологии. 12: 138–63. PMID 13580867.
- ^ Пильуччи М. (декабрь 2007 г.). «Нужен ли нам расширенный эволюционный синтез?». Эволюция; Международный журнал органической эволюции. 61 (12): 2743–9. Дои:10.1111 / j.1558-5646.2007.00246.x. PMID 17924956.
- ^ Стил, Э.Дж. (1979). Соматический отбор и адаптивная эволюция: о наследовании приобретенных признаков (1-е изд.). Торонто: Уильямс-Уоллес.
- ^ Стил, E.J .; Lindley, R.A .; Blanden, R.V. (1998). Дэвис, Пол (ред.). Подпись Ламарка: как ретрогены меняют парадигму естественного отбора Дарвина. Границы науки. Сидней: Аллен и Анвин.
- ^ Линдли, Р.А. (2010). Сома: как на самом деле работают наши гены и как это меняет все!. Пиара Уотерс, Фонд CYO. ISBN 978-1451525649.
- ^ Стил, E.J .; Ллойд, С.С. (2015). «Обратная связь от сомы к зародышевой линии подразумевается крайним полиморфизмом IGHV относительно MHC». BioEssays. 37 (5): 557–569. Дои:10.1002 / bies.201400213. PMID 25810320.
- ^ Стил, Э.Дж. (2016). Левин, Михаил; Адамс, Дэни Спенсер (ред.). Происхождение врожденных дефектов: стабильное наследование по мужской линии через материнские антитела, специфичные к антигенам хрусталика глаза, вызывающие аутоиммунные дефекты глаза у развивающихся кроликов в утробе матери.. Впереди кривая - Скрытые открытия в биологических науках. Бристоль, Великобритания: IOP Publishing Ltd., стр. 3.
- ^ Hoyle, F .; Викрамасингхе, Чандра (1982). Почему неодарвинизм не работает. Кардифф: Университетский колледж Кардифф Пресс. ISBN 0-906449-50-2.
- ^ Hoyle, F .; Викрамасингх, Северная Каролина (1979). Болезни из космоса. Лондон: J.M. Dent.
- ^ Hoyle, F .; Викрамасингхе, Северная Каролина (1981). Эволюция из космоса. Лондон: J.M. Dent.
- ^ Лю, Ю. (2007). «Как отец, как сын. Свежий обзор наследования приобретенных характеристик». EMBO отчеты. 8 (9): 798–803. Дои:10.1038 / sj.embor.7401060. ЧВК 1973965. PMID 17767188.
- ^ Liu, Y .; Ли, X. (2016). «Пангенез Дарвина как молекулярная теория наследственных болезней». Джин 2016a. 582 (1): 19–22. Дои:10.1016 / j.gene.2016.01.051. PMID 26836487.
- ^ Ноубл, Д. (2011). «Теория биологической относительности: нет привилегированного уровня причинности». Фокус интерфейса. 2 (1): 55–64. Дои:10.1098 / rsfs.2011.0067. ЧВК 3262309. PMID 23386960.
- ^ Ноубл, Д. (2013). «Физиология потрясает основы эволюционной биологии». Exp. Физиол. 98 (8): 1235–1243. Дои:10.1113 / expphysiol.2012.071134. PMID 23585325.
- ^ Мэттик, Дж. (2012). «Качаем основы молекулярной генетики». Proc Natl Acad Sci USA. 109 (41): 16400–16401. Bibcode:2012ПНАС..10916400М. Дои:10.1073 / pnas.1214129109. ЧВК 3478605. PMID 23019584.
