Костная пластика - Bone grafting
| Костная пластика | |
|---|---|
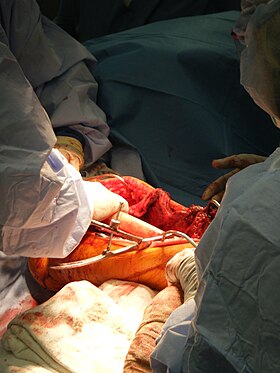 Во время операции хирург устанавливает костный трансплантат. спасение конечностей. | |
| МКБ-9-СМ | 78.0 |
| MeSH | D016025 |
| MedlinePlus | 002963 |
Костная пластика это хирургическая процедура, заменяющая отсутствующие кость чтобы отремонтировать переломы костей которые чрезвычайно сложны, представляют значительный риск для здоровья пациента или не заживают должным образом. Некоторые небольшие или острые переломы можно вылечить без костной пластики, но риск больших переломов, таких как сложные переломы, выше.
Кость обычно обладает способностью к полной регенерации, но для этого требуется очень небольшое пространство перелома или какой-то каркас. Костные трансплантаты могут быть аутологичными (кость берется из собственного тела пациента, часто из гребень подвздошной кости ), аллотрансплантат (трупная кость, обычно получаемая из костного банка) или синтетический (часто сделанный из гидроксиапатит или другие встречающиеся в природе и биосовместимый вещества) с аналогичными механическими свойствами костей. Ожидается, что большинство костных трансплантатов реабсорбируются и заменяются по мере заживления естественной кости в течение нескольких месяцев.
Принципы, лежащие в основе успешных костных трансплантатов, включают остеокондукцию (направление репаративного роста естественной кости), остеоиндукцию (поощрение недифференцированных клеток к превращению в активные остеобласты) и остеогенез (живые костные клетки в материале трансплантата способствуют ремоделированию кости). Остеогенез происходит только с тканью аутотрансплантата и клеточно-костным матриксом аллотрансплантата.
Биологический механизм
| Остеокондуктивный | Остеоиндуктивный | Остеогенный | |
|---|---|---|---|
| Аллопласт | + | – | – |
| Ксенотрансплантат | + | – | – |
| Аллотрансплантат | + | +/– | – |
| Аутотрансплантат | + | + | + |
Костная трансплантация возможна, потому что костная ткань, в отличие от большинства других тканей, обладает способностью полностью регенерироваться, если есть пространство для роста. По мере роста собственной кости она обычно полностью заменяет трансплантат, в результате чего образуется полностью интегрированная область новой кости. Биологические механизмы, лежащие в основе трансплантации кости, - это остеокондукция, остеоиндукция и остеогенез.[1]
Остеокондукция
Остеокондукция возникает, когда материал костного трансплантата служит каркасом для роста новой кости, которая поддерживается собственной костью. Остеобласты от края пересаживаемого дефекта использовать костный трансплантат в качестве основы для распространения и образования новой кости.[1] По крайней мере, материал костного трансплантата должен быть остеокондуктивным.
Остеоиндукция
Остеоиндукция включает в себя стимуляцию остеопрогениторных клеток для дифференцировки в остеобласты, которые затем начинают образование новой кости. Наиболее изученным типом медиаторов остеоиндуктивных клеток являются костные морфогенетические белки (БМП).[1] Материал костного трансплантата, который является остеокондуктивным и остеоиндуктивным, будет не только служить в качестве основы для существующих в настоящее время остеобластов, но также будет запускать образование новых остеобластов, теоретически способствуя более быстрой интеграции трансплантата.
Остеопродвижение
Остеопромоция включает усиление остеоиндукции без обладания остеоиндуктивными свойствами. Например, производная эмалевой матрицы было показано, что усиливает остеоиндуктивный эффект деминерализованный лиофилизированный костный аллотрансплантат (DFDBA), но не будет стимулировать рост новых костей в одиночку.[2]
Остеогенез
Остеогенез происходит, когда жизненно важные остеобласты, происходящие из материала костного трансплантата, способствуют росту новой кости наряду с ростом кости, генерируемым посредством двух других механизмов.[1]
Метод
В зависимости от того, где требуется костный трансплантат, операцию могут попросить другого врача. Врачи, которые проводят операции по пересадке костной ткани, обычно ортопеды, отоларинголог, хирург головы и шеи, нейрохирурги, черепно-лицевые хирурги, челюстно-лицевые хирурги, ортопедические хирурги и пародонтологи, стоматологические хирурги, оральные хирурги и имплантологи.[3]
Аутотрансплантат

Аутологичный (или аутогенная) костная пластика включает использование кости, полученной от того же человека, которому была сделана трансплантация. Кость может быть получена из несущественных костей, например, из гребень подвздошной кости, или чаще в челюстно-лицевой хирургии, от нижнечелюстного симфиза (область подбородка) или передней ветви нижней челюсти ( венечный отросток ); это особенно верно для блочные трансплантаты, в котором небольшой кусок кости помещается целиком в область трансплантации. Когда будет выполняться блочный трансплантат, аутогенная кость является наиболее предпочтительной, потому что существует меньший риск отторжения трансплантата, потому что трансплантат возник из собственного тела пациента.[4] Как указано в таблице выше, такой трансплантат будет остеоиндуктивным и остеогенным, а также остеокондуктивным. Отрицательный аспект аутологичных трансплантатов заключается в том, что требуется дополнительное хирургическое поле, что фактически добавляет еще одно потенциальное место для послеоперационной боли и осложнений.[5]
Аутологичную кость обычно получают из интраоральных источников в виде подбородка или из экстраоральных источников в качестве гребень подвздошной кости, то малоберцовая кость, то ребра, то нижняя челюсть и даже части череп.
Вся кость требует кровоснабжения в месте трансплантации. В зависимости от того, где находится место трансплантации и размера трансплантата, может потребоваться дополнительное кровоснабжение. Для этих типов трансплантатов удаление части надкостница и сопутствующие кровеносные сосуды вместе с донорской костью. Этот вид прививки известен как жизненно важный костный трансплантат.
Аутотрансплантат также может быть выполнен без твердой костной структуры, например, с использованием кости, рассвернутой из передняя верхняя подвздошная ость. В этом случае наблюдается остеоиндуктивное и остеогенное действие, но отсутствует остеокондуктивное действие, так как отсутствует прочная костная структура.
Подбородок предлагает большое количество корково-губчатого аутотрансплантата и легкий доступ ко всем интраоральным участкам. Его можно легко собрать в условиях офиса под местной анестезией в амбулаторных условиях. Близость донора и реципиента сокращает время и стоимость операции. Удобный хирургический доступ, низкая заболеваемость, исключение необходимости пребывания в больнице, минимальный дискомфорт в донорском участке и предотвращение кожных рубцов - дополнительные преимущества.

Дентин трансплантат
Дентин кость из удаленных зубов,[нужна цитата ] Дентин составляет более 85% структуры зуба, эмаль состоит из минерала ГК и составляет 10% структуры зуба. Дентин похож на кость по химическому составу, по объему 70-75% - это минерал ГК и 20% органический матрикс, в основном волокнистый коллаген I типа.[6] Дентин, как и кость, может высвобождать факторы роста и дифференциации при резорбции остеокластами. Чтобы сделать дентиновый трансплантат пригодным для использования и избавить от бактерий, некоторые компании разработали клинические процедуры, которые включают шлифовку, сортировку и чистку зубов для немедленного или будущего использования. В Корее с января 2009 года по октябрь 2012 года Корейский банк зубов провел биологическую переработку собственных зубов 38000 пациентов.
Аллотрансплантаты
Аллотрансплантат кость, как и аутогенная кость, происходит от человека; разница в том, что аллотрансплантат получают не от человека, которому он был получен. Кость аллотрансплантата можно взять из трупы пожертвовали свою кость, чтобы ее можно было использовать живым людям, которые в ней нуждаются; его обычно получают из костный банк. Банки костей также поставляют кость аллотрансплантата из жизнь человеческие доноры костей (обычно стационарные пациенты в больницах), которым проводится плановая тотальная артропластика бедра (операция по тотальному эндопротезированию тазобедренного сустава). Во время полной замены бедра хирург-ортопед удаляет головку бедра пациента, что является необходимой частью процесса установки искусственного протеза бедра. Головка бедренной кости - это примерно сферический участок кости, расположенный на проксимальном конце бедренной кости, диаметром от 45 до 56 мм у взрослых людей. Головка бедренной кости пациента чаще всего выбрасывается в больничные отходы в конце хирургической процедуры. Однако, если пациент соответствует ряду строгих нормативных, медицинских и социальных критериев анамнеза и дает информированное согласие, его головка бедренной кости может быть помещена в банк костей больницы.
Доступны три типа костного аллотрансплантата:[7]
- Свежая или свежезамороженная кость
- Лиофилизированный костный аллотрансплантат (FDBA)
- Деминерализованный лиофилизированный костный аллотрансплантат (DFDBA)
Аллопластические трансплантаты
Аллопластические трансплантаты могут быть изготовлены из гидроксиапатит, естественный минерал, который также является основным минеральным компонентом костей. Они могут быть сделаны из биоактивное стекло.Гидроксилапатит - это синтетический костный трансплантат, который в настоящее время наиболее широко используется среди других синтетических материалов из-за его остеокондукции, твердости и приемлемости для костей. Фосфат трикальция, который теперь используется в сочетании с гидроксилапатитом, таким образом, дает как эффект остеокондукции, так и резорбируемость. Полимеры, такие как некоторые микропористый степени ПММА и различные другие акрилаты (такие как полигидроксилэтилметакрилат, также известный как PHEMA), покрытые гидроксидом кальция для адгезии, также используются в качестве аллопластических трансплантатов для их ингибирования инфекции, их механической устойчивости и биосовместимости.[8] Кальцифицирующие морские водоросли, такие как Кораллина лекарственная имеют фторгидроксиапатитовый состав, структура которого похожа на человеческую кость и обеспечивает постепенную резорбцию, поэтому его рассматривают и стандартизируют как аллопластические костные трансплантаты «FHA (фтор-гидроксиапатитовый) биоматериал».[9]
Синтетические варианты
Искусственная кость могут быть созданы из керамики, такой как фосфат кальция (например, гидроксиапатит и трикальцийфосфат ), Биостекло и сульфат кальция; все они биологически активны в разной степени в зависимости от растворимости в физиологической среде.[10] Эти материалы могут быть легированы факторы роста, ионы, такие как стронций[11] или смешанный с Костный мозг аспирация для повышения биологической активности. Некоторые авторы считают, что этот метод уступает аутогенной костной пластике.[4] однако инфицирование и отторжение трансплантата представляют гораздо меньший риск, а механические свойства, такие как Модуль для младших сравнимы с костью. Наличие таких элементов, как стронций может привести к более высокому минеральная плотность костей и улучшенный остеобласт распространение in vivo.
Временная распорка
Синтетический материал может использоваться в качестве временного спейсера с антибиотиком перед заменой более прочным материалом. Например, Масклет процедура состоит из первоначального использования ПММА, смешанного с антибиотик (ванкомицин или же гентамицин ) в течение 4–12 недель, а затем замените пространство аутологичным костным трансплантатом.[12] Его можно использовать для лечения посттравматических дефектов костей.[12]
Ксенотрансплантаты
Ксенотрансплантат костный заменитель происходит от других видов, кроме человека, таких как бык кость (или недавно свиная кость), которая может быть сублимированный или деминерализованные и депротеинизированные. Ксенотрансплантаты обычно распространяются только в виде кальцинированного матрикса. Мадрепор или миллепор типа кораллы собираются и обрабатываются, чтобы стать «гранулами кораллового происхождения» (CDG)[13] и другие виды кораллиновых ксенотрансплантатов.[14] Ксенотрансплантаты на основе кораллов в основном карбонат кальция (и важная доля фторидов, используемых в контексте трансплантации для содействия развитию костей), в то время как естественная человеческая кость состоит из гидроксиапатита, а также фосфата и карбоната кальция: коралловый материал, таким образом, превращается в промышленном масштабе в гидроксиапатит посредством гидротермальный Процесс, приводящий к получению нерезорбируемого ксенотрансплантата, или просто процесс опускается, и кораллиновый материал остается в своем состоянии карбоната кальция для лучшей резорбции трансплантата естественной костью. Затем ксенотрансплантат кораллов насыщается гелями и растворами, способствующими росту.[15]
Факторы роста
Фактор роста усиленные трансплантаты производятся с использованием технологии рекомбинантной ДНК. Они состоят либо из факторов роста человека, либо из морфогенов (Костные морфогенные белки в сочетании со средой-носителем, например коллагеном).
Восстановление и реабилитация
Время, необходимое человеку для восстановления, зависит от серьезности травмы, которую лечат, и длится от двух недель до двух месяцев с возможностью запрета на интенсивные упражнения на срок до шести месяцев. Для заживления трансплантата дистального отдела бедренной кости требуется до 6 месяцев.[16]
Использует
Зубные имплантаты
Чаще всего костная пластика используется при наложении зубные имплантаты восстановить беззубый область отсутствующего зуба. Зубным имплантатам требуются кости под ними для поддержки и правильная интеграция в рот. Как упоминалось ранее, костные трансплантаты бывают разных форм, таких как аутологичные (от одного человека), аллотрансплантаты, ксенотрансплантаты (в основном бычья кость) и аллопластические материалы. Костные трансплантаты можно использовать до установки имплантата или одновременно.[17] У людей, которые долгое время были беззубыми (без зубов), может не хватить кости в необходимых местах. В этом случае аутологичная кость может быть взята из подбородка, из пилотных отверстий для имплантатов или даже из гребня подвздошной кости таза и вставлена в рот под новым имплантатом. В качестве альтернативы можно использовать экзогенную кость: чаще всего используется ксенотрансплантат, поскольку он дает преимущество исключительной стабильности объема во времени. Аллотрансплантат обеспечивает лучшее качество регенерации, но имеет более низкую стабильность объема. Часто используется смесь разных видов костных трансплантатов.
Как правило, костный трансплантат используется либо единым блоком (например, из подбородка или восходящей ветви нижней челюсти), либо в виде частиц, чтобы лучше приспособить его к дефекту.
Зубная костная пластика - это специализированная хирургическая процедура полости рта, которая была разработана для восстановления утраченной челюстной кости. Эта потеря может быть результатом зубная инфекция абсцесса, парадантоз, травма или естественный процесс старения. Существуют разные причины для замещения утраченной костной ткани и стимулирования естественного роста костей, и каждый метод по-своему устраняет дефекты челюстной кости. Причины, по которым может потребоваться костная пластика, включают: увеличение носовых пазух, сохранение сокета, увеличение гребня или регенерация.
Малоберцовый вал
Другой распространенный костный трансплантат, более крупный, чем те, которые используются для зубных имплантатов, - это диафиз малоберцовой кости. После удаления сегмента диафиза малоберцовой кости на ноге с дефицитом кости разрешены нормальные действия, такие как бег и прыжки. Привитые васкуляризованные малоберцовые кости используются для восстановления целостности скелета длинных костей конечностей, в которых существуют врожденные дефекты костей, и для замены сегментов кости после травмы или инвазии злокачественной опухоли. Надкостница и питательная артерия обычно удаляются вместе с куском кости, так что трансплантат остается живым и растет при трансплантации на новое место хозяина. Как только пересаженная кость закреплена на новом месте, она обычно восстанавливает кровоснабжение кости, в которой она была прикреплена.
Другой
Костные трансплантаты используются в надежде, что дефектная кость заживет или вырастет практически без особого труда. отторжение трансплантата.[16] Помимо основного применения костной пластики - дентальных имплантатов - эта процедура используется для сращивания суставов для предотвращения движения, восстановления сломанных костей с потерей костной массы и восстановления сломанных костей, которые еще не зажили.[16] Кроме того, костные трансплантаты или заменители широко используются для увеличения процедур спондилодеза.[18]
Риски
Как и с любой процедурой, здесь есть риски; к ним относятся реакции на лекарства, проблемы с дыханием, кровотечение, и инфекционное заболевание.[16] Сообщается, что инфекция возникает менее чем в 1% случаев и излечима с помощью антибиотиков. В целом, пациенты с уже существовавшим заболеванием подвергаются более высокому риску заражения, чем те, кто в целом здоров.[19]
Риски для трансплантатов из гребня подвздошной кости
Некоторые из потенциальных рисков и осложнений костных трансплантатов с использованием гребень подвздошной кости в качестве донорского сайта включают:[19][20][21]
- приобретенный грыжа кишечника (это становится риском для более крупных донорских участков (> 4 см)).[19] С 1945 по 1989 год в литературе было зарегистрировано около 20 случаев.[22] и во всем мире зарегистрировано всего несколько сотен случаев[23]
- парестетическая мералгия (травма боковой кожный нерв бедра также называется синдромом Бернхардта-Рота)
- нестабильность таза
- перелом (крайне редко и обычно с другими факторами[24][25])
- повреждение ягодичные нервы (это вызовет боль в задней части таза, которая усиливается при сидении)
- повреждение подвздошно-паховый нерв
- инфекционное заболевание
- незначительный гематома (частое явление)
- глубокий гематома требующие хирургического вмешательства
- серома
- мочеточниковый травма, повреждение
- псевдоаневризма подвздошной артерии (редко)[26]
- трансплантация опухоли
- косметические дефекты (в основном вызванные несохранением верхнего края таза)
- хроническая боль
Костные трансплантаты, взятые из заднего гребня подвздошной кости, в целом менее болезненны, но в зависимости от типа операции может потребоваться переворот, когда пациент находится под общей анестезией.[27][28]
Расходы
Процедуры костного трансплантата - это не только сама операция. Полная трехмесячная общая стоимость сложного костного трансплантата для костного сращения заднебокового отдела поясничного отдела позвоночника, дополненного расширителями, составляет в среднем от 33 860 до 37 227 долларов США.[29] Эта цена включает все посещения и выезд из больницы в течение 3 месяцев. Помимо стоимости самого костного трансплантата (от 250 до 900 долларов США), другие расходы на процедуру включают: стоимость амбулаторной реабилитации (от 5000 до 7000 долларов США), винты и стержни (7500 долларов США), проживание и питание (5000 долларов США). , операционная (3500 долларов США), стерильные принадлежности (1100 долларов США), физиотерапия (1000 долларов США), гонорары хирурга (в среднем 3500 долларов США), анестезиолог сборы (примерно от 350 до 400 долларов США в час), расходы на лекарства (1000 долларов США) и дополнительные сборы за такие услуги, как медицинские принадлежности, диагностические процедуры, плата за использование оборудования и т. д.[30]
Смотрите также
Рекомендации
- ^ а б c d е Клоккевольд П.Р., Йованович С.А. (2002). «Продвинутая хирургия имплантатов и методы костной пластики». В Newman MG, Takei HM, Carranza FA (ред.). Клиническая пародонтология Каррансы (9-е изд.). W.B. Сондерс. С. 907–8. ISBN 9780721683317.
- ^ Boyan BD, Weesner TC, Lohmann CH, Andreacchio D, Carnes DL, Dean DD и др. (Август 2000 г.). «Производное матрикса эмали плода свиньи усиливает образование кости, индуцированное деминерализованным сублимированным костным аллотрансплантатом in vivo». Журнал пародонтологии. 71 (8): 1278–86. Дои:10.1902 / jop.2000.71.8.1278. PMID 10972643.
- ^ «Костная пластика - определение, цель, демография, описание, диагноз / подготовка, последующий уход, риски, нормальные результаты, заболеваемость и смертность, альтернативы». В архиве из оригинала от 17.10.2008.
- ^ а б "Костные трансплантаты: больше не просто обломок старого бедра". В архиве из оригинала от 01.11.2008.
- ^ «Альтернативы костному трансплантату» (PDF). Архивировано из оригинал (PDF) 23 марта 2009 г.. Получено 18 января 2009.
- ^ Ким Ю.К., Ким С.Г., О Дж.С., Джин С.К., Сон Дж.С., Ким С.И., Лим С.И. (август 2011 г.). «Анализ неорганической составляющей аутогенного материала костного трансплантата зуба». Журнал нанонауки и нанотехнологий. 11 (8): 7442–5. Дои:10.1166 / jnn.2011.4857. PMID 22103215. S2CID 27290806.
- ^ «Костные аллотрансплантаты - Часто задаваемые вопросы - Инфекционный контроль в стоматологических учреждениях - Отделение гигиены полости рта - CDC». www.cdc.gov. В архиве с оригинала на 31 декабря 2017 г.. Получено 6 мая 2018.
- ^ Думитреску 2011, п. 94–95
- ^ Думитреску 2011, п. 101–2
- ^ Хенч, Ларри Л. (1991). «Биокерамика: от идеи до клиники» (PDF). Журнал Американского керамического общества. 74 (7): 1487–1510. CiteSeerX 10.1.1.204.2305. Дои:10.1111 / j.1151-2916.1991.tb07132.x. В архиве (PDF) из оригинала от 16.11.2010.
- ^ Чжу Х, Го Д., Сунь Л., Ли Х, Ханаор Д.А., Шмидт Ф., Сюй К. (2018). «Наноструктурное понимание поведения растворения гидроксиапатита, легированного Sr». Журнал Европейского керамического общества. 38 (16): 5554–5562. arXiv:1910.10610. Дои:10.1016 / j.jeurceramsoc.2018.07.056.
- ^ а б Wong TM, Lau TW, Li X, Fang C, Yeung K, Leung F (2014). «Масклет для лечения посттравматических дефектов костей». Журнал ScienceWorld. 2014: 710302. Дои:10.1155/2014/710302. ЧВК 3933034. PMID 24688420.
- ^ Шандор Г.К. (6 мая 2018 г.). «Сведение к минимуму заболеваемости при черепно-челюстно-лицевой костной реконструкции: сбор костного трансплантата и гранулы кораллового происхождения в качестве заменителя костного трансплантата». oulu.fi. В архиве из оригинала 18 января 2012 г.. Получено 6 мая 2018.
- ^ Дженсен СС, Терхейден Х (2009). «Операции по увеличению костной ткани при локализованных дефектах альвеолярного отростка: клинические результаты с использованием различных костных трансплантатов и материалов, заменяющих костную ткань». База данных рефератов обзоров эффектов (DARE): обзоры с оценкой качества [Интернет]. Центр обзоров и распространения (Великобритания). NBK77628.
- ^ Думитреску А.Л. (2011). «Костные трансплантаты и заменители костных трансплантатов в пародонтологической терапии §2.3.3 коралловый карбонат кальция». Химические вещества в хирургической пародонтологической терапии. Springer. п. 92. ISBN 978-3-642-18224-2.
- ^ а б c d «Костный трансплантат - хирургические процедуры и риски - информация о здоровье в NY Times». Нью-Йорк Таймс. В архиве из оригинала от 25 января 2009 г.
- ^ Le BT, Borzabadi-Farahani A (июль 2014 г.). «Одновременная установка имплантата и костная пластика с использованием минерализованного аллотрансплантата в местах с дефектами щечной стенки, трехлетнее наблюдение и обзор литературы». Журнал черепно-челюстно-лицевой хирургии. 42 (5): 552–9. Дои:10.1016 / j.jcms.2013.07.026. PMID 24529349.
- ^ D'Souza M, Macdonald NA, Gendreau JL, Duddleston PJ, Feng AY, Ho AL (сентябрь 2019 г.). «Трансплантат и биопрепараты для спондилодеза». Биомедицины. 7 (4): 75. Дои:10.3390 / biomedicines7040075. ЧВК 6966429. PMID 31561556.
- ^ а б c Зайлер Дж. Г., Джонсон Дж. (2000). «Аутогенная костная пластика гребня подвздошной кости: осложнения со стороны донора». Журнал Южной ортопедической ассоциации. 9 (2): 91–7. PMID 10901646. Архивировано из оригинал на 2012-12-25.
- ^ Банварт Дж. К., Ашер М. А., Хассанейн Р. С. (май 1995 г.). "Заболеваемость донорского участка взятия трансплантата гребня подвздошной кости. Статистическая оценка". Позвоночник. 20 (9): 1055–60. Дои:10.1097/00007632-199505000-00012. PMID 7631235.
- ^ Аррингтон Э.Д., Смит В.Дж., Чемберс Г.Г., Бакнелл А.Л., Давино Н.А. (август 1996 г.). «Осложнения при заборе костного трансплантата гребня подвздошной кости». Клиническая ортопедия и смежные исследования. 329 (329): 300–9. Дои:10.1097/00003086-199608000-00037. PMID 8769465.
- ^ Хамад М.М., Маджид С.А. (ноябрь 1989 г.). «Послеоперационная грыжа через дефекты гребня подвздошной кости. Отчет о трех случаях с обзором литературы». Архив ортопедической и травматологической хирургии. 108 (6): 383–5. Дои:10.1007 / BF00932452. PMID 2695010.
- ^ Анисуддин Бхатти; Вакар Ахмед. (Июнь 1999 г.). «Грыжа через донорский сайт костного трансплантата гребня ILiac». J Surg Pak. 4 (2): 37–9.
- ^ «Перелом таза: осложнение трансплантации гребня подвздошной кости». Архивировано из оригинал на 2009-01-05. Получено 2008-12-29.
- ^ Окли MJ, Смит WR, Морган SJ, Зиран Н.М., Зиран Б.Х. (декабрь 2007 г.). «Повторяющееся извлечение аутотрансплантата из заднего гребня подвздошной кости, приводящее к нестабильному перелому костей таза и инфицированному несращению: отчет о болезни и обзор литературы». Безопасность пациентов в хирургии. 1 (1): 6. Дои:10.1186/1754-9493-1-6. ЧВК 241775. PMID 18271999.
- ^ Энди Шау-Бин Чоу, доктор медицины; Чейн-Фу Хунг, доктор медицины; Jeng-Hwei Tseng, MD; Куанг-Цзе Пан, доктор медицины; Пао-Шэн Йен, доктор медицины (июль 2002 г.). "Псевдоаневризма глубокой околопаточной подвздошной артерии: редкое осложнение на донорском участке переднего подвздошного костного трансплантата, леченном спиральной эмболизацией" (PDF). Чанг Гунг Мед Дж.. 25 (7).
- ^ Маркс Р. Э., Моралес М. Дж. (Март 1988 г.). «Заболеваемость от взятия кости при большой реконструкции челюсти: рандомизированное исследование, сравнивающее латеральный передний и задний доступы к подвздошной кости». Журнал челюстно-лицевой хирургии. 46 (3): 196–203. Дои:10.1016/0278-2391(88)90083-3. PMID 3280759.
- ^ Альманн Э., Патзакис М., Роидис Н., Шеперд Л., Холтом П. (май 2002 г.). «Сравнение передних и задних костных трансплантатов гребня подвздошной кости с точки зрения заболеваемости и функциональных результатов». Журнал костной и суставной хирургии. Американский объем. 84 (5): 716–20. Дои:10.2106/00004623-200205000-00003. PMID 12004011.
- ^ Глассман С.Д., Карреон Л.Я., Кэмпбелл М.Дж., Джонсон-младший, Пуно Р.М., Джурасович М., Димар-младший (2008). «Периоперационная стоимость инфузии костного трансплантата при заднебоковом спондилодезе поясничного отдела позвоночника». Журнал Spine. 8 (3): 443–8. Дои:10.1016 / j.spinee.2007.03.004. PMID 17526436.
- ^ Этессам А. «Костная пластика». Центр стоматологического искусства Неаполя. Получено 11 октября 2019.
дальнейшее чтение
- Десаи А.Дж., Томас Р., Кумар А.Т., Мехта Д.С. (2013). «Современные концепции и рекомендации по сбору трансплантата из подбородка: обзор литературы». Международный журнал наук о здоровье полости рта. 3 (1): 16–25. Дои:10.4103/2231-6027.122094.
