Хлорофиллид - Chlorophyllide
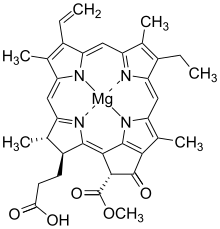 Хлорофиллид а | |
| Имена | |
|---|---|
| Название ИЮПАК Магний (3S,4S,21р) -3- (2-карбоксиэтил) -14-этил-21- (метоксикарбонил) -4,8,13,18-тетраметил-20-оксо-9-винил-23,25-дидегидрофорбин-23,25-диид | |
| Идентификаторы | |
| |
| |
3D модель (JSmol ) | |
| ЧЭБИ |
|
| ChemSpider | |
PubChem CID | |
| |
| |
| Свойства | |
| C35ЧАС34MgN4О5 | |
| Молярная масса | 614,973 г / моль |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хлорофиллид а и Хлорофиллид б являются биосинтетический предшественники хлорофилл а и хлорофилл б соответственно. Их пропионовая кислота группы преобразуются в фитил сложные эфиры ферментом хлорофиллсинтаза на последнем этапе пути. Таким образом, основной интерес к этим химические соединения был в изучении хлорофилл биосинтез в растения, водоросли и цианобактерии. Хлорофиллид а также является промежуточным звеном в биосинтезе бактериохлорофиллы.[1][2]
Структуры

Хлорофиллид а, это карбоновая кислота (R = H). В хлорофиллиде б, то метильная группа в позиции 13 (Нумерация ИЮПАК для хлорофиллида а) и выделенный в зеленом поле, заменяется на формил группа.
Биосинтез ведет к образованию протопорфирина IX
На ранних этапах биосинтеза, который начинается с глютаминовая кислота, а тетрапиррол создается ферментами дезаминаза и косинтетаза которые преобразуют аминолевулиновая кислота через порфобилиноген и гидроксиметилбилан к уропорфириноген III. Последний является первым макроциклический промежуточный общий для гем, сирохем, кофактор F430, кобаламин и сам хлорофилл.[3] Следующие промежуточные звенья копропорфириноген III и протопорфириноген IX, который окисленный в полной мере ароматный протопорфирин IX. Вставка утюг в протопорфирин IX, например, у млекопитающих дает гем, кофактор, переносящий кислород в крови, но растения сочетают магний вместо этого отдать после дальнейших преобразований хлорофилл для фотосинтеза.[4]
Биосинтез хлорофиллидов из протопорфирина IX
Детали поздних этапов пути биосинтеза хлорофилла у растений различаются (например, Arabidopsis thaliana, Nicotiana tabacum и Triticum aestivum ) и бактерии (например, Рубрививакс желатиноз и Synechocystis ), в котором он был изучен. Однако, хотя гены и ферменты варьируются, химические реакции идентичны.[1][5]
Вставка магния

Хлорофилл имеет магний ион согласованный в пределах лиганд называется хлорин. Металл вставляется в протопорфирин IX посредством фермент хелатаза магния[1] который катализирует реакцию EC 6.6.1.1
Этерификация пропионатной группы кольца C
Следующим шагом к хлорофиллидам является образование метилового (CH3) сложный эфир на одной из пропионатных групп, катализируемый ферментом Протопорфирин IX метилтрансфераза магния[6] в метилирование реакция EC 2.1.1.11
- Mg-протопорфирин IX + S-аденозилметионин Mg-протопорфирин IX 13-метиловый эфир + S-аденозил-L-гомоцистеин
От порфирина до хлорина

Кольцевая система хлорина имеет пятичленное углеродное кольцо E, которое создается, когда одна из пропионатных групп порфирина циклизованный к атому углерода, связывающему исходный пиррол кольца C и D. Серия химических стадий, катализируемых ферментом Магний-протопорфирин IX монометиловый эфир (окислительная) циклаза[7] дает общую реакцию EC 1.14.13.81
- Mg-протопорфирин IX 13-монометиловый эфир + 3 НАДФН + 3 H+ + 3 O2 дивинилпротохлорофиллид + 3 НАДФ+ + 5 часов2О
В ячмень электроны обеспечиваются уменьшенным ферредоксин, который может получить их из фотосистема I или в темноте из Ферредоксин — НАДФ (+) редуктаза: белок циклазы называется XanL и кодируется Ксанта-1 ген.[8] В анаэробные организмы такие как Rhodobacter sphaeroides происходит такое же общее преобразование, но кислород, включенный в 13-монометиловый эфир протопорфирина IX, происходит из воды в реакции EC 1.21.98.3.[9]
Этапы восстановления до хлорофиллида а
Для получения хлорофиллида необходимы еще два превращения. а. Оба сокращение реакции: один превращает виниловая группа чтобы этильная группа а второй добавляет два атома водорода к пиррольному кольцу D, хотя общая ароматичность макроцикла сохраняется. Эти реакции протекают независимо, а у некоторых организмов последовательность обратная.[1]Фермент дивинилхлорофиллид 8-винил-редуктаза[10] превращает 3,8-дивинилпротохлорофиллид в протохлорофиллид в ответ EC 1.3.1.75
- 3,8-дивинилпротохлорофиллид + НАДФН + Н+ протохлорофиллид + НАДФ+

Далее следует реакция EC 1.3.1.33 в котором пиррольное кольцо D восстанавливается ферментом протохлорофиллид редуктаза[11]
- протохлорофиллид + НАДФН + Н+ хлорофиллид а + НАДФ+
Эта реакция зависит от света, но есть альтернативный фермент, Ферредоксин: протохлорофиллидредуктаза (АТФ-зависимая),[12] который использует сокращенные ферредоксин как его кофактор и не зависит от света; он выполняет аналогичную реакцию EC 1.3.7.7 но с альтернативой субстрат 3,8-дивинилпротохлорофиллид
- 3,8-дивинилпротохлорофиллид + восстановленный ферредоксин + 2 АТФ + 2 H2О 3,8-дивинилхлорофиллид а + окисленный ферредоксин + 2 АДФ + 2 фосфата
В организмах, которые используют эту альтернативную последовательность стадий восстановления, процесс завершается реакцией EC 1.3.7.13 катализируется ферментом, который может принимать различные субстраты и выполнять необходимое восстановление винильных групп, например, в этом случае
- 3,8-дивинилхлорофиллид а + 2 восстановленный ферредоксин + 2 H+ хлорофиллид а + 2 окисленных ферредоксина
Из хлорофиллида а к хлорофиллиду б
Хлорофиллид а оксигеназа это фермент, который превращает хлорофиллид а к хлорофиллиду б[13] катализируя общую реакцию EC 1.3.7.13
- хлорофиллид а + 2 O2 + 2 НАДФН + 2 Н+ хлорофиллид б + 3 часа2O + 2 НАДФ+
Использование в биосинтезе хлорофилла а и хлорофилл б
Хлорофилл-синтаза[14] завершает биосинтез хлорофилла а, катализируя реакцию EC 2.5.1.62
- хлорофиллид а + фитилдифосфат хлорофилл а + дифосфат
Это образует сложный эфир группы карбоновой кислоты в хлорофиллиде. а с 20 углеродом дитерпен алкоголь фитол.Хлорофилл б производится тем же ферментом, который действует на хлорофиллид б.
Использование в биосинтезе бактериохлорофиллов

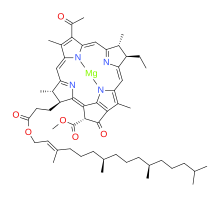
Бактериохлорофиллы - это светособирающие пигменты, обнаруженные в фотосинтезирующих бактериях: они не производят кислород в качестве побочного продукта. Таких структур много, но все они биосинтетически связаны, поскольку происходят из хлорофиллида. а.[1][15] Бактериохлорофилл а это типичный пример; его биосинтез изучен в Rhodobacter capsulatus и Rhodobacter sphaeroides.
Первый шаг - сокращение (с транс стереохимия ) пиррольного кольца B, давая характерную 18-электронную ароматическую систему многих бактериохлорофиллов. Это осуществляется ферментом хлорофиллид редуктаза, который катализирует реакцию EC 1.3.7.15.
- хлорофиллид а + 2 восстановленный ферредоксин + АТФ + H2O + 2 H+ 3-деацетил-3-винилбактериохлорофиллид а + 2 окисленных ферредоксина + АДФ + фосфат
Следующие два шага превращают винильную группу сначала в 1-гидроксиэтильную группу, а затем в ацетильную группу бактериохлорофиллида. а. Реакции катализируются хлорофиллид а 31-гидратаза (EC 4.2.1.165 ) и бактериохлорофиллид дегидрогеназа (EC 1.1.1.396 ) следующим образом:[2][16]
- 3-деацетил-3-винилбактериохлорофиллид а + H2О 3-деацетил 3- (1-гидроксиэтил) бактериохлорофиллид а
- 3-деацетил 3- (1-гидроксиэтил) бактериохлорофиллид а + НАД+ бактериохлорофиллид а + НАДН + Н+
Эти три реакции, катализируемые ферментами, могут происходить в разной последовательности с образованием бактериохлорофиллида. а готов для этерификация к финальным пигментам для фотосинтеза. Фитиловый эфир бактериохлорофилла а не присоединяется напрямую: скорее, исходным промежуточным продуктом является сложный эфир с R = геранилгеранил (от геранилгеранилпирофосфат ), который затем подлежит дополнительным шагам, поскольку три боковых цепочки алкен облигации уменьшаются.[16]
использованная литература
- ^ а б c d е Уиллоуз, Роберт Д. (2003). «Биосинтез хлорофиллов из протопорфирина IX». Отчеты о натуральных продуктах. 20 (6): 327–341. Дои:10.1039 / B110549N. PMID 12828371.
- ^ а б Болливар, Дэвид В. (2007). «Последние достижения в биосинтезе хлорофилла». Фотосинтез Исследования. 90 (2): 173–194. Дои:10.1007 / s11120-006-9076-6. PMID 17370354. S2CID 23808539.
- ^ Баттерсби А.Р., Фукс С.Дж., Мэтчем Г.В., Макдональд Э. (май 1980 г.). «Биосинтез пигментов жизни: формирование макроцикла». Природа. 285 (5759): 17–21. Bibcode:1980Натура 285 ... 17Б. Дои:10.1038 / 285017a0. PMID 6769048. S2CID 9070849.
- ^ Баттерсби, А. Р. (2000). «Тетрапирролы: пигменты жизни. Обзор тысячелетия». Отчеты о натуральных продуктах. 17 (6): 507–526. Дои:10.1039 / B002635M. PMID 11152419.
- ^ Р. Каспи (18 июля 2007 г.). «3,8-дивинил-хлорофиллид а, биосинтез I (аэробный, светозависимый)». База данных метаболических путей MetaCyc. Получено 2020-06-04.
- ^ Пастырь, Марк; Рид, Джеймс Д .; Хантер, К. Нил (2003). «Очистка и кинетическая характеристика метилтрансферазы протопорфирина IX магния из Synechocystis PCC6803». Биохимический журнал. 371 (2): 351–360. Дои:10.1042 / BJ20021394. ЧВК 1223276. PMID 12489983.
- ^ Болливар Д.В., Бил С.И. (сентябрь 1996 г.). "Биосинтетический фермент хлорофилла Mg-протопорфирин IX монометиловый эфир (окислительная) циклаза (характеристика и частичная очистка от Chlamydomonas reinhardtii и Synechocystis sp. PCC 6803)". Физиология растений. 112 (1): 105–114. Дои:10.1104 / стр.112.1.105. ЧВК 157929. PMID 12226378.
- ^ Стюарт, Дэвид; Сандстрём, Малин; Юсеф, Хельми М .; Захрабекова, Шахира; Дженсен, Пол Эрик; Болливар, Дэвид У .; Ханссон, Матс (08.09.2020). "Аэробная циклаза монометилового эфира Mg-протопорфирина IX ячменя питается от ферредоксина электронами". Растения. 9 (9): 1157. Дои:10.3390 / растения9091157.
- ^ Порра, Роберт Дж .; Шафер, Вольфрам; Гад'Он, Наср; Катедер, Ингрид; Дрюс, Герхарт; Шеер, Хьюго (1996). «Происхождение двух карбонильных атомов кислорода бактериохлорофилла а. Демонстрация двух различных путей образования кольца е в Rhodobacter sphaeroides и Roseobacter denitrificans, а также общий механизм гидратазы для образования 3-ацетильной группы». Европейский журнал биохимии. 239 (1): 85–92. Дои:10.1111 / j.1432-1033.1996.0085u.x. PMID 8706723.
- ^ Пархам, Рамин; Ребеиз, Константин А. (1992). «Биогенез хлоропластов: [4-винил] хлорофиллид-редуктаза представляет собой NADPH-зависимый фермент, специфичный для дивинилхлорофиллида а». Биохимия. 31 (36): 8460–8464. Дои:10.1021 / bi00151a011. PMID 1390630.
- ^ Апель, Клаус; Сантель, Ханс-Иоахим; Редлингер, Том Э .; Фальк, Хайнц (2005). «Протохлорофиллидный голохром ячменя (Hordeum vulgare L.)». Европейский журнал биохимии. 111 (1): 251–258. Дои:10.1111 / j.1432-1033.1980.tb06100.x. PMID 7439188.
- ^ Мураки Н., Номата Дж., Эбата К., Мидзогути Т., Шиба Т., Тамиаки Х., Курису Дж., Фудзита Ю. (май 2010 г.). «Рентгеновская кристаллическая структура светонезависимой протохлорофиллидредуктазы». Природа. 465 (7294): 110–4. Bibcode:2010Натура.465..110M. Дои:10.1038 / природа08950. PMID 20400946. S2CID 4427639.
- ^ Eggink, Laura L .; Лобрутто, Рассел; Brune, Daniel C .; Брусслан, Джуди; Ямасато, Акихиро; Танака, Аюми; Хубер, Дж. Кеннет (2004). «Синтез хлорофилла b: локализация хлорофиллид оксигеназы и открытие стабильного радикала в каталитической субъединице». BMC Биология растений. 4: 5. Дои:10.1186/1471-2229-4-5. ЧВК 406501. PMID 15086960.
- ^ Schmid, H.C .; Рассадина, В .; Oster, U .; Schoch, S .; Рюдигер, В. (2002). «Предварительная загрузка хлорофилл-синтазы тетрапренилдифосфатом является обязательным этапом биосинтеза хлорофилла» (PDF). Биологическая химия. 383 (11): 1769–78. Дои:10.1515 / BC.2002.198. PMID 12530542. S2CID 3099209.
- ^ Сенге, Матиас О .; Смит, Кевин М. (2004). «Биосинтез и структуры бактериохлорофиллов». Аноксигенные фотосинтетические бактерии. Достижения в фотосинтезе и дыхании. 2. С. 137–151. Дои:10.1007/0-306-47954-0_8. ISBN 0-7923-3681-X.
- ^ а б Р. Каспи (2015-12-08). «Путь: биосинтез бактериохлорофилла А». База данных метаболических путей MetaCyc. Получено 2020-06-04.



