Гликан-белковые взаимодействия - Glycan-protein interactions - Wikipedia

Гликан-белковые взаимодействия представляют собой класс биомолекулярных взаимодействий, которые происходят между свободными или связанными с белками гликаны и их родственные связывающие партнеры. Внутримолекулярные взаимодействия гликан-белок (белок-гликан) происходят между гликанами и белками, к которым они ковалентно присоединены. Вместе с белок-белковые взаимодействия, они составляют механистическую основу для многих важных клетка процессы, особенно для межклеточные взаимодействия и взаимодействия клетки-хозяина.[2] Например, SARS-CoV-2, возбудитель COVID-19, широко использует гликозилированный белок спайк (S) для связывания с ACE2 рецептор, позволяющий ему проникать в клетки-хозяева.[3] Белок-шип - это тример структура, с каждым подразделение содержащий 22 сайта N-гликозилирования, что делает его привлекательной мишенью для вакцина поиск.[3][4]
Гликаны, общее название для моносахариды и олигосахариды, представляют собой один из основных посттрансляционная модификация из белки вносят свой вклад в огромную биологическую сложность жизни. Действительно, три разных гексозы теоретически может производить от 1056 до 27 648 уникальных трисахаридов, в отличие от всего 6 пептиды или же олигонуклеотиды сформирован из 3 аминокислоты или 3 нуклеотиды соответственно.[2] В отличие от шаблонный биосинтез белка, «язык» гликозилирования до сих пор неизвестен, поэтому гликобиология горячая тема текущих исследований, учитывая их распространенность в живых организмах.[2]
Изучение взаимодействий гликанов и белков дает представление о механизмах передачи сигналов в клетках и позволяет создавать более эффективные инструменты диагностики многих заболеваний, в том числе рак. Действительно, не существует известных типов рака, которые не связаны с беспорядочными белками. гликозилирование.[5]
Термодинамика связывания
Связывание гликановых белков (GBP) с гликанами можно смоделировать с помощью простых равновесие. Обозначая гликаны как и белки как :
С ассоциированным константа равновесия из
Которая переставлена, чтобы дать константа диссоциации следующие биохимические условности:
Учитывая, что многие фунты стерлингов демонстрируют многовалентность, эту модель можно расширить для учета нескольких равновесий:
Обозначая кумулятивное равновесие связывания с лиганды как
С соответствующей константой равновесия:
И писать материальный баланс для белка ( обозначает общую концентрация белка):
Выражая условия через константу равновесия, находим окончательный результат:
Таким образом, концентрация свободного белка составляет:
Если , т.е. существует только один домен углеводного рецептора, уравнение сводится к
С увеличением снижается концентрация свободного белка; следовательно, очевидное тоже уменьшается.
Связывание ароматическими кольцами

Химическая интуиция подсказывает, что сайты связывания гликанов могут быть обогащены полярные аминокислотные остатки эта форма нековалентные взаимодействия, Такие как водородные связи, с полярный углеводы. Действительно, статистический анализ карманов связывания углеводов показывает, что аспарагиновая кислота и аспарагин остатки присутствуют в два раза чаще, чем можно было бы спрогнозировать.[6] Удивительно, но предпочтение отдается ароматические аминокислоты: триптофан имеет 9-кратное увеличение распространенности, тирозин 3-кратный, и гистидин увеличение в 2 раза. Было показано, что основная сила - это взаимодействие ароматических система и в углеводах, как показано на Рисунок 1. В взаимодействие определяется, если °, расстояние (расстояние от к ) меньше 4,5 Å.[6]
Эффекты стереохимии

Этот взаимодействие сильно зависит от стереохимия из углевод молекула. Например, рассмотрим верхний () и дно () лица -D-глюкоза и -D-галактоза. Было показано, что однократное изменение стереохимии у углерода С4 сдвигает предпочтение ароматических остатков от стороне (2,7-кратное предпочтение глюкозы) в сторону сторона (14-кратное предпочтение галактозы).[6]
Эффекты электроники
Сравнение электростатической поверхности потенциалы (ESP) из ароматный звенит в триптофан, тирозин, фенилаланин, и гистидин предполагает, что электронные эффекты также играют роль в связывании с гликанами (см. фигура 2). После нормализации электронной плотности на площадь поверхности триптофан по-прежнему остается наиболее богатым электронами акцептором взаимодействия, предполагая возможную причину его 9-кратного преобладания в карманах связывания углеводов.[6] В целом, карты электростатического потенциала соответствуют тенденции преобладания .

Партнеры, связывающие углеводы
Есть много белков, способных связываться с гликанами, в том числе лектины, антитела, микробный адгезины, популярный агглютинины, так далее.
Лектины
Лектины - это общее название белков с углеводно-узнающими доменами (CRD). Хотя он стал почти синонимом гликановых белков, он не включает антитела которые также принадлежат к классу.
Лектины найдены в растения и грибы клетки широко использовались в исследованиях как инструмент для обнаружения, очистки и анализа гликанов. Однако полезные лектины обычно не оптимальны. особенности. Например, Ulex europaeus агглютинин-1 (UEA-1), лектин растительного происхождения, способный связываться с человеческим группа крови O антиген, может также связываться с неродственными гликанами, такими как 2'-фукозиллактоза, GalNAcα1-4 (Fucα1-2) Galβ1-4GlcNAc и Льюис-И антиген.[7]
Антитела
Несмотря на то что антитела проявляют наномолярное сродство к белковым антигенам, специфичность против гликанов очень ограничена.[8] Фактически, доступные антитела могут связывать только <4% из 7000 гликановых антигенов млекопитающих; более того, большинство этих антител имеют низкую аффинность и перекрестную реактивность.[9][7]
Ламбоди
По сравнению с челюсть позвоночные чей иммунитет основан на вариабельных, разнообразных и соединяющихся генных сегментах (VDJ) иммуноглобулины, без челюсти беспозвоночные, Такие как минога и миксина, создать разнообразие рецепторов соматическими ДНК перестановка лейцин модули -rich repeat (LRR), которые включены в * vlr * гены (вариабельные рецепторы лейкоцитов).[10] Эти LRR образуют трехмерные структуры, напоминающие изогнутые соленоиды которые избирательно связывают определенные гликаны.[11]
Исследование, проведенное в Университете Мэриленда, показало, что антитела миноги (лямбоди) могут избирательно связываться с опухоль -ассоциированные углеводные антигены (такие как Tn и TF) при наномолярном сродстве.[9] Антиген T-nouvelle (Tn) и TF присутствуют в белках в 90% различных рак клетки после посттрансляционная модификация, тогда как в здоровых клетках эти антигены намного сложнее. Подборка ламбоди, которые могут связываться с aGPA, человек эритроцит мембрана гликопротеин покрытый 16 TF части, через магнитно-активированная сортировка клеток (MACS) и сортировка клеток с активацией флуоресценции (FACS) дал богатый лейцином ламбоди VLRB.aGPA.23. Этот лямбоди избирательно окрашивал (по сравнению со здоровыми образцами) клетки 14 различных типов аденокарциномы: мочевой пузырь, пищевод, яичник, язык, щека, шейка матки, печень, нос, носоглотка, большой сальник, двоеточие, грудь, гортань, и легкое.[9] Кроме того, пациенты, чьи ткани были окрашены положительно VLRB.aGPA.23 имел значительно меньшую выживаемость.[9]
Внимательный взгляд на кристаллическую структуру VLRB.aGPA.23 обнаруживает остаток триптофана в положении 187 прямо над карманом связывания углеводов.[12]

Многовалентность в структуре
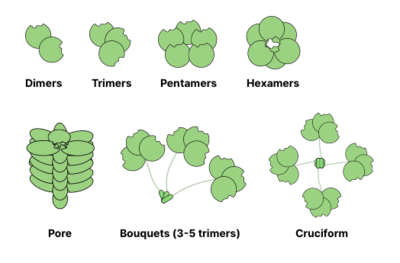
Многие гликановые связывающие белки (GBP) являются олигомерный и обычно содержат несколько места для связывания гликанов (также называемых доменами распознавания углеводов). Способность образовывать поливалентный белоклиганд взаимодействия значительно усиливают силу связывания: в то время как значения для индивидуальных взаимодействий CRD-гликанов могут находиться в мМ диапазоне, общее сродство GBP к гликанам может достигать наномолярный или даже пикомолярный диапазоны. Общая сила взаимодействия описывается как жадность (в отличие от близость которое описывает одиночное равновесие). Иногда жадность также называется очевидный чтобы подчеркнуть неравновесный характер взаимодействия.[13]
Общие структуры олигомеризации лектины показаны ниже. Например, галектины обычно наблюдаются в виде димеров, а интелектины образуют тримеры и пентраксины собрать в пентамеры. Более крупные структуры, например гексамерные Рег белки, может собираться в поры, пронизывающие мембрану. Коллектины могут образовывать еще более причудливые комплексы: букеты тримеров или даже крестообразные структуры (например, в СП-Д ).[14]
Текущее исследование
Учитывая важность взаимодействий гликанов и белков, в настоящее время ведутся исследования, посвященные а) созданию новых инструментов для обнаружения взаимодействий гликанов и белков и б) использованию этих инструментов для расшифровки так называемого сахарного кода.
Гликановые массивы
Одним из наиболее широко используемых инструментов для исследования взаимодействий гликанов с белками является гликановые массивы. Гликановый массив обычно представляет собой NHS- или же эпоксидная смола -активированные стеклянные слайды, на которых гликаны были напечатаны с использованием роботизированной печати.[15][16] Эти коммерчески доступные наборы могут содержать до 600 различных гликанов, специфичность которых тщательно изучена.[17]
Взаимодействия гликанов и белков могут быть обнаружены путем тестирования представляющих интерес белков (или библиотеки из тех) которые несут флуоресцентные метки. Структура гликанового белка может быть расшифрована несколькими аналитическими методами, основанными на масс-спектрометрии, включая МАЛДИ-МС, ЖХ-МС, тандем MS-MS, и / или 2D ЯМР.[18]
Исследования, основанные на биоинформатике
Вычислительные методы применялись для поиска параметров (например, предрасположенности к остаткам, гидрофобности, планарности), которые могли бы отличить гликановые связывающие белки от других участков поверхности. Например, модель, обученная на 19 негомологичных структурах связывания углеводов, смогла предсказать домены связывания углеводов (CRD) с точностью 65% для неферментативных структур и 87% для ферментативных.[19] В дальнейших исследованиях использовались расчеты Энергии Ван-дер-Ваальса взаимодействий белок-зонд и предрасположенности аминокислот к выявлению CRD с 98% специфичность на 73% чувствительность.[20] Более современные методы могут прогнозировать CRD даже из белковые последовательности, сравнивая последовательность с теми, для которых уже известны структуры.[21]
Сахарный код
В отличие от исследований белков, где первичная структура белка однозначно определяется последовательностью нуклеотиды (в генетический код ), гликобиология до сих пор не может объяснить, как определенное «сообщение» закодировано с использованием углеводов или как оно «читается» и «переводится» другими биологическими объектами.
Междисциплинарные усилия, сочетающие химию, биологию и биохимию, изучают взаимодействия гликанов и белков, чтобы увидеть, как разные последовательности углеводов вызывают разные клеточные реакции.[22]
Смотрите также
Рекомендации
- ^ Walls, Alexandra C .; Пак, Юнг-Джун; Торторичи, М. Алехандра; Стена, Эбигейл; Макгуайр, Эндрю Т .; Вислер, Дэвид (2020-03-09). «Структура, функция и антигенность гликопротеина шипа SARS-CoV-2». Клетка. 181 (2): 281–292.e6. Дои:10.1016 / j.cell.2020.02.058. ISSN 0092-8674. ЧВК 7102599. PMID 32155444.
- ^ а б c Варки А, Корнфельд С (2015). «Историческая справка и обзор». В Варки А., Каммингс Р.Д., Эско Д.Д., Стэнли П., Харт Г.В., Эби М. и др. (ред.). Основы гликобиологии (3-е изд.). Лабораторный пресс Колд-Спринг-Харбор. Дои:10.1101 / гликобиология.3e.001 (неактивно 01.09.2020). PMID 28876854. Получено 2020-05-09.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (связь)
- ^ а б Ватанабэ, Ясунори; Аллен, Джоэл Д.; Рэпп, Дэниел; Маклеллан, Джейсон С .; Криспин, Макс (2020-05-04). «Сайт-специфический гликановый анализ спайка SARS-CoV-2». Наука. 369 (6501): 330–333. Дои:10.1126 / science.abb9983. ISSN 0036-8075. ЧВК 7199903. PMID 32366695.
- ^ Аманат, Фатима; Краммер, Флориан (2020-04-06). «Вакцины против SARS-CoV-2: отчет о состоянии дел». Иммунитет. 52 (4): 583–589. Дои:10.1016 / j.immuni.2020.03.007. ISSN 1074-7613. ЧВК 7136867. PMID 32259480.
- ^ Альмогрен А., Абдулла Дж., Гапуре К., Фергюсон К., Глинский В.В., Риттенхаус-Олсон К. (январь 2012 г.). «Анти-Thomsen-Friedenreich-Ag (анти-TF-Ag) потенциал для лечения рака». Границы биологических наук. 4 (3): 840–63. Дои:10,2741 / с304. PMID 22202095.
- ^ а б c d Hudson KL, Bartlett GJ, Diehl RC, Agirre J, Gallagher T., Kiessling LL, Woolfson DN (декабрь 2015 г.). «Углеводно-ароматические взаимодействия в белках». Журнал Американского химического общества. 137 (48): 15152–60. Дои:10.1021 / jacs.5b08424. ЧВК 4676033. PMID 26561965.
- ^ а б Коллинз BC, Ганн Р.Дж., МакКитрик Т.Р., Каммингс Р.Д., Купер М.Д., Херрин Б.Р., Уилсон И.А. (ноябрь 2017 г.). «Структурные представления о тонкой специфичности VLR для углеводов группы крови». Структура. 25 (11): 1667–1678.e4. Дои:10.1016 / j.str.2017.09.003. ЧВК 5677568. PMID 28988747.
- ^ Джайн Д., Салунке Д.М. (февраль 2019 г.). «Специфичность антител и беспорядочные половые связи». Биохимический журнал. 476 (3): 433–447. Дои:10.1042 / BCJ20180670. PMID 30723137.
- ^ а б c d Хонг Х, Ма М.З., Гилдерслив Дж. К., Чоудхури С., Барчи Дж. Дж., Мариуцца Р. А. и др. (Январь 2013). «Сахар-связывающие белки рыб: отбор высокоаффинных« лямбтел », распознающих биомедицинские гликаны». ACS Химическая биология. 8 (1): 152–60. Дои:10.1021 / cb300399s. ЧВК 3756686. PMID 23030719.
- ^ Хан Б.В., Херрин Б.Р., Купер М.Д., Уилсон И.А. (сентябрь 2008 г.). «Узнавание антигена вариабельными рецепторами лимфоцитов». Наука. 321 (5897): 1834–7. Bibcode:2008Sci ... 321.1834H. Дои:10.1126 / science.1162484. ЧВК 2581502. PMID 18818359.
- ^ Купер М.Д., Ольха М.Н. (февраль 2006 г.). «Эволюция адаптивных иммунных систем». Клетка. 124 (4): 815–22. Дои:10.1016 / j.cell.2006.02.001. PMID 16497590. S2CID 16590222.
- ^ а б Луо М., Великовский С.А., Ян Х, Сиддики М.А., Хонг Х, Барчи Дж. Дж. И др. (Август 2013). "Распознавание углеводного антигена панкарциномы Томсена-Фриденрейха вариабельным рецептором лимфоцитов миноги". Журнал биологической химии. 288 (32): 23597–606. Дои:10.1074 / jbc.M113.480467. ЧВК 3949333. PMID 23782692.
- ^ Каммингс Р.Д., Шнаар Р.Л., Эско Д.Д., Дрикамер К., Тейлор М.Э. (2015). «Принципы распознавания гликанов». В Варки А., Каммингс Р.Д., Эско Д.Д., Стэнли П., Харт Г.В., Эби М. и др. (ред.). Основы гликобиологии (3-е изд.). Лабораторный пресс Колд-Спринг-Харбор. Дои:10.1101 / гликобиология.3e.029 (неактивно 01.09.2020). PMID 28876857.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (связь)
- ^ Везенер Д.А., Дуган А., Кисслинг Л.Л. (июнь 2017 г.). «Распознавание микробных гликанов растворимыми лектинами человека». Текущее мнение в структурной биологии. Углеводы: праздник структурной гликобиологии • Последовательности и топология: компьютерные исследования белок-белковых взаимодействий. 44: 168–178. Дои:10.1016 / j.sbi.2017.04.002. ЧВК 6688470. PMID 28482337.
- ^ «Новый метод открывает дверь к лучшему пониманию взаимодействия гликанов и белков». GEN - Новости генной инженерии и биотехнологии. 2018-03-01. Получено 2020-05-13.
- ^ Ойеларан, Ойиндасола; Гилдерслив, Джеффри К. (2009-10-01). «Массивы гликанов: последние достижения и будущие задачи». Современное мнение в области химической биологии. 13 (4): 406–413. Дои:10.1016 / j.cbpa.2009.06.021. ISSN 1367-5931. ЧВК 2749919. PMID 19625207.
- ^ Ван, Линлинь; Каммингс, Ричард Д; Смит, Дэвид Ф; Хуфлейт, Маргарет; Кэмпбелл, Кристофер Т; Гилдерслив, Джеффри К.; Герлах, Джаред Кью; Килкойн, Мишель; Джоши, Локеш; Серна, Соня; Райхард, Нильс-Кристиан (22 марта 2014 г.). «Межплатформенное сравнение форматов микрочипов гликанов». Гликобиология. 24 (6): 507–517. Дои:10.1093 / glycob / cwu019. ISSN 0959-6658. ЧВК 4001710. PMID 24658466.
- ^ Раман, Рахул; Таракараман, Каннан; Сасисекхаран, V; Сасисекхаран, Рам (2016-10-25). «Гликан-белковые взаимодействия в вирусном патогенезе». Текущее мнение в структурной биологии. 40: 153–162. Дои:10.1016 / j.sbi.2016.10.003. ISSN 0959-440X. ЧВК 5526076. PMID 27792989.
- ^ Тарони, Кьяра; Джонс, Сьюзен; Торнтон, Джанет М. (01.02.2000). «Анализ и прогнозирование сайтов связывания углеводов». Белковая инженерия, дизайн и отбор. 13 (2): 89–98. Дои:10.1093 / белок / 13.2.89. ISSN 1741-0126. PMID 10708647.
- ^ Кульхария, Махеш; Бриджит, Стивен Дж .; Goody, Roger S .; Джексон, Ричард М. (2009-10-01). «InCa-SiteFinder: метод предсказания на основе структуры сайтов связывания инозита и углеводов на белках». Журнал молекулярной графики и моделирования. 28 (3): 297–303. Дои:10.1016 / j.jmgm.2009.08.009. ISSN 1093-3263. PMID 19762259.
- ^ Чжао, Хуэйин; Тахерзаде, Газале; Чжоу, Яоци; Ян, Юэдун (2018). «Вычислительное прогнозирование белков, связывающих углеводы и сайтов связывания». Текущие протоколы в науке о белке. 94 (1): e75. Дои:10.1002 / cpps.75. ISSN 1934-3663. PMID 30106511.
- ^ Солис, Долорес; Бовин, Николай В .; Дэвис, Энтони П .; Хименес-Барберо, Хесус; Ромеро, Антонио; Рой, Рене; Сметана, Карел; Габиус, Ханс-Иоахим (01.01.2015). «Руководство по гликонаукам: как химия, биохимия и биология сотрудничают, чтобы взломать сахарный код». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1850 (1): 186–235. Дои:10.1016 / j.bbagen.2014.03.016. HDL:10261/130473. ISSN 0304-4165. PMID 24685397.




![{ displaystyle K_ {a} = { frac {[PG]} {[P] [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/38c58e2be67844c3537babb4f86e1ca38a60d94b)

![{ displaystyle K_ {d} = { frac {[P] [G]} {[PG]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/72976d7d2ea5a25b59b79f62a8f778c4c3bac42b)






![{ displaystyle beta _ {я} = { гидроразрыва {[PG_ {i}]} {[P] [G] ^ {i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9153a83607a00bc4eb96cdf6928a07a2024f1bdd)

![{ Displaystyle c_ {P} = [P] + [PG] + точки + [PG_ {n}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e1cabed41f72e76cf6c1a5e2886153b4bbdfebdc)
![{ displaystyle c_ {P} = [P] (1+ beta _ {1} [G] + dots + beta _ {n} [G] ^ {n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4101827e4dd349b92d1d5aaa3260881cfd76654)
![{ displaystyle [P] = { frac {c_ {P}} {1+ sum _ {i = 1} ^ {n} { beta _ {i} [G] ^ {i}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e5a5b4f3769c0ca0996d6d56e9fe287f3690918)

![{ displaystyle [P] = { frac {c_ {P}} {1+ beta _ {1} [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b617d194d337f431f73fc11a407538b873b5d8de)









