EF рука - EF hand
| EF рука | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Символ | efhand | ||||||||
| Pfam | PF00036 | ||||||||
| ИнтерПро | IPR002048 | ||||||||
| PROSITE | PDOC00018 | ||||||||
| SCOP2 | 1osa / Объем / СУПФАМ | ||||||||
| CDD | cd00051 | ||||||||
| |||||||||
В EF рука это спираль-петля-спираль структурная область или же мотив найдено в большом семья связывания кальция белки.
Мотив EF-руки содержит топологию спираль-петля-спираль, очень похожая на растянутые большой и указательный пальцы человеческой руки, в которой Ca2+ ионы координируются лигандами внутри петли. В мотив берет свое название от традиционной номенклатуры, используемой при описании белка парвальбумин, который содержит три таких мотива и, вероятно, участвует в мышца релаксация через его кальций-связывающую активность.
Рука EF состоит из двух альфа спирали связаны короткой петлей (обычно около 12 аминокислоты ) который обычно связывает кальций ионы. EF-стрелки также появляются в каждом структурная область из сигнальный белок кальмодулин и в мышечном белке тропонин-C.
Сайт связывания иона кальция
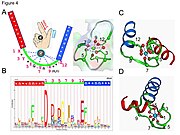
- Ион кальция имеет пентагональную бипирамидную конфигурацию. Шесть остатков, участвующих в связывании, находятся в положениях 1, 3, 5, 7, 9 и 12; эти остатки обозначаются X, Y, Z, -Y, -X и -Z. Инвариантный Glu или Asp в положении 12 обеспечивает два атома кислорода для лигандирования Са (бидентатный лиганд).
- Ион кальция связывается как белковый каркас атомами и аминокислотой боковые цепи, особенно кислотных аминокислотных остатков аспартат и глутамат. Эти остатки заряжены отрицательно и будут взаимодействовать с положительно заряженным ионом кальция. Мотив руки EF был одним из первых структурных мотивов, требования к последовательности которых были подробно проанализированы. Пять из петлевых остатков связывают кальций и поэтому имеют сильное предпочтение кислород -содержащие боковые цепи, особенно аспартат и глутамат. Шестой остаток в петле обязательно глицин из-за конформационных требований магистрали. Остальные остатки обычно гидрофобный и сформировать гидрофобное ядро который связывает и стабилизирует две спирали.
- При привязке к Ca2+, этот мотив может претерпевать конформационные изменения, которые позволяют Ca2+-регулируемые функции, как показано в Ca2+ эффекторы, такие как кальмодулин (CaM) и тропонин C (TnC) и Ca2+ буферы, такие как кальретикулин и кальбиндин D9k. В то время как большинство известных кальций-связывающих белков EF-руки (CaBP) содержат парные мотивы EF-руки, CaBP с единственной EF-рукой также обнаружены как у бактерий, так и у эукариот. Кроме того, «мотивы, похожие на EF-руки» были обнаружены у ряда бактерий. Хотя координационные свойства остаются схожими с каноническим мотивом EF-hand из 29 остатков спираль-петля-спираль, мотивы, подобные EF-руке, отличаются от EF-hands тем, что они содержат отклонения во вторичной структуре фланкирующих последовательностей и / или изменение длины Ca2+-координационная петля.
- Руки EF обладают очень высокой селективностью к кальцию. Например, константа диссоциации альфа парвальбумин для Ca2+ в ~ 1000 раз меньше, чем для аналогичного иона Mg2+.[2] Такая высокая селективность обусловлена относительно жесткой координационной геометрией, наличием множества заряженных боковых цепей аминокислот в сайте связывания, а также свойствами сольватации ионов.[3][4][5]
Прогноз

- Поиск по образцу (сигнатуре мотива) - один из самых простых способов прогнозирования непрерывной EF-руки Ca2+сайты связывания в белках. На основании результатов выравнивания последовательностей канонических мотивов EF-hand, особенно консервативных боковых цепей, непосредственно участвующих в Ca2+ переплет, узор PS50222 был создан для предсказания канонических сайтов EF-hand. Серверы прогнозов можно найти в разделе внешних ссылок.
Классификация
- С тех пор, как в 1973 г. был выделен мотив EF-hand, семейство белков EF-hand расширилось и на данный момент включает по крайней мере 66 подсемейств. EF-мотивы рук делятся на две основные группы:
- Канонические EF-стрелки как видно в кальмодулине (CaM) и прокариотическом CaM-подобном белке калеритрине. Каноническая петля EF-руки из 12 остатков связывает Ca2+ в основном через карбоксилаты или карбонилы боковой цепи (положения 1, 3, 5, 12 петлевой последовательности). Остаток на оси –X координирует Ca2+ ион через мостиковую молекулу воды. Петля EF-руки имеет бидентатный лиганд (Glu или Asp) на оси –Z.
- Псевдо EF-руки обнаруживается исключительно на N-концах S100 и S100-подобных белков. Pseudo EF-ручная петля из 14 остатков хелатирует Ca2+ главным образом через карбонилы основной цепи (положения 1, 4, 6, 9).
Дополнительные пункты:

- EF-подобные белки с разнообразными фланкирующими структурными элементами вокруг Ca2+-связывающая петля была обнаружена у бактерий и вирусов. Эти прокариотические белки, подобные EF-hand, широко участвуют в Са2+ сигнализация и гомеостаз у бактерий. Они содержат гибкие отрезки Ca2+-связывающие петли, которые отличаются от мотивов EF-руки. Однако их координационные свойства напоминают классические мотивы EF-руки.
- Например, полунепрерывный Ca2+Сайт связывания в D-галактозосвязывающем белке (GBP) содержит петлю из девяти остатков. CA2+ ion координируется семью атомами кислорода белка, пять из которых относятся к петле, имитирующей каноническую EF-петлю, тогда как два других относятся к карбоксилатной группе отдаленного Glu.
- Другой пример - новый домен под названием Экскалибур (внеклеточный Ca2+-связывающая область) изолирована от Bacillus subtilis. Этот домен имеет консервативный Ca из 10 остатков.2+-binding loop поразительно похож на каноническую EF-ручную петлю с 12 остатками.
- Разнообразие структуры фланкирующей области иллюстрируется открытием EF-hand-подобных доменов в бактериальных белках. Например, спираль-петля-цепь вместо структуры спираль-петля-спираль находится в периплазматическом белке, связывающем галактозу (Сальмонелла тифимуриум, PDB: 1 гкг) Или альгинат-связывающий белок (Сфингомонады зр., 1 кВтч); входящая спираль отсутствует у защитного антигена (бацилла сибирской язвы, 1acc) Или докерин (Clostridium thermocellum, 1daq).
- Среди всех структур, о которых сообщалось на сегодняшний день, большинство EF-мотивов рук объединены в пары либо между двумя каноническими, либо одним псевдо и одним каноническим мотивами. Для белков с нечетным числом EF-рук, таких как пента-EF-hand калпаин, мотивы EF-hand были связаны посредством гомо- или гетеродимеризации. Недавно идентифицированная EF-рука, содержащая ER Ca2+ сенсорный белок, молекула взаимодействия стромы 1 и 2 (STIM1, STIM2), как было показано, содержит Ca2+-связывающий канонический EF-мотив руки, который сочетается с немедленным, последующим атипичным «скрытым» не-Ca2+-обвязка EF-hand. Одиночные мотивы EF-руки могут служить модулями стыковки с белками: например, одна рука EF в белках NKD1 и NKD2 связывает белки Disheveled (DVL1, DVL2, DVL3).
- Функционально EF-hands можно разделить на два класса: 1) сигнальные белки и 2) буферные / транспортные белки. Первая группа является самой большой и включает наиболее известных представителей семейства, таких как кальмодулин, тропонин С и S100B. Эти белки обычно подвергаются кальций-зависимому конформационному изменению, которое открывает сайт связывания-мишени. Последняя группа представлена кальбиндином D9k и не претерпевает зависимых от кальция конформационных изменений.
Подсемейства
Примеры
Aequorin
Aequorin - это кальций-связывающий белок (CaBP), выделенный из кишечнополостных Aequorea victoria. Aequorin принадлежит к семейству EF-hand CaBP с петлями EF-hand, которые тесно связаны с CaBP у млекопитающих. Кроме того, экворин в течение многих лет использовался в качестве индикатора Ca2 +, и было показано, что он безопасен и хорошо переносится клетками. Aequorin состоит из двух компонентов - компонента, связывающего кальций апоаэкорин (AQ) и хемилюминесцентная молекула целентеразина. Часть AQ этого белка содержит кальций-связывающие домены EF-hand.[6]
Белки человека
Белки человека, содержащие этот домен, включают:
- ACTN1; ACTN2; ACTN3; ACTN4; APBA2BP; AYTL1; AYTL2
- C14orf143; CABP1; CABP2; CABP3; CABP4; CABP5; CABP7; CALB1; CALB2; CALM2; CALM3; CALML3; CALML4; CALML5; CALML6; CALN1; CALU; CAPN1; CAPN11; CAPN2; CAPN3; CAPN9; CAPNS1; CAPNS2; ШАПКИ; CAPS2; CAPSL; CBARA1; CETN1; CETN2; CETN3; ТЭЦ; ТЭЦ2; CIB1; CIB2; CIB3; CIB4; CRNN
- ДГКА; ДГКБ; ДГКГ; Летнее время; DUOX1; DUOX2
- EFCAB1; EFCAB2; EFCAB4A; EFCAB4B; EFCAB6; EFCBP1; EFCBP2; EFHA1; EFHA2; EFHB; EFHC1; EFHD1; EFHD2; EPS15; EPS15L1
- FKBP10; FKBP14; FKBP7; FKBP9; FKBP9L; ЧАСТОТА; FSTL1; FSTL5
- GCA; GPD2; GUCA1A; GUCA1B; GUCA1C
- гиппокальцин; HPCAL1; HPCAL4; HZGJ
- IFPS; ITSN1; ITSN2; KCNIP1; KCNIP2; KCNIP3; KCNIP4; KIAA1799
- LCP1
- MACF1; MRLC2; MRLC3; MST133; MYL1; MYL2; MYL5; MYL6B; MYL7; MYL9; MYLC2PL; MYLPF
- NCALD; NIN; NKD1; NKD2; НЛП; NOX5; NUCB1; NUCB2
- OCM
- PDCD6; PEF1; PKD2; PLCD1; PLCD4; PLCH1; PLCH2; PLS1; PLS3; PP1187; PPEF1; PPEF2; PPP3R1; PPP3R2; ПРКЧШ; PVALB
- RAB11FIP3; РАСЭФ; РАСГРП; RASGRP1; RASGRP2; RASGRP3; RCN1; RCN2; RCN3; RCV1; RCVRN; REPS1; RHBDL3; RHOT1; RHOT2; RPTN; RYR2; RYR3
- S100A1; S100A11; S100A12; S100A6; S100A8; S100A9; S100B; S100G; S100Z; SCAMC-2; SCGN; SCN5A; SDF4; SLC25A12; SLC25A13; SLC25A23; SLC25A24; SLC25A25; SPATA21; ЗИП1; SPTAN1; НИИ
- TBC1D9; TBC1D9B; TCHH; TESC; TNNC1; TNNC2
- USP32
- VSNL1
- ZZEF1
Смотрите также
- Другой отличительный кальций-связывающий мотив, состоящий из альфа-спиралей, - это домен dockerin.
Рекомендации
- ^ Пан С., Рамакришнан Б., Линг К.Ю., Кунг С., Сундаралингам М. (январь 1994 г.). «Структура рекомбинантного кальмодулина Paramecium tetraurelia при разрешении 1,68 А». Acta Crystallogr. D. 50 (Pt 1): 50–63. Дои:10.1107 / S0907444993007991. PMID 15299476.
- ^ Шваллер, Б. (13 октября 2010 г.). «Цитозольные буферы Ca2 +». Перспективы Колд-Спринг-Харбор в биологии. 2 (11): a004051 – a004051. Дои:10.1101 / cshperspect.a004051. ЧВК 2964180. PMID 20943758.
- ^ Гиффорд, Джессика Л .; Уолш, Майкл П .; Фогель, Ханс Дж. (15 июля 2007 г.). «Структуры и свойства связывания ионов металлов Ca-связывающих мотивов EF-руки спираль – петля – спираль». Биохимический журнал. 405 (2): 199–221. Дои:10.1042 / BJ20070255. PMID 17590154.
- ^ Дудев, Тодор; Лим, Кармай (16 сентября 2013 г.). «Конкуренция между ионами металлов за сайты связывания с белками: детерминанты селективности ионов металлов в белках». Химические обзоры. 114 (1): 538–556. Дои:10.1021 / cr4004665. PMID 24040963.
- ^ Цзин, Чжифэн; Лю, Ченгвэнь; Ци, Руи; Рен, Пэнъю (23 июля 2018 г.). «Эффект многих тел определяет селективность в отношении Са и Mg в белках». Труды Национальной академии наук. 115: 201805049. Дои:10.1073 / pnas.1805049115. ЧВК 6094099. PMID 30038003.
- ^ Детерт Дж. А., Адамс Е. Л., Лешер Дж. Д., Лион Дж. А., Мойер Дж. Р. (2013). «Предварительная обработка апоэкворином защищает нейроны CA1 гиппокампа от кислородно-глюкозной депривации». PLoS ONE. 8 (11): e79002. Дои:10.1371 / journal.pone.0079002. ЧВК 3823939. PMID 24244400.
дальнейшее чтение
- Бранден С., Туз Дж. (1999). «Глава 2: Мотивы структуры белка». Введение в структуру белка. Нью-Йорк: Garland Pub. С. 24–25. ISBN 0-8153-2305-0.
- Накаяма С., Крецингер Р.Х. (1994). «Эволюция семейства белков EF-hand». Annu Rev Biophys Biomol Struct. 23: 473–507. Дои:10.1146 / annurev.bb.23.060194.002353. PMID 7919790.
- Чжоу Ю., Ян В., Кирбергер М., Ли Х. В., Аяласомаяджула Г., Ян Дж. Дж. (Ноябрь 2006 г.). «Прогнозирование кальций-связывающих белков EF-руки и анализ бактериальных белков EF-руки». Белки. 65 (3): 643–55. Дои:10.1002 / prot.21139. PMID 16981205.
- Чжоу Ю., Фрей Т.К., Ян Дж.Дж. (июль 2009 г.). «Вирусная кальциомика: взаимодействие между Ca2 + и вирусом». Клеточный кальций. 46 (1): 1–17. Дои:10.1016 / j.ceca.2009.05.005. ЧВК 3449087. PMID 19535138.
- Накаяма С., Монкриф Н.Д., Кретсингер Р.Х. (май 1992 г.). «Эволюция белков, модулируемых кальцием EF-hand. II. Домены нескольких подсемейств имеют различную эволюционную историю». J. Mol. Evol. 34 (5): 416–48. Дои:10.1007 / BF00162998. PMID 1602495.
- Hogue CW, MacManus JP, Banville D, Szabo AG (июль 1992 г.). «Сравнение усиления люминесценции тербия (III) у мутантов кальцийсвязывающих белков руки EF». J. Biol. Chem. 267 (19): 13340–7. PMID 1618836.
- Байрох А., Кокс Дж. А. (сентябрь 1990 г.). "EF-мотивы рук в инозитолфосфолипид-специфической фосфолипазе C". FEBS Lett. 269 (2): 454–6. Дои:10.1016/0014-5793(90)81214-9. PMID 2401372.
- Finn BE, Forsén S (январь 1995 г.). «Развивающаяся модель структуры, функции и активации кальмодулина». Структура. 3 (1): 7–11. Дои:10.1016 / S0969-2126 (01) 00130-7. PMID 7743133.
- Статопулос П. Б., Чжэн Л., Ли Г. Ю., Плевин М. Дж., Икура М. (октябрь 2008 г.). «Структурные и механистические выводы о STIM1-опосредованном инициировании поступления кальция в магазин». Клетка. 135 (1): 110–22. Дои:10.1016 / j.cell.2008.08.006. PMID 18854159.
- Нельсон М.Р., Тулин Э., Фаган П.А., Форсен С., Чазин В.Дж. (февраль 2002 г.). «Домен EF-hand: глобально совместная структурная единица». Белковая наука. 11 (2): 198–205. Дои:10.1110 / л.с. 33302. ЧВК 2373453. PMID 11790829.
внешняя ссылка
- Ресурс Eukaryotic Linear Motif класс мотива LIG_EH_1
- Ресурс Eukaryotic Linear Motif класс мотива LIG_IQ
- Ресурс Eukaryotic Linear Motif класс мотива DOC_PP2B_LxvP_1
- Ресурс Eukaryotic Linear Motif класс мотива LIG_IQ
- Нельсон М., Чазин В. "Библиотека данных по кальций-связывающим белкам EF-Hand". Университет Вандербильта. Получено 2009-08-29.
- Хайех Дж. «База данных белков EF-hand (EF-handome)». Европейское кальциевое общество и Université Libre de Bruxelles. Получено 2009-08-29.
по запросу на [email protected]
- Ян Дж. «Кальциомика». Государственный университет Джорджии. Архивировано из оригинал на 2009-10-12. Получено 2009-08-29.
сервер предсказаний для белков, связывающих кальций EF-hand
