Грепафлоксацин - Grepafloxacin
 | |
| Клинические данные | |
|---|---|
| AHFS /Drugs.com | Информация для потребителей Multum |
| Код УВД | |
| Фармакокинетический данные | |
| Связывание с белками | 50% |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.159.692 |
| Химические и физические данные | |
| Формула | C19ЧАС22FN3О3 |
| Молярная масса | 359.401 г · моль−1 |
| 3D модель (JSmol ) | |
| Хиральность | Рацемическая смесь |
| |
| |
| (проверять) | |
Грепафлоксацин (торговое наименование Раксар, Glaxo Wellcome ) был оральным широким спектром фторхинолон антибактериальный агент, используемый для лечения бактериальный инфекции. Грепафлоксацин был снят с продажи во всем мире в 1999 г.[1][2] из-за его побочного эффекта удлинения QT интервал на ЭКГ, приводящие к сердечным событиям и внезапная смерть.[3]
Клиническое использование
Грепафлоксацин использовался для лечения обострений хронического бронхита, вызванного чувствительными бактериями (например, Haemophilus influenzae, Пневмококк, Moraxella catarrhalis ),[4][5][6] внебольничные пневмонии (в том числе те, которые, помимо перечисленных выше микробов, вызваны Mycoplasma pneumoniae )[7][8] гонорея и негонококковый уретрит и цервицит (например, вызвано Хламидия трахоматис или же Уреаплазма уреалитикум ).[9][10]
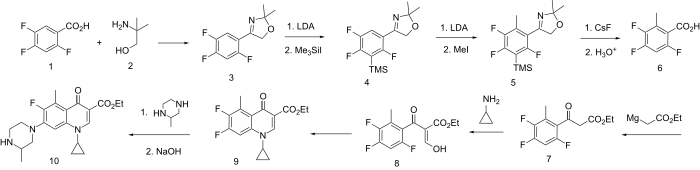
Синтез
Получение хинолонов, содержащих заместитель в положении 5, осложняется более сильным электрофильным характером положения 8. Одна из схем решения проблемы состоит в блокировании доступа к позиции 8 путем добавления в этот центр легко снимаемой группы.
Схема начинается с превращения карбоновой кислоты в (1) к его производному диметилоксазолина (3) по реакции с аминометил пропанол (2). Лития диизопропиламид (LDA) затем удаляет протон из 8-го положения; обработка этого аниона триметилсилил йодид приводит к силилированному промежуточному соединению (4). Второй раунд LDA затем генерирует карбанион на единственной открытой позиции; реакция с метилиодид приводит к соответствующему 5-метильному производному (5). Обработка этого продукта фторид цезия разрывает связь углерод – кремний, удаляя силильную группу; водная кислота затем гидролизует оксазолин чтобы позволить себе свободную кислоту (6). Этот последний промежуточный продукт затем превращается в хинолон (9) [13] по сути по той же схеме, что и для приготовления дифлоксацин, с той разницей, что удлинение цепи происходит с помощью реактива Гриньяра этилбромацетат. Лечение (9) с 2-метилпиперазином протекает по реакции по наименее затрудненной из двух аминогрупп; омыление затем дает грепафлоксацин (10).
Стереохимия
Грепафлоксацин содержит стереоцентр и состоит из двух энантиомеров. Это рацемат, т.е. смесь 1: 1 (р) - и (S) -формы:
| Энантиомеры грепафлоксацина | |
|---|---|
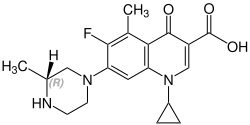 (р) -грепафлоксацин Номер CAS: 146761-68-4 | 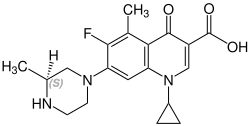 (S) -грепафлоксацин Номер CAS: 146761-69-5 |
Смотрите также
Рекомендации
- ^ "Glaxo Wellcome добровольно отозвал Раксар (грепафлоксацин)" (PDF). Получено 2014-10-12.
- ^ «Выведение продукта: RAXAR (грепафлоксацин HCl) таблетки 600 мг, таблетки 400 мг и таблетки 200 мг». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 2014-10-12.
- ^ Sprandel, KA .; Родволд, К.А. (2003). «Безопасность и переносимость фторхинолонов». Clin Cornerstone. Дополнение 3: S29–36. Дои:10.1016 / с1098-3597 (03) 90027-5. PMID 14992418.
- ^ Chodosh S, Lakshminarayan S, Swarz H, Breisch S (январь 1998 г.). «Эффективность и безопасность 10-дневного курса 400 или 600 миллиграммов грепафлоксацина один раз в день для лечения острых бактериальных обострений хронического бронхита: сравнение с 10-дневным курсом 500 миллиграммов ципрофлоксацина два раза в день». Антимикробный. Агенты Chemother. 42 (1): 114–20. Дои:10.1128 / AAC.42.1.114. ЧВК 105465. PMID 9449270.
- ^ Langan CE, Cranfield R, Breisch S, Pettit R (декабрь 1997 г.). «Рандомизированное двойное слепое исследование грепафлоксацина в сравнении с амоксициллином у пациентов с острыми бактериальными обострениями хронического бронхита». J. Antimicrob. Chemother. 40 Дополнение A: 63–72. Дои:10.1093 / jac / 40.suppl_1.63. PMID 9484875. Получено 2014-10-12.
- ^ Langan CE, Zuck P, Vogel F, McIvor A, Peirzchala W., Smakal M, Staley H, Marr C. (октябрь 1999 г.). «Рандомизированное двойное слепое исследование короткого курса (5 дней) грепафлоксацина по сравнению с 10-дневным кларитромицином у пациентов с острыми бактериальными обострениями хронического бронхита». J. Antimicrob. Chemother. 44 (4): 515–23. Дои:10.1093 / jac / 44.4.515. PMID 10588313. Получено 2014-10-12.
- ^ О'Догерти Б., голландец Д.А., Петтит Р., Мароли А. (декабрь 1997 г.). «Рандомизированное двойное слепое сравнительное исследование грепафлоксацина и амоксициллина в лечении пациентов с внебольничной пневмонией». J. Antimicrob. Chemother. 40 Дополнение A: 73–81. Дои:10.1093 / jac / 40.suppl_1.73. PMID 9484876. Получено 2014-10-12.
- ^ Felmingham D (март 2000 г.). «Респираторные патогены: оценка моделей устойчивости в Европе и потенциальная роль грепафлоксацина в лечении пациентов с инфекциями, вызванными этими организмами». J. Antimicrob. Chemother. 45 (90002): 1–8. Дои:10.1093 / jac / 45.suppl_2.1. PMID 10719006. Получено 2014-10-12.
- ^ Риджуэй Г.Л., Салман Х., Роббинс М.Дж., Денсер С., Фелмингем Д. (декабрь 1997 г.). «Активность грепафлоксацина in vitro против Chlamydia spp., Mycoplasma spp., Ureaplasma urealyticum и Legionella spp.». J. Antimicrob. Chemother. 40 Дополнение A: 31–4. Дои:10.1093 / jac / 40.suppl_1.31. PMID 9484871. Получено 2014-10-12.
- ^ Маккормак WM, Мартин DH, Крюк EW, Джонс РБ (1998). «Ежедневный пероральный грепафлоксацин по сравнению с пероральным доксициклином два раза в день при лечении эндоцервикальной инфекции, вызванной Chlamydia trachomatis». Инфекция Dis Obstet Gynecol. 6 (3): 109–15. Дои:10.1155 / S1064744998000210. ЧВК 1784789. PMID 9785106.
- ^ Hagen, S.E .; Domagala, J.M .; Heifetz, C.L .; Джонсон, Дж. (1991). «Синтез и биологическая активность 5-алкил-1,7,8-тризамещенных-6-фторхинолин-3-карбоновых кислот». Журнал медицинской химии. 34 (3): 1155–61. Дои:10.1021 / jm00107a040. PMID 2002456.
- ^ WO 8906649; эйдем Патент США 4920120 (1989, 1990 и Уорнер-Ламберт).
- ^ Hagen, S.E .; Домагала, Дж. М. (1990). «Синтез 5-метил-4-оксохинолинкарбоновых кислот». Журнал гетероциклической химии. 27 (6): 1609. Дои:10.1002 / jhet.5570270616.