Молекулярная неврология - Molecular neuroscience
Молекулярная неврология это филиал нейробиология который наблюдает концепции в молекулярная биология применяется к нервная система животных. В рамках этого предмета рассматриваются такие темы, как молекулярные нейроанатомия, механизмы молекулярная сигнализация в нервная система, эффекты генетика и эпигенетика на развитие нейронов и молекулярную основу для нейропластичность и нейродегенеративные заболевания.[1] Как и молекулярная биология, молекулярная нейробиология - относительно новая область, которая значительно динамична.
Поиск нейротрансмиттеров
В молекулярная биология коммуникация между нейронами обычно происходит посредством химической передачи через промежутки между клетками, называемые синапсы. Передаваемые химические вещества, известные как нейротрансмиттеры, регулируют значительную часть жизненно важных функций организма.[2] Анатомически локализовать нейротрансмиттеры можно с помощью методов маркировки. Можно химически идентифицировать определенные нейротрансмиттеры, такие как катехоламины к фиксация нервный срезы тканей с формальдегид. Это может вызвать флуоресценцию, индуцированную формальдегидом, при воздействии ультрафиолетовый свет. Дофамин, катехоламин, был обнаружен в нематода C. elegans используя эту технику.[3]Иммуноцитохимия, который включает выработку антител против целевых химических или биологических объектов, включает несколько других интересных методов. Целевой нейротрансмиттер может быть специально помечен первичные и вторичные антитела с радиоактивной маркировкой, чтобы идентифицировать нейромедиатор по авторадиография. Присутствие нейротрансмиттеров (хотя и не обязательно по их местонахождению) можно наблюдать с помощью иммуноцитохимии, связанной с ферментами, или иммуноферментный анализ (ELISA) в которых связывание субстрата в ферментативных анализах может вызывать осаждает, флуорофоры, или же хемилюминесценция. В случае, если нейротрансмиттеры не могут быть идентифицированы гистохимически, альтернативным методом является их локализация по их механизмам нейрального захвата.[1]
Управляемые по напряжению ионные каналы

Возбудимые клетки живых организмов имеют потенциалзависимые ионные каналы. Их можно наблюдать во всей нервной системе в нейронах. Первыми ионными каналами, которые были охарактеризованы, были ионные каналы натрия и калия А.Л. Ходжкин и А. Ф. Хаксли в 1950-х годах при изучении гигантского аксона рода кальмаров Лолиго. Их исследования продемонстрировали избирательную проницаемость клеточных мембран, зависящую от физиологических условий, и электрические эффекты, возникающие в результате этой проницаемости, чтобы производить потенциалы действия.[4]
Каналы для ионов натрия
Натриевые каналы были первыми потенциалозависимыми ионными каналами, выделенными в 1984 г. от угря. Электрофор электрический к Шосаку Нума. В рыба фугу токсин тетродотоксин (ТТХ), блокатор натриевых каналов, был использован для выделения белка натриевых каналов путем связывания его с помощью колоночная хроматография техника химического разделения. В аминокислота последовательность белка анализировали Эдман деградация а затем используется для построения библиотека кДНК который можно использовать для клонирования канального белка. Клонирование самого канала позволило использовать такие приложения, как определение тех же каналов у других животных.[1] Известно, что натриевые каналы работают совместно с калиевыми каналами во время развития ступенчатых потенциалов и потенциалов действия. Натриевые каналы обеспечивают приток Na+ ионов в нейрон, в результате чего деполяризация от мембранный потенциал покоя нейрона, чтобы привести к дифференцированному потенциалу или потенциалу действия, в зависимости от степени деполяризации.[5]
Каналы ионов калия
Калиевые каналы бывают разных форм, присутствуют в большинстве эукариотический клетки, и обычно имеют тенденцию стабилизировать клеточную мембрану на уровне калия равновесный потенциал. Как и в случае с ионами натрия, градиентные потенциалы и потенциалы действия также зависят от калиевых каналов. При поступлении Na+ ионы в нейрон вызывают клеточную деполяризацию, отток K+ ионы из нейрона заставляют клетку реполяризоваться до мембранного потенциала покоя. Активация самих калиевых ионных каналов зависит от деполяризации, вызванной Na+ приток во время потенциала действия.[1] Как и в случае натриевых каналов, в калиевых каналах есть свои токсины, которые блокируют действие белков канала. Примером такого токсина является большой катион, тетраэтиламмоний (TEA), но примечательно, что токсин не обладает одинаковым механизмом действия на все калиевые каналы, учитывая разнообразие типов каналов у разных видов. Наличие калиевых каналов было впервые выявлено в Drosophila melanogaster мухи-мутанты, которые неконтролируемо тряслись под наркозом из-за проблем с реполяризацией клеток, что привело к аномальной электрофизиологии нейронов и мышц. Калиевые каналы были впервые идентифицированы путем манипулирования молекулярной генетикой (мух) вместо очистки белка каналов, потому что на момент открытия не было известных лигандов с высоким сродством для калиевых каналов (таких как TEA).[1][6]
Каналы ионов кальция
Кальциевые каналы важны для определенных клеточных сигнальных каскадов, а также для высвобождения нейромедиаторов в терминалы аксонов. В возбудимых клетках обнаруживается множество различных типов кальциевых ионных каналов. Как и каналы для ионов натрия, каналы для ионов кальция были выделены и клонированы методами хроматографической очистки. Примечательно, что, как и в случае высвобождения нейротрансмиттера, кальциевые каналы могут взаимодействовать с внутриклеточными белками и играть важную роль в передаче сигналов, особенно в таких местах, как саркоплазматический ретикулум мышечных клеток.[1]
Рецепторы
Различные типы рецепторов могут использоваться для передачи сигналов и коммуникации клеток и могут включать ионотропные рецепторы и метаботропные рецепторы. Эти типы рецепторов клеточной поверхности различаются по механизму и продолжительности действия: ионотропные рецепторы связаны с быстрой передачей сигнала, а метаботропные рецепторы связаны с медленной передачей сигнала. Метаботропные рецепторы охватывают широкий спектр рецепторов клеточной поверхности с заметно разными сигнальные каскады.[1][5]
Ионотропные рецепторы
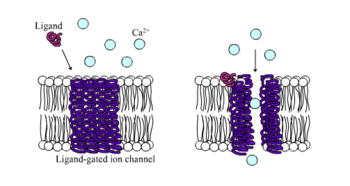
Ионотропные рецепторы, иначе известный как ионные каналы, управляемые лигандами, являются быстродействующими рецепторами, которые опосредуют нервные и физиологические функции посредством потока ионных каналов со связыванием лиганда. Никотиновые, ГАМК и глутаматные рецепторы входят в число некоторых рецепторы клеточной поверхности регулируется потоком по ионному каналу, управляемому лигандом. ГАМК является основным тормозным нейромедиатором мозга, а глутамат является основным возбуждающим нейромедиатором мозга.[1]
Рецепторы ГАМК
ГАМКА и ГАМКC рецепторы известны как ионотропные, в то время как ГАМКB рецептор - метаботропный. ГАМКА рецепторы опосредуют быстрые тормозные реакции в Центральная нервная система (ЦНС) и находятся на нейронах, глиальные клетки, и мозговое вещество надпочечников клетки. Он отвечает за индуцирование Cl− приток ионов в клетки, тем самым снижая вероятность того, что деполяризация мембраны произойдет после достижения градиентного потенциала или потенциала действия. Рецепторы ГАМК также могут взаимодействовать с неэндогенными лигандами, чтобы влиять на активность. Например, соединение диазепам (продается как валиум) является аллостерический агонист, повышающий сродство рецептора к ГАМК. Повышенные физиологические ингибирующие эффекты, возникающие в результате увеличения связывания ГАМК, делают диазепам полезным транквилизатор или же противосудорожное средство (противоэпилептические препараты). С другой стороны, рецепторы ГАМК также могут быть нацелены на снижение Cl− приток клеток с эффектом конвульсантов, таких как пикротоксин. Антагонистический механизм действия этого соединения не относится непосредственно к рецептору ГАМК, но есть другие соединения, которые способны к аллостерической инактивации, включая Т-бутилбициклофоротионат (TBPS) и пентилентетразол (PZT). По сравнению с ГАМКА, ГАМКC рецепторы имеют более высокое сродство к ГАМК, они, вероятно, будут иметь более продолжительную активность, и их ответы, вероятно, будут вызваны более низкими концентрациями ГАМК.[1]
Рецепторы глутамата
Ионотропный рецепторы глутамата может включать NMDA, AMPA, и каинатные рецепторы. Эти рецепторы названы в честь агонистов, которые способствуют активности глутамата. Рецепторы NMDA известны своими возбуждающими механизмами, влияющими на пластичность нейронов при обучении и памяти, а также невропатологиями, такими как инсульт и эпилепсия. Рецепторы NDMA имеют несколько сайтов связывания, как и ионотропные рецепторы ГАМК, и на них могут влиять коагонисты, такие как глицин нейротрансмиттер или фенциклидин (PCP). Рецепторы NMDA переносят ток через Ca2+ ионы и могут быть заблокированы внеклеточным Mg2+ ионы в зависимости от напряжения и мембранного потенциала. Это Ca2+ приток увеличивается на возбуждающие постсинаптические потенциалы (ВПСП), продуцируемые рецепторами NMDA, активирующие Са2+сигнальные каскады (такие как высвобождение нейромедиаторов). AMPA генерирует более короткие и большие возбуждающие постсинаптические токи, чем другие ионотропные рецепторы глутамата.[5]
Никотиновые рецепторы ACh
Никотиновые рецепторы связать ацетилхолин (ACh) нейротрансмиттер для создания неселективного потока катионных каналов, который генерирует возбуждающие постсинаптические ответы. Активность рецепторов, на которую может влиять потребление никотина, вызывает чувство эйфории, расслабления и неизбежно сильной зависимости.[5]
Метаботропные рецепторы

Метаботропные рецепторы, являются рецепторами медленного ответа в постсинаптических клетках. Обычно эти медленные ответы характеризуются более сложными внутриклеточными изменениями биохимии. Ответы на поглощение нейромедиаторов метаботропные рецепторы может привести к активации внутриклеточных ферментов и каскадов с участием вторичных мессенджеров, как в случае с G-белковые рецепторы. Различные метаботропные рецепторы могут включать определенные рецепторы глутамата, мускариновые рецепторы ACh, ГАМК.B рецепторы и рецепторные тирозинкиназы.
G-белковые рецепторы
В G-белок связанный сигнальный каскад может значительно усилить сигнал конкретного нейротрансмиттера для создания сотен и тысяч вторичных мессенджеров в клетке. Механизм действия, по которому G-белковые рецепторы вызвать сигнальный каскад следующим образом:
- Нейротрансмиттер связывается с рецептором
- Рецептор претерпевает конформационные изменения, позволяющие G-белок сложная привязка
- ВВП обменивается с GTP при связывании G-белкового комплекса с рецептором
- Α-субъединица комплекса G-белка связывается с GTP и отделяется для связывания с целевым белком, таким как аденилатциклаза
- Связывание с целевым белком увеличивает или уменьшает скорость вторичного мессенджера (например, циклический AMP ) производство
- GTPase гидролизует α-субъединицу, так что она связана с GDP, а α-субъединица возвращается в комплекс G-белка, неактивный
Выпуск нейротрансмиттера

Нейротрансмиттеры выпускаются дискретными пакетами, известными как кванты от аксонный терминал одного нейрона в дендриты другого через синапс. Эти кванты были идентифицированы электронная микроскопия в качестве синаптические везикулы. Два типа пузырьков - это небольшие синаптические сосуды (SSV), размер которых составляет около 40-60нм в диаметре, и большие везикулы с плотным ядром (LDCV), электронно-плотные везикулы примерно 120-200нм в диаметре.[1] Первое происходит от эндосомы и содержит нейротрансмиттеры, такие как ацетилхолин, глутамат, ГАМК, и глицин. Последний выводится из аппарат Гольджи и вмещает более крупные нейротрансмиттеры, такие как катехоламины и другие пептидные нейротрансмиттеры.[7] Нейротрансмиттеры высвобождаются из терминала аксона и связываются с постсинаптическими дендритами в следующей последовательности:[5]
- Мобилизация / рекрутирование синаптического пузырька из цитоскелет
- Стыковка везикулы (связывание) с пресинаптической мембраной
- Прайминг везикулы АТФ (относительно медленный шаг)
- Слияние примированной везикулы с пресинаптической мембраной и экзоцитоз размещенного нейромедиатора
- Поглощение нейротрансмиттеров рецепторами постсинаптической клетки
- Инициирование или ингибирование потенциала действия в постсинаптической клетке в зависимости от того, являются ли нейротрансмиттеры возбуждающими или тормозящими (возбуждение приведет к деполяризации постсинаптической мембраны)
Высвобождение нейротрансмиттера зависит от кальция
Высвобождение нейротрансмиттера зависит от внешнего источника кальция.2+ ионы, которые попадают в терминалы аксонов через кальциевые каналы. Везикулярное слияние с терминальной мембраной и высвобождение нейротрансмиттера вызвано генерацией Ca2+ градиенты, вызванные входящими потенциалы действия. CA2+ ионы вызывают мобилизацию вновь синтезированных везикул из резервного пула для осуществления этого мембранного слияния. Этот механизм действия был обнаружен в гигантских аксонах кальмаров.[8] Снижение внутриклеточного Ca2+ Ионы оказывают прямое ингибирующее действие на высвобождение нейромедиаторов.[1] После высвобождения нейротрансмиттера везикулярные мембраны возвращаются в исходное состояние. Каналы ионов кальция могут различаться в зависимости от места возникновения. Например, каналы на конце аксона отличаются от типичных кальциевых каналов тела клетки (независимо от того, нервный или нет). Даже на окончаниях аксона типы кальциевых ионных каналов могут различаться, как и в случае кальциевых каналов P-типа, расположенных в нервномышечное соединение.[1]
Экспрессия нейрональных генов
Половые различия
Различия в определении пола контролируются половые хромосомы. Выделение половых гормонов оказывает значительное влияние на половые диморфизмы (фенотипическая дифференциация половых признаков) головного мозга. Недавние исследования, похоже, предполагают, что регулирование этих диморфизмов имеет значение для понимания нормальной и ненормальной функции мозга. На половые диморфизмы может значительно влиять экспрессия генов мозга по признаку пола, которая варьируется от вида к виду.
Модели животных, такие как грызуны, Drosophila melanogaster, и Caenorhabditis elegans, были использованы для наблюдения за происхождением и / или степенью предвзятости по половому признаку в головном мозге по сравнению с производящими гормоны гонадами животного. Что касается грызунов, исследования генетических манипуляций с половыми хромосомами привели к эффекту для одного пола, который был полностью противоположен эффекту для другого пола. Например, нокаутировать определенного гена вызывали тревожные эффекты только у мужчин. С исследованиями на Д. Менланогастер было обнаружено, что сильное половое смещение экспрессии в мозге происходило даже после удаления гонад, что позволяет предположить, что половое смещение могло быть независимым от гормонального контроля в определенных аспектах.[9]
Наблюдение за генами с предвзятым отношением к полу может иметь клиническое значение для наблюдения за физиологией мозга и потенциально связанных (прямо или косвенно) неврологических расстройств. Примеры заболеваний с половым уклоном в развитии включают: болезнь Хантингтона, церебральная ишемия, и Болезнь Альцгеймера.[9]
Эпигенетика мозга
На многие функции мозга можно влиять на клеточном и молекулярном уровне вариациями и изменениями в экспрессии генов без изменения последовательности ДНК в организме. Это иначе известно как эпигенетический регулирование. Примеры эпигенетических механизмов включают: гистон модификации и Метилирование ДНК. Было обнаружено, что такие изменения сильно влияют на частоту заболеваний мозга, психических заболеваний и зависимости.[10] Было показано, что эпигенетический контроль вовлечен в высокий уровень пластичности на раннем этапе развития, тем самым определяя его важность для критический период организма.[11] Примеры того, как эпигенетические изменения могут повлиять на мозг человека, следующие:
- Более высокий уровень метилирования генов рРНК в гиппокамп головного мозга приводит к снижению выработки белков и, таким образом, ограниченная функция гиппокампа может привести к ухудшению обучения и памяти и, как следствие, к суицидным тенденциям.[12]
- В исследовании, сравнивающем генетические различия между здоровыми людьми и пациентами психиатрического профиля, было обнаружено 60 различных эпигенетических маркеров, связанных с передачей сигналов клеток мозга.[12]
- Факторы окружающей среды, такие как жестокое обращение с детьми, по-видимому, вызывают экспрессию эпигенетической метки на рецепторы глюкокортикоидов (связанные со стрессовыми реакциями), которых не было у жертв суицида.[12] Это пример пластичности, зависящей от опыта.
- Обогащение окружающей среды у людей связано с повышенным ацетилированием гистонов гиппокампа и, таким образом, с улучшением консолидации памяти (особенно пространственная память ).[11]
Молекулярные механизмы нейродегенеративных заболеваний
Эксайтотоксичность и рецепторы глутамата
Эксайтотоксичность это явление, при котором рецепторы глутамата активируются ненадлежащим образом. Это может быть вызвано длительной возбуждающей синаптической передачей, при которой высокий уровень глутамат нейромедиатор вызывает чрезмерную активацию постсинаптического нейрона, что может привести к гибели постсинаптического нейрона. После травмы головного мозга (например, от ишемия ), было обнаружено, что эксайтотоксичность является важной причиной повреждения нейронов. Это можно понять в случае, когда внезапная перфузия крови после снижения притока крови к мозгу может привести к чрезмерной синаптической активности, вызванной наличием повышенного глутамат и аспартат в период ишемии.[5][13]
Болезнь Альцгеймера
Болезнь Альцгеймера является наиболее распространенным нейродегенеративным заболеванием и наиболее частой формой слабоумие в пожилом возрасте. Расстройство характеризуется прогрессирующей потерей памяти и различных когнитивных функций. это выдвинутый что отложение амилоид-β пептид (40-42 аминокислотных остатка) в головном мозге является неотъемлемой частью заболеваемости болезнью Альцгеймера. Накопление предназначено для блокировки гиппокамп долгосрочное потенцирование. Также возможно, что рецептор для олигомеров амилоида-β может быть прион белок.[14]
болезнь Паркинсона
болезнь Паркинсона является вторым по распространенности нейродегенеративным заболеванием после болезни Альцгеймера. Это гипокинетическое движение базальный ганглий заболевание, вызванное потерей дофаминергических нейронов в черная субстанция человеческого мозга. Тормозной отток из базальных ганглиев, таким образом, не уменьшается, и поэтому верхние двигательные нейроны при посредничестве таламус, не активируются своевременно. Специфические симптомы включают ригидность, проблемы с осанкой, медленные движения и тремор. Блокировка Рецептор ГАМК ввод от средние шиповатые нейроны к ретикулатные клетки, вызывает подавление верхних мотонейронов, подобное подавлению, которое происходит при болезни Паркинсона.[5]
болезнь Хантингтона
болезнь Хантингтона это гиперкинетическое движение базальный ганглий заболевание, вызванное отсутствием нормального подавляющего воздействия со стороны средние шиповатые нейроны базальных ганглиев. Это приводит к эффектам, противоположным эффектам, связанным с болезнью Паркинсона, включая неправильную активацию верхние двигательные нейроны. Как и в случае ГАМКергических механизмов, наблюдаемых в отношении болезни Паркинсона, агонист ГАМК вводится в черная субстанция pars reticulata снижает ингибирование верхних мотонейронов, что приводит к непроизвольным баллистическим двигательным движениям, похожим на симптомы болезни Хантингтона.[5]
Рекомендации
- ^ а б c d е ж грамм час я j k л Лонгстафф, Алан; Ревест, Патрисия (1998). Молекулярная неврология. Наука о гирляндах. ISBN 978-1859962503.
- ^ "Что такое нейротрансмиттеры?". Архивировано из оригинал 25 сентября 2019 г.. Получено 1 ноября 2013.
- ^ Загадка, Дональд (1998). К. Элеганс II. Нью-Йорк: Лаборатория Прессы Колд-Спринг-Харбор. ISBN 978-0879695323.
- ^ Hodgkin, Allan L .; Эндрю Ф. Хаксли (1952). «Двойное влияние мембранного потенциала на проводимость натрия в гигантском аксоне Лолиго» (PDF). Журнал физиологии. 116 (4): 497–506. Дои:10.1113 / jphysiol.1952.sp004719. ЧВК 1392212. PMID 14946715.[постоянная мертвая ссылка ]
- ^ а б c d е ж грамм час Purves, Дейл (2012). Неврология (5-е изд.). Массачусетс, США: Sinauer Associates, Inc. стр. 80. ISBN 978-0-87893-695-3.
- ^ Камб, Александр; Линда Э. Айверсон; Марк А. Тануй (31 июля 1987 г.). «Молекулярная характеристика Shaker, гена дрозофилы, который кодирует калиевый канал». Клетка. 50 (3): 405–413. Дои:10.1016/0092-8674(87)90494-6. PMID 2440582.
- ^ Дэвис, Р. Уэйн; Брайан Дж. Моррис (1997). Молекулярная биология нейрона. Оксфорд, Великобритания: BIOS Scientific Publishers Ltd. ISBN 978-1859962404.
- ^ Dipolo, R .; К. Капуто; Ф. Безанилья (март 1983 г.). «Напряжение-зависимый кальциевый канал в аксоне кальмара». Proc Natl Acad Sci U S A. 80 (6): 1743–1745. Bibcode:1983PNAS ... 80.1743D. Дои:10.1073 / pnas.80.6.1743. ЧВК 393680. PMID 6300873.
- ^ а б Jazin, E .; Кэхилл, Л. (январь 2010 г.). «Половые различия в молекулярной нейробиологии: от дрозофилы до человека». Обзоры природы Неврология. 11 (1): 9–17. Дои:10.1038 / nrn2754. PMID 20019686.
- ^ «Эпигенетика и человеческий мозг». Центр генетической науки и обучения Университета Юты. Получено 10 ноября 2013.
- ^ а б Фаджиолини, Микела; Кэтрин Л. Дженсен; Фрэнсис А. Шампань (2009). «Эпигенетические влияния на развитие и пластичность мозга» (PDF). Текущее мнение в нейробиологии. 19 (2): 1–6. Дои:10.1016 / j.conb.2009.05.009. ЧВК 2745597. PMID 19545993. Архивировано из оригинал (PDF) 22 июня 2010 г.. Получено 14 ноября 2013.
- ^ а б c Цанкова, Надя; Рентал, Уильям; Кумар, Арвинд; Нестлер, Эрик Дж. (2007). «Эпигенетическая регуляция психических расстройств». Обзоры природы Неврология. 8 (5): 355–367. Дои:10.1038 / nrn2132. PMID 17453016.
- ^ Lau, A .; М. Тымянский (2010). «Глутаматные рецепторы, нейротоксичность и нейродегенерация». Арка Пфлюгерса. 460 (2): 525–542. Дои:10.1007 / s00424-010-0809-1. PMID 20229265.
- ^ Ларен, Юха; Дэвид А. Гимбел; Хокон Б. Найгаард; Джон В. Гилберт (февраль 2009 г.). «Клеточный прионный белок опосредует нарушение синаптической пластичности олигомерами амилоида-β». Природа. 457 (7233): 1128–1132. Bibcode:2009 Натур.457.1128Л. Дои:10.1038 / природа07761. ЧВК 2748841. PMID 19242475.

