Полисомия - Polysomy - Wikipedia

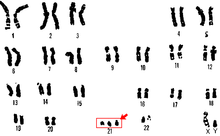
Полисомия это состояние, встречающееся у многих видов, включая грибы, растения, насекомых и млекопитающих, при котором организм есть по крайней мере еще один хромосома чем обычно, то есть может быть три или более копий хромосомы, а не две ожидаемые копии.[1] Наиболее эукариотический виды диплоид, то есть у них есть два набора хромосом, тогда как прокариоты находятся гаплоидный, содержащий по одной хромосоме в каждой клетке. Анеуплоиды обладают номерами хромосом, которые не являются точными кратными гаплоидному числу, а полисомия является типом анеуплоидии.[2] А кариотип набор хромосом в организме и суффикс -Так что мой используется для обозначения анеуплоидных кариотипов. Не следует путать с суффиксом -плоидность, имея в виду количество полных наборов хромосом.
Полисомия обычно вызывается: не дизъюнкция (отказ пары гомологичные хромосомы отделить) во время мейоз, но также может быть из-за транслокационная мутация (хромосомная аномалия, вызванная перестройкой частей между негомологичными хромосомами). Полисомия встречается при многих заболеваниях, в том числе Синдром Дауна у людей, у которых пораженные люди обладают тремя копиями (трисомия ) из хромосома 21.[3]
Полисомное наследование возникает во время мейоза, когда хиазмы образуются между более чем двумя гомологичными партнерами, производя многовалентный хромосомы.[1] Автополиплоиды могут демонстрировать полисомное наследование всех групп сцепления, и их фертильность может снижаться из-за несбалансированного числа хромосом в гаметах.[1] В тетрасомное наследование, четыре копии группы связей вместо двух (тетрасомия ) разбираем по два.[1]
Типы
Типы полисомии классифицируются на основе количества дополнительных хромосом в каждом наборе, отмеченного как диплоид (2n) с дополнительной хромосомой разных номеров. Например, полисомия с тремя хромосомами называется трисомия, полисомия с четырьмя хромосомами называется тетрасомия, так далее.:[4]
| Количество хромосом | Имя | Описание | Примеры |
|---|---|---|---|
| 3 | трисомия | Три копии хромосомы, 2n + 1 | Синдром Дауна (Трисомия 21), Синдром Эдвардса (Трисомия 18), или Синдром Патау (Трисомия 13)[3] |
| 4 | тетрасомия | Четыре копии хромосомы, 2n + 2 | Тетрасомия 9р, Тетрасомия 18р[5] |
| 5 | пентасомия | Пять копий хромосомы, 2n + 3 | Пентасомия X (XXXXX или 49, XXXXX)[6] |
| 6 | гексасомия | Шесть копий хромосомы, 2n + 4 | Мозаика Гексасомия 21 или частичная гексасомия 15[7] |
| 7 | гептасомия | Семь копий хромосомы, 2n + 5 | Гептасомия 21 при остром миелоиде лейкемия[8] |
| 8 | октосомия | Восемь копий хромосомы, 2n + 6 | Октосомия в осетровые рыбы (Acipenser baerii, A. persicus, A. sinensis, и A. transmontanus)[9] |
| 9 | наносомия | Девять копий хромосомы, 2n + 7 | Наносомия при врожденной полидистрофии скелета[10] |
| 10 | декасомия | Десять копий хромосомы, 2n + 8 | деказомия 8 при гистолитическом карцинома[11] |
У млекопитающих
У собак

Полисомия играет важную роль у собак лейкемия, гемангиоперицитомы и щитовидная железа опухоли.[12] Аномалии хромосома 13 наблюдались у собак остеоид хондросаркома и лимфосаркома.[13] Трисомия 13 у собак с лимфосаркома показать большую продолжительность первого ремиссия (лекарство) и выживаемость, хорошо поддающаяся лечению химиотерапевтические агенты.[14] Полисомия 13 хромосомы (Polysomy 13) играет важную роль в развитии рака простаты и часто вызывается центрическими слияниями.[12] Поскольку хромосома 13 собаки похожа на хромосому 8q человека, исследования могут дать представление о лечении рак простаты в людях.[15]Полисомия по 1, 2, 4, 5 и 25 хромосомам также часто встречается в опухолях собак.[16] Хромосома 1 может содержать ген ответственный за опухоль развитие и привести к изменениям в кариотип, в том числе слияние центромера, или центрические сплавы.[16] Анеуплоидия из-за нерасхождение это общая черта в опухолевые клетки.[17]
В людях
Половые хромосомы
Некоторые из наиболее частых генетические нарушения являются аномалиями половых хромосом, но полисомии возникают редко.[18] 49, XXXXY хромосомная полисомия встречается у каждого 85 000 новорожденных мальчиков.[19] Частота других X-полисомий (48, XXXX, 48, XXXY, 48, XXYY ) реже 49, XXXXY.[20] Полисомия Y (47, XYY; 48, XYYY; 48, XXYY; 49, XXYYY) встречается у 1 из 975 мужчин и может вызывать психические, социальные и соматический аномалии.[21] Полисомия X может вызвать задержку умственного развития и развития и физический порок. Синдром Клайнфельтера представляет собой пример полисомии X человека с кариотипом 47, XXY. Полисомы Х-хромосомы могут быть унаследованы от одного материнский (49, X-полисомии) или отцовский (48, X-полисомии) X-хромосома.[18] Полисомия половых хромосом вызвана последовательными нерасхождениями в мейоз I и II.[6]



Хромосома 7
В плоскоклеточная карцинома, белок из рецептор эпидермального фактора роста (EGFR) ген часто чрезмерно выраженный в сочетании с полисомией хромосома 7, поэтому хромосома 7 может использоваться для прогнозирования наличия EGFR при плоскоклеточной карциноме.[22] В колоректальный рак, Экспрессия EGFR снижается при полисомии 7, что упрощает обнаружение полисомии 7 и может использоваться для предотвращения ненужного лечения рака у пациентов.[23]
Хромосома 8

Тетрасомия и гексасомия 8 встречаются редко по сравнению с трисомией 8, которая является наиболее частой кариотипической находкой при острый миелоидный лейкоз (AML) и миелодиспластические синдромы (МДС).[24] ОМЛ, МДС или миелопролиферативное расстройство (МРЗ) с высокой частотой вторичных заболеваний и шестимесячной выживаемостью связаны с полисомией 8 синдром.[25]
Хромосома 17
Избыточное выражение HER2 / neu ген на хромосома 17 и некоторый тип полисомии был зарегистрирован в 8-68% случаев карциномы груди.[26] Если генHER-2 / neu не усилить в случае полисомии белки могут быть сверхэкспрессированы и могут привести к тумерогенез.[27] Полисомия 17 может усложнить интерпретацию результатов тестирования HER2 у онкологических больных. Полисомия хромосомы 17 может отсутствовать, когда центромера усиливается, поэтому позже было обнаружено, что полисомия 17 встречается редко. Это было обнаружено с помощью матричная сравнительная геномная гибридизация, основанная на ДНК альтернатива для клинической оценки HER2 число копий гена.[28]
Трисомия 21
Трисомия 21 - это форма синдрома Дауна, которая возникает при наличии дополнительной копии хромосомы 21. Результатом является генетическое состояние, при котором человек имеет 47 хромосом вместо обычных 46. Во время развития яйцеклетки или сперматозоидов 21-я хромосома не разделяется ни в одном из них. развитие яйцеклетки или сперматозоидов. Конечным результатом является клетка с 24 хромосомами. Эта дополнительная хромосома может вызвать проблемы с развитием тела и мозга.[29]
Тетрасомия 9р
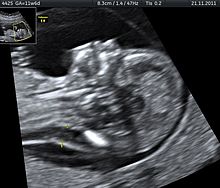
Тетрасомия 9p - это редкое заболевание, при котором у людей есть небольшая дополнительная хромосома, которая содержит две копии части хромосомы 9, а также две нормальные хромосомы 9. Это состояние можно диагностировать, анализируя образец крови человека, так как 9p обнаруживается в крови в высоких концентрациях. Ультразвук - еще один инструмент, который можно использовать для выявления тетрасомии 9р у младенцев до рождения. Пренатальное ультразвуковое исследование может выявить несколько общих характеристик, в том числе: ограничение роста, вентрикуломегалию, расщелину губы или неба и почечные аномалии.[30]
Тетрасомия 18р
Тетрасомия 18p возникает, когда короткое плечо 18-й хромосомы появляется четыре раза, а не дважды, в клетках тела. Это заболевание считается редким и обычно не передается по наследству. Механизм образования 18p, по-видимому, является результатом двух независимых событий: центромерного неправильного деления и нерасхождения.[31] Характерные черты тетрасомии 18p включают, помимо прочего: задержку роста, сколиоз, аномальную МРТ головного мозга, задержку развития и косоглазие.[31]
У насекомых
Полисомия зародышевой линии у кузнечика

Линия зародыша клетки развиваются в яйца и сперма и связанный унаследованный материал может быть передан будущим поколениям.[32] Как показано в связанной кариотип изображение, хромосомы 1–22 сгруппированы A – G. Популяция кузнечиков мужского пола (Chorthippus binotatus ) от Сьерра-Невада (Испания) полисомны мозаика (происходящие из клеток двух генетически разных типов), обладающие дополнительной хромосомой группы E (хромосомы 16, 17 и 18) в своих яичках.[33] Родители с полисомией не прошли экзамен E хромосома ненормальность любого из потомство, так что это не то, что передается в будущее поколения.[33] Самцы кузнечиков (Atractomorpha similis ) из Австралии везут от одной до десяти дополнительных копий хромосома A9, причем один из них является наиболее распространенным в естественных популяциях.[34] Большинство полисомных самцов производят нормальные сперма. Однако полисомия может передаваться как от родителей-мужчин, так и от женщин через нерасхождение.[34]
Гетерохроматическая полисомия у сверчка
Гетерохроматин содержит небольшое количество гены и плотно окрашивающие узелки внутри или вдоль хромосомы.[35] В моль сверчок количество хромосом колеблется от 19 до 23 хромосом в зависимости от части мира, в которой они расположены, в том числе Иерусалим, Палестина, и Европа.[36] Гетерохромная полисомия наблюдается у кротовых сверчков с 23 хромосомами и может быть фактором, способствующим их развитию. эволюция, особенно в разновидность Гриллотальпа гриллотальпа, а также различные жилые помещения и системы спаривания.[36][37]
Полисомия Х-хромосомы у плодовой мушки
В плодовой мушке, Дрозофила, один Х хромосома у мужчин это почти то же самое, что две Х-хромосомы у женщин с точки зрения продуцируемого генного продукта.[38] Несмотря на это, метафамы, или самки, имеющие три Х-хромосомы, вряд ли выживут.[38] Возможно, что дополнительная Х-хромосома снижает экспрессию генов и может объяснить, почему метафамки редко выживают при этой полисомии Х-хромосомы.[38]
В растениях
При обнаружении полисомии у растений происходит кариотипическая перестройка отдельных хромосом. Механизм этого типа перегруппировки - «неразрывность, неправильная сегрегация в диплоидах или полиплоидах; неправильная сегрегация от мультивалентов в гетерозиготах с обменом».[39] Случаи полисомии были выявлены у многих видов растений, в том числе:

- Орнитогалум зонтичный Л. (Лилии )[40]
- Хвойные[41]
- Сорт R570[42]
- Brassica[43]
- Евфразия[44]
- Paspalum dilatatum[45]
В грибах

Несколько грибы были исследованы до сих пор, возможно, из-за низкого количества хромосом у грибов, как определено гель-электрофорез в импульсном поле.[46] Полисомия хромосомы 13 наблюдалась в Флор штаммы дрожжи разновидность Saccharomyces cerevisiae. Хромосома 13 содержит локусы, в частности локусы ADH2 и ADH3, которые кодируют изоферменты из алкогольдегидрогеназа. Эти изоферменты играют первостепенную роль в биологическом старении вин посредством окислительного использования этанола.[47] Полисомия хромосомы 13 усиливается, когда происходит нарушение гена дрожжевой РНК1 последовательностями LEU2.[48]
Диагностические инструменты

Флуоресцентная гибридизация in situ
Флуоресцентная гибридизация in situ (РЫБА) - это цитогенетический метод, который оказался полезным при диагностике пациентов с полисомией.[49] Обычная цитогенетика и флуоресцентная гибридизация in situ (FISH) использовались для обнаружения различных полисомий, включая наиболее распространенные аутосомии (трисомия 13, 18, 21), а также полисомии X и Y.[50] Тестирование на хромосомные анеуплоидия с Флуоресцентная гибридизация in situ может повысить чувствительность цитологического исследования и повысить точность диагностики рака.[51] В Рак шейки матки, TERC, флуоресцентный тест гибридизации in situ, выявляет амплификацию человеческого теломераза РНК компонент (TERC) гена и / или полисомия хромосома 3.[52]
Спектральное кариотипирование
Спектральное кариотипирование (SKY) рассматривает весь кариотип с использованием флуоресцентных меток и присвоения определенного цвета каждой хромосоме. SKY обычно выполняется после того, как обычные цитогенные методы уже обнаружили аномальную хромосому. Затем используется FISH-анализ для подтверждения идентичности хромосомы.[50]
Giemsa banding (кариотипирование с G-полосой)
Кариотипы обычно анализируются с использованием полос Гимзы (G-полосное кариотипирование) ). Каждая хромосома показывает уникальные светлые и темные полосы после того, как они денатурированы трипсин и полисомы можно обнаружить путем подсчета окрашенных хромосом. Необходимо проанализировать несколько клеток, чтобы обнаружить мозаика.[53]
Анализ микрочипов
Субмикроскопические хромосомные аномалии, которые слишком малы, чтобы их можно было обнаружить другими способами кариотипирования, могут быть идентифицированы хромосомным микрочип анализ.[54] Существует несколько существующих методов микроматрицы, которые можно использовать на этапе пренатальной диагностики, и они включают массивы SNP и сравнительная геномная гибридизация (CGH).[55] CGH - это диагностический инструмент на основе ДНК, который использовался для обнаружения полисомии 17 при раке груди.[27] CGH был впервые использован в 1992 году Каллионеми в Калифорнийском университете в Сан-Франциско.[56] При использовании вместе с УЗИ результаты, микроматричный анализ может быть полезен в клинической диагностике хромосомных аномалий.
Пренатальные диагностические тесты
Пренатальные и другие диагностические методы, такие как иммуноцитохимия (ICC) оценка обычно сопровождается FISH или Полимеразной цепной реакции для выявления хромосомных анеуплоидий. Забор материнской крови на фетальные клетки, часто используемый для определения риска трисомии 18 или 21, представляет меньший риск по сравнению с амниоцентезом и отбор проб ворсинок хориона (CVS).[57] При взятии проб ворсинок хориона используется плацентарная ткань для получения информации о статусе хромосом плода, и этот метод используется с 1970-х годов.[58] Помимо CVS, амниоцентез может быть использован для определения кариотипа плода путем исследования фетальных клеток в околоплодных водах. Впервые он был исполнен в 1952 году и стал стандартной практикой в 1970-х годах.[59] Вероятность рождения ребенка с полисомией увеличивается с возрастом матери, поэтому беременные женщины старше 35 лет проходят тестирование.[60]
Анализ полиморфизма длины рестрикционного фрагмента (ПДРФ)
ПДРФ можно использовать для определения происхождения и механизма, связанного с полисомией X и другими хромосомными гетероморфизмами или хромосомами, которые различаются по размеру, форме или свойствам окрашивания. Рестрикционные ферменты разрезают ДНК в определенном месте, и оставшиеся фрагменты ДНК называются полиморфизм длины рестрикционного фрагмента, или RFLP.[61] RFLP также помогает в идентификации Хантингтин (HTT) ген, который является предиктором аутосомного расстройства у взрослых, называемого болезнь Хантингтона (HD). Мутации в хромосоме 4 можно визуализировать, когда RFLP используется в сочетании с Саузерн-блот анализ.[62]
Проточной цитометрии
Культуры лимфоцитов человека можно анализировать с помощью проточной цитометрии для оценки хромосомных аномалий, таких как полиплоидия, гиподиплоидия и гипердиплоидия.[63] Проточные цитометры способны анализировать тысячи клеток каждую секунду и обычно используются для выделения определенных популяций клеток.
Смотрите также
Рекомендации
- ^ а б c d Rieger, R .; Michaelis, A .; Грин, М. (1968). Словарь генетики и цитогенетики: классическая и молекулярная. Нью-Йорк: Springer-Verlag.
- ^ Уайт, Майкл Джеймс Денхэм (1937). Хромосомы. Лондон: Methuen & Co., Ltd., стр. 55.
- ^ а б Гриффитс, AJF; Miller JH; Suzuki DT; и другие. (2000). Введение в генетический анализ: анеуплоидия (7-е изд.). Нью-Йорк: W.H. Freeman & Co. Получено 24 марта 2014.[страница нужна ]
- ^ Энтони Дж. Ф. Гриффитс (1999). Введение в генетический анализ (7. изд., 1. печат. Изд.). Нью-Йорк: Фриман. ISBN 978-0-7167-3520-5.[страница нужна ]
- ^ Кальвиери Ф., Тоцци С., Бенинкори С. и др. (Август 1988 г.). «Частичная тетрасомия 9 у младенца с клиническими и рентгенологическими доказательствами множественных вывихов суставов». Европейский журнал педиатрии. 147 (6): 645–8. Дои:10.1007 / bf00442483. PMID 3181206.
- ^ а б Челик А., Эраслан С., Гекгез Н. и др. (Июнь 1997 г.). «Идентификация родительского происхождения полисомии в двух 49, XXXXY случаях». Клиническая генетика. 51 (6): 426–9. Дои:10.1111 / j.1399-0004.1997.tb02504.x. PMID 9237509.
- ^ Хуан Б., Бартли Дж. (Сентябрь 2003 г.). «Частичная гексасомия 15 хромосомы». Американский журнал медицинской генетики, часть A. 121A (3): 277–80. Дои:10.1002 / ajmg.a.20182. PMID 12923871.
- ^ Фабариус А., Ли Р., Ерганиан Г., Хельманн Р., Дюсберг П. (январь 2008 г.). «Специфические клоны спонтанно развивающихся кариотипов порождают индивидуальность рака». Генетика и цитогенетика рака. 180 (2): 89–99. Дои:10.1016 / j.cancergencyto.2007.10.006. PMID 18206533.
- ^ Людвиг А., Бельфиоре Н.М., Питра С., Свирский В., Йеннекенс I (июль 2001 г.). «События удвоения генома и функциональное снижение уровней плоидности у осетровых (Acipenser, Huso и Scaphirhynchus)». Генетика. 158 (3): 1203–15. ЧВК 1461728. PMID 11454768.
- ^ Шахтер М (1949). «[Наносомия при врожденной полидистрофии скелета - корреляция с материнской гестационной недостаточностью]». Афина (на итальянском). 15 (6): 141–3. PMID 15409638.
- ^ Мори М., Мацусита А., Такиучи Ю. и др. (Июль 2010 г.). «Гистиоцитарная саркома и лежащий в основе хронический миеломоноцитарный лейкоз: предложение по классификации развития гистиоцитарной саркомы». Международный журнал гематологии. 92 (1): 168–73. Дои:10.1007 / s12185-010-0603-z. PMID 20535595.
- ^ а б Рейманн-Берг Н., Вилленброк С., Муруа Эскобар Н. и др. (2011). «Два новых случая полисомии 13 при раке простаты у собак». Цитогенетические и геномные исследования. 132 (1–2): 16–21. Дои:10.1159/000317077. PMID 20668368.
- ^ Винклер С., Муруа Эскобар Х, Рейманн-Берг Н., Буллердик Дж., Нольте I (2005). «Цитогенетические исследования четырех лимфом собак». Противораковые исследования. 25 (6B): 3995–8. PMID 16309190.
- ^ Hahn, KA; Richardson, RC; Хан, EA; Chrisman, CL (сентябрь 1994 г.). «Диагностическое и прогностическое значение хромосомных аберраций, выявленных у 61 собаки с лимфосаркомой». Ветеринарная патология. 31 (5): 528–40. Дои:10.1177/030098589403100504. PMID 7801430.
- ^ Ян Ф., Графодацкий А.С., О'Брайен П.С. и др. (2000). «Картина взаимных хромосом освещает историю эволюции генома домашней кошки, собаки и человека». Хромосомные исследования. 8 (5): 393–404. Дои:10.1023 / А: 1009210803123. PMID 10997780.
- ^ а б Винклер С., Рейманн-Берг Н., Муруа Эскобар Н. и др. (Сентябрь 2006 г.). «Полисомия 13 при раке простаты собаки, подчеркивающая ее значение в развитии рака простаты». Генетика и цитогенетика рака. 169 (2): 154–8. Дои:10.1016 / j.cancergencyto.2006.03.015. PMID 16938574.
- ^ Винклер С., Муруа Эскобар Н., Эберле Н., Рейман-Берг Н., Нолте И., Буллердик Дж. (2005). «Создание клеточной линии, полученной из карциномы простаты собаки с сильно перестроенным кариотипом». Журнал наследственности. 96 (7): 782–5. Дои:10.1093 / jhered / esi085. PMID 15994418.
- ^ а б Leal CA, Belmont JW, Nachtman R, Cantu JM, Medina C (октябрь 1994 г.). «Родительское происхождение дополнительных хромосом при полисомии X». Генетика человека. 94 (4): 423–6. Дои:10.1007 / bf00201605. PMID 7927341.
- ^ Kleczkowska A, Fryns JP, Van den Berghe H (сентябрь 1988 г.). "Полисомия Х-хромосомы у мужчин. Опыт Левена 1966–1987". Генетика человека. 80 (1): 16–22. Дои:10.1007 / BF00451449. PMID 3417301.
- ^ де Груши Дж., Турло С. (октябрь 1986 г.). «Микроцитогенетика 1984». Experientia. 42 (10): 1090–7. Дои:10.1007 / BF01941282. PMID 3533601.
- ^ Элиас, Шерман; Шульман, Ли П. (2009). «Мужчины с полисомией Y и женщины с полисомией X». Глобальная библиотека женской медицины. Дои:10.3843 / GLOWM.10358. Получено 21 апреля 2014.
- ^ Couceiro P, Sousa V, Alarcão A, Silva M, Carvalho L (2010). «Полисомия и амплификация хромосомы 7, определенные для гена EGFR в плоскоклеточной карциноме легкого вместе с экзонами 19 и 21 дикого типа». Revista Portuguesa de Pneumologia. 16 (3): 453–62. Дои:10.1016 / с2173-5115 (10) 70049-х. PMID 20635059.
- ^ Ли Й.Х., Ван Ф., Шен Л. и др. (Январь 2011 г.). «Паттерн гибридизации in situ флуоресценции EGFR дисомии хромосомы 7 позволяет прогнозировать устойчивость к цетуксимабу у пациентов с метастатическим колоректальным раком дикого типа KRAS». Клинические исследования рака. 17 (2): 382–90. Дои:10.1158 / 1078-0432.CCR-10-0208. PMID 20884623.
- ^ Паулссон К., Йоханссон Б. (февраль 2007 г.). «Трисомия 8 как единственная хромосомная аберрация при остром миелоидном лейкозе и миелодиспластических синдромах». Патология-биология. 55 (1): 37–48. Дои:10.1016 / j.patbio.2006.04.007. PMID 16697122.
- ^ Бейер В., Мюлематтер Д., Парлье В. и др. (Июль 2005 г.). «Полисомия 8 определяет клинико-цитогенетическую сущность, представляющую подмножество миелоидных гематологических злокачественных новообразований, связанных с плохим прогнозом: отчет о когорте из 12 пациентов и обзор 105 опубликованных случаев». Генетика и цитогенетика рака. 160 (2): 97–119. Дои:10.1016 / j.cancergencyto.2004.12.003. PMID 15993266.
- ^ Скяовон Б.Н.; Vassallo J; Роча Р.М. (2011). «Является ли полисомия 17 важным явлением для прогнозирования лечения трастузумабом при раке груди?». Прикладные исследования рака. 31 (4): 138–142. Получено 21 апреля 2014.
- ^ а б Ян, Лю; и другие. (15 декабря 2013 г.). «Влияние полисомии 17 на тестирование HER2 у пациентов с инвазивным раком груди». Международный журнал клинической и экспериментальной патологии. 7 (1): 163–173. ЧВК 3885470. PMID 24427336.
- ^ Yeh IT, Martin MA, Robetorye RS и др. (Сентябрь 2009 г.). «Клиническая валидация массивного теста CGH на статус HER2 при раке груди показывает, что полисомия 17 - редкое явление». Современная патология. 22 (9): 1169–75. Дои:10.1038 / modpathol.2009.78. PMID 19448591.
- ^ «Синдром Дауна». Медлайн Плюс. Получено 22 апреля 2014.
- ^ Дхандха, S; Хогге, Вашингтон; Surti, U; McPherson, E (15 декабря 2002 г.). «Три случая тетрасомии 9р». Американский журнал медицинской генетики. 113 (4): 375–80. Дои:10.1002 / ajmg.b.10826. PMID 12457411.
- ^ а б Себольд К., Рёдер Э, Циммерман М., Суало Б., Херд П., Картер Э, Шатц М., Уайт В. А., Перри Б., Райнкер К., О'Доннелл Л., Ланкастер Дж., Ли Дж., Хаси М., Хилл А., Панкрац Л., Hale DE, Cody JD (сентябрь 2010 г.). «Тетрасомия 18p: отчет о молекулярных и клинических данных 43 человек». Американский журнал медицинской генетики, часть A. 152A (9): 2164–72. Дои:10.1002 / ajmg.a.33597. PMID 20803640.
- ^ Мерриам-Вебстер. "Ростковая линия". Merriam-Webster, Incorporated. Получено 7 апреля 2014.
- ^ а б Talavera, M .; Лопес-Леон, M.D .; Cabrero, J .; Камачо, Дж. П. М. (июнь 1990 г.). «Полисомия мужской зародышевой линии у кузнечика Chorthippus binotatus: лишние хромосомы не передаются ». Геном. 33 (3): 384–388. Дои:10.1139 / g90-058.
- ^ а б Петерс, Г. Б. (январь 1981 г.). "Полисомия зародышевой линии у кузнечика Atractomorpha similis". Хромосома. 81 (4): 593–617. Дои:10.1007 / BF00285852.
- ^ Мерриам-Вебстер. «Гетерохроматин». Merriam-Webster, Incorporated. Получено 7 апреля 2014.
- ^ а б Кушнир, Тувиах (февраль 1952 г.). «Гетерохроматическая полисомия у Gryllotalpa gryllotalpa L». Журнал генетики. 50 (3): 361–383. Дои:10.1007 / BF02986834.
- ^ Нево Е., Бейлс А., Король А.Б., Робин Ю.И., Павличек Т., Гамильтон В. (апрель 2000 г.). «Необычайная мультилокусная генетическая организация слепушонков, Gryllotalpidae». Эволюция. 54 (2): 586–605. Дои:10.1111 / j.0014-3820.2000.tb00061.x. PMID 10937235.
- ^ а б c Бирчлер Дж. А., Хиберт Дж. К., Крицман М. (август 1989 г.). «Экспрессия генов у взрослых метафамок Drosophila melanogaster». Генетика. 122 (4): 869–79. ЧВК 1203761. PMID 2503426.
- ^ Gupta, P.K .; Т. Цучия. (1991). Хромосомная инженерия растений: генетика, селекция, эволюция. Амстердам: Эсельвьер.
- ^ Руис Рехон, C .; Р. Лозано; М. Руис Рейон (1987). «Полисомия и дополнительные хромосомы у Ornithogalum umbellatum L. (Liliaceae)». Геном. 29 (1): 19–25. Дои:10.1139 / g87-004.
- ^ Ахуджа, MR; Нил ДБ (2002). «Происхождение полиплоидии в прибрежной секвойи (Sequoia sempervirens (D. DON) ENDL.) И связь прибрежной секвойи с другими родами Taxodiaceae». Silvae Genetica. 51: 2–3.
- ^ D'Hont, A; Гривет, L; Feldmann, P; Рао, S; Бердинг, Н; Glaszmann, JC (7 марта 1996 г.). «Характеристика двойной структуры генома современных сортов сахарного тростника (Saccharum spp.) Методом молекулярной цитогенетики». Молекулярная и общая генетика: MGG. 250 (4): 405–13. Дои:10.1007 / bf02174028. PMID 8602157.
- ^ Mun, JH; и другие. (2010). «Последовательность и структура хромосомы A3 Brassica rapa». Геномная биология. 11 (9): R94. Дои:10.1186 / gb-2010-11-9-r94. ЧВК 2965386. PMID 20875114.
- ^ Barker, W.R .; М. Кин; Э. Витек (1988). «Число хромосом в Австралийской Евфразии (Scrophulariaceae)». Систематика и эволюция растений. 158 (2–4): 161–164. Дои:10.1007 / bf00936342.
- ^ Zhu, J.M .; LJ Davies; Д Коэн; RE Роуленд (1994). «Вариация числа хромосом в потомстве сеянца сомаклона Paspalum dilatatum». Клеточные исследования. 4: 65–78. Дои:10.1038 / кр.1994.7.
- ^ ВЕЧЕРА. Кирк; и другие. (2008). Словарь грибов Эйнсворта и Бисби (10-е изд.). Уоллингфорд, Оксон, Великобритания: CABI. ISBN 978-0-85199-826-8.
- ^ Арора, изд. Дилип К. (2004). Справочник по грибковой биотехнологии (2-е изд., Перераб. И доп. Ред.). Нью-Йорк, штат Нью-Йорк [u.a.]: Марсель Деккер. ISBN 978-0-8247-4018-4.CS1 maint: дополнительный текст: список авторов (связь)
- ^ Аткинсон, Н.С.; Хоппер, AK (июль 1987 г.). «Хромосомная специфичность стимулирования полисомии за счет нарушений гена РНК1 Saccharomyces cerevisiae». Генетика. 116 (3): 371–5. ЧВК 1203148. PMID 3301528.
- ^ Bangarulingam, SY; Bjornsson, E; Эндерс, Ф; Барр Фритчер, EG; Горс, G; Холлинг, KC; Линдор, KD (январь 2010 г.). «Долгосрочные результаты положительных флуоресцентных тестов гибридизации in situ при первичном склерозирующем холангите». Гепатология. 51 (1): 174–80. Дои:10.1002 / hep.23277. PMID 19877179.
- ^ а б Биннс, Виктория; Нэнси Хсу (20 июня 2001 г.). «Пренатальная диагностика». Энциклопедия наук о жизни. Джон Уайли и сыновья. Дои:10.1038 / npg.els.0002291. ISBN 978-0470016176.
- ^ Gonda, TA; Глик, депутат; Сетхи, А; Poneros, JM; Пальмас, Вт; Икбал, S; Гонсалес, S; Nandula, SV; Эмонд, JC; Коричневый, RS; Мурти, В.В.; Стивенс, PD (январь 2012 г.). «Полисомия и делеция p16 с помощью флуоресцентной гибридизации in situ в диагностике неопределенных стриктур желчных путей». Эндоскопия желудочно-кишечного тракта. 75 (1): 74–9. Дои:10.1016 / j.gie.2011.08.022. PMID 22100297.
- ^ Heselmeyer-Haddad, K; Зоммерфельд, К; Белый, NM; Chaudhri, N; Моррисон, LE; Palanisamy, N; Ван, З.Ы .; Auer, G; Стейнберг, Вт; Рид, Т. (апрель 2005 г.). «Геномная амплификация гена теломеразы человека (TERC) в мазках Папаниколау позволяет прогнозировать развитие рака шейки матки». Американский журнал патологии. 166 (4): 1229–38. Дои:10.1016 / S0002-9440 (10) 62341-3. ЧВК 1602397. PMID 15793301.
- ^ Юнис Дж. Дж., Санчес О. (1973). «G-бэндинг и структура хромосом». Хромосома. 44 (1): 15–23. Дои:10.1007 / BF00372570. PMID 4130183.
- ^ «Использование анализа хромосомных микрочипов в пренатальной диагностике». Американский колледж акушеров и гинекологов. Получено 5 мая 2014.
- ^ Шаффер, LG; Rosenfeld, JA; Дабель, депутат; Коппингер, Дж; Бандхольц, AM; Эллисон, JW; Равнан, JB; Torchia, BS; Баллиф, Британская Колумбия; Фишер, AJ (октябрь 2012 г.). «Степень обнаружения клинически значимых геномных изменений с помощью микроматричного анализа для конкретных аномалий, обнаруженных с помощью ультразвука». Пренатальная диагностика. 32 (10): 986–95. Дои:10.1002 / pd.3943. ЧВК 3509216. PMID 22847778.
- ^ Крокер, изд. Дэвид Бернетт; Джон (2005). Наука о лабораторной диагностике (2-е изд.). Чичестер [u.a.]: Уайли. п. 523. ISBN 978-0470859124.CS1 maint: дополнительный текст: список авторов (связь)
- ^ Калабрезе, G; Балди, М; Фантазия, D; Сесса, MT; Калантар, М; Holzhauer, C; Alunni-Fabbroni, M; Палка, Г; Ситар, Джи (август 2012 г.). «Обнаружение хромосомных анеуплоидий в фетальных клетках, выделенных из материнской крови, с использованием однохромосомного двухзондового FISH-анализа». Клиническая генетика. 82 (2): 131–9. Дои:10.1111 / j.1399-0004.2011.01775.x. PMID 21895636.
- ^ Росс, Хелен Л .; Элиас, Шерман (1997). «Скрининг материнской сыворотки на генетические заболевания плода». Клиники акушерства и гинекологии Северной Америки. 24 (1): 33–47. Дои:10.1016 / S0889-8545 (05) 70288-6. PMID 9086517.
- ^ Шерман, Элиас (2013). «Амниоцентез». Генетические нарушения и плод: диагностика, профилактика и лечение. Springer. С. 31–52. Дои:10.1007/978-1-4684-5155-9_2. ISBN 978-1-4684-5157-3.
- ^ Симпсон, Джо Ли (1990). «Частота и сроки невынашивания беременности: актуальность для оценки безопасности ранней пренатальной диагностики». Американский журнал медицинской генетики. 35 (2): 165–173. Дои:10.1002 / ajmg.1320350205. PMID 2178414.
- ^ Дэн, Хань-Сян; Абэ, Кёко; Кондо, Икуко; Цукахара, Масато; Инагаки, Харуйо; Хамада, Исаму; Фукусима, Йошимицу; Ниикава, Норио (1991). «Родительское происхождение и механизм образования полисомии X: случай XXXXX и четыре случая XXXXY определены с помощью RFLP». Генетика человека. 86 (6): 541–4. Дои:10.1007 / BF00201538. PMID 1673956.
- ^ Чиал, Хайди. «Болезнь Хантингтона: открытие гена Хантингтина». Природное образование. Получено 5 мая 2014.
- ^ Muehlbauer PA, Schuler MJ (август 2005 г.). «Обнаружение числовых хромосомных аберраций с помощью проточной цитометрии: новый процесс для идентификации аневгенных агентов». Мутационные исследования. 585 (1–2): 156–69. Дои:10.1016 / j.mrgentox.2005.05.002. PMID 15996509.
дальнейшее чтение
- Гарднер, Р. Дж. М., Грант Р. Сазерленд и Лиза Г. Шаффер. Хромосомные аномалии и генетическое консультирование. 4-е изд. Оксфорд: Oxford UP, 2012.
- Миллер, Орландо Дж. И Ева Терман. Хромосомы человека. Нью-Йорк: Спрингер, 2001.
- Шмид М. и Индраджит Нанда. Хромосомы сегодня, том 14. Дордрехт: Kluwer Academic, 2004.
- Нуссбаум, Роберт Л., Родерик Р. Макиннес, Хантингтон Ф. Уиллард, Ада Хамош и Маргарет У. Томпсон. Томпсон и Томпсон Генетика в медицине. 7-е изд. Филадельфия: Сондерс / Эльзевир, 2007.
