Комплекс, стимулирующий анафазу - Anaphase-promoting complex - Wikipedia

Комплекс, стимулирующий анафазу (также называемый циклосома или же APC / C) является E3 убиквитинлигаза это отмечает цель клеточный цикл белки для деградации 26S протеасома. APC / C представляет собой большой комплекс из 11–13 субъединиц. белки, включая субъединицу cullin (Apc2) и RING (Apc11), очень похожую на SCF. Другие части APC / C все еще имеют неизвестные функции, но очень консервативны.[1]
Это было открытие APC / C (и SCF ) и их ключевую роль в воспроизводстве эукариотических клеток, которая раз и навсегда установила важность убиквитин -опосредованный протеолиз в биологии эукариотических клеток. Когда-то воспринималась как система, исключительно участвующая в удалении поврежденного белка из клетки, убиквитинировании и последующей деградации белка под действием протеасома теперь воспринимается как универсальный механизм регулирования преобразование сигнала чья важность приближается к важности белка фосфорилирование.
В 2014 году APC / C был нанесен на карту в 3D с разрешением менее нанометр, что также выявило его вторичную структуру. Исследователи утверждали, что это открытие может изменить понимание рак и выявить новые сайты связывания для будущих противораковых препаратов.[2][3]
Функция
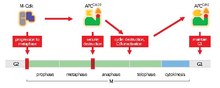
Основная функция APC / C - запускать переход от метафаза к анафаза путем маркировки определенных белков для деградации. Тремя основными целями деградации APC / C являются: Securin и S и M циклины. Securin выпускает отделить (протеаза) после разложения. Сепараза вызывает расщепление когезин, белковый комплекс, который связывает сестру хроматиды вместе. В течение метафаза сестринские хроматиды связаны интактными когезиновыми комплексами. Когда секурин подвергается убиквитинированию с помощью APC / C и высвобождает сепаразу, которая разрушает когезин, сестринские хроматиды становятся свободными перемещаться к противоположным полюсам для анафазы. APC / C также нацелен на митотические циклины для деградации, что приводит к инактивации M-CDK (митотический циклин-зависимая киназа ) комплексов, способствующих выходу из митоз и цитокинез[1]
В отличие от SCF, субъединицы активатора контролируют APC / C. Cdc20 и Cdh1 являются двумя активаторами, имеющими особое значение для клеточного цикла. Эти белки нацелены на APC / C на определенные наборы субстратов в разное время клеточного цикла, тем самым продвигая его вперед. APC / C также играет важную роль в поддержании метаболизма хроматина, особенно в G1 и G0, и играет ключевую роль в фосфорилировании H3 через разрушение киназы Aurora A.[4]
Критическими субстратами APC / C, по-видимому, являются секурин и циклины типа B. Это сохраняется у млекопитающих и дрожжей. Фактически, дрожжи жизнеспособны в отсутствие APC / C, если устранена потребность в нацеливании на эти два субстрата.[5]
Подразделения
Субблоки APC / C, которые в основном служат в качестве адаптеров, не подвергались обширным исследованиям. Исследования субъединиц АРС в основном проводятся у дрожжей, и исследования показывают, что большинство субъединиц АРС дрожжей также присутствует у позвоночных, что предполагает сохранение у эукариот. Одиннадцать основных субъединиц APC были обнаружены у позвоночных по сравнению с тринадцатью у дрожжей.[1] Субъединицы активатора связываются с APC на различных стадиях клеточного цикла, чтобы контролировать его активность убиквитинирования, часто путем направления APC к субстратам-мишеням, предназначенным для убиквитинирования. Предлагается контролировать специфичность лигаз APC путем включения факторов специфичности в лигазный комплекс вместо фосфорилирования субстрата. то есть: субъединица CDC20 позволяет APC разлагать субстраты, такие как ингибиторы анафазы (Pdsp1), в начале анафазы, с другой стороны, когда CDC20 заменяется на фактор специфичности Hct1, APC разрушает другой набор субстратов, в частности циклины митоза в конце анафазы. анафаза. Активаторы CDC20 и Cdh1 имеют особое значение и являются наиболее широко изученными и известными из субъединиц APC / C.
Каталитическое ядро APC / C состоит из субъединицы кульлина Apc2 и субъединицы домена RING H2 Apc11. Эти две субъединицы катализируют убиквитинирование субстратов, когда C-концевой домен Apc2 образует прочный комплекс с Apc11. RING / APc11 связывается с конъюгатом E2-убиквитин, который катализирует перенос убиквитина к активному центру в E2.[1]В дополнение к каталитической функциональности другие коровые белки APC состоят из множества повторяющихся мотивов с основной целью обеспечения поддержки молекулярного каркаса. К ним относятся Apc1, самая большая субъединица, которая содержит 11 тандемных повторов из 35-40 аминокислотных последовательностей, и Apc2, которая содержит три Cullin всего повторы приблизительно 130 аминокислот.[6] Основные мотивы в субъединицах APC включают мотивы тетратрикопептидов (TPR) и повторы WD40 1.[1] С-концевые области CDC20 и Cdh1 имеют домен WD40, который, как предполагается, формирует платформу связывания, которая связывает субстраты APC, тем самым внося вклад в способность APC нацеливаться на эти субстраты, хотя точный механизм, посредством которого они увеличивают активность APC, неизвестен.[7] Также предполагается, что вариации в этих доменах WD40 приводят к различной субстратной специфичности, что подтверждается недавними результатами, предполагающими, что разные субстраты APC могут напрямую и специфически связываться с Cdc20 и Cdh1 / Hct1. В конечном итоге различия в специфичности ответственны за время появления разрушение нескольких мишеней APC во время митоза. CDC20 нацелен на несколько основных субстратов в метафазе, а Cdh1 нацелен на более широкий спектр субстратов в сторону позднего митоза и G1.[8]
В частности, 4 субъединицы дрожжевого APC / C почти полностью состоят из множественных повторов мотива из 34 аминокислотных тетратрикопептидных остатков (TPR). Эти субъединицы TPR, Cdc16,[9] Cdc27,[10] Cdc23, и Apc5, в основном обеспечивают каркас и поддержку для опосредования других белок-белковых взаимодействий. Было показано, что Cdc27 и Cdc23 поддерживают связывание Cdc20 и Cdh1, поскольку мутации в ключевых остатках этих субъединиц приводили к повышенной диссоциации активаторов. Было показано, что Apc10 / Doc1 способствует связыванию субстрата, опосредуя их взаимодействия с Cdh1 и Cdc20.[11]
В частности, CDC20 (также известный как p55CDC, Fizzy или Slp1) инактивирует CDK1 посредством убиквитинирования циклинов B-типа. Это приводит к активации Cdh1 (он же Fizzy-related, Hct1, Ste9 или Srw1), который взаимодействует с APC во время позднего митоза и G1 / G0. Cdh1 инактивируется посредством фосфорилирования во время фазы S, G2 и ранней М. Во время этих этапов цикла сборка невозможна.[12]
Данные показывают, что APC3 и APC7 служат для рекрутирования Cdh1 в комплекс, способствующий анафазе.[13] Это также подтверждает, что Cdh1 отвечает за поддержание активности APC во время G1. Cdh1 не требует фосфорилирования APC для связывания, фактически фосфорилирование Cdh1 с помощью Cdks предотвращает его связывание с APC из фазы S в M. При разрушении M-Cdk теперь может происходить высвобождение CDC20 из APC и связывания Cdh1, позволяя активности APC продолжаться во время входа в G1.[1] Хотя Cdh1 распознает циклины M и S, позволяя их разрушение до тех пор, пока вся клетка не перейдет к новому циклу, он не распознает циклины G1 / S, и во время фазы G1 / S их активность циклинов может беспрепятственно возрастать и фосфорилироваться и, таким образом, инактивация Cdh1 и, следовательно, APC.
Субъединица Apc15 играет важную роль в APC / CCdc20 активация после би-ориентации сестринских хроматид поперек метафазной пластинки. Когда кинетохоры не прикреплены к веретенам, комплексы митотических контрольных точек (MCC) ингибируют APC. В отсутствие Apc15 MCC и Cdc20 остаются заблокированными на APC / C, предотвращая его активность, как только выполняются требования контрольной точки шпинделя. Apc15 опосредует оборот Cdc20 и MCC, чтобы предоставить информацию о состоянии прикрепления кинетохор.[14]
CDC27 / APC3
Одна из субъединиц, которая демонстрирует мотив TPR, CDC27, как было идентифицировано, взаимодействует с белками митотических контрольных точек, такими как Mad2, p55CDC и BUBR1, что позволяет предположить, что она может участвовать во времени М-фазы.[15] Данные показывают, что CDC27 участвует в тройном комплексе с SMAD2 / 3 и Cdh1, который создается в ответ на передачу сигналов TGFβ. В частности, благодаря взаимодействию с Cdh1, он играет потенциальную роль в определении сродства между APC и его активаторами Cdc20 и Cdh1. Исследование предполагает, что индуцированное TGF-β фосфорилирование Cdc27 усиливает взаимодействие между cdc27 и Cdh1, который непосредственно участвует в активации APC.[16] CDC27 может служить средством, с помощью которого передача сигналов TGFβ может активировать APC. Индуцированное гиперфосфорилирование CDC27 под действием TGFβ показало повышенную активность APC.
CDC23, CDC16, CDC27
CDC23, другая субъединица TPR, взаимодействует с SWM1, связываясь с D-боксом CLB2. На основании гибридных анализов in vivo и совместной иммунопреципитации in vitro предполагается, что Cdc16p, Cdc23p и Cdc27p (аналоги Sacchyromyces cerevisiae) взаимодействуют и образуют макромолекулярный комплекс. Предполагается, что их общая тема TPR опосредует эти взаимодействия.[17] Что касается Cdc27 и Cdc16 у дрозофилы, их функции были протестированы с помощью РНК-интерференции (РНКи).[18] Результаты предполагают, что они могут опосредовать активность всего комплекса с помощью различных механизмов на разных участках. В дальнейших исследованиях дрозофилы Cdk16 и cdk23, по-видимому, активируются посредством фосфорилирования с помощью Polo-подобной киназы 1 (Plk1) и ее коллеги из делящихся дрожжей, по-видимому, связываются, в частности, с Cdc23.[19]
Предполагается, что комплекс регулируется активаторами CDC20 и Cdh1 во время митоза. Их роль в деградации циклина B продемонстрирована скринингом мутантов Saccharomyces cerevisiae, дефектных по деградации циклина B, которые, как было обнаружено, имеют мутации в генах CDC16 и CDC23. Все мутанты CDC27, CDC23 и CDC 27 приводили к остановке клеточного цикла в метафазе.[20]
Распознавание субстрата
Субстраты APC / C имеют узнаваемые аминокислотные последовательности, которые позволяют APC / C идентифицировать их. Наиболее распространенная последовательность известна как блок разрушения или D-блок. APC / C объединяет E2 убиквитин-конъюгированный фермент и D-бокс, а не промежуточный ковалентный носитель.[21] D-бокс должен иметь версию следующего аминокислота последовательность: RXXLXXXXN, где R - аргинин, X - любая аминокислота, L - Лейцин, а N равно аспарагин. Коробка Кен - еще один важный мотив. Его последовательность должна напоминать следующую: KENXXXN, где K - лизин и E есть глутамат. Положение последней аминокислоты в Ken-боксе очень вариабельно. Хотя было показано, что мутации в последовательностях действительно ингибируют разрушение белков «in vivo», еще многое предстоит узнать о том, как белки нацелены на APC / C.[1]
После связывания с APC / C, Cdc20 и Cdh1 служат в качестве рецепторов D- и KEN-бокса для различных субстратов APC. Крафт и другие. показали, что D-боксы субстратов напрямую связываются с высококонсервативными WD40 повторить область пропеллера на активаторах APC. Важно отметить, что консервативная область пропеллера Cdh1 намного больше, чем у Cdc20, что позволяет Cdh1 иметь более широкую субстратную специфичность, что согласуется с тем фактом, что APC / CCdh1 также активирует APC-опосредованное разрушение субстратов, содержащих KEN-бокс. D-бокс дополнительно усиливает деградацию белка, поскольку остатки лизина в непосредственной близости от D-бокса служат мишенями для убиквитилирования. Было обнаружено, что остаток Lys, находящийся непосредственно на С-конце D-бокса, может действовать как акцептор убиквитина.[22]
Многие субстраты APC содержат как D-, так и KEN-боксы с их убиквитилированием либо APC / CCdc20 или APC / CCdh1 в зависимости от обеих последовательностей, тем не менее, некоторые субстраты содержат только блок D или блок KEN в одной или нескольких копиях. Наличие двух различных последовательностей деградации создает высокий уровень субстратной специфичности на APC / C с APC / CCdc20 больше зависит от коробки D и APC / CCdh1 больше зависит от коробки KEN. Например, APC / CCdh1 способен убиквитилировать субстраты, содержащие только KEN-бокс, такие как Tome-1 и Sororin.[6]
Хотя Cdc20 и Cdh1 могут служить рецепторами D- и KEN-бокса, низкое сродство этих взаимодействий коактиватор-субстрат предполагает, что маловероятно, что коактиваторы одних только достаточны для обеспечения связывания субстрата с высоким сродством с APC / C.Cdc20 и APC / CCdh1.[6] Следовательно, основные субъединицы APC / C, такие как Apc10, также вносят вклад в ассоциацию с субстратом. В конструкциях APC / C, лишенных субъединицы Apc10 / Doc1, субстраты, такие как Clb2, не могут связываться с APC.Δdoc1–Cdh1, при добавлении очищенного Doc1 к APCΔdoc1Конструкция –Cdh1 восстанавливает способность связывания субстрата.[11]
Переход от метафазы к анафазе
Когда начинается метафаза, КПП шпинделя ингибирует APC / C до тех пор, пока все сестринские кинетохоры не присоединятся к противоположным полюсам митотическое веретено, процесс, известный как биориентация хромосом. Когда все кинетохоры правильно прикреплены, контрольная точка шпинделя заглушается, и APC / C может стать активным. M-Cdks фосфорилирует субъединицы APC / C, которые способствуют связыванию с Cdc20. Затем секурин и М-циклины (циклин A и циклин B) нацелены на APC / C.Cdc20 на деградацию. После разложения сепарин высвобождается, когезин разлагается, и сестринские хроматиды подготавливаются к перемещению к своим полюсам для анафазы.[1]
Вероятно, что в клетках животных, по крайней мере, некоторая активация APC / CCdc20 происходит на ранних этапах клеточного цикла (профаза или прометафаза) в зависимости от времени деградации его субстратов. Циклин А деградирует рано в митозе, подтверждая теорию, но циклин B и секурин не разлагаются до метафазы. Молекулярная основа задержки неизвестна, но считается, что она является ключом к правильному времени инициации анафазы. В клетках животных система контрольных точек веретена вносит свой вклад в задержку, если необходимо исправить би-ориентацию хромосом. Хотя как система контрольных точек веретена ингибирует разрушение циклина B и секурина, позволяя при этом разрушаться циклину A, неизвестно. Задержку также можно объяснить неизвестным взаимодействием с регуляторами, изменениями локализации и фосфорилирования.[1]
Это инициирует негативный отзыв петля. При активации APC / CCdc20 требует M-Cdk, комплекс также отвечает за разрушение циклина, чтобы дезактивировать M-CdK. Это означает, что APC / CCdc20 способствует собственной деактивации. Возможно, что эта отрицательная обратная связь является основой активности Cdk, контролируемой колебаниями концентрации циклинов M и S.[1]
От M до G1 переход
По завершении митоза важно, чтобы клетки (за исключением эмбриональных) прошли период роста, известный как грамм1 фаза, чтобы расти и производить факторы, необходимые для следующего клеточного цикла. Вступление в другой раунд митоза предотвращается путем ингибирования активности Cdk. Хотя за это ингибирование ответственны разные процессы, важным является активация APC / C с помощью Cdh1. Эта продолжающаяся активация предотвращает накопление циклина, которое запускает следующий раунд митоза, и вместо этого запускает выход из митоза.[1]
В начале клеточного цикла Cdh1 фосфорилируется M-Cdk, предотвращая его прикрепление к APC / C. После этого APC / C может присоединиться к Cdc20 и начать переход от метафазы к анафазе. Поскольку M-Cdk деградирует позже в митозе, Cdc20 высвобождается, и Cdh1 может связываться с APC / C, поддерживая его активацию через M / G.1 переход. Ключевое различие, которое следует отметить, заключается в том, что хотя связывание Cdc20 с APC / C зависит от фосфорилирования APC / C митотическими Cdks, связывание Cdh1 не зависит. Таким образом, поскольку APCCdc20 становится инактивированным во время метафазы из-за дефосфорилирования в результате неактивных митотических Cdks, Cdh1 способен немедленно связываться с APC / C, занимая место Cdc20. Cdc20 также является целью APC / CCdh1, гарантируя, что APC / CCdc20 выключен. APC / CCdh1 затем продолжает работать в G1 пометить циклины S и M для разрушения. Однако G1/ S циклины не являются субстратами APC / CCdh1 и поэтому накапливаются на протяжении этой фазы и фосфорилируют Cdh1. К концу G1, достаточно G1/ S-циклины накапливают и фосфорилируют Cdh1, чтобы инактивировать APC / C до следующей метафазы.[1]
Однажды в G1, БТРCdh1 отвечает за деградацию различных белков, которые способствуют правильному развитию клеточного цикла. Геминин - это белок, который связывается с Cdt1, что предотвращает его связывание с комплексом распознавания источника (ORC). APCCdh1 нацеливается на геминин для убиквитинирования по всей G1, сохраняя низкий уровень. Это позволяет Cdt1 выполнять свою функцию во время предварительной сборки RC. Когда APCCdh1 становится неактивным из-за фосфорилирования Cdh1 G1/ S циклины, активность геминина снова повышается. Кроме того, Dbf4 стимулирует Связанная с 7-м циклом деления клетки протеинкиназа (Cdc7), которая способствует активации источников репликации. Предполагается, что APCCdh1 нацелен на уничтожение Dbf4. Это могло бы дать ответ на вопрос, как Cdc7 активируется в начале нового клеточного цикла. Его активность, вероятно, соответствует инактивации APC / CCdh1 компании G / S cyclins.[1]
Дополнительное регулирование
APC / CCdc20 инактивация на ранних стадиях клеточного цикла частично достигается за счет белка Emi1. Первоначальные эксперименты показали, что добавление Emi1 к циклическим экстрактам Xenopus может предотвратить разрушение эндогенного циклина A, циклина B и выход из митоза, предполагая, что Emi1 способен противодействовать активности APC. Более того, истощение Emi1 в соматических клетках ведет к недостаточному накоплению циклина B. Отсутствие Emi1, вероятно, ведет к отсутствию ингибирования APC, предотвращая накопление циклина B.[23]
Из этих ранних наблюдений было подтверждено, что при G2 и ранних митозах Emi1 связывает и ингибирует Cdc20, предотвращая его ассоциацию с субстратами APC. Cdc20 все еще может фосфорилироваться и связываться с APC / C, но связанный Emi1 блокирует взаимодействие Cdc20 с мишенями APC.[1] Связь Emi1 с Cdc20 позволяет стабилизировать различные циклины на протяжении фаз S и G2, но удаление Emi1 важно для прогрессирования через митоз. Таким образом, в поздней профазе Emi1 фосфорилируется Поло-подобная киназа, Plk. Plk активируется во время ранних митозов активностью Cdk1, и его фосфорилирование Emi1's BTRC (ген) Сайт связывания βTrCP делает его мишенью для SCF, что приводит к его последующему разрушению в прометафазе.[24] Разрушение Emi1 приводит к активации APC / CCdc20, что делает возможным разрушение циклина A в раннем митозе. Уровни Emi1 снова начинают расти в G, что помогает ингибировать APC / CCdh1.[1]
Регулирование APC / CCdc20 активность по отношению к метафазным субстратам, таким как секурин и циклин B, может быть результатом внутриклеточной локализации. Предполагается, что белки контрольной точки веретена, которые ингибируют APC / CCdc20 ассоциируют только с подмножеством популяции Cdc20, локализованной около митотического веретена. Таким образом, циклин A может расщепляться, тогда как циклин B и секурин расщепляются только после того, как сестринские хроматиды достигают би-ориентации.[1]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п Морган Д.О. (2007). "Глава 3-10: Комплекс продвижения анафазы". Клеточный цикл: принципы контроля. Лондон: New Science Press. С. 48–49. ISBN 978-0-9539181-2-6.
- ^ «Ученые составили карту одного из самых важных белков в жизни - рака». Институт исследования рака. 20 июля 2014 г.. Получено 22 июля 2014.
- ^ Чанг Л.Ф., Чжан З., Ян Дж., Маклафлин С.Х., Барфорд Д. (сентябрь 2014 г.). «Молекулярная архитектура и механизм комплекса, способствующего анафазе». Природа. 513 (7518): 388–393. Bibcode:2014Натура.513..388C. Дои:10.1038 / природа13543. ЧВК 4456660. PMID 25043029.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П., ред. (2002). «Глава 17. Клеточный цикл и запрограммированная смерть клетки». Молекулярная биология клетки (4-е изд.). Наука о гирляндах. ISBN 0-8153-3218-1.
- ^ Торнтон Б.Р., Точиски Д.П. (декабрь 2003 г.). «Секурин и B-циклин / CDK - единственные существенные мишени APC». Природа клеточной биологии. 5 (12): 1090–4. Дои:10,1038 / ncb1066. PMID 14634663. S2CID 30582585.
- ^ а б c Барфорд Д. (декабрь 2011 г.). «Структурное понимание сложных функций и механизмов, способствующих анафазе». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 366 (1584): 3605–24. Дои:10.1098 / rstb.2011.0069. ЧВК 3203452. PMID 22084387.
- ^ Кастро А., Бернис К., Виньерон С., Лаббе Дж. К., Лорка Т. (январь 2005 г.). «Комплекс, стимулирующий анафазу: ключевой фактор регуляции клеточного цикла». Онкоген. 24 (3): 314–25. Дои:10.1038 / sj.onc.1207973. PMID 15678131.
- ^ Schwab M, Neutzner M, Möcker D, Seufert W (сентябрь 2001 г.). «Дрожжи Hct1 распознают митотический циклин Clb2 и другие субстраты убиквитинлигазы APC». Журнал EMBO. 20 (18): 5165–75. Дои:10.1093 / emboj / 20.18.5165. ЧВК 125620. PMID 11566880.
- ^ Ван Дж., Дай Б.Т., Раджашанкар К.Р., Куринов И., Шульман Б.А. (сентябрь 2009 г.). «Понимание анафазы, способствующей сборке сложных поддоменов TPR из структуры CDC26-APC6». Структурная и молекулярная биология природы. 16 (9): 987–9. Дои:10.1038 / nsmb.1645. ЧВК 2759704. PMID 19668213.
- ^ Yamaguchi M, Yu S, Qiao R, Weissmann F, Miller DJ, VanderLinden R и др. (Апрель 2015 г.). «Структура комплекса APC3-APC16: понимание сборки комплекса / циклосомы, способствующего анафазе». Журнал молекулярной биологии. 427 (8): 1748–64. Дои:10.1016 / j.jmb.2014.11.020. ЧВК 4444369. PMID 25490258.
- ^ а б Passmore LA, McCormack EA, Au SW, Paul A, Willison KR, Harper JW, Barford D (февраль 2003 г.). «Doc1 опосредует активность комплекса, способствующего анафазе, способствуя распознаванию субстрата». Журнал EMBO. 22 (4): 786–96. Дои:10.1093 / emboj / cdg084. ЧВК 145444. PMID 12574115.
- ^ Крамер Э. Р., Шойрингер Н., Подтелейников А. В., Манн М., Петерс Дж. М. (май 2000 г.). «Митотическая регуляция белков-активаторов APC CDC20 и CDH1». Молекулярная биология клетки. 11 (5): 1555–69. Дои:10.1091 / mbc.11.5.1555. ЧВК 14867. PMID 10793135.
- ^ Водермайер Х.С., Гифферс С., Маурер-Штро С., Айзенхабер Ф., Петерс Дж. М. (сентябрь 2003 г.). «Субъединицы TPR комплекса, способствующего анафазе, опосредуют связывание с белком-активатором CDH1». Текущая биология. 13 (17): 1459–68. Дои:10.1016 / s0960-9822 (03) 00581-5. PMID 12956947. S2CID 5942532.
- ^ Мансфельд Дж., Коллин П., Коллинз МО, Чоудхари Дж. С., Пайнс Дж. (Сентябрь 2011 г.). «APC15 управляет оборотом MCC-CDC20, чтобы контрольная точка сборки шпинделя реагировала на прикрепление кинетохор». Природа клеточной биологии. 13 (10): 1234–43. Дои:10.1038 / ncb2347. ЧВК 3188299. PMID 21926987.
- ^ «Ген Entrez: гомолог 27 цикла деления клеток CDC27 (S. cerevisiae)».
- ^ Чжан Л., Фудзита Т., Ву Г, Сяо X, Ван И (март 2011 г.). «Фосфорилирование комплекса, стимулирующего анафазу / Cdc27, участвует в передаче сигналов TGF-бета». Журнал биологической химии. 286 (12): 10041–50. Дои:10.1074 / jbc.M110.205518. ЧВК 3060455. PMID 21209074.
- ^ Lamb JR, Michaud WA, Sikorski RS, Hieter PA (сентябрь 1994 г.). «Cdc16p, Cdc23p и Cdc27p образуют комплекс, необходимый для митоза». Журнал EMBO. 13 (18): 4321–8. Дои:10.1002 / j.1460-2075.1994.tb06752.x. ЧВК 395359. PMID 7925276.
- ^ Хуан Дж. Ю., Рафф Дж. В. (июль 2002 г.). «Динамическая локализация APC / C дрозофилы: свидетельство существования множества комплексов, которые выполняют разные функции и по-разному локализованы». Журнал клеточной науки. 115 (Pt 14): 2847–56. PMID 12082146.
- ^ Деак П., Дональдсон М., Гловер Д.М. (октябрь 2003 г.). «Мутации в mákos, гене дрозофилы, кодирующем Cdc27-субъединицу комплекса, способствующего анафазе, усиливают центросомные дефекты в поло и подавляются мутациями в близнецах / аар, которые кодируют регуляторную субъединицу PP2A». Журнал клеточной науки. 116 (Pt 20): 4147–58. Дои:10.1242 / jcs.00722. PMID 12953067.
- ^ Хартвелл Л. Х., Смит Д. (июль 1985 г.). «Измененная точность передачи митотической хромосомы у мутантов клеточного цикла S. cerevisiae». Генетика. 110 (3): 381–95. ЧВК 1202570. PMID 3894160.
- ^ Кинг Р. У., Деше Р. Дж., Петерс Дж. М., Киршнер М. В. (декабрь 1996 г.). «Как протеолиз управляет клеточным циклом». Наука. 274 (5293): 1652–9. Bibcode:1996Наука ... 274.1652K. Дои:10.1126 / science.274.5293.1652. PMID 8939846. S2CID 25369228.
- ^ Kraft C, Vodermaier HC, Maurer-Stroh S, Eisenhaber F, Peters JM (май 2005 г.). «Пропеллерный домен WD40 Cdh1 функционирует как рецептор деструктивного бокса для субстратов APC / C». Молекулярная клетка. 18 (5): 543–53. Дои:10.1016 / j.molcel.2005.04.023. PMID 15916961.
- ^ Рейманн Дж. Д., Фрид Е., Хсу Дж. Ю., Крамер Е. Р., Петерс Дж. М., Джексон П. К. (июнь 2001 г.) «Emi1 - митотический регулятор, который взаимодействует с Cdc20 и ингибирует комплекс, способствующий анафазе». Клетка. 105 (5): 645–55. Дои:10.1016 / s0092-8674 (01) 00361-0. PMID 11389834. S2CID 16366514.
- ^ Хансен Д.В., Локтев А.В., Бан К.Х., Джексон П.К. (декабрь 2004 г.). «Plk1 регулирует активацию комплекса, способствующего анафазе, фосфорилированием и запуском SCFbetaTrCP-зависимого разрушения ингибитора APC Emi1». Молекулярная биология клетки. 15 (12): 5623–34. Дои:10.1091 / mbc.e04-07-0598. ЧВК 532041. PMID 15469984.
дальнейшее чтение
- Визинтин Р., Принц С., Амон А. (октябрь 1997 г.). «CDC20 и CDH1: семейство субстрат-специфических активаторов APC-зависимого протеолиза». Наука. 278 (5337): 460–3. Bibcode:1997Наука ... 278..460В. Дои:10.1126 / science.278.5337.460. PMID 9334304.
- Hsu JY, Reimann JD, Sørensen CS, Lukas J, Jackson PK (май 2002 г.). «E2F-зависимое накопление hEmi1 регулирует вступление в S-фазу путем ингибирования APC (Cdh1)». Природа клеточной биологии. 4 (5): 358–66. Дои:10.1038 / ncb785. PMID 11988738. S2CID 25403043.
- Захария В., Нэсмит К. (август 1999 г.). «Чей конец - разрушение: деление клеток и комплекс, способствующий анафазе». рассмотрение. Гены и развитие. 13 (16): 2039–58. Дои:10.1101 / gad.13.16.2039. PMID 10465783.
- Харпер Дж. У., Бертон Дж. Л., Соломон М. Дж. (Сентябрь 2002 г.). «Комплекс, способствующий анафазе: он больше не только для митоза». рассмотрение. Гены и развитие. 16 (17): 2179–206. Дои:10.1101 / гад.1013102. PMID 12208841.
- Лима М., Элой Н.Б., Пегораро С., Сагит Р., Рохас С., Бретц Т. и др. (Ноябрь 2010 г.). «Геномная эволюция и сложность комплекса, способствующего анафазе (APC) у наземных растений». BMC Биология растений. 10: 254. Дои:10.1186/1471-2229-10-254. ЧВК 3095333. PMID 21087491.
внешняя ссылка
- комплекс, способствующий анафазе в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- 3D-электронная микроскопия структур комплекса, способствующего анафазе, в банке данных EM (EMDB)
