Аминогликозид - Aminoglycoside - Wikipedia
Аминогликозид это лечебный и бактериологический категория традиционных Грамотрицательный антибактериальный лекарства которые ингибируют синтез белка и содержат в составе молекулы амино-модифицированный гликозид (сахар ).[1][2] Термин может также относиться к любой органической молекуле, содержащей аминосахар подконструкции. Аминогликозид антибиотики проявляют бактерицидную активность против грамотрицательных аэробов и некоторых анаэробных бациллы где устойчивость еще не возникла, но, как правило, не против грамположительных и анаэробных грамотрицательных бактерий.[3]
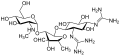
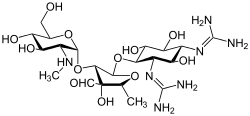
Стрептомицин это первый в своем классе аминогликозид антибиотик. Это получено из Streptomyces griseus и это самый ранний современный агент, используемый против туберкулез. В стрептомицине отсутствует общий 2-дезоксистрептаминовый фрагмент (изображение справа, ниже), присутствующий в большинстве других представителей этого класса. Другие примеры аминогликозидов включают дезоксистрептаминсодержащие агенты. канамицин, тобрамицин, гентамицин, и неомицин (Смотри ниже).

Номенклатура
Аминогликозиды, полученные из бактерий Streptomyces род названы с суффиксом -мицин, тогда как те, которые получены из Микромоноспора[4] названы с суффиксом -мицин.[5] Однако эта система номенклатуры не специфична для аминогликозидов, и поэтому появление этого набора суффиксов не подразумевает общего механизма действия. (Например, ванкомицин, а гликопептидный антибиотик,[6] и эритромицин,[7] а макролид антибиотик, производимый Saccharopolyspora erythraea, вместе с его синтетическими производными кларитромицин и азитромицин, все имеют одинаковые суффиксы, но имеют заметно разные механизмы действия.)
В следующей галерее от канамицина А до нетилмицина являются примерами 4,6-дизамещенного дезоксистрептамина подкласса аминогликозидов, неомицины являются примерами 4,5-дизамещенный подкласс, и стрептомицин является примером недезоксистрептамин аминогликозида.[2]
Механизмы действия
Аминогликозиды проявляют зависящую от концентрации бактерицидную активность против «большинства грамотрицательных аэробных и факультативных анаэробных бацилл», но не против грамотрицательных анаэробов и большинства грамположительных бактерий.[3] Они требуют лишь короткого времени контакта и наиболее эффективны против быстро размножающихся восприимчивых популяций бактерий.[8] Эти действия относятся к основному способу действия как ингибиторы синтеза белка, хотя для некоторых конкретных агентов задействованы дополнительные механизмы и / или подробные описания механизмов пока недоступны.[2][3][8]
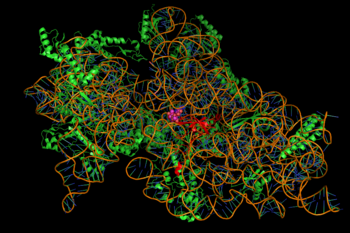
Подавление синтеза белка опосредуется энергозависимым, иногда необратимым связыванием аминогликозидов с цитозольный, мембраносвязанные бактериальные рибосома (изображение справа).[2] (Аминогликозиды сначала проникают через стенки бактериальных клеток -липополисахарид в грамотрицательных бактериях и клеточных мембранах, где они активно транспортируется.[8]) Хотя конкретные стадии затронутого синтеза белка могут несколько различаться между конкретными аминогликозидными агентами, как и их сродство и степень связывания,[8] Присутствие аминогликозида в цитозоле обычно нарушает удлинение пептида в 30S рибосомальный субъединица, вызывающая неточную трансляцию мРНК и, следовательно, биосинтез белков, которые усечены или содержат измененный аминокислотный состав в определенных точках.[2] В частности, связывание ухудшает переводная корректура приводит к неправильному прочтению сообщения РНК, преждевременному завершению или и тому, и другому, и, следовательно, к неточности переведено белковый продукт. Подмножество аберрантных белков, которые включены в мембрану бактериальной клетки, могут затем привести к изменению ее проницаемости и затем к «дальнейшему стимулированию транспорта аминогликозидов».[2] В аминосахар Часть этого класса молекул (например, 2-дезоксистрептамин в канамицинах, гентамицинах и тобрамицине, см. выше) вовлечена в ассоциацию небольшой молекулы с рибосомными структурами, что приводит к неверности трансляции (там же). Подавление рибосомная транслокация - то есть, перемещение пептидил-тРНК от А- к Р-сайту - также было предложено.[нужна цитата ] (Спектиномицин родственный, но особый класс химической структуры, часто обсуждаемый с аминогликозидами, не вызывает неправильного считывания мРНК и, как правило, не является бактерицидным.)[8]
Наконец, аминогликозиды также имеют дополнительный «эффект клеточной мембраны»; «функциональная целостность мембраны бактериальной клетки» может быть утрачена позднее в ходе воздействия и транспорта аминогликозидов.[9]
Фармакокинетика и фармакодинамика
Существует значительная вариабельность во взаимосвязи между введенной дозой и результирующим уровнем в плазме крови.[нужна цитата ] Мониторинг терапевтических препаратов (TDM) необходимо для получения правильной дозы. Эти агенты проявляют постантибиотический эффект при котором в крови не обнаруживается или обнаруживается очень низкий уровень лекарственного средства, но, по-видимому, все еще наблюдается ингибирование повторного роста бактерий. Это происходит из-за сильного необратимого связывания с рибосомой и остается внутриклеточной еще долгое время после падения уровня в плазме и позволяет увеличить интервал между дозами.[нужна цитата ] В зависимости от концентрации они действуют как бактериостатический или же бактерицидный агенты.[нужна цитата ]
Показания
Аминогликозиды полезны прежде всего при инфекциях, связанных с аэробный, Грамотрицательный бактерии, такие как Псевдомонады, Acinetobacter, и Энтеробактер. Кроме того, некоторые Микобактерии, включая бактерии, вызывающие туберкулез, чувствительны к аминогликозидам. Стрептомицин был первым эффективным лекарственным средством для лечения туберкулеза, хотя роль аминогликозидов, таких как стрептомицин и амикацин, затмевается (из-за их токсичности и неудобного пути введения), за исключением штаммов с множественной лекарственной устойчивостью.[нужна цитата ] Наиболее частым применением аминогликозидов является эмпирическая терапия серьезных инфекций, таких как сепсис, осложненные внутрибрюшные инфекции, осложненные инфекции мочевыводящих путей и нозокомиальные инфекции дыхательных путей. Обычно после выращивания культур возбудителя и проверки их чувствительности прием аминогликозидов прекращается в пользу менее токсичных антибиотиков.[нужна цитата ]
Как уже отмечалось, аминогликозиды в большинстве своем неэффективны против анаэробных бактерий, грибов и вирусов.[2] Инфекции, вызванные Грамположительный бактерии также можно лечить аминогликозидами, но другие типы антибиотиков более эффективны и менее опасны для хозяина. В прошлом аминогликозиды использовались вместе с бета-лактамными антибиотиками при стрептококковых инфекциях из-за их синергического действия, в частности, при эндокардит. Одна из самых частых комбинаций - это ампициллин (а бета-лактам, или антибиотик, связанный с пенициллином) и гентамицин. Часто персонал больницы называет эту комбинацию «amp и гент» или, в последнее время, «ручка и гент» для пенициллина и гентамицина.[нужна цитата ]
Подавление бессмыслицы
Вмешательство в корректуру мРНК использовалось для лечения генетических заболеваний, возникающих в результате преждевременного стоп-кодоны (что приводит к преждевременному прекращению синтеза белка и усечению белков). Аминогликозиды могут заставить клетку преодолевать стоп-кодоны, вставлять случайную аминокислоту и экспрессировать полноразмерный белок.[10] Аминогликозид гентамицин использовался для лечения кистозный фиброз (CF) клетки в лаборатории, чтобы побудить их к росту полноразмерных белков. МВ вызывается мутацией в ген кодирование для регулятор трансмембранной проводимости при муковисцидозе (CFTR) белок. Примерно в 10% случаев муковисцидоза мутация в этом гене вызывает его преждевременное прекращение во время перевод, что приводит к образованию усеченного и нефункционального белка CFTR. Верят что гентамицин искажает структуру комплекса рибосома-РНК, что приводит к неправильному чтению завершающий кодон, вызывая рибосома «пропустить» стоп-последовательность и продолжить нормальное удлинение и производство белка CFTR.[11]
Пути администрирования
Поскольку они не всасываются из кишечника, их вводят внутривенно и внутримышечно. Некоторые из них используются в местных препаратах для лечения ран. Пероральный прием можно использовать для деконтаминации кишечника (например, при печеночной энцефалопатии). Тобрамицин можно вводить в небулайзерной форме.[12]
Клиническое использование
Недавнее появление инфекций, вызванных штаммами грамотрицательных бактерий с расширенными моделями устойчивость к противомикробным препаратам побудило врачей пересмотреть использование этих антибактериальных средств.[13] Этот возродившийся интерес к использованию аминогликозидов вновь пролил свет на дебаты по двум основным вопросам, связанным с этими соединениями, а именно по спектру чувствительности к противомикробным препаратам и токсичности. Текущие данные показывают, что аминогликозиды действительно сохраняют активность против большинства грамотрицательных клинических бактерий. изолирует во многих частях мира. Тем не менее, относительно частое проявление нефротоксичности и ототоксичности во время лечения аминогликозидами заставляет врачей неохотно использовать эти соединения в повседневной практике. Недавние успехи в понимании влияния различных схем дозирования аминогликозидов на токсичность обеспечили частичное решение этой проблемы, хотя для полного преодоления этой проблемы все еще необходимо провести дополнительные исследования.[14]
Аминогликозиды входят в категория беременности D,[15] то есть есть положительные доказательства риска для плода у человека, основанные на данных о побочных реакциях, полученных из исследовательского или маркетингового опыта или исследований на людях, но потенциальные выгоды могут служить основанием для использования препарата беременными женщинами, несмотря на потенциальные риски.
Побочные эффекты
Аминогликозид может вызвать интоксикацию внутреннего уха, что может привести к нейросенсорная тугоухость. Частота токсичности внутреннего уха колеблется от 7 до 90% в зависимости от типов используемых антибиотиков, восприимчивости пациента к таким антибиотикам и продолжительности приема антибиотиков.[16]
Еще один серьезный побочный эффект от приема аминогликозидов, который приводит к инвалидности, - это вестибулярная ототоксичность. Это приводит к осциллопсии (нестабильности взгляда) и нарушениям равновесия, которые влияют на все аспекты антигравитационной функции человека. Эта потеря необратима и может произойти при любой дозе.[17][18][19][20]
Противопоказания при определенных заболеваниях
Аминогликозиды могут усиливать слабость у пациентов с миастения, поэтому таких пациентов следует избегать.[21]
Аминогликозиды противопоказаны пациентам с митохондриальными заболеваниями, так как они могут привести к нарушению трансляции мтДНК, что может привести к необратимой потере слуха, шуму в ушах, сердечной и почечной токсичности. Однако потеря слуха и шум в ушах также наблюдались у некоторых пациентов без митохондриальных заболеваний.[22]
Рекомендации
- ^ Например, см. Www.merriam-webster.com/medical/aminoglycoside: «любой из группы антибиотиков (как стрептомицин и неомицин), которые ингибируют синтез бактериального белка и активны, особенно в отношении грамотрицательных бактерий».
- ^ а б c d е ж грамм Mingeot-Leclercq MP, Glupczynski Y, Tulkens PM (1999). «Аминогликозиды: активность и устойчивость». Антимикробный. Агенты Chemother. 43 (4): 727–37. Дои:10.1128 / AAC.43.4.727. ЧВК 89199. PMID 10103173.
- ^ а б c М.Э. Левисон, доктор медицины, 2012 г., Аминогликозиды, Руководство компании Merck [1], по состоянию на 22 февраля 2014 г.
- ^ Kroppenstedt RM, Mayilraj S, Wink JM (июнь 2005 г.). "Восемь новых видов рода Микромоноспора, Micromonospora citrea sp. ноя., Micromonospora echinaurantiaca sp. ноя., Micromonospora echinofusca sp. ноя Micromonospora fulviviridis sp. ноя., Микромоноспора inyonensis sp. ноя., Micromonospora peucetia sp. ноя., Micromonospora sagamiensis sp. ноя., и Micromonospora viridifaciens sp. ноя ". Syst Appl Microbiol. 28 (4): 328–39. Дои:10.1016 / j.syapm.2004.12.011. PMID 15997706.
- ^ Пол М. Дьюик (2009). Лекарственные натуральные продукты: биосинтетический подход (3-е изд.). Вайли. ISBN 978-0-470-74167-2.
- ^ Уолтер П. Хаммес1 и Фрэнсис К. Нойхаус (1974). «О механизме действия ванкомицина: ингибирование синтеза пептидогликана у Gaffkya homari». Противомикробные препараты и химиотерапия. 6 (6): 722–728. Дои:10.1128 / AAC.6.6.722. ЧВК 444726. PMID 4451345.
- ^ Механизм действия макролидов, линкозамидов и стрептограмина B раскрывает путь выхода зарождающегося пептида в рибосоме Мартин Ловмар и Монс Эренберг
- ^ а б c d е DVM Boothe, DVM, PhD, 2012, Аминогликозиды (аминоциклитолы), Ветеринарное руководство Merck «Архивная копия». Архивировано из оригинал на 2014-03-01. Получено 2014-02-22.CS1 maint: заархивированная копия как заголовок (связь), по состоянию на 22 февраля 2014 г.
- ^ Как отмечает Бут, «высокие концентрации аминогликозидов могут вызывать неспецифическую мембранную токсичность, вплоть до лизиса бактериальных клеток», хотя физиологическое значение этих концентраций для конкретных клинических ситуаций неясно. DVM Boothe, DVM, PhD, 2012, Аминогликозиды (аминоциклитолы), Ветеринарное руководство Merck «Архивная копия». Архивировано из оригинал на 2014-03-01. Получено 2014-02-22.CS1 maint: заархивированная копия как заголовок (связь), по состоянию на 22 февраля 2014 г.
- ^ Фиро, В. Грегори; Guttmacher, Alan E .; Дитц, Гарри К. (2010). «Новые терапевтические подходы к менделевским расстройствам». Медицинский журнал Новой Англии. 363 (9): 852–63. Дои:10.1056 / NEJMra0907180. PMID 20818846. S2CID 5809127.
- ^ Вильщанский, Майкл; Яхав, Яаков; Яаков, Ясмин; Блау, Ханна; Бентур, Леа; Ривлин, Джозеф; Авирам, Миха; Бдола-Абрам, Тали; и другие. (2003). «Гентамицин-индуцированная коррекция функции CFTR у пациентов с муковисцидозом и мутациями остановки CFTR». Медицинский журнал Новой Англии. 349 (15): 1433–41. Дои:10.1056 / NEJMoa022170. PMID 14534336.
- ^ Пай В.Б., Нахата М.С. (октябрь 2001 г.). «Эффективность и безопасность аэрозольного тобрамицина при муковисцидозе». Педиатр. Пульмонол. 32 (4): 314–27. Дои:10.1002 / ppul.1125. PMID 11568993.
- ^ Фалагас, Мэтью Э; Grammatikos, Alexandros P; Михалопулос, Аргирис (2008). «Потенциал антибиотиков старого поколения для удовлетворения текущей потребности в новых антибиотиках». Экспертный обзор противоинфекционной терапии. 6 (5): 593–600. Дои:10.1586/14787210.6.5.593. PMID 18847400.
- ^ Дуранте-Мангони, Эмануэле; Грамматикос, Александрос; Утили, Риккардо; Фалагас, Мэтью Э. (2009). «Нужны ли нам еще аминогликозиды?». Международный журнал противомикробных агентов. 33 (3): 201–5. Дои:10.1016 / j.ijantimicag.2008.09.001. PMID 18976888.
- ^ Руководство компании Merck: Бактерии и антибактериальные препараты: аминогликозиды Последний полный обзор / исправление - июль 2009 г., Мэтью Левисон, доктор медицины.
- ^ L, Петерсон; C, Роджерс (18 февраля 2015 г.). «Нарушения слуха, вызванные аминогликозидами - обзор ототоксичности улитки». Семейная практика в Южной Африке. 57 (2): 77–82. Дои:10.1080/20786190.2014.1002220.
- ^ Черный, FO; Pesznecker, S; Stallings, V (июль 2004 г.). «Постоянная вестибулоксичность гентамицина». Отология и невротология. 25 (4): 559–69. Дои:10.1097/00129492-200407000-00025. PMID 15241236.
- ^ Ахмед, РМ; Ханниган, ИП; MacDougall, HG; Чан, RC; Халмаджи, GM (18 июня 2012 г.). «Ототоксичность гентамицина: 23-летняя отобранная серия случаев 103 пациентов». Медицинский журнал Австралии. 196 (11): 701–4. Дои:10.5694 / mja11.10850. PMID 22554194.
- ^ Ахмед, РМ; MacDougall, HG; Халмаджи, GM (сентябрь 2011 г.). «Односторонняя вестибулярная потеря из-за системного введения гентамицина». Отология и невротология. 32 (7): 1158–62. Дои:10.1097 / MAO.0b013e31822a2107. PMID 21844784.
- ^ Исияма, G; Ишимая, А; Кербер, К; Балох, Р.В. (октябрь 2006 г.). «Ототоксичность гентамицина: клинические особенности и влияние на вестибулоокулярный рефлекс человека». Acta Otolaryngologica. 126 (10): 1057–61. Дои:10.1080/00016480600606673. PMID 16923710.
- ^ Гаутам Мехта и Билал Икбал. Клиническая медицина для MRCP PACES. Том 1. Основные клинические навыки. Издательство Оксфордского университета. 2010 г.
- ^ упоминается в Бинду, LH; Редди, ПП (2008). «Генетика аминогликозид-индуцированного и предъязыкового несиндромального митохондриального нарушения слуха: обзор». Int J Audiol. 47 (11): 702–7. Дои:10.1080/14992020802215862. PMID 19031229. Смотрите также Фишель-Годсиан, Н. (1999). «Генетические факторы токсичности аминогликозидов». Ann N Y Acad Sci. 884: 99–109. Дои:10.1111 / j.1749-6632.1999.tb08639.x. PMID 10842587.
внешняя ссылка
- Информация о препаратах MedlinePlus - Аминогликозиды (системные)
- Science Daily Бактериальная «Битва за выживание» - Родострептомицин