Неомицин - Neomycin
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Neo-RX |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a682274 |
| Беременность категория |
|
| Маршруты администрация | Актуальные, устный |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | Никто |
| Связывание с белками | Нет данных |
| Метаболизм | Нет данных |
| Устранение период полураспада | От 2 до 3 часов |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ECHA InfoCard | 100.014.333 |
| Химические и физические данные | |
| Формула | C23ЧАС46N6О13 |
| Молярная масса | 614.650 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Неомицин является аминогликозид антибиотик содержится во многих лекарствах для местного применения, таких как кремы, мази и глазные капли. Неомицин относится к классу аминогликозидов антибиотиков, которые содержат два или более аминосахара связаны гликозидные связи.
Открытие неомицина датируется 1949 годом. Он был запатентован в 1950 году и разрешен для использования в медицине в 1952 году.[1]
Медицинское использование
Неомицин обычно используется в качестве актуальный препарат, такой как Неоспорин (неомицин / полимиксин B / бацитрацин ). Его также можно вводить перорально, где он обычно сочетается с другими антибиотиками. Неомицин не всасывается из желудочно-кишечного тракта и используется в профилактических целях. печеночная энцефалопатия и гиперхолестеринемия. Убивая бактерии в кишечном тракте, он поддерживает низкий уровень аммиака и предотвращает печеночную энцефалопатию, особенно перед операцией на желудочно-кишечном тракте. Он действует как антибиотик, активный против стрептомицин-резистентных бактерий, в том числе в случае туберкулезных организмов.[2] Он также использовался для лечения избыточный бактериальный рост в тонком кишечнике. Его не вводят путем инъекции, так как неомицин чрезвычайно нефротоксичный даже по сравнению с другими аминогликозиды. Исключение составляют случаи, когда неомицин в очень малых количествах используется в качестве консерванта в некоторых вакцинах - обычно 25 мкг на дозу.[3]
Спектр
Подобно другим аминогликозидам, неомицин обладает отличной активностью против Грамотрицательные бактерии, и частично эффективен против Грамположительные бактерии. Он относительно токсичен для человека, и у многих людей на него возникают аллергические реакции.[4] Видеть: Гиперчувствительность. Иногда врачи рекомендуют использовать мази с антибиотиками без неомицина, такие как Полиспорин.[5] Ниже представлены данные о чувствительности к МИК для нескольких значимых с медицинской точки зрения грамотрицательных бактерий.[6]
- Энтеробактерные клоаки:> 16 мкг / мл
- кишечная палочка: 1 мкг / мл
- Proteus vulgaris: 0,25 мкг / мл
Побочные эффекты
В 2005–2006 годах неомицин был пятым по распространенности аллергеном в патч-тест результаты (10,0%).[7] Он также является известным антагонистом ГАМК и может вызывать судороги и психозы.[8]Неомицин, как и другие аминогликозиды, оказался ототоксичный вызывая тиннитус, потеря слуха и вестибулярные проблемы у небольшого числа пациентов. Пациенты с шумом в ушах или нейросенсорной тугоухостью должны поговорить со своим врачом о рисках и побочных эффектах до приема этого лекарства.
Молекулярная биология
Устойчивость к неомицину обеспечивается одним из двух генов аминогликозид фосфотрансферазы.[9] А нео ген обычно включен в ДНК плазмиды используется молекулярными биологами для установления стабильного состояния млекопитающих Сотовые линии экспрессия клонированных белков в культуре; многие коммерчески доступные плазмиды экспрессии белков содержат нео как выбираемый маркер. Не-трансфицированный клетки в конечном итоге отмирают, когда культуру обрабатывают неомицином или аналогичным антибиотиком. Неомицин или канамицин может использоваться для прокариоты, но генетицин (G418), как правило, нужен для эукариоты.
Неомицин связывается с 30S субъединицей рибосома и подавляет трансляцию белков с мРНК.[10]
Неомицин проявляет высокое сродство к связыванию фосфатидилинозитол-4,5-бисфосфата (PIP2), который является фосфолипидным компонентом клеточных мембран.[11]
Биосинтетический путь
Сначала изолирован от Streptomyces fradiae и Streptomyces albogriseus в 1949 г. (NBRC 12773).[12] Неомицин представляет собой смесь неомицина B (фрамицетина); и это эпимер неомицин С, последний компонент составляет около 5–15% смеси. Это основное соединение, которое наиболее активно при щелочной реакции.[2] Это также термостабильное соединение, растворимое в воде, но не растворимое в органических растворителях.[2] Неомицин обладает хорошей активностью против Грамположительный и Грамотрицательные бактерии, но очень ототоксичный. Таким образом, его использование ограничивается пероральным лечением кишечных инфекций.[13]
Неомицин B состоит из четырех связанных частей: D-неозамин, 2-дезоксистрептамин (2-ДОС), D-рибоза и L-неозамин.
Неомицин А, также называемый неамином, содержит D-неозамин и 2-дезоксистрептамин. Неамин состоит из шести генов, гена DOIS (btrC, neo7); L-глутамин: ген аминотрансферазы DOI (btrS, neo6); предполагаемый ген гликозилтрансферазы (btrM, neo8); предполагаемый ген аминотрансферазы (аналог глутамат-1-полуальдегид 2,1-аминомутазы) (btrB, neo18); предполагаемый ген алкогольдегидрогеназы (btrE, neo5); еще один предполагаемый ген дегидрогеназы (похожий на хлордегидрогеназу и родственные флавопротеины) ген (btrQ, neo11).[14] Деацетилаза, действующая для удаления ацетильной группы на остатках N-ацетилглюкозамина аминогликозид промежуточные соединения (Neo16), все еще нуждаются в уточнении (последовательность аналогична BtrD).[15]
Далее идет прикрепление D-рибоза через рибозилирование неамина с использованием 5-фосфорибозил-1-дифосфата (PRPP) в качестве донора рибозила (BtrL, BtrP);[16] гликозилтрансферазы (потенциальные гомологи RibF, LivF, Parf) (Neo15).[17]
Неозамин B (L-неозамин B), скорее всего, биосинтезируется таким же образом, как неозамин C (D-ниозамин) в биосинтезе неамина, но с дополнительным эпимеризация шаг, необходимый для учета присутствия эпимерного неозамина B в неомицине B.[18]
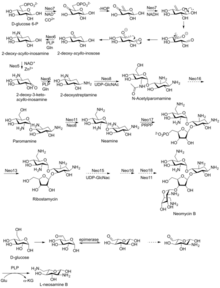
Неомицин C может подвергаться ферментативному синтезу из рибостамицина.[19]
Сочинение
Неомицин стандартного качества состоит из ряда родственных соединений, включая неомицин А (неамин), неомицин B (фрамицетин), неомицин C и несколько второстепенных соединений, обнаруженных в гораздо меньших количествах. Неомицин B является наиболее активным компонентом неомицина, за ним следуют неомицин C и неомицин A. Неомицин A является неактивным продуктом разложения изомеров C и B.[20] Количество этих компонентов в неомицине варьируется от партии к партии в зависимости от производителя и производственного процесса.[21]
История
Неомицин был открыт в 1949 году микробиологом. Селман Ваксман и его ученик Хуберт Лешевалье из Университета Рутгерса. Вырабатывается естественным образом бактериями. Streptomyces fradiae.[22] Синтез требует определенных питательных условий в стационарных или погруженных аэробных условиях. Затем соединение выделяют и очищают от бактерии.[23]
Связывание ДНК
Аминогликозиды, такие как неомицин, известны своей способностью связываться с дуплексной РНК с высоким сродством.[24] Константа ассоциации неомицина с РНК A-сайта находится в пределах 109 M−1 классифицировать.[25] Однако более чем через 50 лет после открытия его ДНК-связывающие свойства все еще оставались неизвестными. Было показано, что неомицин индуцирует термостабилизацию триплексной ДНК, в то же время практически не влияя на стабилизацию дуплекса B-ДНК.[26] Также было показано, что неомицин связывается со структурами, которые принимают структуру А-формы, одной из которых является триплексная ДНК. Неомицин также включает образование гибридного триплекса ДНК: РНК.[27]
Рекомендации
- ^ Фишер Дж, Ганеллин ЧР (2006). Открытие лекарств на основе аналогов. Джон Вили и сыновья. п. 507. ISBN 9783527607495.
- ^ а б c Ваксман С.А., Лешевалье HA (март 1949 г.). «Неомицин, новый антибиотик, активный против стрептомицин-резистентных бактерий, включая туберкулезные организмы». Наука. Нью-Йорк, штат Нью-Йорк. 109 (2830): 305–7. Bibcode:1949Наука ... 109..305Вт. Дои:10.1126 / science.109.2830.305. PMID 17782716.
- ^ Heidary N, Cohen DE (сентябрь 2005 г.). «Реакции гиперчувствительности к компонентам вакцины». Дерматит. 16 (3): 115–20. Дои:10.1097/01206501-200509000-00004. PMID 16242081.
- ^ DermNet дерматит / аллергия на неомицин
- ^ «Ваш аптечный кабинет». DERMAdoctor.com, Inc. Архивировано с оригинал на 2009-07-09. Получено 2008-10-19.
- ^ «Неомицин сульфат, данные о чувствительности к EP и минимальной ингибирующей концентрации (MIC)» (PDF). ТОКУ-Э.
- ^ Zug KA, Warshaw EM, Fowler JF, Maibach HI, Belsito DL, Pratt MD, et al. (2009). «Результаты патч-теста Североамериканской группы контактного дерматита за 2005-2006 годы». Дерматит. 20 (3): 149–60. Дои:10.2310/6620.2009.08097. PMID 19470301.
- ^ Ли К., де Сильва А.Дж. Взаимодействие нервно-мышечных блокирующих эффектов неомицина и полимиксина B. Анестезиология. 1979. 50 (3): 218–220. DOI: 10.1097 / 00000542-197903000-00010
- ^ "Перекрестная устойчивость к G418 / неомицину?". Получено 2008-10-19.
- ^ Mehta R, Champney WS (сентябрь 2003 г.). «Неомицин и паромомицин ингибируют сборку 30S рибосомной субъединицы в Staphylococcus aureus». Современная микробиология. 47 (3): 237–43. Дои:10.1007 / s00284-002-3945-9. PMID 14570276.
- ^ Габев Э., Касьянович Дж., Эбботт Т., Маклафлин С. (февраль 1989 г.). «Связывание неомицина с фосфатидилинозитол-4,5-бисфосфатом (PIP2)». Biochimica et Biophysica Acta (BBA) - Биомембраны. 979 (1): 105–12. Дои:10.1016/0005-2736(89)90529-4. PMID 2537103.
- ^ Ваксман С.А., Лешевалье Х.А., Харрис Д.А. (сентябрь 1949 г.). «Неомицин - производство и свойства антибиотиков 123». Журнал клинических исследований. 28 (5, Пет. 1): 934–9. Дои:10.1172 / JCI102182. ЧВК 438928. PMID 16695766.
- ^ Дьюик М. Д. (март 2009 г.). Лекарственные натуральные продукты: биосинтетический подход (3-е изд.). Атриум, Южные ворота, Чичестер, Западный Сассекс, PO19 8SQ, Великобритания: John Wiley and Sons Ltd., стр. 508, 510, 511. ISBN 978-0-470-74168-9.CS1 maint: location (связь)
- ^ Кудо Ф, Ямамото Й, Йокояма К., Эгути Т., Какинума К. (декабрь 2005 г.). «Биосинтез 2-дезоксистрептамина тремя ключевыми ферментами Streptomyces fradiae NBRC 12773». Журнал антибиотиков. 58 (12): 766–74. Дои:10.1038 / ja.2005.104. PMID 16506694.
- ^ Пак Дж. У., Парк С. Р., Непал К. К., Хан А. Р., Бан Ю. Х., Ю Й. Дж. И др. (Октябрь 2011 г.). «Открытие параллельных путей биосинтеза канамицина позволяет проводить манипуляции с антибиотиками». Природа Химическая Биология. 7 (11): 843–52. Дои:10.1038 / nchembio.671. PMID 21983602.
- ^ Кудо Ф., Фуджи Т., Киношита С., Эгучи Т. (июль 2007 г.). «Уникальное О-рибозилирование в биосинтезе бутирозина». Биоорганическая и медицинская химия. 15 (13): 4360–8. Дои:10.1016 / j.bmc.2007.04.040. PMID 17482823.
- ^ Фан Кью, Хуанг Ф., Лидлей П.Ф., Спенсер Дж. Б. (сентябрь 2008 г.). «Кластер биосинтетических генов неомицина Streptomyces fradiae NCIMB 8233: генетические и биохимические доказательства роли двух гликозилтрансфераз и деацетилазы». Органическая и биомолекулярная химия. 6 (18): 3306–14. Дои:10.1039 / B808734B. PMID 18802637.
- ^ Ллевеллин Н.М., Спенсер Дж. Б. (декабрь 2006 г.). «Биосинтез 2-дезоксистрептамин-содержащих аминогликозидных антибиотиков». Отчеты о натуральных продуктах. 23 (6): 864–74. Дои:10.1039 / B604709M. PMID 17119636.
- ^ Кудо Ф, Кавасима Т., Йокояма К., Эгути Т. (ноябрь 2009 г.). «Ферментативный препарат неомицина С из рибостамицина». Журнал антибиотиков. 62 (11): 643–6. Дои:10.1038 / ja.2009.88. PMID 19713992.
- ^ Cammack R, Attwood TK, Campbell PN, Parish JH, Smith AD, Stirling JL, Vella F (2006). «неомицин». Оксфордский словарь биохимии и молекулярной биологии (2-е изд.). Издательство Оксфордского университета. п. 453.
- ^ Цуджи К., Робертсон Дж. Х., Баас Р., Макиннис Д. Д. (сентябрь 1969 г.). «Сравнительное изучение ответов на неомицины В и С микробиологическими методами и методами газожидкостной хроматографии». Прикладная микробиология. 18 (3): 396–8. Дои:10.1128 / AEM.18.3.396-398.1969. ЧВК 377991. PMID 4907002.
- ^ "Нобелевская премия по физиологии и медицине 1952 г.". Нобелевский фонд. Получено 2008-10-29.
- ^ «Неомицин». Энциклопедия фармацевтического производства. 3 (3-е изд.). 2007. С. 2415–2416.
- ^ Джин Ю., Уоткинс Д., Дегтярева Н.Н., Грин К.Д., Спано М.Н., Гарно-Цодикова С., Арья Д.П. (январь 2016 г.). «Связанные с аргинином димеры неомицина B: синтез, связывание рРНК и активность фермента устойчивости». MedChemComm. 7 (1): 164–169. Дои:10.1039 / C5MD00427F. ЧВК 4722958. PMID 26811742.
- ^ Каул М., Пильч Д.С. (июнь 2002 г.). «Термодинамика распознавания аминогликозид-рРНК: связывание аминогликозидов класса неомицина с сайтом А 16S рРНК». Биохимия. 41 (24): 7695–706. Дои:10.1021 / bi020130f. PMID 12056901.
- ^ Арья Д.П., Coffee RL (сентябрь 2000 г.). «Стабилизация тройной спирали ДНК аминогликозидными антибиотиками». Письма по биоорганической и медицинской химии. 10 (17): 1897–9. Дои:10.1016 / S0960-894X (00) 00372-3. PMID 10987412.
- ^ Арья Д.П., Кофе Р.Л., Карл I (ноябрь 2001 г.). «Неомицин-индуцированное образование гибридного триплекса». Журнал Американского химического общества. 123 (44): 11093–4. Дои:10.1021 / ja016481j. PMID 11686727.
