Пептид гибридизации коллагена - Collagen hybridizing peptide

А коллагеновый гибридизующий пептид (ТЭЦ) является синтетическим пептид последовательность с обычно от 6 до 10 повторяющихся единиц Gly-Xaa-Yaa аминокислота триплет, который имитирует характерную последовательность натуральных коллагены.[1][2] Пептид CHP обычно имеет высокое содержание Пролин и Гидроксипролин в позициях Xaa и Yaa, что придает ему сильную склонность к образованию уникального коллагена. тройная спираль конформация.[1][3] В одноцепочечном (мономерном) статусе пептид может распознавать денатурированные нити коллагена в тканях, образуя гибридизованную тройную спираль с нитями коллагена.[2] Это происходит за счет сборки тройной спиральной цепи и межцепочечных водородных связей, аналогично связыванию праймеров с расплавленными ДНК пряди во время ПЦР.[4] Связывание не зависит от конкретной последовательности или эпитопа на коллагене, что позволяет КГП нацеливаться на денатурированные цепи коллагена различных типов.[5][6]
Коллаген, CHP, CMP и CLP
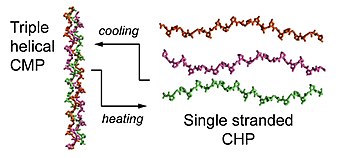
Коллаген - главный компонент внеклеточный матрикс (ECM).[7] Суперсемейство коллагена состоит из 28 различных типов коллагена.[7] Хотя функция и иерархическая структура этих коллагенов могут различаться, все они являются определяющим структурным признаком, известным как тройная спираль,[1] где трое левшей полипролин II типа (PPII) спирали собираются, образуя правосторонний спиральный мотив.[1][8] Короткие синтетические пептиды, известные как пептиды-миметики коллагена (CMP) или коллагеноподобные пептиды (CLP), сыграли важную роль в выяснении трехмерной структуры коллагена. тройная спираль, его кинетику складывания и термостабильность как малые тройные спиральные модели.[3][9][10][11] Все CMP, CLP и CHP очень похожи с точки зрения их аминокислотных последовательностей, но только когда CMP или CLP нагреваются выше их температур плавления, они существуют в диссоциированном, одноцепочечном состоянии и могут рассматриваться как CHP.[2]
Обвязочный механизм
Одноцепочечные КГП связываются с денатурированными цепями коллагена и желатин способом, который отличается от других механизмов нацеливания, поскольку они специфически распознают уникальный структурный мотив (тройная спираль коллагена ) для сворачивания и сборки цепи, в отличие от связывания специфических эпитопов, которое наблюдается для моноклональные антитела (mAbs), например.[12] Благодаря своему уникальному механизму нацеливания, CHP обладают высокой специфичностью связывания с денатурированными цепями коллагена, но почти не имеют сродства к интактному (тройной спирали) коллагену.[13] КГП могут широко нацеливаться на цепочки коллагена, денатурированные термическим,[13] химический[14] механический[15] или ферментативные процессы,[13] а также несколько типов коллагена (например, Col I, II, IV ).[5][6] Исследования также показали, что КГП и их флуорофорные конъюгаты обладают превосходной стабильностью при контакте с сывороткой.[16]
Денатурированный коллаген как биомаркер ремоделирования и повреждения тканей
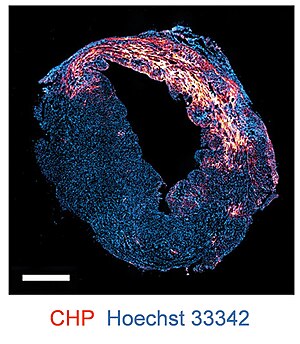
Контролируемый оборот коллагена имеет решающее значение для эмбрионального развития, морфогенеза органов, а также для поддержания и восстановления тканей.[17] Однако изменения гомеостаза коллагена связаны с многочисленными заболеваниями и патологическими состояниями. Чрезмерная деградация коллагена может быть связана с метастаз рака, старение кожи, артрит, и остеопороз.[17] CHP могут нацеливаться на ткани, претерпевающие ремоделирование, на основе их способности связываться с разрушенными и развернутыми коллагеновыми цепями посредством образования тройной спирали. В качестве целевой группы ТЭЦ обладают большим потенциалом в гистопатология, диагностика и доставка лекарств при широком спектре заболеваний.
Большинство методов оценки денатурации коллагена при болезненных состояниях являются косвенными, например, определение матричная металлопротеиназа (MMP) активность или количественное определение пептидных фрагментов коллагена в моче, сыворотке или синовиальная жидкость.[18][19][20] Используя обычные методы прямого воздействия на коллаген, исследователи должны полагаться на пептиды, связывающие коллаген, выбранные фаговый дисплей,[21] полученные из связывающих коллаген белков,[22] или антитела против коллагенов. К сожалению, эти соединения не могут воздействовать на денатурированные коллагены, которые не имеют структуры и не представляют определенный 3D-эпитоп. Кроме того, антитела, которые, как сообщалось, распознают определенные деградированные фрагменты коллагена, могут распознавать только один или несколько типов коллагена.[2][23] Напротив, CHP в принципе могут связываться со всеми типами денатурированных коллагенов.[4][5][6]
Приложения
Окрашивание тканей

Меченные флуорофором или биотином КГП используются в качестве окрашивающего агента для обнаружения деградации и денатурации коллагена через иммунофлуоресценция и иммуногистохимия Приложения.[5] ТЭЦ могут окрашивать замороженные срезы тканей, фиксированные формалином парафиновые срезы (FFPE),[5] а также свежие ткани.[14][15] CHP применим к образцам тканей от нескольких видов и целого ряда заболеваний, таких как инфаркт миокарда, артрит, нефрит, и фиброз.[5]
Визуализация in vivo
ТЭЦ также могут быть помечены флуорофоры ближнего инфракрасного диапазона за in vivo флуоресцентная визуализация.[13][24]
Идентификация коллагена
КГП можно использовать для визуализации множества различных типов коллагеновых полос в SDS-СТРАНИЦА гели.[6] Коллаген денатурируется нагреванием в присутствии SDS перед нанесением геля. Полосы коллагена визуализируются посредством гибридизации CHP-коллаген, когда гели окрашиваются флуоресцентно меченными CHP.[6]
Обнаружение механических повреждений соединительной ткани
Коллаген обеспечивает механическую прочность в несущих нагрузку тканях тела, таких как сухожилия, связки и кости. Когда к этим тканям прикладываются силы, тройная спираль коллагена может быть повреждена и раскручена, а ГПК позволяют обнаруживать механические повреждения в таких соединительных тканях на молекулярном уровне.[15][25]
Рекомендации
- ^ а б c d Плечи, Мэтью Д.; Рейнс, Рональд Т. (2009). «Структура и стабильность коллагена». Ежегодный обзор биохимии. 78: 929–958. Дои:10.1146 / annurev.biochem.77.032207.120833. ISSN 1545-4509. ЧВК 2846778. PMID 19344236.
- ^ а б c d Вахьюди, Хендра; Рейнольдс, Аманда А .; Ли, Ян; Оуэн, Шон С.; Ю., Майкл С. (октябрь 2016 г.). «Нацеливание на коллаген для диагностической визуализации и терапевтического применения». Журнал контролируемого выпуска. 240: 323–331. Дои:10.1016 / j.jconrel.2016.01.007. ЧВК 4936964. PMID 26773768.
- ^ а б Персиков, А. В .; Ramshaw, J. A .; Киркпатрик, А .; Бродский, Б. (2000-12-05). «Аминокислотные склонности тройной спирали коллагена». Биохимия. 39 (48): 14960–14967. Дои:10.1021 / bi001560d. ISSN 0006-2960. PMID 11101312.
- ^ а б Ли, Ян; Ю., Майкл С. (декабрь 2013 г.). «Нацеливание и имитация коллагенов через тройную спиральную сборку пептидов». Современное мнение в области химической биологии. 17 (6): 968–975. Дои:10.1016 / j.cbpa.2013.10.018. ISSN 1879-0402. ЧВК 3863647. PMID 24210894.
- ^ а б c d е ж Хван, Чонмин; Хуанг, Юфэн; Беруэлл, Тимоти Дж .; Петерсон, Норман С.; Коннор, Джейн; Вайс, Стивен Дж .; Ю., С. Майкл; Ли, Ян (2017-10-24). «Визуализация ремоделирования тканей с помощью пептидов, гибридизирующих коллаген». САУ Нано. 11 (10): 9825–9835. Дои:10.1021 / acsnano.7b03150. ISSN 1936-0851. ЧВК 5656977. PMID 28877431.
- ^ а б c d е Ли, Ян; Хо, Даниэль; Мэн, Хуан; Чан, Таня Р .; Ан, Бо; Ю, Хэнри; Бродский, Варвара; Jun, Albert S .; Михаил Ю, С. (16.01.2013). «Прямое определение коллагеновых белков флуоресцентно мечеными пептидами-миметиками коллагена». Биоконъюгат Химия. 24 (1): 9–16. Дои:10.1021 / bc3005842. ISSN 1043-1802. ЧВК 3586774. PMID 23253177.
- ^ а б Бирк, Дэвид Э .; Брукнер, Питер (2005-04-12), "Коллагеновые супраструктуры", Темы современной химии, Springer Berlin Heidelberg, стр. 185–205, Дои:10.1007 / b103823, ISBN 9783540232728
- ^ Энгель, Юрген; Бехингер, Ханс Петер (2005-04-12), "Структура, стабильность и складывание тройной спирали коллагена", Темы современной химии, Springer Berlin Heidelberg, стр. 7–33, Дои:10.1007 / b103818, ISBN 9783540232728
- ^ Будько, Сергей; Франк, Сабина; Каммерер, Ричард А .; Стетефельд, Йорг; Шультесс, Тереза; Ландвер, Рут; Люстиг, Ариэль; Бэхингер, Ганс Петер; Энгель, Юрген (март 2002). «Зарождение и распространение тройной спирали коллагена в одноцепочечных и тримеризованных пептидах: переход от кинетики третьего к первому порядку». Журнал молекулярной биологии. 317 (3): 459–470. Дои:10.1006 / jmbi.2002.5439. ISSN 0022-2836. PMID 11922677.
- ^ Бэхингер, Ганс Петер; Моррис, Николас П .; Дэвис, Дженис М. (1993-01-15). «Термическая стабильность и сворачивание тройной спирали коллагена и влияние мутаций несовершенного остеогенеза на тройную спираль коллагена I типа». Американский журнал медицинской генетики. 45 (2): 152–162. Дои:10.1002 / ajmg.1320450204. ISSN 0148-7299. PMID 8456797.
- ^ Холмгрен, Стивен К .; Тейлор, Кимберли М .; Bretscher, Lynn E .; Рейнс, Рональд Т. (апрель 1998 г.). «Расшифрован код стабильности коллагена». Природа. 392 (6677): 666–667. Дои:10.1038/33573. ISSN 0028-0836. PMID 9565027. S2CID 4425523.
- ^ Сюй, Цзинсонг; Родригес, Дороти; Ким, Дженни Дж .; Брукс, Питер С. (октябрь 2000 г.). «Создание моноклональных антител к скрытым сайтам коллагена с помощью субтрактивной иммунизации». Гибридома. 19 (5): 375–385. Дои:10.1089/02724570050198893. ISSN 0272-457X. PMID 11128027.
- ^ а б c d Li, Y .; Foss, C.A .; Саммерфилд, Д. Д .; Дойл, Дж. Дж .; Torok, C.M .; Dietz, H.C .; Pomper, M. G .; Ю., С. М. (27.08.2012). «Нацеливание на коллагеновые нити посредством фото-триггерной гибридизации с тройной спиралью». Труды Национальной академии наук. 109 (37): 14767–14772. Дои:10.1073 / pnas.1209721109. ISSN 0027-8424. ЧВК 3443117. PMID 22927373.
- ^ а б Хван, Чонмин; Сан, Бой Хоа; Тернер, Нил Дж .; Белый, Лиза Дж .; Фолк, Денвер М .; Бадилак, Стивен Ф .; Ли, Ян; Ю., С. Майкл (апрель 2017 г.). «Молекулярная оценка денатурации коллагена в децеллюляризованных тканях с использованием гибридизующего пептида коллагена». Acta Biomaterialia. 53: 268–278. Дои:10.1016 / j.actbio.2017.01.079. ISSN 1742-7061. ЧВК 5462463. PMID 28161576.
- ^ а б c Weiss, Jeffrey A .; Ю., С. Майкл; Бюлер, Маркус Дж .; Риз, Шон П .; Депалле, Батист; Сан, Бой Хоа; Цинь, Чжао; Ли, Ян; Зитнай, Джаред Л. (22 марта 2017 г.). «Обнаружение на молекулярном уровне и локализация механических повреждений в коллагене благодаря гибридизации коллагеновых пептидов». Nature Communications. 8: 14913. Дои:10.1038 / ncomms14913. ISSN 2041-1723. ЧВК 5364439. PMID 28327610.
- ^ Беннинк, Лукас Л .; Смит, Дэниел Дж .; Фосс, Кэтрин А .; Помпер, Мартин Г .; Ли, Ян; Ю, С. Майкл (2017-05-08). «Высокая стабильность сыворотки гибридизирующих коллаген пептидов и их флуорофорных конъюгатов». Молекулярная фармацевтика. 14 (6): 1906–1915. Дои:10.1021 / acs.molpharmaceut.7b00009. ISSN 1543-8384. PMID 28445649.
- ^ а б Боннанс, Кэролайн; Чжоу, Джонатан; Верб, Зена (декабрь 2014 г.). «Ремоделирование внеклеточного матрикса в процессе развития и болезни». Обзоры природы Молекулярная клеточная биология. 15 (12): 786–801. Дои:10.1038 / nrm3904. ISSN 1471-0072. ЧВК 4316204. PMID 25415508.
- ^ Немировский, О.В .; Dufield, D.R .; Sunyer, T .; Aggarwal, P .; Welsch, D.J .; Мэтьюз, W.R. (февраль 2007 г.). «Открытие и разработка биомаркера неоэпитопа коллагена типа II (TIINE) для активности матриксной металлопротеиназы: от in vitro до in vivo». Аналитическая биохимия. 361 (1): 93–101. Дои:10.1016 / j.ab.2006.10.034. PMID 17187753.
- ^ Garvican, Elaine R .; Воан-Томас, Энн; Иннес, Джон Ф .; Клегг, Питер Д. (июль 2010 г.). «Биомаркеры хрящевого обновления. Часть 1. Маркеры деградации и синтеза коллагена». Ветеринарный журнал. 185 (1): 36–42. Дои:10.1016 / j.tvjl.2010.04.011. PMID 20488735.
- ^ Руссо, Жан-Шарль; Дельмас, Пьер Д. (июнь 2007 г.). «Биологические маркеры остеоартроза». Природа Клиническая Практика Ревматология. 3 (6): 346–356. Дои:10.1038 / ncprheum0508. ISSN 1745-8382. PMID 17538566. S2CID 13168927.
- ^ Helms, Brett A .; Reulen, Sanne W. A .; Ниджхейс, Себастьян; Грааф-Хевельманс, Пегги Т. Х. М. де; Merkx, Maarten; Мейер, Э. У. (26 августа 2009 г.). "Таргетинг на высокоаффинный пептидный коллаген с использованием синтетических имитаторов фагов: от фагового дисплея до дендримерного дисплея". Журнал Американского химического общества. 131 (33): 11683–11685. Дои:10.1021 / ja902285m. ISSN 0002-7863. PMID 19642697.
- ^ Лян, Хуэй; Ли, Сяорань; Чен, Бинг; Ван, Бин; Чжао, Яннань; Чжуан, Ян; Шен, Он; Чжан, Чжицзюнь; Дай, Цзяньву (июль 2015 г.). «Фрагмент одноцепочечного Fv-антитела, связывающего коллаген EGFR, для направленной терапии рака». Журнал контролируемого выпуска. 209: 101–109. Дои:10.1016 / j.jconrel.2015.04.029. PMID 25916496.
- ^ Фреймарк, Брюс; Кларк, Дерек; Перназетти, Флавия; Никель, Джефф; Мышка, Дэвид; Baeuerle, Patrick A .; Ван Эппс, Деннис (июль 2007 г.). «Нацеливание гуманизированного антитела D93 на участки ангиогенеза и роста опухоли путем связывания с множественными эпитопами на денатурированных коллагенах». Молекулярная иммунология. 44 (15): 3741–3750. Дои:10.1016 / j.molimm.2007.03.027. PMID 17507095.
- ^ Беннинк, Лукас Л .; Ли, Ян; Ким, Бумджин; Шин, Ик Джэ; Сан, Бой Хоа; Зангари, Маурицио; Юн, Донхун; Ю., С. Майкл (ноябрь 2018). «Визуализация протеолиза коллагена путем гибридизации пептидов: от трехмерной клеточной культуры к визуализации in vivo». Биоматериалы. 183: 67–76. Дои:10.1016 / j.biomaterials.2018.08.039. PMID 30149231.
- ^ Converse, Мэтью I .; Вальтер, Раймонд Дж .; Инграм, Джастин Т .; Ли, Ян; Ю., С. Майкл; Монсон, Кеннет Л. (01.02.2018). «Обнаружение и характеристика повреждения коллагена на молекулярном уровне в чрезмерно растянутых церебральных артериях». Acta Biomaterialia. 67: 307–318. Дои:10.1016 / j.actbio.2017.11.052. ISSN 1742-7061. ЧВК 5794621. PMID 29225149.
