Открытие и разработка ингибиторов АПФ - Discovery and development of ACE inhibitors
Обнаружение орально неактивного пептид из Змеиный яд установил важную роль фермент, превращающий ангиотензин (ТУЗ) ингибиторы в регулировании артериальное давление. Это привело к разработка из Каптоприл, первый Ингибитор АПФ. Когда побочные эффекты Каптоприла стало очевидно, что были разработаны новые производные. Затем после открытия двух активные сайты АПФ: N-домен и С-домен началась разработка доменно-специфических ингибиторов АПФ.[1][2]
Разработка ингибиторов АПФ первого поколения
Развитие нонапептид тепротид (Glu -Trp -Pro -Arg -Pro-Gln -Иль -Pro-Pro), который изначально был выделен из яда бразильской гадюки. Ботропс Харарака, значительно прояснили важность ACE в гипертония. Однако отсутствие пероральной активности ограничивает его терапевтическую ценность.[3][4]
L-бензилЯнтарная кислота (2 (R) -бензил-3-карбоксипропионовая кислота) была описана как наиболее мощный ингибитор карбоксипептидаза А в начале 1980-х гг. В авторы назвал это побочный продукт аналог и было предложено связываться с активным центром карбоксипептидазы A через сукцинил карбоксильная группа и карбонильная группа. Их результаты установили, что L-бензилянтарная кислота связывается в одном локусе в активном центре карбоксипептидазы A. Авторы обсуждали, но отклонили предложение что карбоксилат функция может связываться с каталитически функциональной цинк ион присутствует на активном сайте. Однако позже выяснилось, что это так.[3][5][6]
Дизайн препарата каптоприл (сульфгидрилы)
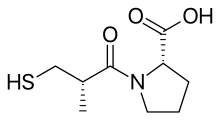
Более 2000 соединения были протестированы случайным образом в морская свинка подвздошная кишка test и было обнаружено, что сукцинил-L-пролин обладает свойствами специфического ингибитора АПФ. Он показал ингибирующее действие ангиотензин I и брадикинин не оказывая никакого влияния на ангиотензин II. Затем исследователи начали поиск модели, объясняющей торможение на основе конкретных химические взаимодействия соединений с активным центром АПФ.[5] Предыдущие исследования с субстраты и ингибиторы АПФ предположили, что это был цинксодержащий металлопротеин и карбоксипептидаза, подобная панкреатический карбоксипептидаза А. Однако АПФ высвобождает дипептиды а не одинокий аминокислоты от C-конец из пептид субстраты. И предполагалось, что оба их механизм действия и их активный сайт может быть похож. Положительно заряжен Arg145 считалось, что активный сайт связывается с отрицательно заряженной С-концевой карбоксильной группой пептидного субстрата. Было также предложено, чтобы ACE связывает водородная связь к терминалу, без ножниц, пептидная связь субстрата.[3]
Но поскольку АПФ представляет собой дипептид карбоксипептидазу, в отличие от карбоксипептидазы А, расстояние между катионным карбоксилсвязывающим сайтом и атомом цинка должно быть больше, примерно на длину одного аминокислотного остатка. Пролин был выбран в качестве аминокислоты часть из-за его присутствия в качестве аминокислотного остатка на конце карбокси в тепротиде и других ингибиторах АПФ, обнаруженных в ядах змей. Были протестированы еще 11 аминокислот, но ни одна из них не оказалась более ингибирующей. Было высказано предположение, что производное сукциниламинокислоты должно быть ингибитором АПФ, и было обнаружено, что таким ингибитором является сукцинил-L-пролин.[3][5][7]
Также было известно, что природа предпоследнего аминокислотного остатка пептидного субстрата для АПФ влияет на связывание с ферментом. В ацильная группа карбоксиалканоиламинокислоты связывает ион цинка фермента и занимает то же положение в активном центре АПФ, что и предпоследний. Следовательно заместитель ацильной группы также может влиять на связывание с ферментом. А 2-метил заместитель с D-конфигурацией усиливает ингибирующий потенция примерно в 15 раз больше сукцинил-L-пролина. Затем начались поиски группы, которая лучше связывает цинк. Замена сукцинилкарбоксильной группы на азот -содержащие функциональные возможности (амин, амид или же гуанидин ) не усиливали ингибирующую активность. Однако прорыв в эффективности был достигнут за счет замены карбоксильной группы сульфгидрильной функцией (SH ), группа с большим близость для связанного ферментом иона цинка. В результате был получен мощный ингибитор, который был в 1000 раз сильнее, чем сукцинил-L-пролин.[3][7]Оптимальная длина ацильной цепи для меркаптоалканоил Производные пролина оказались 3-меркаптопропаноил-L-пролином, в 5 раз превосходящим производные 2-меркаптоалканоила и в 50 раз превосходящие производные 4-меркаптоалканоила. Таким образом, D-3-меркапто-2-метилпропаноил-L-пролин или каптоприл был самым сильным ингибитором. Позже исследователи сравнили несколько ингибиторов меркаптоациламинокислоты и пришли к выводу, что связывание ингибитора с ферментом включает водородную связь между донорным участком на ферменте и кислородом амидного карбонила, как и предполагалось для субстратов.[3][8]
Разработка лекарственных препаратов других ингибиторов АПФ первого поколения


Наиболее частые побочные эффекты каптоприла, кожа сыпь и потеря вкус, такие же, как вызванные меркаптосодержащими пеницилламин. Таким образом, группа исследователей стремилась найти сильнодействующие селективные ингибиторы АПФ, которые не содержали бы меркапто (SH) функции и имели бы более слабую функцию. хелатирующий функция. Они вернулись к работе с карбоксильными соединениями и начали работать с замещенными N-карбоксиметил-дипептиды как общая структура (R-CHCOOH-A1-А2). Согласно предыдущим исследованиям они предположили, что циклический иминокислоты приведет к хорошей активности, если будет замещен на карбоксильном конце дипептида. Следовательно, подставляя A2 с пролином дали хорошие результаты. Они также отметили, что в соответствии со специфичностью фермента иминокислоты в положении рядом с карбоксильным концом не дают сильнодействующего соединения. Подставляя R и A1 группы с гидрофобный и базовый остатки дадут сильнодействующее соединение. Замена –NH в общей структуре приводит к потере активности, что соответствует потребности фермента в –NH в соответствующем положении на субстратах. Результатом стали 2 активных ингибитора: Эналаприлат и Лизиноприл. Оба эти соединения имеют фенилаланин в позиции R, которая занимает S1 бороздка в ферменте. Таким образом, результатом стали эти два новых мощных аналога трипептида с карбоксильной группой, координирующей цинк: эналаприлат и лизиноприл.[1][9]
Обнаружение 2 активных сайтов: C-домен и N-домен
Большинство ингибиторов АПФ на рынке сегодня неизбирательный по отношению к двум активным центрам АПФ, поскольку их связывание с ферментом в основном основано на сильном взаимодействие между атомом цинка в ферменте и сильной хелатирующей группой ингибитора. Разрешение 3D структура зародышевого АПФ, имеющая только один активный сайт, соответствующий C-домену соматический ACE предлагает структурную основу для структурно-ориентированного подхода к проектированию. Хотя N- и C-домен имеют сопоставимые показатели in vitro гидролиза АПФ, похоже, что in vivo C-домен в основном отвечает за регулирование артериального давления. Это указывает на то, что селективные ингибиторы C-домена могут иметь профиль, аналогичный профилю текущих неселективных ингибиторов. Ангиотензин I в основном гидролизуется С-доменом. in vivo но брадикинин гидролизуется обоими активными центрами. Таким образом, разработка селективного ингибитора C-домена позволит некоторым деградация брадикинина с помощью N-домена, и этой деградации может быть достаточно, чтобы предотвратить накопление избыточного брадикинина, которое наблюдалось во время атак ангионевротический отек. Селективное ингибирование С-домена могло бы привести к специализированному контролю артериального давления с меньшими затратами. вазодилататор -связанные побочные эффекты. С другой стороны, селективные ингибиторы N-домена дают возможность открыть новые терапевтические области. По-видимому, N-домен не играет большой роли в контроле артериального давления, но, по-видимому, является основным. метаболизм фермент для AcSDKP, естественного геморегуляторного гормон.[1][10][11]
Разработка лекарственных препаратов кето-АПФ и его производных кетометилена
Было обнаружено, что другие карбонилсодержащие группы, такие как кетоны может заменить амидную связь, которая связывает Phe и Gly в ингибиторах АПФ. Кето-АПФ, впервые описанный в 1980 году, стал потенциальным ведущим соединением для ингибиторов АПФ, специфичных для С-домена. Кето-АСЕ, а трипептид аналог Phe-Gly-Pro, содержит громоздкий P1 и P2 бензил кольцо, и было показано, что он ингибирует гидролиз ангиотензина I и брадикинина через C-домен. Синтез аналогов кето-АПФ с Trp или Phe на P2Позиция привела к заметному увеличению C-домена избирательность, но введение алифатический п2 группа предоставила селективность N-домена. Ингибирующая способность может быть дополнительно усилена включением гидрофобного заместителя, такого как фенильная группа, в P1' позиция. п1'Заместители с S-стереохимия также было показано, что они обладают большей ингибирующей способностью, чем их R-аналоги.[2][8][12][13]
Кето-АПФ был использован в качестве основы для дизайна производных кетометилена. Его аналоги содержат кетометилен. изостера замена на ножничная связка который, как считается, имитирует тетраэдр переходное состояние из протеолитический реакция на активном сайте. Основное внимание было уделено простому трипептиду Phe-Ala-Pro, который ранее ферментные анализы проявил ингибирующую активность. Замена аланина глицином давала трипептид с 1/14 ингибирующей активности Phe-Ala-Pro. Бензоилированное производное Phe-Gly-Pro, Bz-Phe-Gly-Pro, было в два раза активнее. Чтобы снизить пептидную природу ингибиторов кетометилена, P1’И P2'Заместитель может быть циклизован с образованием лактам, где существует корреляция между ингибирующей способностью и размером кольца. В 2001 г. было постулировано, что замена α к азоту и получению 3-метилзамещенного аналога A58365A, пиридоновой кислоты, выделенной в результате ферментации бульон из бактерия Streptomyces хромофускус с ингибирующей активностью АПФ, может влиять на уровень биологическая активность к стерический или же гидрофобный эффект, и / или предотвращая реакции на C3. Это также было замечено во время синтетический работать на A58365A, что потенциал предшественники были чувствительны к окисление пятичленного кольца, и поэтому 3-метильный аналог может быть более стабильным в этом отношении.[2][14][15]
Дизайн препарата силандиол
Дело в том, что углерод и силикон имеют схожие, но также разные характеристики, что вызвало интерес к замене углерода силандиолом в качестве центральной хелатирующей группы цинка. Силикон образует соединение диалкилсиландиола, которое в достаточной степени затруднено, поэтому образование силоксан полимер не происходит. Силандиолы более стабильны, чем углерод диолы поэтому ожидается, что они будут дольше период полураспада. Силандиолы также нейтральны по физиологическим показателям. pH (не ионизировать ) .Четыре стереоизомеры силандиола Phe-Ala сравнивали с ингибиторами на основе кетонов, и было обнаружено, что силандиол в четыре раза менее эффективен, чем аналог кетона. Это связано с тем, что силандиолы являются более слабыми хелаторами цинка по сравнению с кетонами. Замена силандиола на группу метилсилана дала мало фермент торможение. Это подтверждает, что силандиоловая группа взаимодействует с АПФ как аналог переходного состояния и взаимодействие аналогично кетону.[16][17] Если бензильная группа силандиола заменена на i-бутил группа дает более слабый ингибитор АПФ. Введение гидрофобного метилфенила дает немного большую эффективность, чем аналог с трет-бутильной группой при P1. Это говорит о том, что метилфенил дает лучшее распознавание S1, чем трет-бутильная группа.[2]
Фосфиновые пептиды
Фосфиновый пептиды - это псевдопептиды, в которых фосфиновая кислота облигация (ЗП2-CH-) заменил пептидную связь в последовательности аналога пептида. В некоторой степени химическая структура фосфиновых пептидов аналогична таковой из промежуточные звенья которые производятся в гидролиз пептидов протеолитическими ферментами. В гипотеза Было установлено, что эти псевдопептиды имитируют структуру ферментных субстратов в их переходном состоянии и кристаллография протеаз цинка в комплексе с фосфиновыми пептидами подтверждает эту гипотезу.[10]
Лекарственный дизайн RXP 407
RXP 407 - это первый фосфиновый пептид, селективный к N-домену, который был обнаружен путем скрининга библиотек фосфиновых пептидов. До открытия RXP 407 давно утверждалось, что свободная C-концевая карбоксилатная группа в P2'Положение было важным для эффективности ингибитора АПФ, поэтому можно предположить, что это отложило открытие селективных ингибиторов АПФ к N-домену. Когда был обнаружен RXP 407, исследователи изучили фосфиновые пептиды с 3 различными общими формулами, каждая из которых содержала 2 неидентифицированные аминокислоты, только 1 из этих общих формул показала сильное ингибирование (Ac-Yaa-Pheψ (PO2-CH2) Ала-Яа-NH2). Были приготовлены смеси пептидов, в которых Yaa и Yaa ’были заменены различными аминокислотами, пытаясь установить, существует ли мощный ингибитор, который мог бы ингибировать либо N-домен, либо C-домен фермента. В результате соединение Ac-Жерех(L)-Pheψ (PO2-CH2)(L)Ала-Ала-NH2 активно ингибировал N-домен и получил название RXP 407. Взаимосвязь структура-функция показала, что карбоксамидная группа С-конца играет решающую роль в селективности N-домена ACE. Кроме того, N-ацетильная группа и боковая цепь аспарагиновой кислоты в P2 Положение способствует селективности ингибитора к N-домену. Эти особенности делают ингибитор недоступным для C-домена, но дают хорошую эффективность для N-домена, что приводит к разнице в ингибирующей способности активных сайтов на три порядка величины. Эти результаты также показывают, что N-домен обладает более широкой селективностью, чем C-домен. Еще одно различие между более старыми ингибиторами АПФ и RXP 407 заключается в том, что молекулярный размер соединения. Более старые ингибиторы АПФ в основном взаимодействовали с S1’, S2’И S1 подсайты, но RXP 407 взаимодействует дополнительно с S2 дочерний сайт. Это также важно для селективности ингибитора, поскольку боковая цепь аспарагиновой кислоты и N-ацетильная группа расположены в P2 позиция.[18]
Лекарственный дизайн RXPA 380
RXPA380 был первым ингибитором, который был высокоселективным по отношению к C-домену ACE, он имеет формулу Phe-Phe-Pro-Trp.[1] Разработка этого соединения была основана на исследованиях, которые показали, что некоторые пептиды, усиливающие брадикинин, проявляют селективность в отношении C-домена, и все они содержат несколько пролинов в своей структуре. Эти наблюдения привели исследователей к синтезу фосфиновых пептидов, содержащих остаток пролина в P1’И оценка этих соединений привели к открытию RXPA380.[19] Чтобы изучить роль остатков на RXPA380, исследователи создали 7 аналогов RXPA380. Все полученные соединения были получены как смесь 2 или 4 диастереоизомеры но все они были легко разрешены, и только один из них был действенным. Это согласуется с первоначальными модельными исследованиями RXPA380, которые показали, что только один диастереомер может размещаться в активном центре зародышевого АПФ. Аналоги, в которых были заменены остатки псевдопролина или триптофана, показали меньшую селективность, чем RXPA380. Вероятно, это связано с тем, что эти два аналога обладают большей активностью в отношении N-домена, чем RXPA380. Замена обоих этих остатков дает большую эффективность, но не селективность. Это показывает, что остатки псевдопролина и триптофана хорошо приспосабливаются к C-домену, но не к N-домену. Еще 2 аналога с псевдопролином и триптофаном, но без остатка псевдофенилаланина в P1 положение показало низкую эффективность для N-домена, аналогичную RXPA380. Это подтверждает важную роль этих двух остатков в селективности в отношении C-домена. Эти два аналога также имеют меньшую активность в отношении C-домена, что показывает, что C-домен предпочитает псевдофенилаланиновую группу в P1 позиция. Моделирование комплекса RXPA380-ACE показало, что псевдопролиновый остаток ингибитора окружен аминокислотами, аналогичными аминокислотам в N-домене, таким образом, взаимодействуя с S2’Может не отвечать за селективность RXPA380. 7 из 12 аминокислот, окружающих триптофан, одинаковы в C- и N-доменах, самая большая разница состоит в том, что 2 объемные и гидрофобные аминокислоты в C-домене были заменены на 2 более мелкие и полярные аминокислоты в N-домене. Это указывает на то, что низкая эффективность RXPA380 для N-домена не связана с тем, что S2'Полость не вмещает боковую цепь триптофана, а скорее отсутствуют важные взаимодействия между боковой цепью триптофана и аминокислотами С-домена. На основе близости боковой цепи триптофана и Asp1029 также возможна водородная связь между карбоксилатом Asp1029 и NH индол кольцо в C-области, но это взаимодействие намного слабее в N-области.[1]
Рекомендации
- ^ а б c d е Acharya, K.R .; Sturrock, E.D .; Riodan, J.K .; Элерс, М.Р. (2003), «Повторное посещение ACE: новая цель для проектирования земляных работ на основе конструкций», Обзоры природы Drug Discovery, 2 (11): 891–902, Дои:10.1038 / nrd1227, ЧВК 7097707, PMID 14668810
- ^ а б c d Redelinghuys, P .; Nchinda, A.T .; Старрок, Э. (2005), «Разработка доменно-селективных ингибиторов ферментов», Летопись Нью-Йоркской академии наук, 1056: 160–175, Дои:10.1196 / летопись.1352.035, PMID 16387685, S2CID 25407204
- ^ а б c d е ж Cushman, D.W .; Cheung, H.S .; Sabo, E.F .; Ондетти, M.A. (1977), "Разработка эффективных конкурентных ингибиторов ангиотензин-превращающего фермента. Карбоксиалканоил и меркаптоалканоил аминокислоты", Биохимия, 16 (25): 5484–5491, Дои:10.1021 / bi00644a014, PMID 200262
- ^ Crantz, F.R .; Swartz, S.L .; Холленберг, Н.К .; Мур, T.J .; Dluhy, R.G .; Уильямс, Г. (1980), «Различия в реакции на ингибиторы пептидипептидгидролазы SQ 20,881 и SQ 14,225 при эссенциальной гипертензии с нормальным ренином», Гипертония, 2 (5): 604–609, Дои:10.1161 / 01.hyp.2.5.604, PMID 6158478
- ^ а б c Cushman, D.W .; Ондетти, М.А. (1991), "История создания каптоприла и связанных с ним ингибиторов ангиотензинпревращающего фермента.", Гипертония, 17 (4): 589–592, Дои:10.1161 / 01.hyp.17.4.589, PMID 2013486
- ^ Byers, L.D .; Вольфенден, Р. (1973), "Связывание побочного продукта аналога бензилянтарной кислоты карбоксипептидазой А.", Биохимия, 12 (11): 2070–2078, Дои:10.1021 / bi00735a008, PMID 4735879
- ^ а б Ондетти, M.A .; Рубин, Б .; Кушман, Д. (1977), «Дизайн специфических ингибиторов ангиотензин-превращающего фермента: новый класс перорально активных антигипертензивных агентов», Наука, 196 (4288): 441–444, Bibcode:1977Наука ... 196..441O, Дои:10.1126 / наука.191908, PMID 191908
- ^ а б Condon, M.E .; и другие. (1982), "Ингибиторы ангиотензинпревращающего фермента: важность амид-карбонила меркаптоациламинокислот для связывания водорода с ферментом", Журнал медицинской химии, 25 (3): 250–258, Дои:10.1021 / jm00345a011, PMID 6279843
- ^ Patchett, A.A .; и другие. (1980), «Новый класс ингибиторов ангиотензинпревращающего фермента», Природа, 288 (5788): 280–283, Bibcode:1980Натура.288..280P, Дои:10.1038 / 288280a0, PMID 6253826
- ^ а б Дайв, В .; и другие. (2004), «Обзор: фосфиновые пептиды как ингибиторы металлопротеиназы цинка», Клеточные и молекулярные науки о жизни, 61 (16): 2010–2019, Дои:10.1007 / s00018-004-4050-у, PMID 15316651
- ^ Gerogiadis, D .; Guniasse, P .; Cotton, J .; Yiotakis, A .; Дайв В. (2004), "Структурные детерминанты RXPA380, мощного и высокоселективного ингибитора С-домена ангиотензин-превращающего фермента", Биохимия, 43 (25): 8048–8054, Дои:10.1021 / bi049504q, PMID 15209500
- ^ Nchinda, A.T .; Chibale, K .; Redelinghuys, P .; Стиррок, Э. (2006), «Синтез новых аналогов кето-АПФ в качестве доменно-селективных ингибиторов ангиотензин-превращающего фермента», Письма по биоорганической и медицинской химии, 16 (17): 4612–4615, Дои:10.1016 / j.bmcl.2006.06.003, PMID 16784850
- ^ Redelinghuys, P .; Nchinda, A.T .; Chibale, K .; Старрок, Э. (2006), «Новые кетометиленовые ингибиторы ангиотензин-I-превращающего фермента (АПФ): ингибирование и молекулярное моделирование», Биологическая химия, 387 (4): 461–466, Дои:10.1515 / BC.2006.061, PMID 16606345
- ^ Almquist, R.G .; Chao, W.R .; Ellis, M.E .; Джонсон, Х.Л. (1980), "Синтез и биологическая активность кетометиленового аналога трипептидного ингибитора ангиотензин-превращающего фермента", Журнал медицинской химии, 23 (12): 1392–1398, Дои:10.1021 / jm00186a020, PMID 6256550
- ^ Clive, D.L.J .; Ян, H .; Леванчук, Э. (2001), «Синтез и активность in vitro неэпимеризуемого аналога ингибитора ангиотензинпревращающего фермента A58365A», Химия, 4 (6): 505–512, Дои:10.1016 / с1387-1609 (01) 01263-4
- ^ Kim, J .; Зибурт, С. (2004), «Силандиоловые пептидомиметики. Оценка четырех диастереомерных ингибиторов АПФ», Письма по биоорганической и медицинской химии, 14 (11): 2853–2856, Дои:10.1016 / j.bmcl.2004.03.042, PMID 15125946
- ^ Kim, J .; Hewitt, G .; Carroll, P .; Зибурт, С. (2005), "Силандиоловые ингибиторы ангиотензин-превращающего фермента. Синтез и оценка четырех диастереомеров аналогов дипептида Phe [Si] Ala", Журнал органической химии, 70 (15): 5781–5785, Дои:10.1021 / jo048121v, PMID 16018669
- ^ Дайв, В .; и другие. (1999), «RXP 407, фосфиновый пептид, является мощным ингибитором ангиотензин I, превращающего фермент, способный различать два своих активных сайта», PNAS, 96 (8): 4330–4335, Bibcode:1999PNAS ... 96.4330D, Дои:10.1073 / пнас.96.8.4330, ЧВК 16332, PMID 10200262
- ^ Георгиадис, Д .; Beau, F .; Чарны, Б; Коттин, Дж; Йотакис, А; Dive, V (2003), «Роли двух активных сайтов соматического ангиотензин-превращающего фермента в расщеплении ангиотензина I и брадикинина: выводы из селективных ингибиторов», Циркуляционные исследования, 93 (2): 148–154, Дои:10.1161 / 01.RES.0000081593.33848.FC, PMID 12805239
