Структура и геном ВИЧ - Structure and genome of HIV
В геном и белки из ВИЧ (Вирус иммунодефицита человека) были предметом обширных исследований с момента открытия вируса в 1983 году.[1][2] «При поиске возбудителя первоначально предполагалось, что этот вирус представляет собой форму вируса Т-клеточного лейкоза человека (HTLV), который, как было известно, в то время влияет на иммунную систему человека и вызывает определенные лейкемии. Однако, исследователи из Института Пастера в Париже выделили ранее неизвестный и генетически отличный ретровирус у пациентов со СПИДом, который позже был назван ВИЧ ». [3] Каждый вирион включает в себя вирусный конверт и связанная матрица, содержащая капсид, который включает в себя две копии одноцепочечного РНК геном и несколько ферменты. Открытие самого вируса произошло через два года после сообщения о первых серьезных случаях заболеваний, связанных со СПИДом.[4][5]
Структура
Полная последовательность генома ВИЧ-1, выделенная из инфекционных вирионов, была решена до разрешения одного нуклеотида.[6]Геном ВИЧ кодирует небольшое количество вирусных белков, неизменно устанавливая кооперативные ассоциации между белками ВИЧ и между ВИЧ и белками хозяина, чтобы проникнуть в клетки хозяина и захватить их внутренние механизмы.[7]
ВИЧ отличается по структуре от других ретровирусы. Вирион ВИЧ имеет диаметр ~ 100 нм. Его самая внутренняя область состоит из конусообразного ядра, которое включает две копии (положительного смысла) генома оцРНК, ферменты обратной транскриптазы, интегразы и протеазы, некоторые второстепенные белки и основной белок ядра.[8] Геном вируса иммунодефицита человека (ВИЧ) кодирует 8 вирусных белков, играющих важную роль в жизненном цикле ВИЧ.[7]

ВИЧ-1 состоит из двух копий нековалентно связанных, неспецифических, позитивный смысл одноцепочечная РНК, заключенная в конический капсид, состоящий из вирусного белка стр. 24, типично лентивирусы.[9][10] Компонент РНК - 9749 нуклеотиды длинная[11][12] и несет 5 ’крышка (Gppp), 3 ’ поли (А) хвост, и много открытые рамки для чтения (ORF).[13] Структурные белки вируса кодируются длинными ORF, тогда как меньшие ORF кодируют регуляторы жизненного цикла вируса: прикрепление, слияние мембран, репликацию и сборку.[13]
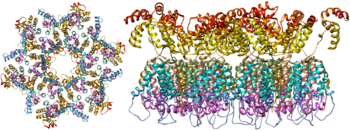
Одноцепочечная РНК прочно связана с p7. нуклеокапсид белки, белок поздней сборки p6 и ферменты необходимы для развития вириона, например обратная транскриптаза и интегрировать. Лизиновая тРНК представляет собой праймер для магнийзависимой обратной транскриптазы.[9] Нуклеокапсид связывается с геномной РНК (одна молекула на гексамер) и защищает РНК от переваривания путем нуклеазы. В частицу вириона также заключены Vif, Впр, Неф, и вирусные протеаза. Матрица, состоящая из ассоциации вирусного белка p17, окружает капсид, обеспечивая целостность частицы вириона. Это, в свою очередь, окружено конверт происхождения клетки-хозяина. Оболочка образуется, когда капсид отрывается от клетки-хозяина, забирая с собой часть мембраны клетки-хозяина. Оболочка включает гликопротеины gp120 и gp41, которые отвечают за связывание с клеткой-хозяином и проникновение в нее.
Будучи единственными белками на поверхности вируса, гликопротеины оболочки (gp120 и gp41) являются основными мишенями для Вакцина против ВИЧ усилия.[14] Более половины массы шипа тримерной оболочки составляет N-связанные гликаны. Плотность высока, как гликаны защищает базовый вирусный белок от нейтрализации антителами. Это одна из известных молекул с наиболее плотным гликозилированием, и ее плотность достаточно высока, чтобы предотвратить нормальный процесс созревания гликанов во время биогенеза в эндоплазматическом аппарате и аппарате Гольджи.[15][16] Таким образом, большинство гликанов останавливаются как незрелые гликаны с высоким содержанием маннозы, которые обычно не присутствуют на секретируемых гликопротеинах человека или гликопротеинах клеточной поверхности.[17] Необычный процессинг и высокая плотность означают, что почти все широко нейтрализующие антитела, которые были идентифицированы до сих пор (от подгруппы пациентов, которые были инфицированы в течение многих месяцев или лет), связываются с этими гликанами оболочки или адаптированы для борьбы с ними.[18]
Молекулярная структура вирусного спайка теперь определена с помощью рентгеновской кристаллографии.[19] и криоэлектронная микроскопия.[20] Эти успехи в структурной биологии стали возможными благодаря развитию стабильных рекомбинантных форм вирусного шипа за счет введения межсубъединичной дисульфидной связи и мутации изолейцина в пролин в gp41.[21] Так называемые тримеры SOSIP не только воспроизводят антигенные свойства нативного вирусного шипа, но также демонстрируют ту же степень незрелости гликанов, что и нативный вирус.[22] Рекомбинантные тримерные вирусные шипы являются многообещающими кандидатами в вакцины, поскольку они демонстрируют меньше ненейтрализующих эпитопов, чем рекомбинантный мономерный gp120, который подавляет иммунный ответ на целевые эпитопы.[23]
Организация генома

У ВИЧ есть несколько основных генов, кодирующих структурные белки, которые присутствуют во всех ретровирусах, а также несколько неструктурных («дополнительных») генов, уникальных для ВИЧ.[24] Геном ВИЧ содержит девять генов, кодирующих пятнадцать вирусных белков.[25] Они синтезируются как полипротеины, которые продуцируют белки внутренней части вириона, называемые Gag, группоспецифический антиген; вирусные ферменты (Pol, полимераза) или гликопротеины вириона env (конверт).[26] В дополнение к этому ВИЧ кодирует белки, которые также выполняют определенные регуляторные и вспомогательные функции.[26] ВИЧ-1 имеет два важных регуляторных элемента: Tat и Rev и несколько важных дополнительных белков, таких как Nef, Vpr, Vif и Vpu, которые не являются необходимыми для репликации в определенных тканях.[26] В кляп ген обеспечивает базовую физическую инфраструктуру вируса, и pol обеспечивает основной механизм воспроизводства ретровирусов, в то время как другие помогают ВИЧ проникнуть в клетку-хозяин и усилить ее размножение. Хотя они могут быть изменены в результате мутации, все эти гены, кроме tev существуют во всех известных вариантах ВИЧ; увидеть Генетическая изменчивость ВИЧ.
ВИЧ использует сложную систему дифференциации Сплайсинг РНК для получения девяти различных генных продуктов из генома менее 10 килобайт.[27] ВИЧ имеет геномный транскрипт размером 9,2 КБ, который кодирует предшественники gag и pol; однократно сплайсированная мРНК размером 4,5 т.п.н., кодирующая env, Vif, Vpr и Vpu, и многократно сплайсированная мРНК размером 2 т.п.н., кодирующая Tat, Rev и Nef.[27]
| Класс | Имя гена | Первичные белковые продукты | Обработанные белковые продукты |
|---|---|---|---|
| Структурные белки вирусов | кляп | Полипротеин Gag | MA, CA, SP1, NC, SP2, P6 |
| pol | Полипротеин | RT, РНКаза H, IN, PR | |
| env | gp160 | gp120, gp41 | |
| Основные регулирующие элементы | тат | Tat | |
| rev | Rev | ||
| Дополнительные регуляторные белки | неф | Неф | |
| впр | Впр | ||
| vif | Vif | ||
| впу | Впу |
Структурные белки вирусов

- кляп (группоспецифический антиген) кодирует предшественник gag полипротеин который обрабатывается вирусной протеазой во время созревания до МА (матричный белок, стр.17); CA (белок капсида, стр. 24 ); SP1 (спейсерный пептид 1, p2); NC (нуклеокапсидный белок, p7); SP2 (спейсерный пептид 2, p1) и белок P6.[28]
- pol коды для вирусных ферментов обратная транскриптаза (RT) и РНКаза H, интегрировать (В и Протеаза ВИЧ (PR).[26] Протеаза ВИЧ необходима для расщепления предшественника полипротеина Gag с образованием структурных белков, ОТ требуется для транскрипции ДНК с матрицы РНК, а ИН необходим для интеграции двухцепочечной вирусной ДНК в геном хозяина.[24]
- env (для "конверта") коды для gp160, который расщепляется протеазой хозяина, фурин, в пределах эндоплазматический ретикулум клетки-хозяина. Посттрансляционный процессинг производит поверхностный гликопротеин, gp120 или SU, который прикрепляется к CD4 рецепторы, присутствующие на лимфоцитах, и gp41 или TM, который внедряется в вирусную оболочку, чтобы вирус мог прикрепиться к клеткам-мишеням и слиться с ними.[24][28]
Основные регулирующие элементы
- тат (Трансактиватор ВИЧ) играет важную роль в регуляции обратной транскрипции РНК вирусного генома, обеспечивая эффективный синтез вирусных мРНК и регулируя высвобождение вирионов из инфицированных клеток.[26] Tat экспрессируется как одноэкзонный Tat из 72 аминокислот, а также как двухэкзонный Tat из 86–101 аминокислоты и играет важную роль на ранних стадиях ВИЧ-инфекции. Tat (14–15 лет) кДа) связывается с выпуклой геномной РНК стебель-петля вторичная структура около 5 'LTR-области, образующая элемент ответа на трансактивацию (TAR).[9][26]
- rev (регулятор экспрессии белков вириона): белок Rev связывается с вирусным геномом через аргинин -богатый РНК-связывающий мотив, который также действует как NLS (сигналы ядерной локализации ), необходимый для транспорта Rev в ядро из цитозоля во время репликации вируса.[26] Rev распознает сложную структуру мРНК типа стержень-петля. env расположенный в интроне, разделяющем кодирующий экзон Tat и Rev, известный как Элемент ответа на ВИЧ Rev (RRE).[9][26] Rev важен для синтеза основных вирусных белков и, следовательно, необходим для репликации вируса.
Дополнительные регуляторные белки
- впр (лентивирус белок R): Vpr представляет собой связанный с вирионом, ядерно-цитоплазматический регулирующий белок.[26] Считается, что он играет важную роль в репликации вируса, в частности, в ядерном импорте преинтеграционного комплекса. Vpr также, по-видимому, заставляет свои клетки-хозяева задерживать их клеточный цикл в фазе G2. Этот арест активирует механизм репарации ДНК хозяина, который может сделать возможной интеграцию вирусной ДНК.[9] ВИЧ-2 и SIV кодируют дополнительный связанный с Vpr белок, называемый Vpx, который функционирует вместе с Vpr.[26]
- vif - Vif представляет собой высококонсервативный фосфопротеин массой 23 кДа, важный для инфекционности вирионов ВИЧ-1 в зависимости от типа клеток.[9] Было обнаружено, что ВИЧ-1 требуется Vif для синтеза инфекционных вирусов в лимфоцитах, макрофагах и некоторых линиях клеток человека. Похоже, что Vif не требуется для того же процесса в HeLa клетки или COS клетки, среди прочего.[26]
- неф - Nef, негативный фактор, представляет собой N-концевой миристоилированный мембранно-связанный фосфопротеин. Он участвует во многих функциях в цикле репликации вируса. Считается, что он играет важную роль в апоптозе клеток и увеличивает инфекционность вируса.[26]
- впу (Вирусный белок U) - Vpu специфичен для ВИЧ-1. Это олигомерный интегральный мембранный фосфопротеин класса I с многочисленными биологическими функциями. Впу участвует в CD4 деградация с участием убиквитина протеасома пути, а также в успешном высвобождении вирионов из инфицированных клеток.[9][26]
- tev: Этот ген присутствует только в нескольких изолятах ВИЧ-1. Это слияние частей тат, env, и rev гены и кодирует белок с некоторыми свойствами тат, но мало или совсем не свойства rev.[29]
Вторичная структура РНК
| Стеблевая петля pol-1 ВИЧ | |
|---|---|
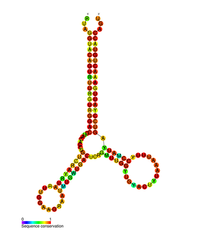 Прогнозируемая вторичная структура стержневой петли pol-1 ВИЧ | |
| Идентификаторы | |
| Символ | pol |
| Рфам | RF01418 |
| Прочие данные | |
| РНК тип | Снг |
| PDB структуры | PDBe |
Несколько консервированных вторичная структура элементы были идентифицированы в РНК ВИЧ геном. Структура 5'UTR состоит из серии структур стержень-петля, соединенных небольшими линкерами.[10] Эти стержневые петли (от 5 'до 3') включают элемент области трансактивации (TAR), 5 'сигнал полиаденилирования [поли (A)], PBS, DIS, основную SD и структуру шпильки ψ, расположенную внутри 5 'конец генома и Элемент ответа на ВИЧ Rev (RRE) в гене env.[10][30][31] Другая идентифицированная структура РНК - это петля ствола кляпа 3 (GSL3), считается, что он участвует в вирусной упаковке.[32][33] Было высказано предположение, что вторичные структуры РНК влияют на жизненный цикл ВИЧ, изменяя функцию ВИЧ. протеаза и обратная транскриптаза, хотя не всем идентифицированным элементам назначена функция.
Вторичная структура РНК, определяемая ФОРМА анализ показал, что он содержит три стержневые петли и расположен между генами протеазы ВИЧ и обратной транскриптазы. Этот СНГ Было показано, что регуляторная РНК сохраняется во всем семействе ВИЧ и, как полагают, влияет на жизненный цикл вируса.[34]
Петля V3
В третий цикл переменных или Петля V3 является частью или регионом Вирус иммунодефицита человека. В Петля V3 гликопротеина оболочки вирона, gp120, позволяет ему инфицировать иммунные клетки человека, связываясь с цитокин рецептор на целевой иммунной клетке человека, такой как CCR5 ячейка или CXCR4 ячейка, в зависимости от штамма ВИЧ.[35]Гликопротеин оболочки (Env) gp 120/41 необходим для проникновения ВИЧ-1 в клетки. Env служит молекулярной мишенью для лекарств, применяемых для лечения людей с ВИЧ-1, и источником иммуногена для разработки вакцины против СПИДа. Однако структура функционального тримера Env остается неуловимой.[36]
Смотрите также
Рекомендации
- ^ Barré-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, Dauguet C, Axler-Blin C, Vézinet-Brun F, Rouzioux C, Rozenbaum W, Montagnier L (май 1983). «Выделение Т-лимфотропного ретровируса от пациента с риском синдрома приобретенного иммунодефицита (СПИД)». Наука. 220 (4599): 868–71. Bibcode:1983Sci ... 220..868B. Дои:10.1126 / science.6189183. PMID 6189183.
- ^ Галло Р.С., Зарин П.С., Гельманн Е.П., Роберт-Гурофф М., Ричардсон Е., Кальянараман В.С., Манн Д., Сидху Г.Д., Шталь Р.Э., Золла-Пазнер С., Лейбович Дж., Попович М. (май 1983 г.). «Выделение вируса Т-клеточного лейкоза человека при синдроме приобретенного иммунодефицита (СПИД)». Наука. 220 (4599): 865–7. Bibcode:1983Научный ... 220..865Г. Дои:10.1126 / science.6601823. PMID 6601823.
- ^ Churi, C .; Росс, М. В. (2015). «ВИЧ / СПИД». In Whelehan, P .; Болин, А. (ред.). Международная энциклопедия сексуальности человека. Вайли. ISBN 9781405190060. OCLC 949701914.
- ^ Центры по контролю за заболеваниями (июнь 1981 г.). «Пневмоцистная пневмония - Лос-Анджелес». MMWR. Еженедельный отчет о заболеваемости и смертности. 30 (21): 250–2. PMID 6265753.
- ^ Центры по контролю за заболеваниями (CDC) (июль 1981 г.). «Саркома Капоши и пневмоцистная пневмония среди гомосексуальных мужчин - Нью-Йорк и Калифорния» (PDF). MMWR. Еженедельный отчет о заболеваемости и смертности. 30 (25): 305–8. PMID 6789108. Архивировано 22 октября 2012 года.. Получено 15 сентября, 2017.CS1 maint: неподходящий URL (ссылка на сайт)
- ^ Уоттс Дж. М., Данг К. К., Горелик Р. Дж., Леонард К. В., Бесс Дж. В., Суонстром Р., Берч К. Л., Недели КМ (август 2009 г.). «Архитектура и вторичная структура всего генома РНК ВИЧ-1». Природа. 460 (7256): 711–6. Bibcode:2009 Натур.460..711Вт. Дои:10.1038 / природа08237. ЧВК 2724670. PMID 19661910.
- ^ а б Ли Джи, Де Клерк Э. (сентябрь 2016 г.). «Полногеномные белковые ассоциации ВИЧ: обзор 30-летних исследований». Обзоры микробиологии и молекулярной биологии. 80 (3): 679–731. Дои:10.1128 / MMBR.00065-15. ЧВК 4981665. PMID 27357278.
- ^ Синглтон, П .; Sainsbury, D., eds. (2006). "ВИЧ". Словарь по микробиологии и молекулярной биологии (3-е изд.). Хобокен, Нью-Джерси: Уайли. ISBN 9780470035450. OCLC 71223221.
- ^ а б c d е ж грамм Монтанье Л. (1999). «Вирусы иммунодефицита человека (Retroviridae)». Энциклопедия вирусологии (2-е изд.). С. 763–774.
- ^ а б c Лу К., Хэн Х, Саммерс М.Ф. (июль 2011 г.). «Структурные детерминанты и механизм упаковки генома ВИЧ-1». Журнал молекулярной биологии. 410 (4): 609–33. Дои:10.1016 / j.jmb.2011.04.029. ЧВК 3139105. PMID 21762803.
- ^ Уэйн-Хобсон С., Сониго П., Данос О., Коул С., Ализон М. (январь 1985 г.). «Нуклеотидная последовательность вируса СПИДа, LAV». Клетка. 40 (1): 9–17. Дои:10.1016/0092-8674(85)90303-4. PMID 2981635.
- ^ Ратнер Л., Хазелтин В., Патарка Р., Ливак К.Дж., Старчич Б., Джозефс С.Ф., Доран Е.Р., Рафальски Дж.А., Уайтхорн Е.А., Баумейстер К. (1985). «Полная нуклеотидная последовательность вируса СПИДа, HTLV-III». Природа. 313 (6000): 277–84. Bibcode:1985Натура.313..277р. Дои:10.1038 / 313277a0. PMID 2578615.
- ^ а б Кастелли Дж. К., Леви А. (2002). «ВИЧ (вирус иммунодефицита человека)». Энциклопедия рака. 2 (2-е изд.). п. 407–415.
- ^ Национальный институт здоровья (17 июня 1998 г.). «Кристаллическая структура ключевого белка ВИЧ открывает новые возможности для профилактики и лечения» (Пресс-релиз). Архивировано из оригинал 19 февраля 2006 г.. Получено 14 сентября, 2006.
- ^ Беренс А.Дж., Васильевич С., Причард Л.К., Харви Д.Д., Андев Р.С., Крумм С.А., Струве В.Б., Купо А., Кумар А., Цицманн Н., Сибрайт Г.Е., Крамер Н.Б., Спенсер Д.И., Ройл Л., Ли Дж.Х., Класс П.Дж., Бертон Д.Р. , Wilson IA, Ward AB, Sanders RW, Moore JP, Doores KJ, Crispin M (март 2016 г.). «Состав и антигенные эффекты отдельных гликановых сайтов тримерного гликопротеина оболочки ВИЧ-1». Отчеты по ячейкам. 14 (11): 2695–706. Дои:10.1016 / j.celrep.2016.02.058. ЧВК 4805854. PMID 26972002.
- ^ Притчард Л.К., Спенсер Д.И., Ройл Л., Бономелли С., Сибрайт Г.Е., Беренс А.Дж., Кулп Д.В., Менис С., Крамм С.А., Данлоп, округ Колумбия, Криспин Д.И., Боуден Т.А., Сканлан К.Н., Уорд А.Б., Шиф В.Р., Дурс К.Дж., Криспин М. (Июнь 2015 г.). «Кластеризация гликанов стабилизирует маннозный участок ВИЧ-1 и сохраняет уязвимость для широко нейтрализующих антител». Nature Communications. 6: 7479. Bibcode:2015НатКо ... 6.7479P. Дои:10.1038 / ncomms8479. ЧВК 4500839. PMID 26105115.
- ^ Причард Л.К., Харви Д.Дж., Бономелли С., Криспин М., Дурс К.Дж. (сентябрь 2015 г.). «Клеточное и белковое гликозилирование нативной расщепленной оболочки ВИЧ-1». Журнал вирусологии. 89 (17): 8932–44. Дои:10.1128 / JVI.01190-15. ЧВК 4524065. PMID 26085151.
- ^ Crispin M, Doores KJ (апрель 2015 г.). «Нацеливание на гликаны, полученные из хозяина, на вирусы с оболочкой для разработки вакцины на основе антител». Текущее мнение в области вирусологии. Вирусный патогенез • Профилактические и лечебные вакцины. 11: 63–9. Дои:10.1016 / j.coviro.2015.02.002. ЧВК 4827424. PMID 25747313.
- ^ Жюльен Дж. П., Купо А., Сок Д., Стэнфилд Р.Л., Люмкис Д., Деллер М.К., Класс П.Дж., Бертон Д.Р., Сандерс Р.В., Мур Дж. П., Уорд А.Б., Уилсон И.А. (декабрь 2013 г.). «Кристаллическая структура растворимого расщепленного тримера оболочки ВИЧ-1». Наука. 342 (6165): 1477–83. Bibcode:2013Научный ... 342.1477J. Дои:10.1126 / science.1245625. ЧВК 3886632. PMID 24179159.
- ^ Люмкис Д., Жюльен Дж. П., де Вал Н., Купо А., Поттер С. С., Класс П. Дж., Бертон Д. Р., Сандерс Р. В., Мур Дж. П., Каррагер Б., Уилсон И. А., Уорд А.Б. (декабрь 2013 г.). «Крио-ЭМ структура полностью гликозилированного растворимого расщепленного тримера оболочки ВИЧ-1». Наука. 342 (6165): 1484–90. Bibcode:2013Научный ... 342.1484L. Дои:10.1126 / science.1245627. ЧВК 3954647. PMID 24179160.
- ^ Сандерс Р.У., Деркинг Р., Купо А., Жюльен Дж. П., Ясмин А., де Вал Н., Ким Х. Дж., Блаттнер С., де ла Пенья А. Т., Корзун Дж., Голабек М., де Лос Рейес К., Кетас Т. Дж., Ван Гилс М. Дж., Кинг CR , Wilson IA, Ward AB, Klasse PJ, Moore JP (сентябрь 2013 г.). «Расщепленный растворимый тример Env ВИЧ-1 нового поколения, BG505 SOSIP.664 gp140, экспрессирует несколько эпитопов для широко нейтрализующих, но не ненейтрализующих антител». PLOS Патогены. 9 (9): e1003618. Дои:10.1371 / journal.ppat.1003618. ЧВК 3777863. PMID 24068931.
- ^ Причард Л.К., Васильевич С., Озоровски Г., Сибрайт Дж. Э., Купо А., Ринге Р., Ким Х. Дж., Сандерс Р. В., Дур К. Дж., Бертон Д. Р., Уилсон И. А., Уорд А. Б., Мур Дж. П., Криспин М. (июнь 2015 г.). «Структурные ограничения определяют гликозилирование тримеров оболочки ВИЧ-1». Отчеты по ячейкам. 11 (10): 1604–13. Дои:10.1016 / j.celrep.2015.05.017. ЧВК 4555872. PMID 26051934.
- ^ de Taeye SW, Ozorowski G, Torrents de la Peña A, Guttman M, Julien JP, van den Kerkhof TL, Burger JA, Pritchard LK, Pugach P, Yasmeen A, Crampton J, Hu J, Bontjer I, Torres JL, Arendt H , DeStefano J, Koff WC, Schuitemaker H, Eggink D, Berkhout B, Dean H, LaBranche C, Crotty S, Crispin M, Montefiori DC, Klasse PJ, Lee KK, Moore JP, Wilson IA, Ward AB, Sanders RW (декабрь 2015). «Иммуногенность стабилизированных тримеров оболочки ВИЧ-1 с пониженным воздействием ненейтрализующих эпитопов». Клетка. 163 (7): 1702–15. Дои:10.1016 / j.cell.2015.11.056. ЧВК 4732737. PMID 26687358.
- ^ а б c Мушахвар И.К. (2007). «Вирусы иммунодефицита человека: молекулярная вирусология, патогенез, диагностика и лечение». Перспективы медицинской вирусологии. 13: 75–87. Дои:10.1016 / S0168-7069 (06) 13005-0. ISBN 9780444520739.
- ^ Ли Дж., Пьямпонгсант С., Фариа Н. Р., Воет А., Пинеда-Пенья А. С., Кури Р., Лемей П., Вандамм А. М., Тейс К. (февраль 2015 г.). «Интегрированная карта вариаций генома ВИЧ с точки зрения популяции». Ретровирология. 12 (1): 18. Дои:10.1186 / s12977-015-0148-6. ЧВК 4358901. PMID 25808207.
- ^ а б c d е ж грамм час я j k л м Воттелер Дж, Шуберт У (2008). «Вирусы иммунодефицита человека: молекулярная биология». Энциклопедия вирусологии (3-е изд.). С. 517–525.
- ^ а б Файнберг Марк Б., Грин Уорнер С. (1992). «Молекулярные взгляды на патогенез вируса иммунодефицита человека 1 типа». Текущее мнение в иммунологии. 4 (4): 466–474. Дои:10.1016 / s0952-7915 (06) 80041-5. PMID 1356348.
- ^ а б Король Стивен Р. (1994). «ВИЧ: вирусология и механизмы заболевания». Анналы неотложной медицины. 24 (3): 443–449. Дои:10.1016 / s0196-0644 (94) 70181-4. PMID 7915889.
- ^ Бенко Д.М., Шварц С., Павлакис Г.Н., Фельбер Б.К. (июнь 1990 г.). «Новый белок вируса иммунодефицита человека типа 1, tev, имеет общие последовательности с белками tat, env и rev». Журнал вирусологии. 64 (6): 2505–18. Дои:10.1128 / JVI.64.6.2505-2518.1990. ЧВК 249426. PMID 2186172.
- ^ Беркхут Б (январь 1992 г.). «Структурные особенности TAR РНК вирусов иммунодефицита человека и обезьян: филогенетический анализ». Исследования нуклеиновых кислот. 20 (1): 27–31. Дои:10.1093 / nar / 20.1.27. ЧВК 310321. PMID 1738599.
- ^ Пайярт Дж. К., Скрипкин Э., Эресманн Б., Эресманн С., Марке Р. (февраль 2002 г.). «Доказательства in vitro длинного псевдоузла в 5'-нетранслируемой и матричной кодирующих областях геномной РНК ВИЧ-1». Журнал биологической химии. 277 (8): 5995–6004. Дои:10.1074 / jbc.M108972200. PMID 11744696.
- ^ Дамгаард К.К., Андерсен Е.С., Кнудсен Б., Городкин Дж., Кьемс Дж. (Февраль 2004 г.). «Взаимодействие РНК в 5'-области генома ВИЧ-1». Журнал молекулярной биологии. 336 (2): 369–79. Дои:10.1016 / j.jmb.2003.12.010. PMID 14757051.
- ^ Ронг Л., Рассел Р.С., Ху Дж., Лауреа М., Вайнберг М.А., Лян С. (сентябрь 2003 г.). «Делеция стебель-петля 3 компенсируется мутациями второго сайта в белке Gag вируса иммунодефицита человека типа 1». Вирусология. 314 (1): 221–8. Дои:10.1016 / S0042-6822 (03) 00405-7. PMID 14517075.
- ^ Ван Кью, Барр И., Го Ф, Ли К. (декабрь 2008 г.). «Доказательства новой вторичной структуры РНК в кодирующей области гена pol ВИЧ-1». РНК. 14 (12): 2478–88. Дои:10.1261 / rna.1252608. ЧВК 2590956. PMID 18974280.
- ^ «Взаимодействие петли gp120 V3 различных штаммов ВИЧ-1 с мощным человеческим моноклональным антителом против ВИЧ 447-52D». Институт Вейцмана: Отдел структурной биологии. Архивировано из оригинал на 2007-07-18. Получено 2017-04-18.
- ^ Takeda S, Takizawa M, Miyauchi K, Urano E, Fujino M, Murakami T., Murakami T., Komano J (июнь 2016 г.). «Конформационные свойства третьей вариабельной петли гликопротеина оболочки ВИЧ-1AD8 в лигандированных условиях». Сообщения о биохимических и биофизических исследованиях. 475 (1): 113–8. Дои:10.1016 / j.bbrc.2016.05.051. PMID 27178216.
внешняя ссылка
- Молекулярная биология ВИЧ - структура генома; https://www.youtube.com/watch?v=0hg_U3WSqeA
- Вход rfam для стержневой петли pol-1 ВИЧ
- 3D-модель полного вириона ВИЧ1
- Лю Дж., Райт Э.Р., Винклер Х. (2010). «3D визуализация вирионов ВИЧ с помощью криоэлектронной томографии». Крио-ЭМ, часть C: анализ, интерпретация и тематические исследования. Методы в энзимологии. 483. С. 267–90. Дои:10.1016 / S0076-6879 (10) 83014-9. ISBN 9780123849939. ЧВК 3056484. PMID 20888479.
