Анемия, вызванная недостаточностью витамина B12 - Vitamin B12 deficiency anemia
| Витамин B12 дефицитная анемия | |
|---|---|
| Другие имена | Злокачественная анемия, анемия Бирмера,[1] Анемия Аддисона,[2] Анемия Аддисона – Бирмера[3] |
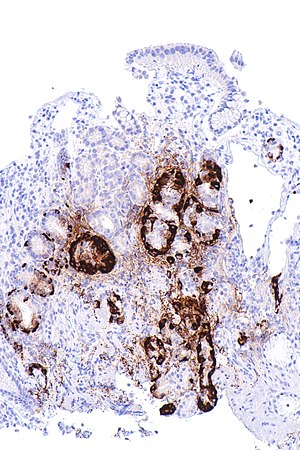 | |
| Микрофотография показывая узелковую гиперплазию энтерохромаффиноподобных клеток, как показано с хромогранин А иммуноокрашивание, в теле желудок. Париетальные клетки не так очевидны. Эти изменения соответствуют аутоиммунному метапластическому атрофическому гастриту. гистологический коррелят витамина B12 дефицитная анемия. | |
| Специальность | Гематология |
| Симптомы | Чувство усталости, одышка, бледная кожа, онемение в руках и ногах, плохая рефлексы, путаница[4] |
| Обычное начало | > 60 лет[1] |
| Причины | Недостаточно витамин B12[5] |
| Диагностический метод | Анализы крови, исследования костного мозга[6] |
| Уход | Витамин B12 таблетки или уколы[7] |
| Прогноз | При лечении нормальная жизнь[5] |
| Частота | 1 на 1000 человек[1] |
Витамин B12 дефицитная анемия, из которых злокачественная анемия (PA) - это тип,[8] это болезнь, при которой недостаточно красные кровяные тельца производятся из-за дефицита витамин B12.[5] Самый частый начальный симптом - чувство усталости.[4] Другие симптомы могут включать: одышка, бледная кожа, боль в груди, онемение рук и ног, нарушение равновесия, гладкий красный язык, плохое рефлексы, депрессия и замешательство.[4] Без лечения некоторые из этих проблем могут стать постоянными.[5]
Пагубная анемия относится к анемия это результат отсутствия внутренний фактор.[5] Отсутствие внутреннего фактора чаще всего связано с аутоиммунный нападение на клетки которые создают его в желудок.[9] Это также может произойти после хирургического удаления части желудка или в результате наследственного заболевания.[9] Другие причины низкого уровня витамина B12 включать недостаточное питание (что может быть веганская диета ), глютеновая болезнь, или же инфекция ленточного червя.[9] При подозрении на него диагноз ставится на основе анализа крови и, иногда, анализа костного мозга.[6] Анализы крови могут показать меньше, но больше эритроцитов, небольшое количество молодые эритроциты, низкий уровень витамина B12, и антитела к внутреннему фактору.[6]
Поскольку пагубная анемия возникает из-за отсутствия внутреннего фактора, ее нельзя предотвратить.[10] Витамин B12 дефицит по другим причинам можно предотвратить с помощью сбалансированной диеты или добавок.[10] Пагубную анемию легко лечить инъекциями или таблетками витамина B.12.[7] Если симптомы серьезны, обычно сначала рекомендуются инъекции.[7] Для тех, у кого есть проблемы с глотанием таблеток, доступен назальный спрей.[7] Часто лечение длится всю жизнь.[11]
Пагубная анемия из-за аутоиммунных проблем встречается примерно у одного человека на 1000 человек.[1] Среди лиц старше 60 лет около 2% страдают этим заболеванием.[1] Чаще страдают люди североевропейского происхождения.[2] Женщины страдают чаще, чем мужчины.[12] При правильном лечении большинство людей живут нормальной жизнью.[5] Из-за более высокого риска рак желудка тем, у кого злокачественная анемия, следует регулярно проверять на это.[11] Первое четкое описание было сделано Томас Аддисон в 1849 г.[13][14] Термин «пагубный» означает «смертельный», и этот термин вошел в употребление, потому что до доступности лечения болезнь часто была фатальной.[5][15]
Признаки и симптомы

Симптомы злокачественной анемии появляются медленно. Без лечения это может привести к неврологическим осложнениям, а в серьезных случаях - к смерти. Многие признаки и симптомы связаны с самой анемией, когда анемия присутствует.[16] Симптомы могут включать триаду покалывания или других кожных ощущений (парестезия ), болезненность языка (глоссит ), и усталость и общая слабость.[17][18][19][страница нужна ] Он представляет собой ряд других общих симптомов,[19][страница нужна ][20][страница нужна ] включая депрессивное настроение, низкая оценка лихорадка, понос, диспепсия, потеря веса,[17] невропатическая боль, желтуха, язвочки в углу рта (угловой хейлит ), вид истощения с бледными и обезвоженными или потрескавшимися губами и темными кругами вокруг глаз, а также ломкими ногтями,[18] истончение и раннее поседение волос.[18] Поскольку ПА может влиять на нервную систему, симптомы также могут включать проприоцепция,[21] изменения памяти,[20][страница нужна ] легкие когнитивные нарушения (включая трудности с концентрацией внимания и вялые реакции, в просторечии называемые мозговой туман ), и даже психоз, нарушение мочеиспускания,[17] потеря чувствительности в стопах, шаткая походка,[21] трудности при ходьбе,[18] мышечная слабость[19][страница нужна ] и неуклюжесть.[17] Анемия также может привести к тахикардии (учащенному сердцебиению),[17] сердечные шумы, желтый воск бледность,[18] измененное артериальное давление (низкий или же высоко ), а одышка (известный как «вздохи»).[19][страница нужна ] Дефицит также может проявляться при заболеваниях щитовидной железы.[19][страница нужна ] В тяжелых случаях анемия может вызвать застойную сердечную недостаточность.[20][страница нужна ] Осложнением тяжелой хронической ПА является подострая комбинированная дегенерация спинного мозга, что приводит к дистальной потере чувствительности (задний столбец), отсутствию рефлекса голеностопного сустава, усилению рефлекторного ответа коленного сустава и подошвенного разгибателя.[22] Помимо анемии, гематологические симптомы могут включать: цитопении, интрамедуллярный гемолиз и псевдотромботическая микроангиопатия.[1] Пагубная анемия может способствовать задержке физического роста у детей, а также может быть причиной задержки полового созревания у подростков.
Причины
Витамин B12 не могут вырабатываться человеческим организмом и должны поступать с пищей. Когда продукты, содержащие B12 При употреблении в пищу витамин обычно связывается с белком и выделяется протеазами, выделяемыми поджелудочной железой в тонкой кишке. После его выпуска большинство B12 всасывается в тонком кишечнике (подвздошная кишка ) после связывания с белком, известным как внутренний фактор. Внутренний фактор производится париетальные клетки из желудочный слизистая оболочка (слизистая оболочка желудка) и внутренний фактор-B12 комплекс поглощается рецепторами кубилина на подвздошной кишке эпителиальные клетки.[23][24] PA характеризуется B12 дефицит, вызванный отсутствием внутреннего фактора.[25]
ПА можно рассматривать как конечную стадию иммунного гастрит, заболевание, характеризующееся атрофией желудка и наличием антитела париетальным клеткам и внутреннему фактору.[26] Специфическая форма хронического гастрита, гастрит типа А или атрофический гастрит тела, тесно связан с ПА. Это аутоиммунное заболевание локализовано в теле желудка, где расположены париетальные клетки.[25] Антитела к внутреннему фактору и париетальным клеткам вызывают разрушение оксинтной слизистой оболочки желудка, в которой расположены париетальные клетки, что приводит к последующей потере синтеза внутреннего фактора. Без внутреннего фактора подвздошная кишка больше не может поглощать B12.[27]
Хотя точная роль Helicobacter pylori инфекции в ПА остается спорным, данные свидетельствуют о Хеликобактер пилори участвует в патогенезе заболевания. Давний Хеликобактер пилори инфекция может вызвать аутоиммунитет желудка с помощью механизма, известного как молекулярная мимикрия. Антитела, продуцируемые иммунной системой, могут иметь перекрестную реакцию и могут связываться с обоими Хеликобактер пилори антигены и те, что были найдены в слизистая желудка. Антитела производятся активированным В-клетки которые распознают как патоген, так и пептиды собственного происхождения. В аутоантигены Считается, что причиной аутореактивности являются альфа- и бета-субъединицы H+/ К+-ATPase.[27][28]
Реже, Хеликобактер пилори и Синдром Золлингера-Эллисона может также вызвать форму неаутоиммунного гастрита, которая может привести к злокачественной анемии.[29]
Нарушение B12 абсорбция может также произойти после удаления желудка (гастрэктомия ) или операцию обходного желудочного анастомоза. Во время этих операций либо удаляются части желудка, которые производят желудочный секрет, либо их обходят. Это означает внутренний фактор, а также другие факторы, необходимые для B12 абсорбция, недоступны. Однако B12 его дефицит после операции на желудке обычно не становится клинической проблемой. Вероятно, это связано с тем, что в организме накапливается много лет B12 в хирургии печени и желудка пациенты получают адекватное добавление витамина.[30][31]
Несмотря на то, что специфические гены восприимчивости к PA не были идентифицированы, вероятно, что в заболевание вовлечен генетический фактор. Пагубная анемия часто встречается в сочетании с другими аутоиммунными заболеваниями, что указывает на то, что общие гены аутоиммунной предрасположенности могут быть причинным фактором.[25] Несмотря на это, предыдущие семейные исследования и отчеты о случаях, посвященных ПА, предположили, что существует тенденция генетического наследования, в частности, ПА, и у близких родственников пациентов с ПА, по-видимому, выше частота ПА и связанных с ней состояний.[32][33][34] Более того, дополнительно указывалось, что образование антител к клеткам желудка было определено аутосомно-доминантным геном, и наличие антител к клеткам желудка не обязательно могло быть связано с возникновением атрофического гастрита, связанного с ПА.[32][34]
Патофизиология
Хотя в здоровом организме запасы витамина B за три-пять лет12 в печени обычно не обнаруживаемая аутоиммунная активность в кишечнике в течение длительного периода времени приводит к B12 истощение и связанная с этим анемия. B12 требуется ферментам для двух реакций: превращения метилмалонил КоА к сукцинил КоА, а преобразование гомоцистеин к метионин. В последней реакции метильная группа из 5-метилтетрагидрофолат превращается в гомоцистеин для производства тетрагидрофолат и метионин. Эта реакция катализируется ферментом метионинсинтаза с B12 как существенный кофактор. Во время B12 дефицит, эта реакция не может продолжаться, что приводит к накоплению 5-метилтетрагидрофолата. Это накопление истощает другие типы фолиевой кислоты, необходимые для пурин и тимидилат синтез, которые необходимы для синтеза ДНК. Подавление Репликация ДНК при созревании эритроцитов приводит к образованию крупных хрупких мегалобластов. эритроциты. Считается, что неврологические аспекты заболевания возникают из-за накопления метилмалонил-КоА из-за потребности в витамине B12 в качестве кофактора фермента метилмалонил-КоА-мутазы.[23][35][36][37]
Диагностика

ПА может заподозрить, когда у пациента мазок крови показывает большие, хрупкие, незрелые эритроциты, известные как мегалобласты. Диагноз ПА в первую очередь требует демонстрации мегалобластная анемия проведя полный анализ крови и мазок крови, который оценивает средний корпускулярный объем (MCV), а также средняя концентрация корпускулярного гемоглобина (MCHC). PA идентифицируется с высоким MCV (макроцитарная анемия ) и нормальный MCHC (нормохромный анемия).[38] Овалоциты также обычно видны в мазке крови, и патогномоничный Особенностью мегалобластных анемий (к которым относятся ПА и др.) являются гиперсегментированные нейтрофилы.[18]
Сыворотка витамин B12 уровни используются для обнаружения его недостатка, но они не определяют его причины. Витамин B12 уровни могут быть ложно высокими или низкими, а данные для чувствительность и специфичность широко варьироваться. Нормальные уровни сыворотки могут быть обнаружены в случаях дефицита, когда миелопролиферативные заболевания, болезнь печени, транскобаламин II дефицит, или чрезмерный бактериальный рост в кишечнике присутствуют. Низкий уровень витамина B в сыворотке12 может быть вызвано другими факторами, кроме B12 дефицит, такой как дефицит фолиевой кислоты, беременность, оральный контрацептив использовать, гаптокоррин дефицит, и миелома.[39][40]
При ПА часто встречаются антитела к париетальным клеткам желудка и внутреннему фактору. Антитела к париетальным клеткам обнаруживаются при других аутоиммунных заболеваниях, а также у 10% здоровых людей, что делает этот тест неспецифическим. Однако около 85% пациентов с ПА имеют антитела к париетальным клеткам, что означает, что они являются чувствительным маркером заболевания. Антитела к внутреннему фактору намного менее чувствительны, чем антитела к париетальным клеткам, но они гораздо более специфичны. Они обнаруживаются примерно у половины пациентов с ПА и очень редко встречаются при других заболеваниях. Эти тесты на антитела могут различать PA и пищевой B12 мальабсорбция.[40] Комбинация обоих тестов на антитела к внутреннему фактору и антитела к париетальным клеткам может улучшить общую чувствительность и специфичность диагностических результатов.[41]
Накопление определенных метаболитов происходит в B12 дефицит из-за его роли в клеточной физиологии. Метилмалоновая кислота (ММА) может быть измерена как в крови, так и в моче, тогда как гомоцистеин измеряется только в крови. Увеличение как ММА, так и гомоцистеина отличает B12 дефицит из-за дефицита фолиевой кислоты, потому что один гомоцистеин увеличивает последний.[40][42]
Повышенный гастрин уровни могут быть обнаружены примерно в 80-90% случаев ПА, но они также могут быть обнаружены при других формах гастрита. Также могут быть обнаружены пониженные уровни пепсиногена I или пониженное соотношение пепсиноген I к пепсиногену II, хотя эти результаты менее специфичны для PA и могут быть обнаружены в пище-B12 мальабсорбция и другие формы гастрита.[42]
Диагноз атрофического гастрита типа А необходимо подтвердить с помощью гастроскопии и пошаговой биопсии.[43] Около 90% людей с ПА имеют антитела к париетальным клеткам; однако только 50% всех людей в общей популяции с этими антителами страдают злокачественной анемией.[44]
Формы витамина B12 дефицит, отличный от PA, следует учитывать в дифференциальная диагностика мегалобластной анемии. Например, B12-дефицитное состояние, которое вызывает мегалобластную анемию и которое может быть ошибочно принято за классическую ПА, может быть вызвано инфекцией ленточный червь Дифиллоботрий латум, возможно, из-за конкуренции паразита с хозяином за витамин B12.[45]
Классический тест на PA, Тест Шиллинга, больше не используется широко, поскольку доступны более эффективные методы. Этот исторический тест на первом этапе состоял из перорального приема радиоактивно меченый витамин B12с последующим количественным определением витамина в моче пациента в течение 24-часового периода путем измерения радиоактивность. На втором этапе теста повторяется режим и процедура первого этапа с добавлением орального внутреннего фактора. У пациента с ПА представлен более низкий, чем обычно, уровень внутреннего фактора; следовательно, добавление внутреннего фактора на втором этапе приводит к увеличению витамина B12 абсорбция (выше базовой линии, установленной в первом). Тест Шиллинга отличал PA от других форм B12 дефицит,[23] в частности, от синдрома Имерслунда-Грасбека (IGS), дефицита витамина B12, вызванного мутациями в кубилин рецептор кобаламина.[46]
Уход
Лечение ПА зависит от страны и региона. Мнения разнятся относительно эффективности введения (парентерального / перорального), количества и временного интервала доз или форм витамина B.12 (например, цианокобаламин / гидроксокобаламин). Все еще необходимы более всесторонние исследования, чтобы подтвердить применимость конкретного терапевтического метода для лечения ПА в клинической практике. Постоянного лекарства от ПА не хватает, хотя восполнение витамина B12 следует ожидать, что это приведет к прекращению симптомов, связанных с анемией, остановке неврологического ухудшения, а в случаях, когда неврологические проблемы не развиваются, к неврологическому выздоровлению и полной и стойкой ремиссии всех симптомов, пока B12 дополняется. Пополнение B12 может быть достигнуто разными способами.
Внутримышечные инъекции
Стандартным лечением ПА были внутримышечные инъекции кобаламина в виде цианокобаламин (CN-Cbl), гидроксокобаламин (OH-Cbl) или метилкобаламин.[47]
Пероральные дозы
Лечение высокими дозами витамина B12 устно также оказывается эффективным.[47][48][49]
Прогноз
Человек с хорошо леченным ПА может вести здоровый образ жизни. Однако несвоевременная диагностика и лечение может привести к необратимому неврологическому повреждению, чрезмерной усталости, депрессии, потере памяти и другим осложнениям. В тяжелых случаях неврологические осложнения пернициозной анемии могут привести к смерти - отсюда и название "пагубный ", что означает смертельный.
Была обнаружена связь между злокачественной анемией и некоторыми видами рака желудка, но причинно-следственная связь не установлена.[27]
Эпидемиология
По оценкам, ПА поражает 0,1% населения в целом и 1,9% людей старше 60 лет, что составляет 20–50% B12 дефицит у взрослых.[1] Обзор литературы показывает, что распространенность ПА выше в Северной Европе, особенно в скандинавских странах, и среди лиц африканского происхождения, и что повышение осведомленности о болезни и более совершенные диагностические инструменты могут сыграть роль в явно более высоких показателях заболеваемости.[50]
История
Симптомы впервые описаны в 1822 г. Джеймс Скарт Комб в Труды Медико-хирургического общества Эдинбурга, под названием История случая анемии.[51]
Однако это не было исследовано более глубоко до 1849 года британским врачом. Томас Аддисон, от которого он получил общее название анемии Аддисона. В 1871 году немецкий врач Майкл Антон Бирмер (1827–1892) заметил особую характеристику анемии у одного из своих пациентов; позже он ввел термин «прогрессирующая злокачественная анемия».[52][нужен лучший источник ] В 1907 г. Ричард Кларк Кэбот сообщил о серии из 1200 пациентов с ПА; их средняя выживаемость составляла от одного до трех лет.[нужна цитата ] Замок Уильяма Босворта провел эксперимент, в котором он проглотил сырое мясо гамбургера и срыгнул его через час, а затем скормил его группе из 10 пациентов.[53][требуется полная цитата ] Необработанное сырое мясо гамбургеров скармливали контрольной группе. Первая группа показала реакцию болезни, тогда как вторая группа - нет. Это не было устойчивой практикой, но она продемонстрировала существование «внутреннего фактора» желудочного сока.
Пагубная анемия была смертельным заболеванием примерно до 1920 года, когда Джордж Уиппл предложил сырой печень как лечение.[нужна цитата ] Первое действенное лечение злокачественной анемии началось, когда Уиппл в ходе экспериментов сделал открытие, в котором он брал кровь у собак, чтобы вызвать у них анемию, а затем кормил их различными продуктами, чтобы посмотреть, что поможет им быстрее выздороветь (он искал методы лечения анемии. от кровотечения, а не при злокачественной анемии). Уиппл обнаружил, что употребление в пищу большого количества печени, по-видимому, излечивает анемию от кровопотери, и попробовал проглатывание печени в качестве лечения пагубной анемии, сообщив об улучшении этого состояния в статье в 1920 году.[нужна цитата ] Джордж Майнот и Уильям Мерфи затем приступил к частичному выделению целебных свойств печени, и в 1926 году показал, что оно содержится в сыром печеночном соке (в процессе также показано, что именно железо в ткани печени, а не растворимый фактор в печеночном соке, излечивает анемию от кровотечение у собак); таким образом, открытие фактора печеночного сока для лечения злокачественной анемии было случайным.[нужна цитата ] Фрида Робшайт-Роббинс работал в тесном сотрудничестве с Уипплом, соавтором 21 статьи за 1925–1930 гг.[нужна цитата ] За открытие лекарства от ранее смертельной болезни неизвестной причины Уиппл, Майнот и Мерфи поделились Нобелевская премия по медицине.[54][требуется полная цитата ]
После того, как Майнот и Мерфи подтвердили результаты Уиппла в 1926 году, жертвы злокачественной анемии ели или пили по крайней мере полфунта сырой печени или пили сок сырой печени каждый день.[нужна цитата ] Так продолжалось несколько лет, пока не стал доступен концентрат печеночного сока. В 1928 г. химик Эдвин Кон приготовили экстракт печени, который был в 50-100 раз сильнее, чем натуральная пища (печень).[нужна цитата ] Экстракт можно было даже вводить в мышцы, что означало, что пациентам больше не нужно было есть большое количество печени или сока. Это также значительно снизило стоимость лечения.[нужна цитата ]
Активный ингредиент печени оставался неизвестным до 1948 года, когда он был выделен двумя химиками, Карл А. Фолкерс Соединенных Штатов и Александр Р. Тодд Великобритании.[нужна цитата ] Вещество было кобаламин, который первооткрыватели назвали витамин B12. Новый витамин в соке печени был в конечном итоге полностью очищен и охарактеризован в 1950-х годах, и были разработаны другие методы его получения из бактерий.[нужна цитата ] Его можно вводить в мышцу с еще меньшим раздражением, что позволяет лечить ПА с еще большей легкостью.[нужна цитата ] Пернициозную анемию в конечном итоге лечили инъекциями или большими пероральными дозами витамина B.12, обычно от 1 до 4 мг в день.[нужна цитата ]
Один писатель предположил, что Мэри Тодд Линкольн, жена американского президента Абрахам Линкольн, десятилетиями болел пагубной анемией и умер от нее.[55][56]
Исследование
Комплекс SNAC
Хотя пероральные мегадозы и внутримышечные инъекции являются наиболее распространенными методами лечения, доступными в настоящее время, в настоящее время проходят испытания несколько новых методов, с большой надеждой на их включение в основные методы лечения в будущем. Поскольку инъекции являются неблагоприятным средством доставки лекарств, текущие исследования включают улучшение пассивной диффузии через подвздошную кишку при пероральном приеме производных кобаламина. Исследователи недавно воспользовались преимуществами нового соединения N- [8- (2-гидроксибензоил) амино] каприлата натрия (SNAC), которое значительно увеличивает как биодоступность, так и метаболическую стабильность.[57] SNAC может образовывать нековалентный комплекс с кобаламином, сохраняя при этом его химическую целостность.[нужна цитата ] Этот комплекс гораздо более липофильный, чем водорастворимый витамин B.12, поэтому может с большей легкостью проходить через клеточные мембраны.
Рекомбинантный внутренний фактор
Другой метод увеличения абсорбции через подвздошную кишку - проглатывание комплекса Cbl, с которым IF уже связан. Отсутствие внутреннего фактора, продуцируемого организмом пациента, может быть восполнено использованием синтетического человеческого IF, полученного из растения гороха. рекомбинанты.[58] Однако в случаях, когда IF-антитела являются причиной мальабсорбции через подвздошную кишку, это лечение было бы неэффективным.[нужна цитата ]
Сублингвальная доставка
Сублингвальный постулируется, что лечение более эффективно, чем пероральное лечение. Исследование 2003 г.[59] Было обнаружено, что хотя этот метод является эффективным, доза цианокобаламина в 500 мкг, вводимая перорально или сублингвально, одинаково эффективна для восстановления нормальных физиологических концентраций кобаламина.
Рекомендации
- ^ а б c d е ж грамм Андрес Э., Серрадж К. (2012). «Оптимальное лечение злокачественной анемии». Журнал медицины крови. 3: 97–103. Дои:10.2147 / JBM.S25620. ЧВК 3441227. PMID 23028239.
- ^ а б Профессиональный справочник по болезням (9-е изд.). Филадельфия: Wolters Kluwer Health / Lippincott Williams & Wilkins. 2009. с.502. ISBN 9780781778992.
- ^ Forbis, Пэт (2005). Эпонимы Стедмана медицинские (2-е изд.). Балтимор, штат Мэриленд: Липпинкотт Уильямс и Уилкинс. п. 6. ISBN 9780781754439.
- ^ а б c «Каковы признаки и симптомы злокачественной анемии?». NHLBI. 1 апреля 2011 г. В архиве из оригинала 14 марта 2016 г.. Получено 14 марта 2016.
- ^ а б c d е ж грамм "Что такое пагубная анемия?". NHLBI. 1 апреля 2011 г. В архиве из оригинала 14 марта 2016 г.. Получено 14 марта 2016.
- ^ а б c «Как диагностируется пагубная анемия?». NHLBI. 1 апреля 2011 г. В архиве из оригинала 14 марта 2016 г.. Получено 14 марта 2016.
- ^ а б c d "Как лечится пагубная анемия?". NHLBI. 1 апреля 2011 г. В архиве из оригинала 14 марта 2016 г.. Получено 14 марта 2016.
- ^ «Версия МКБ-10: 2015 г.». apps.who.int. В архиве из оригинала от 02.11.2015. Получено 2015-11-13.
- ^ а б c "Что вызывает пагубную анемию?". NHLBI. 1 апреля 2011 г. В архиве из оригинала 14 марта 2016 г.. Получено 14 марта 2016.
- ^ а б «Как можно предотвратить пагубную анемию?». NHLBI. 1 апреля 2011 г. В архиве из оригинала 14 марта 2016 г.. Получено 14 марта 2016.
- ^ а б «Жизнь с пагубной анемией». NHLBI. 1 апреля 2011 г. В архиве из оригинала 14 марта 2016 г.. Получено 14 марта 2016.
- ^ Грир, Джон П. (2009). Клиническая гематология Винтроба (12-е изд.). Филадельфия: Wolters Kluwer Health / Lippincott Williams & Wilkins. п. 1157. ISBN 9780781765077. В архиве из оригинала от 14 марта 2016 г.
- ^ Вайлу, Кейт (1999). «Корпоративное« завоевание »пагубной анемии». Определение технологии крови и идентификации болезней в Америке двадцатого века (Издательство Джонса Хопкинса в мягкой обложке). Балтимор, штат Мэриленд: Издательство Университета Джона Хопкинса. п. Глава 4. ISBN 9780801870293. В архиве из оригинала от 14 марта 2016 г.
- ^ Словарь медицины. Рутледж. 2014. с. 404. ISBN 9781135928414. В архиве из оригинала от 14.03.2016.
- ^ Тампаро, Кэрол (2016). Заболевания человеческого тела. F.A. Davis. п. 295. ISBN 9780803657915. В архиве из оригинала от 17.03.2016.
- ^ В 20% случаев дефицита кобаламина анемия не наблюдается.
- ^ а б c d е Schick, P .; Конрад, Марсель Э .; Беса, Эммануэль С., ред. (2015-08-15). «Пагубная анемия, клиническая картина». Medscape. В архиве из оригинала 17 ноября 2012 г.. Получено 21 января 2013.
- ^ а б c d е ж Значит, Роберт Т. младший и Глэдер, Бертил (2009). «Анемия: общие соображения (Глава 26)». In Greer, J.P .; Foerster, J .; Rodgers, G.M .; Paraskevas, F .; Glader, B .; Arber, D.A .; Средство младший, Р. (ред.). Клиническая гематология Винтроба. 1 (12-е изд.). Филадельфия, Пенсильвания, США: Wolters Kluwer / Lippincott Williams & Wilkins. С. 779–809, особенно. 782. ISBN 978-0781765077. Получено 10 марта 2016.CS1 maint: использует параметр авторов (связь)
- ^ а б c d е Рамани, Джеймс Картон, Ричард Дейли, Прамила (2007). Клиническая патология. Оксфорд, ENG: Издательство Оксфордского университета. ISBN 978-0198569466.[страница нужна ]
- ^ а б c Turgeon, Мэри Л. (2005). Клиническая гематология: теория и процедуры (4-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. ISBN 978-0781750073.[страница нужна ]
- ^ а б Hvas AM, Nexo E (ноябрь 2006 г.). «Диагностика и лечение дефицита витамина B12 - новости». Haematologica. 91 (11): 1506–12. PMID 17043022.
- ^ Герстен, Тодд и сеть здравоохранения VeriMed (2016). "Злокачественная анемия". В Зиве, Дэвид; Огилви, Исла; и другие. (ред.). Медицинская энциклопедия MedlinePlus. Вашингтон, округ Колумбия: nlm.nih.gov. В архиве из оригинала 11 марта 2016 г.. Получено 11 марта 2016.CS1 maint: использует параметр авторов (связь)
- ^ а б c Викрамасингх, С. Н. (ноябрь 2006 г.). «Диагностика мегалобластных анемий». Отзывы о крови. 20 (6): 299–318. Дои:10.1016 / j.blre.2006.02.002. PMID 16716475.
- ^ Кристенсен Э.И., Бирн Х (апрель 2002 г.). «Мегалин и кубилин: многофункциональные рецепторы эндоцитов». Nat. Преподобный Мол. Cell Biol. 3 (4): 256–66. Дои:10.1038 / nrm778. PMID 11994745. S2CID 21893726.
- ^ а б c Банк С., Райан К., Томсон В., Ньюман В. Г. (июнь 2011 г.). «Пагубная анемия - генетические открытия». Отзывы об аутоиммунности. 10 (8): 455–9. Дои:10.1016 / j.autrev.2011.01.009. PMID 21296191.
- ^ Де Блок CE, Де Лиу И.Х., Ван Гал Л.Ф. (февраль 2008 г.). «Аутоиммунный гастрит при диабете 1 типа: клинически ориентированный обзор». Журнал клинической эндокринологии и метаболизма. 93 (2): 363–71. Дои:10.1210 / jc.2007-2134. PMID 18029461.
- ^ а б c Ланер Э, Аннибале Б. (ноябрь 2009 г.). «Пагубная анемия: новые открытия с гастроэнтерологической точки зрения». Мир J. Гастроэнтерол. 15 (41): 5121–8. Дои:10.3748 / wjg.15.5121. ЧВК 2773890. PMID 19891010.
- ^ Desai HG, Gupte PA (декабрь 2007 г.). «Связь Helicobacter pylori с злокачественной анемией». Журнал Ассоциации врачей Индии. 55: 857–9. PMID 18405134.
- ^ Kaferle J, Strzoda CE (1 февраля 2009 г.). «Оценка макроцитоза». Американский семейный врач. 79 (3): 203–8. PMID 19202968.
- ^ фон Дригальский А., Андрис Д.А. (апрель – май 2009 г.). «Анемия после бариатрической операции: больше, чем просто дефицит железа». Питание в клинической практике. 24 (2): 217–26. Дои:10.1177/0884533609332174. PMID 19321896. S2CID 21448167.
- ^ Джон С., Хёгерл С. (ноябрь 2009 г.). «Недостаток питания после операции желудочного шунтирования». Журнал Американской остеопатической ассоциации. 109 (11): 601–4. Дои:10.7556 / jaoa.2009.109.11.601 (неактивно 10.09.2020). PMID 19948694.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (связь)
- ^ а б Whttingham S., Ungar B., Mackay I. R., Mathews J. D. (1969). "Генетический фактор пагубной анемии. Семейное исследование пациентов с гастритом". Ланцет. 1 (7602): 951–954. Дои:10.1016 / S0140-6736 (69) 91856-X. PMID 4180811.CS1 maint: несколько имен: список авторов (связь)
- ^ Макинтайр О. Р., Салливан Л. В., Джеффрис Г. Х., Сильвер Р. Х. (1965). «Пагубная анемия в детстве». Медицинский журнал Новой Англии. 272 (19): 981–986. Дои:10.1056 / nejm196505132721901. PMID 14279251.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Вангель А. Г., Каллендер С. Т., Спрей Г. Х., Райт Р. (1968). «Семейное исследование пагубной анемии II. Секреция внутреннего фактора, абсорбция витамина B12 и генетические аспекты желудочного аутоиммунитета». Британский журнал гематологии. 14 (2): 183–204. Дои:10.1111 / j.1365-2141.1968.tb01486.x. PMID 5635601. S2CID 6994133.CS1 maint: несколько имен: список авторов (связь)
- ^ О, Р., Браун DL (1 марта 2003 г.). «Дефицит витамина В12». Американский семейный врач. 67 (5): 979–86. PMID 12643357.
- ^ О'Лири Ф., Сэмман С. (март 2010 г.). «Витамин B12 в здоровье и болезни». Питательные вещества. 2 (3): 299–316. Дои:10.3390 / nu2030299. ЧВК 3257642. PMID 22254022.
- ^ Стовер, П.Дж. (июнь 2004 г.). «Физиология фолиевой кислоты и витамина B12 в здоровье и болезни». Отзывы о питании. 62 (6 Pt 2): S3–12, обсуждение S13. Дои:10.1111 / j.1753-4887.2004.tb00070.x. PMID 15298442.
- ^ Пагана, Тимоти Джеймс; Пагана, Кэтлин Деска (2006). Руководство Мосби по диагностическим и лабораторным исследованиям. Мосби Эльзевьер. ISBN 978-0-323-03903-1.[страница нужна ]
- ^ Devalia V (август 2006 г.). «Диагностика дефицита витамина B-12 на основе анализа сывороточного B-12». BMJ. 333 (7564): 385–6. Дои:10.1136 / bmj.333.7564.385. ЧВК 1550477. PMID 16916826.
- ^ а б c Snow, CF (28 июня 1999 г.). «Лабораторная диагностика дефицита витамина B12 и фолиевой кислоты: руководство для терапевта». Архивы внутренней медицины. 159 (12): 1289–98. Дои:10.1001 / archinte.159.12.1289. PMID 10386505.
- ^ Грасбек Р. (2006). «Синдром Имерслунда-Грасбека (селективная мальабсорбция витамина B12 с протеинурией)». Журнал редких заболеваний Orphanet. 1 (1): 17. Дои:10.1186/1750-1172-1-17. ЧВК 1513194. PMID 16722557.
- ^ а б Моридани, Маджид; Шана Бен-Пурат (март 2006 г.). «Лабораторное исследование дефицита витамина B12». Лабораторная медицина. 37 (3): 166–74. Дои:10.1309 / cvhkle2r4w68k2nq.
- ^ Мидерер, С. (1977). Гистотопография слизистой оболочки желудка. Тиме, ISBN 3-13-508601-1
- ^ Батлер С.К., Видал-Алабалл Дж., Каннингс-Джон Р. и др. (Июнь 2006 г.). «Пероральный витамин B12 по сравнению с внутримышечным витамином B12 при дефиците витамина B12: систематический обзор рандомизированных контролируемых испытаний». Семейная практика. 23 (3): 279–85. Дои:10.1093 / fampra / cml008. PMID 16585128.
- ^ Рамакришнан, под редакцией Уша (2000). Алиментарные анемии. Бока-Ратон: CRC Press. ISBN 978-0849385698.CS1 maint: дополнительный текст: список авторов (связь)
- ^ Андрес Э., Серра К. (2012). «Оптимальное лечение злокачественной анемии». Журнал медицины крови. 3: 97–103. Дои:10.2147 / JBM.S25620. ЧВК 3441227. PMID 23028239.
- ^ а б Andrès, E .; Fothergill, H .; Мечили, М. (2010). «Эффективность пероральной терапии кобаламином (витамином B12)». Мнение эксперта по фармакотерапии. 11 (2): 249–256. Дои:10.1517/14656560903456053. PMID 20088746. S2CID 37088496.
- ^ Andrès, E .; Дали-Юсеф, Н .; Vogel, T .; Serraj, K .; Циммер, Дж. (2009). «Пероральное лечение кобаламином (витамином B12). Обновленная информация». Международный журнал лабораторной гематологии. 31 (1): 1–8. Дои:10.1111 / j.1751-553X.2008.01115.x. PMID 19032377.
- ^ Кармель, Р. (7 июля 2008 г.). «Как я лечу дефицит кобаламина (витамина B12)». Кровь. 112 (6): 2214–2221. Дои:10.1182 / кровь-2008-03-040253. ЧВК 2532799. PMID 18606874.
- ^ Стейблер С. П., Аллен Р. Х. (2004). «Дефицит витамина B12 как мировая проблема». Ежегодный обзор питания. 24 (1): 299–326. Дои:10.1146 / annurev.nutr.24.012003.132440. PMID 15189123.
- ^ "История Лейта, Эдинбург". leithhistory.co.uk. Получено 11 марта 2016.
- ^ Энерсен, Оле Даниэль (2016). «Словарь медицинских эпонимов Whonamedit». whonamedit.com. В архиве из оригинала 3 марта 2016 г.. Получено 11 марта 2016.[нужен лучший источник ]
- ^ Уильям Б. Кастл 1897–1990 Биографические воспоминания Джеймса Х. Джэндла Copyright 1995 National Academies Press Вашингтон, округ Колумбия.[требуется полная цитата ]
- ^ Архив Нобелевской премии. "Нобелевская премия по физиологии и медицине 1934 г." (Nobelprize.org). В архиве из оригинала от 02.08.2012. Получено 2012-08-05.[требуется полная цитата ]
- ^ Джон Г. Сотос, Справочник Мэри Линкольн о разуме и теле: включая объединяющий диагноз, объясняющий ее общественное разложение, проявление безумия и медленную смерть (Маунт Вернон, Вирджиния: Книжные системы Маунт Вернон, 2016) ISBN 978-0-9818193-8-9
- ^ Джон Г. Сотос, Что за недуг - Смертельная пагубная анемия Мэри Тодд Линкольн. Перспективы биологии и медицины. 2015; 58: 419-443.
- ^ Castelli, M. C .; Вонг, Д. Ф .; Фридман, К .; Райли, М.Г.И. (2011). «Фармакокинетика орального цианокобаламина, содержащего натрий N- 8- (2-гидроксибензоил) амино] каприлат (SNAC): открытое, рандомизированное, однократное исследование в параллельных группах с участием здоровых мужчин». Клиническая терапия. 33 (7): 934–945. Дои:10.1016 / j.clinthera.2011.05.088. PMID 21722960.
- ^ Федосов, С. Н .; Laursen, N.B .; Nexo, E .; Moestrup, S.K .; Petersen, T. E .; Jensen, E. O .; Берглунд, Л. (2003). «Внутренний фактор человека, выраженный в растении Arabidopsis thaliana» (PDF). Европейский журнал биохимии. 270 (16): 3362–3367. Дои:10.1046 / j.1432-1033.2003.03716.x. PMID 12899693.
- ^ Sharabi, A .; Cohen, E .; Sulkes, J .; Гарти, М. (2003). «Заместительная терапия при дефиците витамина B12: сравнение сублингвального и перорального приема». Британский журнал клинической фармакологии. 56 (6): 635–638. Дои:10.1046 / j.1365-2125.2003.01907.x. ЧВК 1884303. PMID 14616423.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
