Зотаролимус - Zotarolimus - Wikipedia
 | |
| Клинические данные | |
|---|---|
| Другие имена | (42S) -42-дезокси-42- (1ЧАС-тетразол-1-ил) -рапамицин |
| Код УВД |
|
| Идентификаторы | |
| |
| Количество CAS | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| Химические и физические данные | |
| Формула | C52ЧАС79N5О12 |
| Молярная масса | 966,21 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Зотаролимус (ГОСТИНИЦА, кодовое название ABT-578) является иммунодепрессант. Это полусинтетическое производное сиролимус (рапамицин). Он был разработан для использования в стенты с фосфорилхолин как носитель. Зотаролимус, или ABT-578, первоначально использовался на платформах коронарных стентов Abbott для уменьшения раннего воспаления и рестеноза; однако Zotarolimus не помог основной конечной точке Abbott вывести на рынок их стент / систему доставки лекарств. Препарат был продан / распределен компании Medtronic для использования на их платформах стентов, это тот же препарат, который они используют сегодня. Коронарные стенты снижают вероятность ранних осложнений и улучшают отдаленные клинические исходы у пациентов, нуждающихся в интервенционной кардиологии.[1] Первая имплантация коронарного стента человеку была впервые проведена в 1986 году Puel et al.[1][2] Однако есть осложнения, связанные с использованием стентов, развитием тромбоз что снижает эффективность коронарных стентов, геморрагические осложнения и осложнения рестеноза являются проблемами, связанными со стентами.[1]
Эти осложнения привели к развитию стенты с лекарственным покрытием. Стенты связаны мембраной, состоящей из полимеров, которые не только медленно высвобождают зотаролимус и его производные в окружающие ткани, но также не вызывают воспалительной реакции организма.
Medtronic используют зотаролимус в качестве антипролиферативный агент в полимерном покрытии продуктов Endeavour и Resolute.[3]
Фон
Присущие многим противораковым агентам свойства ингибирования роста делают эти лекарства идеальными кандидатами для предотвращения рестеноз. Однако эти же свойства часто связаны с цитотоксичностью при дозах, которые блокируют пролиферацию клеток. Таким образом, уникальная цитостатическая природа иммунодепрессанта рапамицин легло в основу разработки зотаролимуса Джонсоном и Джонсоном. Рапамицин был первоначально одобрен для профилактики отторжения почечного трансплантата в 1999 году. Abbott Laboratories разработала соединение из того же класса, зотаролимус (ранее ABT-578), в качестве первого цитостатического агента, который будет использоваться исключительно для доставки из стентов с лекарственным покрытием для предотвращения рестеноза.[4]
Стенты с лекарственным покрытием
Стенты с лекарственным покрытием революционизировали сферу интервенционных кардиология и предоставили значительные инновации для предотвращения коронарной артерии рестеноз. Полимерные покрытия, которые доставляют антипролиферативные препараты к стенке сосуда, являются ключевыми компонентами этих революционных медицинских устройств. Разработка стентов, которые элюируют мощный антипролиферативный агент, зотаролимус, из синтетического фосфорилхолин полимер на основе, известный своим биосовместимым профилем. Зотаролимус - первое лекарство, разработанное специально для местной доставки из стентов с целью предотвращения рестеноза, и оно было тщательно протестировано для подтверждения этого показания. Клинический опыт использования полимера ПК также обширен, поскольку на сегодняшний день более 120 000 пациентам были имплантированы стенты, содержащие это нетромбогенное покрытие.[4]
Структура и свойства
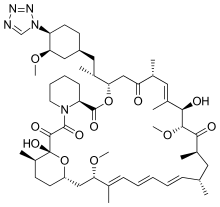
Зотаролимус - это аналог сделано путем замены тетразол кольцо на место родного гидроксильная группа в положении 42 рапамицина, выделенного и очищенного как натуральный продукт ферментации. Было обнаружено, что это место модификации является наиболее устойчивым местом для внесения новых структурных изменений без нарушения биологической активности. Состав чрезвычайно липофильный, с очень высоким коэффициент распределения октанол-вода, и поэтому имеет ограниченную растворимость в воде. Эти свойства очень полезны для создания стента с лекарственным средством, содержащего зотаролимус, для получения медленного длительного высвобождения лекарственного средства из стента непосредственно в стенку коронарных сосудов. Плохая растворимость в воде предотвращает быстрое высвобождение в кровоток, поскольку элюирование лекарственного средства из стента будет частично ограничено скоростью растворения. Медленная скорость высвобождения и последующая диффузия молекулы способствует поддержанию терапевтических уровней лекарственного средства, элюируемого из стента. Кроме того, его липофильный характер способствует прохождению через клеточные мембраны для ингибирования неоинтимальной пролиферации ткани-мишени. Коэффициенты распределения октанол-вода для ряда соединений, недавно полученные в сравнительном исследовании, указывают на то, что зотаролимус является наиболее липофильным из всех лекарственных средств DES. [4]
Рестеноз
Зотаролимус используется для противодействия рестеноз. Рестеноз обычно описывается клиническими испытаниями с использованием бинарного подхода, также известного как «бинарный рестеноз» или просто «бинарный стеноз». Бинарный рестеноз определяется как стеноз> 50% диаметра сосуда (стеноз диаметра) или потеря> 50% острого просвета, также известная как «поздняя потеря» после «резкого увеличения» диаметра просвета после стентирования.[1] Термин «бинарный» означает, что пациенты разделены на 2 группы: пациенты со стенозом> 50% и пациенты со стенозом <50%. An окклюзия, или блокирование всего кровотока через сосуд, считается 100% стенозом.
Ранее считалось, что рестеноз возникает из-за развития утолщения неоинтимы в результате стимуляции гладких мышц.[1] Однако теперь считается, что механизмом является сокращение расширенного сегмента кровеносного сосуда.[1] Это объясняет, почему стентирование, увеличивающее площадь просвета, так эффективно снижает вероятность рестеноза.[1] Рестеноз сосудов обычно определяется ангиография, но также может быть обнаружен дуплексным УЗИ и другие методы визуализации.
Профилактика рестеноза
Основным достижением в профилактике рестеноза является использование стентов. Исследование рестеноза стента (STRESS) показало, что стенты снижают частоту рестеноза до 32% по сравнению с другими медицинскими методами, которые в совокупности снижают его только до 42%.[1]
Физиологические эффекты
Ключевым биологическим событием, связанным с рестенотическим процессом, несомненно, является пролиферация гладкомышечных клеток в ответ на расширение инородного тела на стенку сосуда. Этот пролиферативный ответ инициируется ранней экспрессией факторов роста, таких как изоформы PDGF, bFGF, тромбин, которые связываются с клеточными рецепторами.
Однако ключ к пониманию механизма, с помощью которого такие соединения, как зотаролимус, ингибируют пролиферацию клеток, основан на событиях, которые происходят после связывания этого фактора роста. События передачи сигнала, которые завершаются остановкой клеточного цикла в фазе G1, инициируются в результате связывания лиганда с иммунофилином, известным как FK-связывающий белок-12. Обозначение FK было основано на ранних исследованиях, проведенных с такролимус, ранее известный как FK-506, который связывает этот цитоплазматический белок с высокой аффинностью.
Последующие исследования показали, что рапамицин также связывается с этой внутриклеточной мишенью, образуя комплекс FKBP12-рапамицин, который сам по себе не является ингибирующим, но обладает способностью блокировать интегральную протеинкиназу, известную как мишень рапамицина (TOR). TOR был впервые обнаружен в дрожжах[5] и позже идентифицирован в эукариотических клетках, где он был обозначен как mTOR, мишень рапамицина у млекопитающих. Важность mTOR основана на его способности фосфорилировать ряд ключевых белков, включая те, которые связаны с синтезом белка (p70s6kinase) и инициацией трансляции (4E-BP1).
Особое значение имеет роль, которую mTOR играет в регуляции p27kip1, ингибитора циклин-зависимых киназ, таких как cdk2. Считается, что связывание таких агентов, как рапамицин и зотаролимус, с mTOR блокирует решающую роль mTOR в этих клеточных событиях, что приводит к остановке клеточного цикла и, в конечном итоге, к пролиферации клеток.
Рекомендации
- ^ а б c d е ж грамм час Браунвальд Э, Зипес Д., Либби П., ред. (2001). Болезни сердца: учебник сердечно-сосудистых заболеваний (6-е изд.). Филадельфия: Сондерс Эльзевьер.
- ^ Зигварт Ю., Пуэль Дж, Миркович В., Жоффре Ф., Каппенбергер Л. (март 1987 г.). «Внутрисосудистые стенты для предотвращения окклюзии и рестеноза после транслюминальной ангиопластики». Медицинский журнал Новой Англии. 316 (12): 701–6. Дои:10.1056 / NEJM198703193161201. PMID 2950322.
- ^ «Medtronic получает одобрение FDA на коронарную стент-систему Endeavour, выделяющую зотаролимус».
- ^ а б c Берк С.Е., Кунц Р. Е., Шварц Л. Б. (июнь 2006 г.). «Стенты с зотаролимусом (ABT-578)». Расширенные обзоры доставки лекарств. 58 (3): 437–46. Дои:10.1016 / j.addr.2006.01.021. PMID 16581153.
- ^ Хейтман Дж., Мовва Н.Р., Холл М.Н. (август 1991 г.). «Мишени для остановки клеточного цикла с помощью иммунодепрессанта рапамицина в дрожжах». Наука. 253 (5022): 905–9. Bibcode:1991Sci ... 253..905H. Дои:10.1126 / science.1715094. PMID 1715094. S2CID 9937225.
