Аппарицин - Apparicine
 | |
| Имена | |
|---|---|
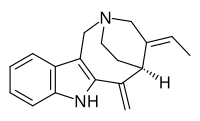
| Название ИЮПАК (2р,4E,5S) -4-Этилиден-6-метилиден-1,3,4,5,6,7-гексагидро-2,5-этаноазоцино [4,3-б] индол | |
| Идентификаторы | |
3D модель (JSmol ) | |
| 3DMet | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| КЕГГ | |
PubChem CID | |
| |
| |
| Характеристики | |
| C18ЧАС20N2 | |
| Молярная масса | 264.372 г · моль−1 |
| Плотность | 0.945875 |
| бревно п | 3.404 |
| Кислотность (пKа) | 8.37 |
| 1.665 | |
| 0.552121 | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Аппарицин это монотерпеноид индольный алкалоид.[1] Он назван в честь Аппарисио Дуарте, бразильца. ботаник кто изучал Аспидосперма вид, из которого впервые был выделен аппарицин.[2][3] Это был первый участник валлезамин группа алкалоиды быть изолированным и иметь установленную структуру,[3] который был впервые опубликован в 1965 году.[4] Это также было известно синонимами гомезин, перикаллина, и табернощизин.[5]
Биохимия
Алкалоид был выделен из семи видов Аспидосперма.[6] Это основной алкалоид, содержащийся в мозоль из Tabernaemontana elegans, а также был обнаружен в других Tabernaemontana виды, в том числе T. africana, Т. divaricata, T. orientalis, и Т. пахисифон.[7][8] В исследованиях Т. пахисифонбыло обнаружено, что содержание алкалоидов, включая аппарицин, было наибольшим в молодых листьях и листьях, получающих большую тень, и варьировалось в зависимости от возраста листа, возраста растения и происхождения.[9]
Исследования по Aspidosperma pyricollum привело к открытию того, что аппарицин биосинтезированный из триптофан "потерей C-2 и удержанием C-3".[10] Биосинтез аппарицина требует изменения обычного триптамин боковая цепь с потерей С-1.[1]
Определение структуры
Его структура была создана методами химическое разложение, и зарождающееся поле развязка ядерного магнитного резонанса (ЯМР) с использованием 1Изотоп H водорода.[11] Ультрафиолетовая видимая спектроскопия показали, что аппарицин имеет такое же УФ-поглощение, что и улейн,[12] и их хромофоры оказались идентичными.[11]
Эксперименты по развязке ЯМР показали, что в аппарицине отсутствует N-метильный сигнал и имеет один метиленовый атом углерода между атомом азота и индол кольца, что позволяет исследователям отличить его от улеина.[12] Это было заметное раннее использование разделения ЯМР для определения химической структуры.[12] Его углерод скелет Было обнаружено, что он связан с улеином, но отличается от него, а структуры валлезамина и O-ацетил-валлезамина связаны с аппарицином.[13]
Дегидрирование аппарицина, за которым следует окисление с перманганат разрешенное расположение двух пиперидин кольцевые углеродные заместители.[14]
Приложения
Апарицин может иметь несколько потенциальных применений. В клеточные культуры, он показал цитотоксичность против экспериментального лимфоцитарный лейкоз P388 клеточная линия.[15] Проявляет сильную активность против полиовирус тип 3 (ПВ3),[15] и имеет умеренную или сильную активность против некоторых людей патогены.[16] Он также активен в опиоидные рецепторы[15] и имеет микромолярный близость за аденозиновые рецепторы.[17] Аппарицин имеет местное обезболивающее характеристики.[16]
Примечания
- ^ а б Герберт 1983, п. 13.
- ^ Элиа 2008, п. 594.
- ^ а б Джоуль 1983, п. 286.
- ^ Joule et al. 1965 г., п. 4773.
- ^ Гилберт 1968, п. 273.
- ^ Монтейро 1966, п. 39.
- ^ Verpoorte et al. 1989 г., п. 139.
- ^ Элиа 2008, п. 593.
- ^ Элиа 2008, п. 596.
- ^ Шамма 1970, п. 324.
- ^ а б Joule et al. 1980 г., п. 230.
- ^ а б c Джоуль 1983, п. 287.
- ^ Биман 1966, п. 40.
- ^ Джоуль 1983, п. 288.
- ^ а б c Шмельцер 2008, п. 592.
- ^ а б Mairura & Schmelzer 2008 г., п. 590.
- ^ Ingkaninan et al. 1999 г., п. 1441.
Рекомендации
- Биманн, Клаус (1966). «Масс-спектрометрия избранных натуральных продуктов». В Zechmeister, L. (ред.). Fortschritte der Chemie Organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products / Progrès dans la chimie des elements organiques naturelles. 24. Springer-Verlag. С. 1–98. Дои:10.1007/978-3-7091-8143-0_1. ISBN 978-3-7091-8145-4. PMID 5958065.
- Элиа, Дж. (2008). "Tabernaemontana pachysiphon Stapf". В Schmelzer, G.H .; Гуриб-Факим, А. (ред.). Лекарственные растения 1. Растительные ресурсы Тропической Африки. 11. Фонд ПРОТА; Издатели Backhuys; CTA. С. 593–596. ISBN 978-90-5782-204-9.
- Гилберт, Б. (1968). "Алкалоиды Аспидосперма, Охрозия, Плейокарпа, Мелодин, и родственные роды ». В Manske, R.H.F. (ed.). Алкалоиды: химия и физиология. 11. Академическая пресса. С. 205–306. Дои:10.1016 / S1876-0813 (08) 60121-9. ISBN 978-0-12-469511-5.
- Герберт, Ричард Б. (1983). «Структурные и биосинтетические отношения». В Saxton, Дж. Эдвин (ред.). Индолы: часть четвертая: монотерпеноидные индольные алкалоиды. Химия гетероциклических соединений. 25. Джон Уайли и сыновья. стр.1–46. Дои:10.1002 / 9780470186954.ch1. ISBN 0-471-89748-5.
- Ingkaninan, K .; Айзерман, А. П .; Таэзотикул, Т .; Verpoorte, R. (1999). "Выделение опиоидно-активных соединений из Tabernaemontana pachysiphon листья". Журнал фармации и фармакологии. 51 (12): 1441–1446. Дои:10.1211/0022357991777092. PMID 10678501.
- Джоуль, Джон А. (1983). «Улеин – эллиптицин – валлезаминовая группа». В Saxton, Дж. Эдвин (ред.). Индолы: часть четвертая: монотерпеноидные индольные алкалоиды. Химия гетероциклических соединений. 25. Джон Вили и сыновья. стр.265–292. Дои:10.1002 / 9780470186954.ch1. ISBN 0-471-89748-5.
- Joule, J. A .; Allen, M. S .; Бишоп, Д. И .; Harris, M .; и другие. (1980). «Подходы к синтезу аппарицина». В Филлипсоне, Джон Дэвид; Зенк, М. Х. (ред.). Индол и биогенетически родственные алкалоиды. Ежегодные труды Фитохимического общества Европы. 17. Академическая пресса. С. 229–248. ISBN 0-12-554450-2.
- Joule, J. A .; Monteiro, H .; Durham, L.J .; Gilbert, B .; и другие. (1965). «Исследования алкалоидов. Часть XLVIII. Структура аппарицина, нового алкалоида аспидоспермы». Журнал химического общества (4): 4773–4780. Дои:10.1039 / JR9650004773. PMID 5891947.
- Mairura, F. S .; Шмельцер, Г. Х. (2008). "Tabernaemontana crassa Benth.". В Schmelzer, G.H .; Гуриб-Факим, А. (ред.). Лекарственные растения 1. Растительные ресурсы Тропической Африки. 11. Фонд ПРОТА; Издатели Backhuys; CTA. С. 589–592. ISBN 978-90-5782-204-9.
- Монтейро, Уго Хорхе (1966). Исследования некоторых индольных алкалоидов: структура валлезиахотамина. аппарицин, индольный алкалоид новой структуры. структура и химия нервобскурина. тубулозин и его химическая корреляция с дезокситубулозином, части 1–4.
- Шмельцер, Г. Х. (2008). "Tabernaemontana elegans Stapf". В Schmelzer, G.H .; Гуриб-Факим, А. (ред.). Лекарственные растения 1. Растительные ресурсы Тропической Африки. 11. Фонд ПРОТА; Издатели Backhuys; CTA. С. 592–593. ISBN 978-90-5782-204-9.
- Шамма, Морис (1970). «Алкалоиды». У Каина Корнилий К .; и другие. (ред.). Годовые отчеты по медицинской химии, 1969 г.. Академическая пресса. С. 323–332. Дои:10.1016 / S0065-7743 (08) 60353-X. ISBN 978-0-12-040505-3.
- Verpoorte, R .; van der Heijden, R .; Schripsema, J .; Sierra, M .; и другие. (1989). «Вторичные метаболиты в клеточных культурах Teabernaemontana виды ". В Курце, Вольфганг Г. В. (ред.). Первичный и вторичный метаболизм культур клеток растений II. Springer-Verlag. С. 138–148. Дои:10.1007/978-3-642-74551-5_16. ISBN 978-3-642-74553-9.
внешняя ссылка
- (-) - Аппарицин на Агентство по охране окружающей среды США
- (-) - Аппарицин в KNApSAck
- Перикалин в ChemIDplus

