Генетическая устойчивость человека к малярии - Human genetic resistance to malaria - Wikipedia
Эта статья поднимает множество проблем. Пожалуйста помоги Улучши это или обсудите эти вопросы на страница обсуждения. (Узнайте, как и когда удалить эти сообщения-шаблоны) (Узнайте, как и когда удалить этот шаблон сообщения)
|
Генетическая устойчивость человека к малярии относится к унаследованным изменениям в ДНК людей, которые повышают устойчивость к малярия и привести к увеличению выживаемости людей с этими генетическими изменениями. Существование этих генотипы вероятно из-за эволюционное давление проявляется паразитами рода Плазмодий которые вызывают малярию. Поскольку малярия поражает красные кровяные тельца эти генетические изменения чаще всего представляют собой изменения молекул, необходимых для функции красных кровяных телец (и, следовательно, выживания паразитов), например гемоглобин или другие клеточные белки или ферменты красных кровяных телец. Эти изменения обычно защищают эритроциты от вторжения Плазмодий паразиты или размножение паразитов в красных кровяных тельцах.
Эти унаследованные изменения гемоглобина или других характерных белков, которые являются критическими и довольно инвариантными характеристиками биохимии млекопитающих, обычно вызывают наследственное заболевание. Поэтому их обычно называют именами заболевания крови связанные с ними, в том числе серповидноклеточная анемия, талассемия, дефицит глюкозо-6-фосфатдегидрогеназы, и другие. Эти заболевания крови вызывают повышенное болезненность и смертность в регионах мира, где малярия менее распространена.
Развитие генетической устойчивости к малярии
Микроскопический паразиты, как вирусы, простейшие, вызывающие малярию, и другие, не могут размножаться сами по себе и полагаться на хозяина для продолжения своего жизненного цикла. Они реплицируются, вторгаясь в клетки хозяев и узурпируя клеточные механизмы для самовоспроизведения. В конце концов, неконтролируемая репликация приводит к тому, что клетки лопаются, убивая клетки и высвобождая инфекционные организмы в кровоток, где они могут заразить другие клетки. По мере отмирания клеток и накопления токсичных продуктов репликации инвазивных организмов появляются симптомы заболевания. Поскольку в этом процессе участвуют специфические белки, продуцируемые инфекционным организмом, а также клеткой-хозяином, даже очень небольшое изменение критического белка может сделать инфекцию трудной или невозможной. Такие изменения могут возникнуть в результате мутации гена, кодирующего этот белок. Если изменение касается гаметы, то есть сперматозоида или яйцеклетки, которые соединяются, образуя зиготу, которая вырастает в человека, защитная мутация будет унаследована. Поскольку смертельные болезни убивают многих людей, у которых отсутствуют защитные мутации, со временем многие люди в регионах, где смертельные заболевания являются эндемическими, наследуют защитные мутации.
Когда P. falciparum паразит заражает клетку-хозяин, он изменяет характеристики мембраны эритроцитов, делая ее «более липкой» для других клеток. Кластеры паразитированных эритроцитов могут превышать размер капиллярного кровообращения, прилипать к эндотелий, и заблокировать циркуляцию. Когда эти закупорки образуются в кровеносных сосудах, окружающих мозг, они вызывают церебральная гипоксия, в результате чего неврологический симптомы, известные как церебральная малярия. Это состояние характеризуется спутанностью сознания, дезориентацией и часто заканчивается смертельным исходом. кома. На его долю приходится 80% смертей от малярии. Следовательно, мутации, защищающие от заражения малярией и смертельного исхода, имеют значительное преимущество.
Малярия заняла самое сильное место среди известных селективное давление на человеческий геном с момента возникновения сельского хозяйства в течение последних 10 000 лет.[1][2] Плазмодий falciparum вероятно не смог закрепиться среди Африканский населения до большего сидячий сообщества возникли в связи с развитием домашнего сельского хозяйства в Африке ( сельскохозяйственная революция ). Несколько унаследованных вариантов в красные кровяные тельца стали обычным явлением в тех частях мира, где малярия является частым явлением в результате отбора, осуществляемого этим паразит.[3] Этот выбор был исторически важен как первый задокументированный пример болезнь как агент естественный отбор в люди. Это также был первый пример генетически контролируемого врожденный иммунитет который действует на ранней стадии развития инфекций, предшествует адаптивному иммунитету, который проявляется через несколько дней. При малярии, как и при других заболеваниях, врожденный иммунитет приводит к возникновению и стимулирует адаптивный иммунитет.
Мутации могут иметь как вредные, так и положительные эффекты, и любая отдельная мутация может иметь и то и другое. Инфекция малярии зависит от конкретных белков, присутствующих в клеточных стенках и других частях красных кровяных телец. Защитные мутации изменяют эти белки таким образом, что они становятся недоступными для малярийных организмов. Однако эти изменения также изменяют функционирование и форму красных кровяных телец, что может иметь видимые эффекты либо явно, либо при микроскопическом исследовании красных кровяных телец. Эти изменения могут нарушать функцию эритроцитов различными способами, что пагубно сказывается на здоровье или долголетии человека. Однако, если чистый эффект защиты от малярии перевешивает другие пагубные последствия, защитная мутация будет сохраняться и передаваться из поколения в поколение.
Эти изменения, которые защищают от малярийных инфекций, но ухудшают эритроциты, обычно считаются заболеваниями крови, поскольку они, как правило, имеют явные и пагубные последствия. Их защитная функция была открыта и признана лишь недавно. Некоторые из этих заболеваний известны под причудливыми и загадочными названиями, такими как серповидноклеточная анемия, талассемия, дефицит глюкозо-6-фосфатдегидрогеназы, овалоцитоз, эллиптоцитоз и потеря антигена Гербиха и антигена Даффи. Эти названия относятся к различным белкам, ферментам и форме или функции красных кровяных телец.
Врожденное сопротивление
Мощный эффект генетически контролируемой врожденной резистентности отражается в вероятности выживания маленьких детей в районах, эндемичных по малярии. Необходимо изучать врожденный иммунитет в уязвимой возрастной группе (моложе четырех лет), потому что у детей старшего возраста и взрослых эффекты врожденного иммунитета уступают влиянию адаптивного иммунитета. Также необходимо изучить популяции, в которых случайное использование противомалярийные препараты не происходит. Некоторые ранние вклады в врожденную устойчивость к инфекциям позвоночных, включая человека, суммированы в таблице 1.
| Год открытия | Возбудитель | Механизм сопротивления | Авторы |
|---|---|---|---|
| 1954 | P. falciparum | Серповидноклеточная гетерозигота | Эллисон[4] |
| 1975 | P. knowlesi | Невыражение антигена Даффи на эритроцитах | Миллер и др. |
| 1976 | P. vivax | Невыражение антигена Даффи на эритроцитах | Miller et al.[5] |
Примечательно, что два новаторских исследования были посвящены малярии. Классические исследования рецептора Толля в Дрозофила плодовая муха[6] были быстро распространены на Толл-подобные рецепторы в млекопитающие[7] а затем к другим рецепторы распознавания образов, которые играют важную роль в врожденном иммунитете. Однако первые вклады в борьбу с малярией остаются классическими примерами врожденной резистентности, которые выдержали испытание временем.
Механизмы защиты
Механизмы, с помощью которых эритроциты, содержащие аномальные гемоглобины или испытывающие дефицит G6PD, частично защищены от P. falciparum инфекции до конца не изучены, хотя недостатка в предложениях нет. На стадии репликации в периферической крови малярийные паразиты имеют высокую скорость кислород потребление[8] и проглотить большое количество гемоглобина.[9] Вероятно, что HbS в эндоцитарных везикулах деоксигенируется, полимеризуется и плохо переваривается. В эритроцитах, содержащих аномальные гемоглобины или дефицитных по G6PD, кислородные радикалы продуцируются, а паразиты малярии вызывают дополнительный окислительный стресс.[10] Это может привести к изменениям мембран эритроцитов, включая перемещение фосфатидилсерин на их поверхность[жаргон ]с последующим распознаванием и проглатыванием макрофагов.[11] Авторы предполагают, что этот механизм, вероятно, произойдет раньше в аномальных эритроцитах, чем в нормальных эритроцитах, тем самым ограничивая размножение в первых. Кроме того, связывание паразитированных серповидных клеток с эндотелиальными клетками значительно снижается из-за измененного отображения P. falciparum мембранный белок эритроцита-1 (PfMP-1).[12] Этот белок является основным лигандом цитоадгезии паразита и фактором вирулентности на поверхности клетки. На поздних стадиях репликации паразита красные клетки прикрепляются к венозному эндотелию, и подавление этого прикрепления может подавить репликацию.
Серповидный гемоглобин вызывает экспрессию гемоксигеназы-1 в кроветворный клетки. Монооксид углерода, побочный продукт катаболизма гема гемоксигеназа -1 (HO-1), предотвращает накопление циркулирующего свободного гема после Плазмодий инфекция, подавляющая патогенез экспериментальной церебральной малярии.[13] Были описаны другие механизмы, такие как повышенная толерантность к заболеванию, опосредованному HO-1, и снижение роста паразитов из-за транслокации микро-РНК хозяина в паразита.[14]
Типы врожденного сопротивления
Первая линия защиты от малярии в основном обеспечивается аномальными гемоглобинами и дефицитом глюкозо-6-фосфатдегидрогеназы. Три основных типа наследственной генетической устойчивости - серповидноклеточная анемия, талассемии, и Дефицит G6PD - присутствовали в Средиземноморье мир ко времени Римская империя.
Нарушения гемоглобина
Распределение аномальных гемоглобинов
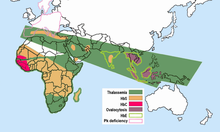
Малярия не встречается в более прохладном и сухом климате высокогорья в тропических и субтропических регионах мира. Были изучены десятки тысяч людей, и высокая частота аномальных гемоглобинов не была обнаружена ни в одном населении, свободном от малярии. Частоты аномальных гемоглобинов в разных популяциях сильно различаются, но некоторые из них, несомненно, полиморфны, имея частоты выше, чем ожидалось при повторяющейся мутации. Больше нет сомнений в том, что малярийный отбор играл главную роль в распространении всех этих полиморфизмов. Все они находятся в малярийных областях,
- Серповидная клетка. Ген HbS, связанный с серповидно-клеточной анемией, сегодня широко распространен в странах Африки к югу от Сахары, на Ближнем Востоке и в некоторых частях Индийского субконтинента, где частоты носителей колеблются от 5-40% и более населения. Частота серповидноклеточных гетерозигот составляла 20-40% в маляриозных областях Кения, Уганда и Танзания. Более поздние исследования многих исследователей дополнили картину.[15][16] Высокие частоты гена HbS ограничены широким поясом поперек Центральная Африка, но исключая большую часть Эфиопия и Восточноафриканское нагорье; это близко соответствует районам передачи малярии. Частота серповидноклеточных гетерозигот до 20% также встречается в очагах Индия и Греция которые ранее были очень малярийными.
Талассемии широко распространены в широком диапазоне, простирающемся от Средиземноморского бассейна и некоторых частей Африки до Ближнего Востока, Индийского субконтинента, Юго-Восточной Азии, Меланезии и до островов Тихого океана.
- α-талассемия, частота которой достигает 30% в некоторых частях Западной Африки;[17]
- β-талассемия с частотой до 10% в некоторых частях Италии;
- HbE, который достигает частот до 55% в Таиланде и других странах Юго-Восточной Азии;[18] HbE обнаружен в восточной половине Индийского субконтинента и по всей Юго-Восточной Азии, где в некоторых регионах частота носителей может превышать 60% населения.
- HbC, который достигает частот, приближающихся к 20% в северной Гане и Буркина-Фасо. HbC ограничен некоторыми частями Западной и Северной Африки.[нужна цитата ]
- сопутствующие полиморфизмы - двойные гетерозиготы по HbS и β-талассемии, а также по HbS и HbC, страдают от вариантных форм серповидноклеточной анемии, более мягких, чем SS, но, вероятно, снизят физическую форму до того, как будет доступно современное лечение. Как и предполагалось, эти вариантные аллели обычно исключают друг друга в популяциях. Существует отрицательная корреляция между частотой HbS и β-талассемии в разных частях Греции и HbS и HbC в Западной Африке.[19] Там, где нет отрицательного взаимодействия мутаций, как в случае аномальных гемоглобинов и дефицита G6PD, можно ожидать и обнаружить положительную корреляцию этих вариантных аллелей в популяциях.[19]
Серповидная клетка
Эта секция отсутствует информация о менделевской генетике, природе серповидно-клеточной анемии, степени защиты от малярии, пораженных видах плазмодий, химическом составе белков, вызывающих деформацию эритроцитов.. (Апрель 2014 г.) |
Серповидно-клеточная анемия - это генетическое заболевание, связанное с мутацией определенного белка. Полинг представил свою принципиально важную концепцию серповидно-клеточной анемии как генетически передающегося молекулярного заболевания.[20]

Молекулярная основа серповидно-клеточной анемии была окончательно выяснена в 1959 году, когда Ингрэм усовершенствовал методику снятия отпечатков пальцев триптических пептидов. В середине 1950-х годов одним из новейших и наиболее надежных способов разделения пептидов и аминокислот был фермент трипсин, который расщеплял полипептидные цепи, специфически разрушая химические связи, образованные карбоксильными группами двух аминокислот, лизина и аргинин. Небольшие различия в гемоглобинах A и S приведут к небольшим изменениям в одном или нескольких из этих пептидов.[21] Чтобы попытаться обнаружить эти небольшие различия, Ингрэм объединил методы бумажного электрофореза и бумажной хроматографии. Посредством этой комбинации он создал двухмерный метод, который позволил ему сравнительно «отпечатать пальцем» фрагменты S и A гемоглобина, которые он получил из триспинового перевариваемого вещества. Отпечатки пальцев выявили приблизительно 30 пептидных пятен, одно пептидное пятно было четко видно в переваривании гемоглобина S, которое не было очевидным в отпечатке пальца гемоглобина А. Дефект гена HbS представляет собой мутацию одного нуклеотида (от A до T) гена β-глобина, заменяющую аминокислотную глутаминовую кислоту на менее полярную аминокислоту валин в шестом положении β-цепи.[22]
HbS имеет более низкий отрицательный заряд при физиологическом pH, чем нормальный взрослый гемоглобин. Последствия простой замены заряженной аминокислоты гидрофобной нейтральной аминокислотой весьма разнообразны. Недавние исследования в Западной Африке показывают, что наибольшее влияние Hb S, по-видимому, заключается в защите от смерти или тяжелых заболеваний, то есть от глубокая анемия или церебральная малярия - хотя сами по себе оказывают меньшее влияние на инфекцию. Дети, гетерозиготные по гену серповидных клеток, имеют только одну десятую риска смерти от falciparum, как и дети, гомозиготные по гену нормального гемоглобина. Связывание паразитированных серповидных эритроцитов с эндотелиальными клетками и моноцитами крови значительно снижается из-за измененного отображения Плазмодий falciparum белок мембраны эритроцитов 1 (PfEMP-1), главный лиганд цитоадгезии паразита и фактор вирулентности на поверхности эритроцитов.[23]
Защита также происходит из-за нестабильности серповидного гемоглобина, который объединяет преобладающий интегральный белок мембраны эритроцитов (называемый полосой 3) и запускает ускоренное удаление фагоцитарными клетками. Природные антитела распознают эти кластеры на стареющих эритроцитах. Защита с помощью HbAS предполагает усиление не только врожденного, но и приобретенного иммунитета к паразиту.[24] Преждевременно денатурированный серповидный гемоглобин приводит к активации естественных антител, которые контролируют адгезию эритроцитов как при малярии, так и при серповидно-клеточной анемии.[25] Нацеливание на стимулы, которые приводят к активации эндотелия, будет представлять собой многообещающую терапевтическую стратегию для подавления адгезии серповидных эритроцитов и вазоокклюзии.[26]
Это привело к гипотезе о том, что пока гомозиготы потому что ген серповидных клеток страдает от болезней, гетерозиготы можно защитить от малярии.[27] Малярия остается селективным фактором серповидно-клеточного синдрома.[28]
Талассемии
Давно известно, что разновидность анемии, получившая название талассемия, имеет высокую частоту у некоторых средиземноморских популяций, включая греков и южных итальянцев. Название происходит от греческих слов «море» (таласса), имея в виду Средиземное море, и кровь (Хайма). Вернон Ингрэм заслуживает похвалы за объяснение генетической основы различных форм талассемии как дисбаланса в синтезе двух полипептидных цепей гемоглобина.[29]
В обычном средиземноморском варианте мутации снижают продукцию β-цепи (β-талассемия). При α-талассемии, которая относительно часто встречается в Африке и некоторых других странах, производство α-цепи гемоглобина нарушено, и наблюдается относительное перепроизводство β-цепи. Люди, гомозиготные по β-талассемии, страдают тяжелой анемией и вряд ли выживут и размножаются, поэтому отбор против этого гена является сильным. Гомозиготные по α-талассемии также страдают анемией, и существует некоторая степень отбора против этого гена.
Нижний Предгорья Гималаев и Внутренние Тераи или Дунские долины из Непал и Индия очень малярийны из-за теплого климата и болот, поддерживаемых в сухой сезон грунтовыми водами, просачивающимися с высоких холмов. Малярийные леса преднамеренно поддерживались правителями Непала в качестве защитной меры. Люди, пытающиеся жить в этой зоне, страдали гораздо более высокой смертностью, чем на более высоких возвышенностях или ниже на более сухих. Гангетическая равнина. Тем не менее Люди тару прожили в этой зоне достаточно долго, чтобы развить устойчивость через несколько генов. Медицинские исследования среди тару и не-тару населения Тераи предоставили доказательства того, что распространенность случаев остаточной малярии среди таров почти в семь раз ниже. Установлено, что в основе устойчивости лежит гомозиготность гена α-талассемии среди местного населения.[30] Эндогамия по кастовому и этническому признаку, по-видимому, препятствовали более широкому распространению этих генов в соседних популяциях.[31]
Эритроиды HbC и HbE
Есть свидетельства того, что люди с α-талассемией, HbC и HbE имеют некоторую степень защиты от паразита.[17][32]Гемоглобин C (HbC) представляет собой аномальный гемоглобин с заменой остатка лизина на остаток глутаминовой кислоты в цепи β-глобина в точно таком же положении β-6, что и мутация HbS. Обозначение «C» для HbC происходит от названия города, в котором он был обнаружен - Крайстчерч, Новая Зеландия. У людей с этим заболеванием, особенно у детей, могут быть эпизоды боли в животе и суставах, увеличения селезенки и легкой желтухи, но у них не бывает серьезных кризов, как при серповидно-клеточной анемии. Гемоглобин C распространен в малярийных районах Западной Африки, особенно в Буркина-Фасо. В крупном исследовании случай-контроль, проведенном в Буркина-Фасо с участием 4 348 субъектов Мосси, этот HbC был связан со снижением риска клинической малярии на 29% у гетерозигот HbAC и на 93% у гомозигот HbCC. HbC представляет собой «медленную, но бесплатную» генетическую адаптацию к малярии через временный полиморфизм по сравнению с полицентрической «быстрой, но дорогостоящей» адаптацией через сбалансированный полиморфизм HbS.[33][34]HbC изменяет количество и распределение вариантного антигена P. falciparum Белок мембраны 1 эритроцитов (PfEMP1) на поверхности инфицированных эритроцитов и модифицированное отображение поверхностных белков малярии снижает адгезию паразитов (тем самым предотвращая выведение селезенкой) и может снизить риск тяжелого заболевания.[35][36]
Гемоглобин E возникает из-за единственной точечной мутации в гене бета-цепи с заменой глутамата на лизин в положении 26. Это одна из наиболее распространенных гемоглобинопатий, которой страдают 30 миллионов человек. Гемоглобин E очень распространен в некоторых частях Юго-Восточной Азии. Эритроциты HbE имеют неустановленную мембранную аномалию, которая делает большую часть популяции эритроцитов относительно устойчивой к инвазии посредством P falciparum.[37]
Другие мутации эритроцитов
Другие генетические мутации помимо аномалий гемоглобина, которые придают устойчивость к Плазмодия инфекции вовлекают изменения клеточной поверхности антигенный белки, клеточная мембрана структурные белки или ферменты, участвующие в гликолиз.
Дефицит глюкозо-6-фосфатдегидрогеназы

Глюкозо-6-фосфатдегидрогеназа (G6PD) - важный фермент в эритроцитах, метаболизируя глюкоза сквозь пентозофосфатный путь, анаболическая альтернатива катаболическому окислению (гликолизу) при сохранении восстанавливающей среды. G6PD присутствует во всех клетках человека, но особенно важен для красных кровяных телец. Поскольку зрелым эритроцитам не хватает ядра и цитоплазматический РНК, они не могут синтезировать новые молекулы ферментов, чтобы заменить генетически аномальные или стареющие. Все белки, включая ферменты, должны существовать в течение всего срока жизни эритроцита, который обычно составляет 120 дней.
В 1956 году Алвинг и его коллеги показали, что в некоторых афро-американцы противомалярийный препарат примахин вызывает гемолитическую анемию и что эти люди имеют наследственный дефицит G6PD в эритроцитах.[38] Дефицит G6PD связано с полом и распространено среди средиземноморских, африканских и других популяций. В странах Средиземноморья у таких людей может развиться гемолитический диатез (фавизм ) после употребления бобы. Люди с дефицитом G6PD также чувствительны к нескольким лекарствам в дополнение к примахину.
Дефицит G6PD - второй по распространенности дефицит ферментов у людей (после ALDH2 дефицит), которым, по оценкам, страдают около 400 миллионов человек.[39] В этом локусе имеется много мутаций, две из которых достигают частоты 20% или выше в африканских и средиземноморских популяциях; их называют мутациями A и Med.[40] Мутантные разновидности G6PD могут быть более нестабильными, чем встречающиеся в природе ферменты, поэтому их активность снижается быстрее с возрастом эритроцитов.
Этот вопрос изучался в изолированных группах населения, где противомалярийные препараты не использовались, в Танзании, Восточной Африке.[41] и в Республика Гамбия, Западная Африка, наблюдение за детьми в период, когда они наиболее восприимчивы к Falciparum малярия.[42] В обоих случаях количество паразитов было значительно ниже у людей с дефицитом G6PD, чем у людей с нормальными ферментами эритроцитов. Эта ассоциация также была изучена на людях, что возможно, потому что дефицит фермента связан с полом, а гетерозиготы женского пола представляют собой мозаику из-за лионизация, где случайная инактивация Х-хромосома в определенных клетках создает популяцию эритроцитов с дефицитом G6PD, сосуществующих с нормальными эритроцитами. Малярийные паразиты значительно чаще наблюдались в нормальных эритроцитах, чем в клетках с дефицитом ферментов.[43] Эволюционный генетический анализ малярийной селекции генов дефицита G6PD был опубликован Tishkoff и Verelli.[40] Дефицит ферментов распространен во многих странах, которые ранее были или были маляриозными, но не где-либо еще.
Дефицит PK
Дефицит пируваткиназы (PK), также называемый дефицитом пируваткиназы эритроцитов, является наследственным нарушением метаболизма фермента пируваткиназы. В этом состоянии недостаток пируваткиназы замедляет процесс гликолиза. Этот эффект особенно разрушителен для клеток, в которых отсутствуют митохондрии, поскольку эти клетки должны использовать анаэробный гликолиз в качестве единственного источника энергии, поскольку цикл TCA недоступен. Одним из примеров являются эритроциты, которые в состоянии дефицита пируваткиназы быстро становятся дефицитными по АТФ и могут подвергаться гемолизу. Следовательно, дефицит пируваткиназы может вызвать гемолитическую анемию.
Существует значительная корреляция между степенью тяжести Дефицит PK и степень защиты от малярии.[44]
Эллиптоцитоз
Эллиптоцитоз - заболевание крови, при котором аномально большое количество эритроцитов пациента имеют эллиптическую форму. Среди пострадавших существует большая генетическая изменчивость. Существует три основных формы наследственного эллиптоцитоза: общий наследственный эллиптоцитоз, сфероцитарный эллиптоцитоз и овалоцитоз Юго-Восточной Азии.
Овалоцитоз Юго-Восточной Азии
Овалоцитоз представляет собой подтип эллиптоцитоза и является наследственным заболеванием, при котором эритроциты имеют овальную, а не круглую форму. В большинстве популяций овалоцитоз встречается редко, но овалоцитоз Юго-Восточной Азии (SAO) встречается у 15% коренных жителей Малайзия и из Папуа - Новая Гвинея. Сообщалось о нескольких аномалиях эритроцитов SAO, включая повышенную жесткость эритроцитов и снижение экспрессии некоторых антигенов эритроцитов.[46]SAO вызывается мутацией в гене, кодирующем эритроцит. группа 3 белок. В гене происходит делеция кодонов 400–408, что приводит к делеции 9 аминокислот на границе между цитоплазматическим и трансмембранным доменами белка полосы 3.[47] Полоса 3 служит основным сайтом связывания для мембранного скелета, субмембранной белковой сети, состоящей из анкирин, спектрин, актин, и полоса 4.1. Полоса 3 овалоцитов более плотно, чем нормальная полоса 3, связывается с анкирином, который соединяет скелет мембраны с транспортером анионов полосы 3. Эти качественные дефекты создают мембрану эритроцитов, менее устойчивую к напряжению сдвига и более подверженную постоянной деформации.
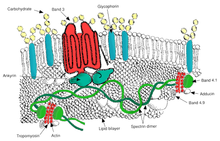
SAO ассоциируется с защитой от церебральной малярии у детей, поскольку снижает секвестрацию эритроцитов, паразитирующих P. falciparum в микрососудов головного мозга.[48] Адгезия P. falciparum-инфицированные эритроциты до CD36 усилены защитным от малярии признаком SAO. Более высокая эффективность секвестрации посредством CD36 у лиц с SAO может определять другое распределение в органах секвестрированных инфицированных эритроцитов. Это дает возможное объяснение избирательного преимущества, предоставляемого SAO против церебральной малярии.[49]
Отрицательность рецептора антигена Даффи
Плазмодий вивакс имеет широкое распространение в тропических странах, но отсутствует или редко встречается в большом регионе Западной и Центральной Африки, как недавно было подтверждено типированием видов с помощью ПЦР.[50] Этот разрыв в распределении объясняется отсутствием экспрессии рецептора антигена Даффи для хемокинов (DARC) в эритроцитах многих африканцев к югу от Сахары. Даффи-отрицательные люди гомозиготны по аллелю DARC, несущему единственную нуклеотидную мутацию (DARC 46 T → C), которая нарушает активность промотора, нарушая сайт связывания для фактора транскрипции эритроидного клона hGATA1.[жаргон ][51] В широко цитируемых in vitro и in vivo исследования, Miller et al. сообщил, что группа крови Даффи является рецептором для P. vivax и что отсутствие группы крови Даффи на эритроцитах является фактором устойчивости к P. vivax у лиц африканского происхождения.[5] Это стало хорошо известным примером врожденной устойчивости к инфекционному агенту из-за отсутствия рецептора агента на клетках-мишенях.
Однако накопились наблюдения, показывающие, что исходный отчет Миллера требует уточнения. В человеческих исследованиях P. vivax передачи, есть доказательства передачи P. vivax среди Даффи-отрицательного населения в Западной Кении,[52] бразильский Amazon область, край,[53] и Мадагаскар.[54] В Малагасийский народ на Мадагаскаре есть смесь Даффи-позитивных и Даффи-негативных людей различного этнического происхождения.[55] 72% населения острова оказались Даффи-отрицательными. P. vivax положительный результат был обнаружен у 8,8% из 476 бессимптомных по Даффи-отрицательных людей, а клинические P. vivax малярия обнаружена у 17 таких лиц. Генотипирование показало, что множественные P. vivax штаммы вторгались в эритроциты людей, отрицательных по Даффи. Авторы предполагают, что среди малагасийских популяций есть достаточно людей с положительной реакцией на Даффи, чтобы поддерживать передачу комаров и инфекцию печени. Совсем недавно отрицательные по Даффи индивидуумы, инфицированные двумя разными штаммами P. vivax были найдены в Ангола и Экваториальная Гвинея; дальше, P. vivax инфекции были обнаружены как у людей, так и у комаров, что означает, что происходит активная передача. Частота такой передачи пока неизвестна.[56] Из-за этих нескольких отчетов из разных частей света становится ясно, что некоторые варианты P. vivax передаются людям, которые не экспрессируют DARC на своих эритроцитах. То же явление наблюдалось у обезьян Нового Света. [Примечание 1] Однако DARC по-прежнему остается основным рецептором передачи вируса человеку. P. vivax.
Распространение негатива Даффи в Африке не коррелирует в точности с распространением негатива. P. vivax коробка передач.[50] Частота отрицательного отношения Даффи так же высока в Восточной Африке (более 80%), где паразит передается, так же как и в Западной Африке, где этого не происходит. Сила P. vivax как агент естественного отбора неизвестен и может варьироваться от места к месту. Отрицательность DARC остается хорошим примером врожденной устойчивости к инфекции, но она дает относительную, а не абсолютную устойчивость к ней. P. vivax коробка передач.

Отрицательность антигенного рецептора Гербиха
В Антигенная система Гербиха является составным мембранным белком эритроцита и играет функционально важную роль в поддержании формы эритроцита. Он также действует как рецептор для P. falciparum связывающий эритроциты белок. Есть четыре аллели гена, кодирующего антиген, от Ge-1 до Ge-4. Известны три типа отрицательности антигена Ge: Ge-1, -2, -3, Ge-2, -3 и Ge-2, + 3. люди с относительно редким фенотипом Ge-1, -2, -3 менее восприимчивы (~ 60% от контроля) к инвазии P. falciparum. У таких людей есть подтип состояния, называемый наследственный эллиптоцитоз, характеризующиеся эритроцитами овальной или эллиптической формы.
Другие редкие мутации эритроцитов
Редкие мутации гликофорин А и B также известно, что белки опосредуют устойчивость к P. falciparum.
Полиморфизм человеческого лейкоцитарного антигена
Полиморфизм человеческого лейкоцитарного антигена (HLA), распространенный у западноафриканцев, но редкий у других расовых групп, связан с защитой от тяжелой малярии. Эта группа генов кодирует антигенпредставляющие белки клеточной поверхности и выполняет множество других функций. В Западной Африке они обеспечивают такое же значительное снижение заболеваемости, как и вариант серповидно-клеточного гемоглобина. Исследования показывают, что необычный полиморфизм главный комплекс гистосовместимости гены эволюционировали в основном путем естественного отбора инфекционными патогенами.
Полиморфизмы в локусах HLA, которые кодируют белки, участвующие в презентации антигена, влияют на течение малярии. В Западной Африке антиген HLA класса I (HLA Bw53) и гаплотип HLA класса II (DRB1 * 13OZ-DQB1 * 0501) независимо связаны с защитой от тяжелой малярии.[59] Однако корреляции HLA варьируются в зависимости от генетической конституции полиморфного малярийного паразита, который различается в разных географических регионах.[60][61]
Наследственное сохранение гемоглобина плода
Некоторые исследования показывают, что высокий уровень гемоглобин плода (HbF) обеспечивают некоторую защиту от малярии falciparum у взрослых с Наследственное сохранение гемоглобина плода.[62]
Подтверждение гипотезы о малярии
Эволюционный биолог J.B.S. Холдейн был первым, кто выдвинул гипотезу о связи между малярией и генетическим заболеванием. Он впервые представил свою гипотезу на восьмом Международном генетическом конгрессе, состоявшемся в 1948 году в Стокгольме, на тему «Скорость мутации генов человека».[63] Он формализовал в технической статье, опубликованной в 1949 году, в котором он сделал пророческое заявление: «Тельца анемичных гетерозигот меньше нормального размера и более устойчивы к гипотоническим растворам. По крайней мере, возможно, что они также более устойчивы к атакам спорозоа, вызывающие малярию ".[64] Это стало известно как «гипотеза малярии Холдейна», или кратко, «гипотеза малярии».[65]
Детальное исследование когорты из 1022 кенийских детей, живущих поблизости Озеро Виктория, опубликованное в 2002 году, подтвердило это предсказание.[66] Многие дети СС все еще умирали, не дожив до одного года. В период от 2 до 16 месяцев смертность у детей с АА была значительно ниже, чем у детей с АА. Это хорошо контролируемое исследование показывает продолжающееся действие естественного отбора через болезнь в человеческой популяции.
Анализ общегеномная ассоциация (GWA) и высокое разрешение сопоставление ассоциаций является мощным методом определения устойчивости к инфекциям и другим заболеваниям по наследству. Два независимых предварительных анализа связи GWA с тяжелой малярией falciparum у африканцев были проведены: один Консорциумом Malariagen для населения Гамбии, а другой Рольфом Хорстманном (Институт тропической медицины Бернхарда Нохта, Гамбург) и его коллегами для населения Ганы. . В обоих случаях единственным сигналом ассоциации, имеющим значение для всего генома, был сигнал HBB локус, кодирующий β-цепь гемоглобина, аномальная для HbS.[67] Это не означает, что HbS - единственный ген, придающий врожденную устойчивость к малярии falciparum; может быть много таких генов, оказывающих более умеренные эффекты, которые сложно обнаружить с помощью GWA из-за низких уровней нарушение равновесия по сцеплению в африканских популяциях. Однако одна и та же ассоциация GWA в двух популяциях является убедительным доказательством того, что единственный ген, обеспечивающий самую сильную врожденную устойчивость к Falciparum малярия кодирует HbS.
Фитнес разных генотипов
В приспособленность разных генотипы в африканском регионе, где наблюдается интенсивный отбор малярии, оценил Энтони Эллисон в 1954 году.[68] в Баамба У населения, проживающего в районе леса Семлики в Западной Уганде, частота серповидноклеточных гетерозигот (AS) составляет 40%, что означает, что частота серповидноклеточного гена составляет 0,255, и 6,5% рожденных детей являются гомозиготами SS. [Заметка 2]Разумно предположить, что до появления современного лечения три четверти гомозигот SS не могли воспроизводиться. Чтобы сбалансировать потерю серповидноклеточных генов, скорость мутации 1: 10,2 на ген на поколение. Это примерно в 1000 раз больше, чем частота мутаций, измеренная в Дрозофила и других организмов и намного выше, чем зарегистрировано для серповидноклеточного локуса у африканцев.[69] Чтобы сбалансировать полиморфизм, Энтони Эллисон подсчитал, что приспособленность гетерозиготы AS должна быть в 1,26 раза выше, чем приспособленность нормальной гомозиготы. Более поздний анализ показателей выживаемости дал аналогичные результаты с некоторыми отличиями от места к месту. У гамбийцев было установлено, что гетерозиготы AS имеют 90% защиту от P. falciparum-ассоциированная тяжелая анемия и церебральная малярия,[59] тогда как в популяции луо в Кении было подсчитано, что гетерозиготы AS имеют 60% защиту от тяжелой малярийной анемии.[66] Эти различия отражают интенсивность передачи P. falciparum малярия от места к месту и от сезона к сезону, поэтому расчеты пригодности также будут разными. Во многих африканских популяциях частота АС составляет около 20%, и превосходство приспособленности над людьми с нормальным гемоглобином порядка 10% достаточно для получения стабильного полиморфизма.
Смотрите также
Примечания
- ^ P. vivax может передаваться в Беличьи обезьяны (Saimiri boliviensis и S. sciureus), и Barnwell et al.[57] получили доказательства того, что P. vivax входит Саймири эритроциты обезьян независимо от группы крови Даффи, показывая, что P. vivax имеет альтернативный путь проникновения в эти клетки. В Связывающий белок Даффи найти на Плазмодия, единственный лиганд инвазии для DARC, не связывается с Саймири эритроциты, хотя эти клетки экспрессируют DARC и, очевидно, заражаются P. vivax.[58]
- ^ Если частота гетерозиготы составляет 0,40, то частоту гена серповидноклетки (q) можно вычислить из Уравнение Харди-Вайнберга 2q (1-q) = 0,40, откуда q = 0,255 и q2, частота серповидно-клеточных гомозигот составляет 0,065.
Глоссарий
- актин, анкрин, спектрин - белки, которые являются основными компонентами каркаса цитоскелета в цитоплазме клетки
- аэробный - использует кислород для производства энергии (контраст анаэробный)
- аллель - одна из двух или более альтернативных форм гена, возникающих в результате мутации
- α-цепь / β-цепь (гемоглобин) - подкомпоненты молекулы гемоглобина; две α-цепи и две β-цепи составляют нормальный гемоглобин (HbA)
- альвеолярный - относящиеся к альвеолам, крошечным воздушным мешочкам в легких
- аминокислота - любое из двадцати органических соединений, которые являются субъединицами белка в организме человека
- анаболический - о синтезе сложных молекул в живых организмах из более простых или связанных с ним
- вместе с накопителем энергии; конструктивный метаболизм (контраст катаболический)
- анаэробный - относится к процессу или реакции, которая не требует кислорода, но производит энергию другими способами (контраст аэробный)
- переносчик анионов (органические) - молекулы, которые играют важную роль в распределении и выведении многочисленных эндогенных продуктов метаболизма и экзогенных органических анионов.
- антиген - любое чужеродное для организма вещество (в виде иммуногена или гаптена), которое вызывает иммунный ответ либо само по себе, либо после образования комплекса с более крупной молекулой (в виде белка) и способное связываться с компонентом (в виде антитела или Т-клетка) иммунной системы
- АТФ – (Аденозинтрифосфат ) - органическая молекула, содержащая высокоэнергетические фосфатные связи, используемые для переноса энергии внутри клетки
- катаболический - или связаны с распадом сложных молекул в живых организмах с образованием более простых вместе с выделением энергии; деструктивный метаболизм (контраст анаболический)
- хемокин - представляют собой семейство небольших цитокинов или сигнальных белков, секретируемых клетками
- кодон - последовательность из трех нуклеотидов, которые определяют, какая аминокислота будет добавлена следующей во время синтеза белка
- тельце - устаревшее название эритроцита
- цитоадгерантность - инфицированные эритроциты могут прилипать к стенкам неровностей крови и неинфицированным эритроцитам
- цитоплазма - прозрачное желеобразное вещество, в основном вода, внутри клетки
- диатез - склонность к определенному заболеванию
- ДНК - дезоксирибонуклеиновая кислота, наследственный материал генома
- Дрозофила - разновидность плодовой мухи, используемой для генетических экспериментов из-за простоты воспроизводства и манипулирования ее геномом
- эндоцитарный - перенос твердого вещества или жидкости в клетку с помощью покрытой вакуоли или везикулы
- эндогамия - обычай заключать брак только в пределах местного сообщества, клана или племени
- эндотелиальный - относящиеся к тонкой внутренней поверхности кровеносных сосудов
- фермент - белок, который способствует клеточному процессу, как катализатор в обычной химической реакции
- эпидемиология - изучение распространения болезней среди населения
- эритроцит - красные кровяные тельца, которые вместе с лейкоцитами составляют клеточный состав крови (контраст лейкоцит)
- эритроид - эритроцитов, красных кровяных телец или относящихся к ним
- фитнес (генетический) - в широком смысле репродуктивный успех, который имеет тенденцию воспроизводить черту или черты (см. естественный отбор)
- геном - (абстрактно) все наследуемые признаки организма; представлен его хромосомами
- генотип - генетический состав клетки, организма или человека, обычно со ссылкой на конкретный признак
- гликолиз - расщепление глюкозы ферментами с высвобождением энергии
- гликофорин - трансмембранные белки красных кровяных телец
- гаплотип - набор вариаций ДНК или полиморфизмов, которые, как правило, наследуются вместе.
- Hb (HbC, HbE, HbS и т. Д.) гемоглобин (полиморфизмы гемоглобина: гемоглобин типа C, гемоглобин типа E,
- гемоглобин типа S)
- кроветворный (стволовые клетки) - стволовые клетки крови, которые дают начало всем другим клеткам крови
- гемоксигеназа-1 (HO-1) - фермент, расщепляющий гем, железосодержащую небелковую часть гемоглобина
- гемоглобин - органическая молекула на основе железа в красных кровяных тельцах, которая переносит кислород и придает крови красный цвет
- гемолиз - разрыв красных кровяных телец и выброс их содержимого (цитоплазмы) в окружающую жидкость (например, плазму крови)
- гетерозиготный - обладание только одной копией гена для определенного признака
- гомозиготный - наличие двух идентичных копий гена для определенного признака, по одной от каждого родителя
- гипотонический - обозначает раствор с более низким осмотическим давлением, чем другой раствор, с которым он контактирует, так что определенные молекулы будут мигрировать из области более высокого осмотического давления в область более низкого осмотического давления, пока давления не выровняются.
- in vitro - в пробирке или другом лабораторном сосуде; обычно используется в отношении протокола тестирования
- in vivo - у живого человека (или животного); обычно используется в отношении протокола тестирования
- лейкоцит - лейкоциты, часть иммунной системы, которые вместе с эритроцитами составляют клеточный компонент крови (контраст эритроцит)
- лиганд - внеклеточная сигнальная молекула, которая при связывании с клеткой рецептор, вызывает ответ клетки
- локус (ген или хромосома) - конкретное расположение гена или последовательности ДНК или положение на хромосоме
- макрофаг - большая белая кровяная клетка, часть иммунной системы, которая поглощает инородные частицы и инфекционные микроорганизмы
- главный комплекс гистосовместимости (MHC) - белки на поверхности клеток, которые помогают иммунной системе распознавать чужеродные вещества; также называется системой человеческого лейкоцитарного антигена (HLA)
- микро-РНК - фрагмент клеточной РНК, который предотвращает производство определенного белка за счет связывания и разрушения информационной РНК, которая могла бы произвести этот белок.
- микрососудистая сеть - очень мелкие кровеносные сосуды
- митохондрии - органеллы клетки, производящие энергию
- мутация - спонтанное изменение гена в результате ошибки репликации ДНК; обычно мутации упоминаются в контексте унаследованных мутаций, то есть изменений гамет
- естественный отбор - постепенный процесс, при котором биологические признаки становятся более или менее распространенными в популяции в зависимости от влияния унаследованных признаков на дифференциальный репродуктивный успех организмов, взаимодействующих со своей средой (тесно связанный с фитнес)
- нуклеотид - органические молекулы, представляющие собой субъединицы нуклеиновых кислот, таких как ДНК и РНК
- нуклеиновая кислота - сложная органическая молекула, присутствующая в живых клетках, особенно ДНК или РНК, которые состоят из множества нуклеотидов, связанных длинной цепью.
- кислородный радикал - высокореактивный ион, содержащий кислород, способный повредить микроорганизмы и нормальные ткани.
- патогенез - способ развития болезни
- ПЦР - Полимеразная цепная реакция, ферментативная реакция, при которой ДНК реплицируется в пробирке для последующего тестирования или анализа.
- фенотип - совокупность наблюдаемых характеристик или признаков организма, таких как его морфология
- Плазмодий - общий тип (род) простейших микроорганизмов, вызывающих малярию, хотя только некоторые из них вызывают
- полимеризовать - объединить реплицированные субъединицы в более длинную молекулу (обычно относящуюся к синтетическим материалам, но также и к органическим молекулам)
- полиморфизм - наличие чего-либо в нескольких различных формах, например, гемоглобина (HbA, HbC и т. Д.)
- полипептид - цепь аминокислот, составляющих часть белковой молекулы
- рецептор (клеточная поверхность) - специализированные интегральные мембранные белки, участвующие в коммуникации клетки с внешним миром; рецепторы реагируют на специфические лигандs, которые прикрепляются к ним.
- уменьшение окружающей среды (клеточная) - восстановительная среда - это среда, в которой окисление предотвращается путем удаления кислорода и других окисляющих газов или паров, и которая может содержать активно восстанавливающие газы, такие как водород, окись углерода, и газы, которые могут окисляться в присутствии кислорода, такие как водород сульфид.
- РНК - рибонуклеиновая кислота, нуклеиновая кислота, присутствующая во всех живых клетках. Его основная роль - действовать как посланник, несущий инструкции ДНК для управления синтезом белков.
- секвестрация (биология) - процесс, посредством которого организм накапливает соединение или ткань (в виде красных кровяных телец) из окружающей среды.
- связанный с полом - признак, связанный с геном, который передается только родителю мужского или женского пола (в отличие от аутосомного)
- Спорозоа - большой класс строго паразитических неподвижных простейших, в том числе Плазмодия которые вызывают малярию
- Цикл TCA - Цикл трикарбоновых кислот - это серия катализируемых ферментами химических реакций, которые составляют ключевую часть аэробного дыхания в клетках.
- перемещение (клеточная биология) - движение молекул снаружи внутрь (или наоборот) клетки
- трансмембранный - существующие или происходящие через клеточную мембрану
- венозный - или относящиеся к венам
- везикул - небольшая органелла внутри клетки, состоящая из жидкости, заключенной в жировую оболочку
- факторы вирулентности - позволить инфекционному агенту размножаться и распространяться в пределах хоста, частично путем подрыва или уклонения от защиты хоста.
Рекомендации
- ^ Квятковский Д.П. (август 2005 г.). «Как малярия повлияла на геном человека и чему человеческая генетика может научить нас о малярии». Американский журнал генетики человека. 77 (2): 171–92. Дои:10.1086/432519. ЧВК 1224522. PMID 16001361.
- ^ Хедрик П.В. (октябрь 2011 г.). «Популяционная генетика устойчивости к малярии у людей». Наследственность. 107 (4): 283–304. Дои:10.1038 / hdy.2011.16. ЧВК 3182497. PMID 21427751.
- ^ Anstee DJ (июнь 2010 г.). «Взаимосвязь между группами крови и заболеванием». Кровь. 115 (23): 4635–43. Дои:10.1182 / blood-2010-01-261859. PMID 20308598.
- ^ Эллисон AC (1954). «Защита, обеспечиваемая серповидно-клеточной характеристикой против субтертийной малярийной инфекции» (PDF). Br Med J. 1 (4857): 290–294. Дои:10.1136 / bmj.1.4857.290. ЧВК 2093356. PMID 13115700. Архивировано из оригинал (PDF) 28 сентября 2011 г.
- ^ а б Миллер Л. Х., Мейсон С. Дж., Клайд Д. Ф., МакГиннисс М. Х. (1976). «Фактор устойчивости к Plasmodium vivax у чернокожих. Генотип группы крови Даффи, FyFy». N Engl J Med. 295 (6): 302–4. Дои:10.1056 / NEJM197608052950602. PMID 778616.
- ^ Леметр Б, Николя Э, Мишо Л., Райххарт Дж. М., Хоффманн Дж. А. (1996). «Кассета дорсовентральных регуляторных генов spätzle / Toll / cactus контролирует мощный противогрибковый ответ у взрослых особей дрозофилы» (PDF). Клетка. 86 (6): 973–983. Дои:10.1016 / S0092-8674 (00) 80172-5. PMID 8808632. S2CID 10736743.
- ^ Полторак А, Хе Икс, Смирнова И., Лю М.Ю., Ван Хаффель С., Дю Икс, Бердвелл Д., Алехос Э., Сильва М., Галанос С., Фройденберг М., Риккарди-Кастаньоли П., Лейтон Б., Бейтлер Б. (1998). «Нарушение передачи сигналов LPS у мышей C3H / HeJ и C57BL / 10ScCr: мутации в гене Tlr4». Наука. 282 (5396): 2085–2088. Bibcode:1998Научный ... 282.2085П. Дои:10.1126 / science.282.5396.2085. PMID 9851930.
- ^ Вайдья А.Б., Мазер М.В. (2009). «Митохондриальная эволюция и функции у малярийных паразитов». Анну Рев Микробиол. 63: 249–267. Дои:10.1146 / annurev.micro.091208.073424. PMID 19575561.
- ^ Эллиотт Д.А., Макинтош М.Т., Хосгуд HD 3-е, Чен С., Чжан Г., Баевова П., Джойнер К.А. (2008). «Четыре различных пути поглощения гемоглобина у малярийного паразита Plasmodium falciparum». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 105 (7): 2463–2468. Bibcode:2008PNAS..105.2463E. Дои:10.1073 / pnas.0711067105. ЧВК 2268159. PMID 18263733.
- ^ Курос С.А., Ранг Б.Н., Хеббель Р.П. (1988). «Избыток гема в мембранах серповидных эритроцитов наизнанку: возможная роль в окислении тиолов» (PDF). Кровь. 71 (4): 876–882. Дои:10.1182 / кровь.V71.4.876.876. PMID 3355895.
- ^ Фёллер М., Боббала Д., Кока С., Хубер С.М., Гулбинс Э., Ланг Ф (2009). «Самоубийство ради выживания - смерть инфицированных эритроцитов как механизм хозяина для выживания при малярии». Cell Physiol Biochem. 24 (3–4): 133–140. Дои:10.1159/000233238. PMID 19710527.
- ^ Холера Р., Бриттен Нью-Джерси, Гилри М.Р., Лопера-Меса TM, Диаките С.А., Арье Т., Краузе М.А., Гиндо А., Табман А., Фуджиока Х., Диалло Д.А., Думбо ОК, Хо М., Веллемс Т.Э., Фэрхерст Р.М. (2008). «Нарушение цитоадгезии эритроцитов, инфицированных Plasmodium falciparum, содержащих серповидный гемоглобин». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 105 (3): 991–996. Bibcode:2008PNAS..105..991C. Дои:10.1073 / pnas.0711401105. ЧВК 2242681. PMID 18192399.
- ^ Феррейра А., Маргути I, Бехманн I, Джени В., Хора А., Палха Н.Р., Ребело С., Анри А., Безар И., Соареш МП (2011). «Серповидный гемоглобин придает толерантность к инфекции Plasmodium» (PDF). Клетка. 145 (3): 398–409. Дои:10.1016 / j.cell.2011.03.049. PMID 21529713. S2CID 8567718. Архивировано из оригинал (PDF) на 2011-10-03.
- ^ Гонг Л., Парих С., Розенталь П.Дж., Теплица B (2013). «Биохимические и иммунологические механизмы, с помощью которых серповидноклеточные клетки защищают от малярии» (PDF). Журнал Малярии. 12 (1): 317. Дои:10.1186/1475-2875-12-317. ЧВК 3847285. PMID 24025776.
- ^ Эллисон AC (2009). «Генетический контроль устойчивости к малярии человека». Текущее мнение в иммунологии. 21 (5): 499–505. Дои:10.1016 / j.coi.2009.04.001. PMID 19442502.
- ^ Пил Ф. Б., Патил А. П., Хоус Р. Э., Ньянгири О. А., Гетинг П. У., Уильямс Т. Н., Уэтеролл Д. Д., Хэй С. И. (2010). «Глобальное распространение гена серповидных клеток и географическое подтверждение гипотезы малярии». Nat Commun. 1 (8): 104. Bibcode:2010НатКо ... 1..104П. Дои:10.1038 / ncomms1104. ЧВК 3060623. PMID 21045822.
- ^ а б Мэй Дж., Эванс Дж. А., Тимманн С., Эмен С., Буш В., Тай Т., Агбеньега Т., Хорстманн Р. Д. (2007). «Варианты гемоглобина и проявления болезни при тяжелой малярии falciparum». JAMA. 297 (20): 2220–2226. Дои:10.1001 / jama.297.20.2220. PMID 17519411.
- ^ Flatz G (1967). «Гемоглобин Е: распределение и динамика популяции». Humangenetik. 3 (3): 189–234. Дои:10.1007 / BF00273124. PMID 6074385. S2CID 22541254.
- ^ а б Эллисон А.С. (1955). «Аспекты полиморфизма в человеке». Колд Спринг Харб Симп Квант Биол. 20: 239–251. Дои:10.1101 / SQB.1955.020.01.023. PMID 13433567.
- ^ Полинг Л, Итано Х, Певец SJ, Уэллс I (1949). «Серповидноклеточная анемия, молекулярное заболевание» (PDF). Наука. 110 (2865): 543–548. Bibcode:1949Научный ... 110..543П. Дои:10.1126 / science.110.2865.543. PMID 15395398.
- ^ Инграм В.М. (1959). «Аномальные гемоглобины человека. III. Химическая разница между нормальными и серповидноклеточными гемоглобинами». Biochim Biophys Acta. 36 (2): 543–548. Дои:10.1016/0006-3002(59)90183-0. PMID 13852872.
- ^ Инграм В.М. (2004). "Гемоглобин серповидной анемии: молекулярная биология первого" молекулярного заболевания "- решающее значение интуитивной прозорливости". Генетика. 167 (1): 1–7. Дои:10.1534 / genetics.167.1.1. ЧВК 1470873. PMID 15166132.
- ^ Холера Р., Бриттен Нью-Джерси, Гилри М.Р., Лопера-Меса TM, Диаките С.А., Арье Т., Краузе М.А., Гиндо А., Табман А., Фуджиока Х., Диалло Д.А., Думбо ОК, Хо М., Веллемс Т.Э., Фэрхерст Р.М. (2008). «Нарушение цитоадгезии эритроцитов, инфицированных Plasmodium falciparum, содержащих серповидный гемоглобин». Proc Natl Acad Sci USA. 105 (3): 991–996. Bibcode:2008PNAS..105..991C. Дои:10.1073 / pnas.0711401105. ЧВК 2242681. PMID 18192399.
- ^ Уильямс Т.Н., Мванги Т.В., Робертс Диджей, Александр Н.Д., Уэтеролл Диджей, Вамбуа С. и др. (Май 2005 г.). «Иммунная основа защиты от малярии за счет серповидноклеточного признака». PLoS Медицина. 2 (5): e128. Дои:10.1371 / journal.pmed.0020128. ЧВК 1140945. PMID 15916466.
- ^ Хеббель Р.П. (2003). «Серповидная нестабильность гемоглобина: механизм защиты от малярии». Редокс-отчет. 8 (5): 238–40. Дои:10.1179/135100003225002826. PMID 14962356. S2CID 28951874.
- ^ Кауль Д.К. (2008). «Адгезия серповидных эритроцитов: многие вопросы и некоторые ответы». Transfusion Clinique Et Biologique. 15 (1–2): 51–5. Дои:10.1016 / j.tracli.2008.03.012. PMID 18495516.
- ^ Мозг П (1952). «Серповидно-клеточная анемия в Африке». Br Med J. 2 (4789): 880. Дои:10.1136 / bmj.2.4789.880. ЧВК 2021738.
- ^ Эльгеро Э., Деликат-Лембет Л.М., Ружерон В., Арнатау С., Рош Б., Бекварт П. и др. (2015). «Малярия продолжает выделять серповидно-клеточные признаки в Центральной Африке». Proc Natl Acad Sci U S A. 112 (22): 7051–4. Bibcode:2015PNAS..112.7051E. Дои:10.1073 / pnas.1505665112. ЧВК 4460506. PMID 25941403.
- ^ Инграм В.М., Стреттон А.О. (1959). «Генетические основы талассемии». Природа. 184 (4703): 1903–1909. Bibcode:1959Натура.184.1903I. Дои:10.1038 / 1841903a0. PMID 13852871. S2CID 36535895.
- ^ Модиано Дж., Морпурго Дж., Терренато Л., Новеллетто А., Ди Риенцо А., Коломбо Б., Пурпура М., Мариани М., Сантачиара-Бенерецетти С., Брега А., Диксит К. А., Шреста С. Л., Ланиа А., Ваначиванавин В., Луццатто Л. (1991) . «Защита от заболеваемости малярией: близкая фиксация гена α-талассемии у населения Непала». Являюсь. J. Hum. Genet. 48 (2): 390–397. ЧВК 1683029. PMID 1990845.
- ^ Терренато Л., Шреста С., Диксит К.А., Луццатто Л., Модиано Г., Морпурго Дж., Арезе П. (1988). «Снижение заболеваемости малярией среди народа тару по сравнению с симпатичным населением в Непале». Энн Троп Мед Паразитол. 82 (1): 1–11. Дои:10.1080/00034983.1988.11812202. PMID 3041928.
- ^ Hutagalung R, Wilairatana P, Looareesuwan S, Brittenham GM, Aikawa M, Gordeuk VR (1999). «Влияние признака гемоглобина Е на тяжесть малярии Falciparum». J Infect Dis. 179 (1): 283–286. Дои:10.1086/314561. JSTOR 30117260. PMID 9841856.
- ^ Модиано Д., Луони Дж., Сирима Б.С., Симпоре Дж., Верра Ф., Конате А., Растрелли А., Оливьери А., Калиссано С., Паганотти Г. М., Д'Урбано Л., Сану И., Савадого А., Модиано Дж., Колуцци М. (2001). «Гемоглобин С защищает от клинической малярии, вызванной Plasmodium falciparum». Природа. 414 (6861): 305–308. Bibcode:2001Натура.414..305М. Дои:10.1038/35104556. PMID 11713529. S2CID 4360808.
- ^ Модиано Д., Бэнконе Дж., Чиминелли Б.М., Помпеи Ф., Блот I, Симпоре Дж., Модиано Г. (2008). «Гемоглобин S и гемоглобин C:« быстрые, но дорогостоящие »по сравнению с« медленными, но бесплатными »генетическими адаптациями к малярии Plasmodium falciparum». Хум Мол Генет. 17 (6): 789–799. Дои:10,1093 / hmg / ddm350. PMID 18048408.
- ^ Риет П., Флори Л., Талль Ф, Траоре А.С., Фуму Ф (2004). «Гемоглобин C связан со снижением паразитемии Plasmodium falciparum и низким риском легкого приступа» (PDF). Хум Мол Генет. 13 (1): 1–6. Дои:10.1093 / hmg / ddh002. PMID 14613965.
- ^ Fairhurst RM, Baruch DI, Brittain NJ, Ostera GR, Wallach JS, Hoang HL, Hayton K, Guindo A, Makobongo MO, Schwartz OM, Tounkara A, Doumbo OK, Diallo DA, Fujioka H, Ho M, Wellems TE (2005) . «Аномальное отображение PfEMP-1 на эритроцитах, несущих гемоглобин С, может защитить от малярии» (PDF). Природа. 435 (7045): 1117–1121. Bibcode:2005 Натур.435.1117F. Дои:10.1038 / природа03631. PMID 15973412. S2CID 4412263. Архивировано из оригинал (PDF) на 2014-04-07. Получено 2014-04-01.
- ^ Chotivanich K, Udomsangpetch R, Pattanapanyasat K, Chierakul W., Simpson J, Looareesuwan S, White N (август 2002 г.). «Гемоглобин E: сбалансированный полиморфизм, защищающий от высоких паразитемий и, следовательно, от тяжелой малярии, вызванной P. falciparum». Кровь. 100 (4): 1172–6. Дои:10.1182 / blood.V100.4.1172.h81602001172_1172_1176. PMID 12149194.
- ^ Алвинг А.С., Карсон П.Е., Фланаган К.Л., Икес К.Э. (1956). «Ферментативная недостаточность в чувствительных к примахину эритроцитах». Наука. 124 (3220): 484–485. Bibcode:1956 г., наука ... 124..484C. Дои:10.1126 / science.124.3220.484-а. PMID 13360274.
- ^ Cappellini MD, Fiorelli G (январь 2008 г.). «Дефицит глюкозо-6-фосфатдегидрогеназы». Ланцет. 371 (9606): 64–74. Дои:10.1016 / S0140-6736 (08) 60073-2. PMID 18177777. S2CID 29165746.
- ^ а б Тишкофф С.А., Верелли Б.Дж. (2004). «Дефицит G6PD и устойчивость к малярии у людей: выводы из эволюционного генетического анализа». В Дронамраджу К. (ред.). Эволюционные аспекты инфекционных заболеваний. Издательство Кембриджского университета.
- ^ Эллисон А.С., Клайд Д.Ф. (1961). «Малярия у африканских детей с дефицитом глюкозо-6-фосфатдегидрогеназы в эритроцитах». Br Med J. 1 (5236): 1346–1349. Дои:10.1136 / bmj.1.5236.1346. ЧВК 1954496. PMID 13682585.
- ^ Ruwende C, Khoo SC, Snow RW, Yates SN, Kwiatkowski D, Gupta S, Warn P, Allsopp CE, Gilbert SC, Peschu N, Newbold CI, Greenwood BM, Marsh K, Hill AV (1995). «Естественный отбор полу- и гетерозигот для дефицита G6PD в Африке по устойчивости к тяжелой малярии». Природа. 376 (6537): 246–249. Bibcode:1995Натура 376..246р. Дои:10.1038 / 376246a0. PMID 7617034. S2CID 4301352.
- ^ Луццатто Л. (1979). «Генетика эритроцитов и предрасположенность к малярии» (PDF). Кровь. 54 (5): 961–976. Дои:10.1182 / кровь.V54.5.961.961. PMID 387115.
- ^ Ayi K, Min-Oo G, Serghides L, Crockett M, Kirby-Allen M, Quirt I, Gros P, Kain KC (2008). «Недостаток пируваткиназы и малярия». N Engl J Med. 358 (17): 1805–1810. Дои:10.1056 / NEJMoa072464. PMID 18420493.
- ^ Хемпельманн Э., Гётце О. (1984). «Характеристика мембранных белков с помощью полихроматического окрашивания серебром». Z Physiol Chem Хоппе-Зейлера. 365: 241–242.
- ^ Джаролим П., Палек Дж., Амато Д., Хассан К., Сапак П., Медсестра Г. Т., Рубин Г. Л., Чжай С., Сахр К. Э., Лю С. К. (1991). «Делеция гена полосы 3 эритроцитов при устойчивом к малярии овалоцитозе в Юго-Восточной Азии». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 88 (24): 11022–11026. Bibcode:1991PNAS ... 8811022J. Дои:10.1073 / пнас.88.24.11022. ЧВК 53065. PMID 1722314.
- ^ Лю С.К., Чжай С., Палек Дж., Голан Д.Э., Амато Д., Хассан К., Медсестра Г.Т., Бабона Д., Кутцер Т., Яролим П., Заик М., Борвейн С. (1990). «Молекулярный дефект белка группы 3 в овалоцитозе в Юго-Восточной Азии». N Engl J Med. 323 (22): 1530–1538. Дои:10.1056 / NEJM199011293232205. PMID 2146504.
- ^ Аллен SJ, O'Donnell A, Александр Н.Д., Mgone CS, Peto TE, Clegg JB, Alpers MP, Weatherall DJ (1999). «Профилактика церебральной малярии у детей в Папуа-Новой Гвинее с помощью диапазона 3 овалоцитоза в Юго-Восточной Азии». Am J Trop Med Hyg. 60 (6): 1056–1060. Дои:10.4269 / ajtmh.1999.60.1056. PMID 10403343.
- ^ Кортес А., Мелломбо М., Мгоне С.С., Бек ХП, Ридер Дж. К., Кук Б.М. (2005). «Адгезия эритроцитов, инфицированных Plasmodium falciparum, к CD36 под током усиливается церебральным малярийно-защитным признаком овалоцитоза Юго-Восточной Азии». Мол Биохим Паразитол. 142 (2): 252–257. Дои:10.1016 / j.molbiopara.2005.03.016. PMID 15978955.
- ^ а б Каллетон Р.Л., Мита Т., Ндунга М., Унгер Х., Краво П.В., Паганотти Г.М., Такахаши Н., Канеко А., Это Х., Тинто Х., Карема С., Д'Алессандро У., до Росарио В., Кобаякава Т., Нтуми Ф., Картер Р. , Танабэ К. (2008). «Неспособность обнаружить Plasmodium vivax в Западной и Центральной Африке с помощью ПЦР-типирования». Малар Дж. 7 (1): 174–182. Дои:10.1186/1475-2875-7-174. ЧВК 2546428. PMID 18783630.
- ^ Tournamille C, Колин Y, Картрон JP, Ле Ван Ким C (1995). «Нарушение мотива GATA в промоторе гена Даффи устраняет экспрессию гена эритроида у людей, отрицательных по Даффи». Нат Жене. 10 (2): 224–228. Дои:10.1038 / ng0695-224. PMID 7663520. S2CID 7125832.
- ^ Райан Дж. Р., Стаут Дж. А., Амон Дж., Дантон Р. Ф., Мталиб Р., Корос Дж., Оуур Б., Лакхарт С., Виртц Р. А., Барнуэлл Дж. В., Розенберг Р. (2006). "Доказательства передачи Плазмодий вивакс среди тупого антиген-отрицательного населения в Западной Кении " (PDF). Am J Trop Med Hyg. 75 (4): 575–581. Дои:10.4269 / ajtmh.2006.75.575. PMID 17038676.
- ^ Кавасини К.Э., де Маттос Л.С., Коуту А.А., Коуту В.С., Голлино Ю., Моретти Л.Дж., Бонини-Домингос С.Р., Россит А.Р., Кастильо Л., Мачадо Р.Л. (2007). «Полиморфизм генов группы крови Даффи среди больных малярией vivax в четырех областях бразильского региона Амазонки». Малар Дж. 6 (1): 167. Дои:10.1186/1475-2875-6-167. ЧВК 2244634. PMID 18093292.
- ^ Менар Д., Барнадас С., Бушье С., Генри-Холлдин С., Грей Л.Р., Рацимбасоа А., Тонье V, Карод Дж. Ф., Домарль О, Колин И., Бертран О, Пико Дж., Кинг С.Л., Гримберг Б.Т., Мерсеро-Пуйялон О., Циммерман PA (2010). «Клиническая малярия, вызванная Plasmodium vivax, обычно наблюдается у малагасийских людей, отрицательных по Даффи». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 107 (13): 5967–71. Bibcode:2010ПНАС..107.5967М. Дои:10.1073 / pnas.0912496107. ЧВК 2851935. PMID 20231434.
- ^ Пьерон Д., Хейске М., Разафиндразака Х., Переда-Лот V, Санчес Дж., Альва О. и др. (Март 2018 г.). «Сильный отбор в течение последнего тысячелетия по африканскому происхождению в смешанном населении Мадагаскара». Nature Communications. 9 (1): 932. Дои:10.1038 / s41467-018-03342-5. ЧВК 5834599. PMID 29500350.
- ^ Мендес К., Диас Ф, Фигейредо Дж., Мора В. Г., Кано Дж., Де Соуза Б., ду Росариу В. Э., Бенито А., Берзоса П., Арес А. П. (2011). Франко-Паредес С (ред.). «Отрицательный антиген Даффи больше не является препятствием для Plasmodium vivax - молекулярные данные с западного побережья Африки (Ангола и Экваториальная Гвинея)». PLOS Negl Trop Dis. 5 (e1192): e1192. Дои:10.1371 / journal.pntd.0001192. ЧВК 3119644. PMID 21713024.
- ^ Барнуэлл Дж. У., Николс М. Е., Рубинштейн П. (1989). «Оценка in vitro роли группы крови Даффи в инвазии эритроцитов Plasmodium vivax». J Exp Med. 169 (5): 1795–802. Дои:10.1084 / jem.169.5.1795. ЧВК 2189319. PMID 2469769.
- ^ Вертхаймер С.П., Барнуэлл Дж.В. (1989). "Плазмодий вивакс взаимодействие с гликопротеином группы крови Даффи человека: идентификация белка, подобного рецептору паразита ». Exp Parasitol. 69 (4): 340–350. Дои:10.1016/0014-4894(89)90083-0. PMID 2680568.
- ^ а б Хилл А.В., Оллсопп К.Э., Квятковски Д., Ансти Н.М., Твумаси П., Роу ПА, Беннет С., Брюстер Д., МакМайкл А.Дж., Гринвуд Б.М. (1991). «Общие западноафриканские антигены HLA связаны с защитой от тяжелой малярии». Природа. 352 (6336): 595–600. Bibcode:1991Натура.352..595H. Дои:10.1038 / 352595a0. PMID 1865923. S2CID 2667496.
- ^ Фродшем А.Дж., Хилл А.В. (2004). «Генетика инфекционных болезней». Хум Мол Генет. 13 Спецификация № 2: R187 – R194. Дои:10,1093 / hmg / ddh225. PMID 15358724.
- ^ Биллиг Э.М., Маккуин П.Г., Маккензи ИП (2012). «Гемоглобин плода и динамика детской малярии». Журнал Малярии. 11: 396. Дои:10.1186/1475-2875-11-396. ЧВК 3538578. PMID 23190739.
- ^ Бренда Акини, И. Вебала, "Распространенность гемоглобина плода и реакции антител на Плазмодий falciparum Антигены у пациентов с серповидноклеточной болезнью в Западной Кении ». Магистерская работа, Школа чистых и прикладных наук Университета Кеньятта, 2013.
- ^ Bengtsson BO, Tunlid A (июль 2010 г.). «Международный конгресс генетиков 1948 года в Швеции: люди и политика». Генетика. 185 (3): 709–15. Дои:10.1534 / генетика.110.119305. ЧВК 2907196. PMID 20660651.
- ^ Холдейн, Дж. Б. С. (1949). «Скорость мутации генов человека». Наследие. 35 (S1): 267–273. Дои:10.1111 / j.1601-5223.1949.tb03339.x.
- ^ Ледерберг Дж (сентябрь 1999 г.). "Дж. Б. С. Холдейн (1949) об инфекционных заболеваниях и эволюции". Генетика. 153 (1): 1–3. ЧВК 1460735. PMID 10471694.
- ^ а б c Aidoo M, Terlouw DJ, Kolczak MS, McElroy PD, ter Kuile FO, Kariuki S, Nahlen BL, Lal AA, Udhayakumar V (2002). «Защитные эффекты гена серповидных клеток против заболеваемости и смертности от малярии» (PDF). Ланцет. 359 (9314): 1311–1312. Дои:10.1016 / S0140-6736 (02) 08273-9. PMID 11965279. S2CID 37952036. Архивировано из оригинал (PDF) на 09.06.2010.
- ^ Джаллоу М., Тео Ю.Ю., Смолл К.С., Рокетт К.А. и др. (2009). «Полногеномный анализ малярии в Западной Африке с высоким разрешением». Нат Жене. 41 (6): 657–665. Дои:10,1038 / нг.388. ЧВК 2889040. PMID 19465909.
- ^ Эллисон AC (1954). «Заметки о серповидноклеточном полиморфизме». Анналы генетики человека. 19 (1): 39–57. Дои:10.1111 / j.1469-1809.1954.tb01261.x. PMID 13208024. S2CID 10056569.[мертвая ссылка ]
- ^ Вандепитте Дж. М., Цуэльцер В. В., Нил СП, Коларт Дж. (1955). «Доказательства неадекватности мутации в качестве объяснения частоты гена серповидноклеточной анемии в Бельгийском Конго». Кровь. 10 (4): 341–350. Дои:10.1182 / blood.V10.4.341.341. PMID 14363315.
дальнейшее чтение
- Дронамраджу КР, Арезе П. (2006) Малярия: генетические и эволюционные аспекты, Springer; Берлин, ISBN 0-387-28294-7 / ISBN 978-0-387-28294-7
- Фэй ФБК (2009) Устойчивость к малярии или восприимчивость к заболеваниям эритроцитов, Nova Science Publishers Inc, Нью-Йорк. ISBN 9781606929438

