Репликация ДНК - DNA replication
В молекулярная биология, Репликация ДНК это биологический процесс получения двух идентичных реплик ДНК из одного оригинала ДНК молекула.[1] Репликация ДНК происходит во всех живые организмы действуя как самая важная часть для биологическая наследственность. Клетка обладает отличительным свойством деления, что делает репликацию ДНК необходимой.
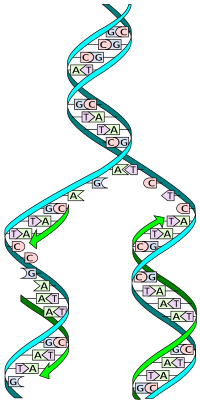
ДНК состоит из двойная спираль из двух дополнительный пряди. Во время репликации эти нити разделяются. Каждая нить исходной молекулы ДНК затем служит шаблоном для производства своего аналога, процесс, называемый полуконсервативная репликация. В результате полуконсервативной репликации новая спираль будет состоять из исходной цепи ДНК, а также из вновь синтезированной цепи.[2] Сотовый корректура и механизмы проверки ошибок обеспечивают почти идеальное верность для репликации ДНК.[3][4]
В клетка, Репликация ДНК начинается в определенных местах, или истоки репликации, в геном.[5] Раскручивание ДНК при возникновении и синтезе новых цепей, приспособленных фермент известный как геликаза, приводит к вилки репликации растет в обоих направлениях от источника. Номер белки связаны с вилкой репликации, чтобы помочь в запуске и продолжении Синтез ДНК. Наиболее заметно, ДНК-полимераза синтезирует новые нити, добавляя нуклеотиды которые дополняют каждую (шаблонную) прядь. Репликация ДНК происходит на S-стадии межфазный.
Репликация ДНК (амплификация ДНК) также может выполняться in vitro (искусственно, вне клетки). ДНК-полимеразы, выделенные из клеток, и искусственные праймеры ДНК могут использоваться для запуска синтеза ДНК в известных последовательностях в матричной молекуле ДНК. Полимеразной цепной реакции (ПЦР), лигазная цепная реакция (LCR) и транскрипционная амплификация (TMA) являются примерами.
Структура ДНК
ДНК существует как двухцепочечная структура, в которой обе цепи скручены вместе, образуя характерную двойная спираль. Каждая отдельная цепь ДНК представляет собой цепочку из четырех типов нуклеотиды. Нуклеотиды в ДНК содержат дезоксирибоза сахар, а фосфат, а азотистое основание. Четыре типа нуклеотид соответствуют четырем азотистые основания аденин, цитозин, гуанин, и тимин, обычно обозначаемые как A, C, G и T. Аденин и гуанин являются пурин оснований, а цитозин и тимин пиримидины. Эти нуклеотиды образуют фосфодиэфирные связи, создавая фосфат-дезоксирибозный остов двойной спирали ДНК с азимутальными основаниями, направленными внутрь (т. е. к противоположной цепи). Нуклеооснования совпадают между цепями через водородные связи формировать пар оснований. Аденин соединяется с тимином (две водородные связи), а пары гуанина с цитозином (три водородные связи ).
Нити ДНК имеют направленность, а разные концы одной нити называются «3 '(три простых) конца» и «5' (пять простых) концов». По соглашению, если дана последовательность оснований одной цепи ДНК, левый конец последовательности является 5'-концом, а правый конец последовательности - 3'-концом. Нити двойной спирали антипараллельны, одна из которых находится от 5 'до 3', а противоположная нить от 3 'до 5'. Эти термины относятся к атому углерода в дезоксирибозе, к которому присоединяется следующий фосфат в цепи. Направленность имеет последствия для синтеза ДНК, потому что ДНК-полимераза может синтезировать ДНК только в одном направлении, добавляя нуклеотиды к 3'-концу цепи ДНК.
Спаривание дополнительных оснований в ДНК (через водородная связь ) означает, что информация, содержащаяся в каждой цепочке, является избыточной. Фосфодиэфирные (внутрицепочечные) связи прочнее, чем водородные (межцепочечные). Это позволяет отделить пряди друг от друга. Следовательно, нуклеотиды на одной цепи могут использоваться для реконструкции нуклеотидов на вновь синтезированной цепи-партнере.[6]
ДНК-полимераза

ДНК-полимеразы семья ферменты которые осуществляют все формы репликации ДНК.[8] ДНК-полимеразы в целом не могут инициировать синтез новых цепей, а могут только удлинить существующую цепь ДНК или РНК в паре с цепью-матрицей. Чтобы начать синтез, короткий фрагмент РНК, называемый грунтовка, должны быть созданы и спарены с цепью ДНК-матрицы.
ДНК-полимераза добавляет новую цепь ДНК, удлиняя 3'-конец существующей нуклеотидной цепи, добавляя новые нуклеотиды сопоставлены с нитью шаблона по одному за счет создания фосфодиэфирные связи. Энергия этого процесса полимеризации ДНК поступает от гидролиза высокоэнергетический фосфат (фосфоангидридные) связи между тремя фосфатами, присоединенными к каждому невключенному основание. Свободные основания с присоединенными к ним фосфатными группами называются нуклеотиды; в частности, основания с тремя присоединенными фосфатными группами называются нуклеозидтрифосфаты. Когда нуклеотид добавляется к растущей цепи ДНК, образование фосфодиэфирной связи между проксимальным фосфатом нуклеотида и растущей цепью сопровождается гидролизом высокоэнергетической фосфатной связи с высвобождением двух дистальных фосфатов в виде пирофосфат. Ферментативный гидролиз полученного пирофосфат в неорганический фосфат потребляет вторую высокоэнергетическую фосфатную связь и делает реакцию фактически необратимой.[Примечание 1]
В целом ДНК-полимеразы очень точны, с частотой внутренних ошибок менее одной ошибки на каждые 107 добавлены нуклеотиды.[9] Кроме того, некоторые ДНК-полимеразы также обладают способностью корректировать; они могут удалять нуклеотиды с конца растущей нити, чтобы исправить несовпадающие основания. Наконец, механизмы восстановления несоответствия после репликации контролируют ДНК на предмет ошибок, будучи способными отличить несовпадения в вновь синтезированной цепи ДНК от исходной последовательности цепи. Вместе эти три шага различения обеспечивают точность репликации менее одной ошибки на каждые 109 добавлены нуклеотиды.[9]
Скорость репликации ДНК в живой клетке сначала измеряли как скорость удлинения ДНК фага Т4 в инфицированных фагом. Кишечная палочка.[10] В период экспоненциального увеличения ДНК при 37 ° C скорость составила 749 нуклеотидов в секунду. Частота мутаций на пару оснований на репликацию во время синтеза ДНК фага Т4 составляет 1,7 на 108.[11]
Процесс репликации

Репликация ДНК, как и все процессы биологической полимеризации, протекает в трех ферментативно катализируемых и скоординированных стадиях: инициация, удлинение и завершение.
Инициация
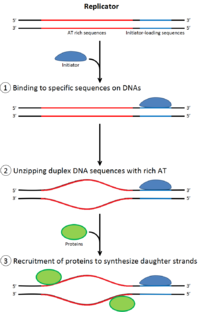
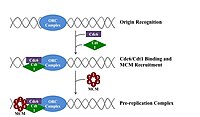
Для ячейка для деления, он должен сначала воспроизвести свою ДНК.[12] Репликация ДНК - это процесс «все или ничего»; как только репликация начинается, она продолжается до завершения. После завершения репликации она не повторяется в том же клеточном цикле. Это стало возможным благодаря разделению инициации пререпликационный комплекс.
Пререпликационный комплекс
В конце митоз и рано Фаза G1, большой комплекс белков-инициаторов собирается в пререпликационный комплекс в определенных точках ДНК, известный как "происхождение ".[5] В Кишечная палочка первичный белок-инициатор DnaA; в дрожжи, это комплекс распознавания происхождения.[13] Последовательности, используемые белками-инициаторами, имеют тенденцию быть «AT-богатыми» (богатыми основаниями аденина и тимина), потому что пары оснований A-T имеют две водородные связи (а не три, образованные в паре C-G), и поэтому их легче разделить на цепи.[14] У эукариот комплекс распознавания ориджина катализирует сборку белков-инициаторов в пререпликационный комплекс. Cdc6 и Cdt1 затем свяжите с привязанным комплексом распознавания исходной точки в исходной точке, чтобы сформировать более крупный комплекс, необходимый для загрузки МКМ комплекс на ДНК. Комплекс Mcm - это геликаза, которая распутывает спираль ДНК в источниках репликации и вилки репликации у эукариот. Комплекс Mcm рекрутируется на поздней фазе G1 и загружается комплексом ORC-Cdc6-Cdt1 на ДНК посредством АТФ-зависимого ремоделирования белка. Нагрузка комплекса Mcm на исходную ДНК знаменует завершение образования пререпликационного комплекса.[15]
Если условия окружающей среды правильные в конце фазы G1, G1 и G1 / S циклин -Cdk активируются комплексы, которые стимулируют экспрессию генов, кодирующих компоненты синтетического аппарата ДНК. Активация G1 / S-Cdk также способствует экспрессии и активации комплексов S-Cdk, которые могут играть роль в активации источников репликации в зависимости от вида и типа клеток. Контроль этих Cdk варьируется в зависимости от типа клеток и стадии развития. Это правило лучше всего понимается в бутоньерки, где S циклины Clb5 и Clb6 в первую очередь отвечают за репликацию ДНК.[16] Комплексы Clb5,6-Cdk1 непосредственно запускают активацию ориджинов репликации и, следовательно, необходимы на протяжении S-фазы для прямой активации каждого ориджина.[15]
Аналогичным образом Cdc7 также требуется через S фаза для активации источников репликации. Cdc7 не активен на протяжении клеточного цикла, и его активация строго рассчитана по времени, чтобы избежать преждевременного инициирования репликации ДНК. В конце G1 активность Cdc7 резко возрастает в результате ассоциации с регуляторной субъединицей. Dbf4, который напрямую связывает Cdc7 и способствует его протеинкиназной активности. Было обнаружено, что Cdc7 является ограничивающим скорость регулятором активности происхождения. Вместе G1 / S-Cdks и / или S-Cdks и Cdc7 взаимодействуют, чтобы непосредственно активировать источники репликации, что приводит к инициации синтеза ДНК.[15]
Преинициативный комплекс
В ранней S фазе активация S-Cdk и Cdc7 ведет к сборке преинициативного комплекса, массивного белкового комплекса, сформированного в начале. Формирование преинициативного комплекса вытесняет Cdc6 и Cdt1 из исходного репликационного комплекса, инактивируя и разбирая пререпликационный комплекс. Загрузка преинициативного комплекса на ориджин активирует геликазу Mcm, вызывая раскручивание спирали ДНК. Комплекс прединициирования также загружает α-примаза и другие ДНК-полимеразы на ДНК.[15]
После того, как α-примаза синтезирует первые праймеры, соединения праймер-матрица взаимодействуют с загрузчиком зажима, который загружает скользящий зажим в ДНК, чтобы начать синтез ДНК. Компоненты комплекса преинициации остаются связанными с вилками репликации по мере их выхода из источника.[15]
Удлинение
ДНК-полимераза обладает 5'– 3 'активностью. Для всех известных систем репликации ДНК требуется свободный 3' гидроксил группы до начала синтеза (примечание: матрица ДНК читается в направлении от 3 'к 5', тогда как новая цепь синтезируется в направлении от 5 'к 3' - это часто путают). Различают четыре различных механизма синтеза ДНК:
- Все клеточные формы жизни и многие ДНК вирусы, фаги и плазмиды использовать прима для синтеза короткого праймера РНК со свободной 3'-ОН-группой, которая впоследствии удлиняется ДНК-полимеразой.
- Ретроэлементы (в том числе ретровирусы ) используют передающую РНК, которая запускает репликацию ДНК, обеспечивая свободный 3'-ОН, который используется для удлинения обратная транскриптаза.
- в аденовирусы и семейство φ29 бактериофаги, 3'-ОН-группа обеспечивается боковой цепью аминокислоты присоединенного к геному белка (концевой белок), к которому ДНК-полимераза добавляет нуклеотиды с образованием новой цепи.
- В одноцепочечных ДНК-вирусах - группа, которая включает цирковирусы, то геминивирусы, то парвовирусы и другие, а также многие фаги и плазмиды которые используют механизм репликации катящегося круга (RCR), эндонуклеаза RCR создает разрыв в цепи генома (одноцепочечные вирусы) или одной из цепей ДНК (плазмиды). 5'-конец надрезанной нити переносится на тирозин остаток на нуклеазе и свободная 3'-ОН-группа затем используется ДНК-полимеразой для синтеза новой цепи.
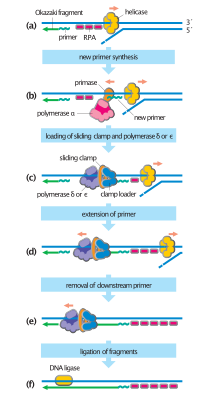
Первый из этих механизмов является наиболее известным и используется клеточными организмами. В этом механизме, когда две нити разделены, прима добавляет праймеры РНК к цепям матрицы. Ведущая цепь получает один праймер РНК, а отстающая цепь - несколько. Ведущая цепь непрерывно расширяется от праймера ДНК-полимеразой с высоким процессивность, в то время как отстающая нить продолжается прерывисто от каждого праймера, образуя Фрагменты Окадзаки. РНКаза удаляет фрагменты РНК праймера, и ДНК-полимераза с низкой процессивностью, отличная от репликативной полимеразы, входит, чтобы заполнить пробелы. Когда это будет завершено, можно будет найти одну щель на ведущей нити и несколько щелей на отстающей нити. Лигаза работает, чтобы заполнить эти зазоры, завершая тем самым новую реплицированную молекулу ДНК.
Primase, используемая в этом процессе, значительно отличается между бактерии и археи /эукариоты. Бактерии используют примазы, принадлежащие DnaG суперсемейство белков, которое содержит каталитический домен складчатого типа TOPRIM.[17] Фолд TOPRIM содержит ядро α / β с четырьмя консервативными цепями в Россманн топология. Эта структура также обнаруживается в каталитических доменах топоизомераза Ia, топоизомераза II, нуклеазы семейства OLD и белки репарации ДНК, связанные с белком RecR.
Примаза, используемая археями и эукариотами, напротив, содержит высокопроизводительную версию Мотив распознавания РНК (RRM). Эта примаза структурно сходна со многими вирусными РНК-зависимыми РНК-полимеразами, обратными транскриптазами, циклазами, генерирующими циклические нуклеотиды, и ДНК-полимеразами семейств A / B / Y, которые участвуют в репликации и репарации ДНК. При репликации эукариот праймаза образует комплекс с Pol α.[18]
Множественные ДНК-полимеразы играют разные роли в процессе репликации ДНК. В Кишечная палочка, ДНК Pol III это фермент полимераза, который в первую очередь отвечает за репликацию ДНК. Он собирается в репликационный комплекс на репликационной вилке, который демонстрирует чрезвычайно высокую процессивность, оставаясь нетронутым в течение всего цикла репликации. В отличие, ДНК Pol I это фермент, отвечающий за замену праймеров РНК на ДНК. ДНК Pol I имеет от 5 'до 3' экзонуклеаза активность в дополнение к своей полимеразной активности, и использует свою экзонуклеазную активность для разрушения праймеров РНК перед ним, поскольку он удлиняет цепь ДНК позади себя, в процессе, называемом ник перевод. Pol I гораздо менее процессивен, чем Pol III, потому что его основная функция в репликации ДНК состоит в создании множества коротких участков ДНК, а не нескольких очень длинных участков.
В эукариоты, фермент с низкой процессивностью, Pol α, помогает инициировать репликацию, потому что он образует комплекс с примазой.[19] У эукариот синтез ведущей цепи, как полагают, осуществляется Pol ε; однако это мнение недавно было оспорено, предполагая роль Pol δ.[20] Удаление грунтовки завершено Pol δ[21] в то время как репарация ДНК во время репликации завершается Pol ε.
По мере продолжения синтеза ДНК исходные нити ДНК продолжают раскручиваться по обе стороны от пузыря, образуя вилка репликации с двумя зубцами. У бактерий, имеющих единственную точку начала репликации на их кольцевой хромосоме, этот процесс создает "тета-структура "(напоминает греческую букву тета: θ). Напротив, эукариоты имеют более длинные линейные хромосомы и инициируют репликацию в нескольких источниках внутри них.[22]
Вилка репликации
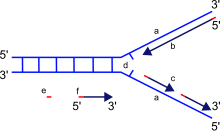
a: шаблон, b: ведущая цепь, c: отстающая цепь, d: репликационная вилка, e: праймер, f: Фрагменты Окадзаки
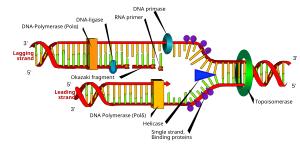
Репликационная вилка - это структура, которая формируется внутри длинной спиральной ДНК во время репликации ДНК. Он создается геликазами, которые разрывают водородные связи, удерживающие две нити ДНК вместе в спирали. Полученная структура имеет два ветвящихся «зубца», каждый из которых состоит из одной нити ДНК. Эти две цепи служат в качестве матрицы для ведущей и отстающей цепей, которые будут созданы, когда ДНК-полимераза сопоставит комплементарные нуклеотиды шаблонам; шаблоны могут правильно называться шаблоном ведущей нити и шаблоном отстающей нити.
ДНК считывается ДНК-полимеразой в направлении от 3 'до 5', что означает, что возникающая цепь синтезируется в направлении от 5 'до 3'. Так как матрицы ведущей и отстающей нити ориентированы в противоположных направлениях на вилке репликации, основная проблема заключается в том, как добиться синтеза зарождающейся (новой) отстающей цепи ДНК, направление синтеза которой противоположно направлению растущей вилки репликации.
Ведущая прядь
Ведущая цепь - это цепь растущей ДНК, которая синтезируется в том же направлении, что и растущая репликационная вилка. Этот вид репликации ДНК непрерывен.
Отстающая прядь
Отстающая нить - это нить растущей ДНК, направление синтеза которой противоположно направлению растущей репликационной вилки. Из-за своей ориентации репликация отстающей цепи более сложна по сравнению с репликацией ведущей цепи. Как следствие, ДНК-полимераза на этой цепи, как видно, «отстает» от другой цепи.
Отстающая нить синтезируется в виде коротких отдельных сегментов. На отстающей пряди шаблон, а прима «читает» матричную ДНК и инициирует синтез короткого комплементарного РНК грунтовка. ДНК-полимераза удлиняет примированные сегменты, образуя Фрагменты Окадзаки. Затем праймеры РНК удаляются и заменяются ДНК, и фрагменты ДНК соединяются вместе посредством ДНК-лигаза.
Динамика на вилке репликации
Во всех случаях геликаза состоит из шести полипептидов, которые охватывают только одну цепь реплицируемой ДНК. Две полимеразы связаны с гексимером геликазы. У эукариот геликаза оборачивается вокруг ведущей цепи, а у прокариот - вокруг отстающей.[23]
Когда геликаза раскручивает ДНК в репликационной вилке, ДНК впереди вынуждена вращаться. Этот процесс приводит к накоплению изгибов в ДНК впереди.[24] Это нарастание образует сопротивление скручиванию, которое в конечном итоге остановит продвижение репликационной вилки. Топоизомеразы - это ферменты, которые временно разрывают цепи ДНК, снимая напряжение, вызванное раскручиванием двух цепей спирали ДНК; топоизомеразы (включая ДНК-гираза ) добиться этого, добавив отрицательный суперспирали к спирали ДНК.[25]
Голая одноцепочечная ДНК имеет тенденцию сворачиваться обратно, образуя второстепенные конструкции; эти структуры могут мешать движению ДНК-полимеразы. Чтобы предотвратить это, одноцепочечные связывающие белки связываются с ДНК до тех пор, пока не будет синтезирована вторая цепь, предотвращая образование вторичной структуры.[26]
Двухцепочечная ДНК намотана на гистоны которые играют важную роль в регуляции экспрессии генов, поэтому реплицированная ДНК должна быть намотана вокруг гистонов в тех же местах, что и исходная ДНК. Для этого гистон шапероны разобрать хроматин перед репликацией и замените гистоны в нужном месте. Некоторые шаги в этой сборке несколько умозрительны.[27]
Зажимные белки образуют скользящий зажим вокруг ДНК, помогая ДНК-полимеразе поддерживать контакт со своей матрицей, тем самым способствуя процессивности. Внутренняя поверхность зажима позволяет пропустить через него ДНК. Как только полимераза достигает конца матрицы или обнаруживает двухцепочечную ДНК, скользящий зажим претерпевает конформационное изменение, которое высвобождает ДНК-полимеразу. Белки, загружающие зажим, используются для первоначальной нагрузки зажима, распознавая соединение между матрицей и праймерами РНК.[4]:274-5
Белки репликации ДНК
На вилке репликации многие ферменты репликации собираются на ДНК в сложную молекулярную машину, называемую ответственный. Ниже приводится список основных ферментов репликации ДНК, которые участвуют в реплисоме:[28]
| Фермент | Функция в репликации ДНК |
|---|---|
| ДНК-геликаза | Также известен как фермент, дестабилизирующий спираль. Геликаза разделяет две цепи ДНК на Вилка репликации за топоизомеразой. |
| ДНК-полимераза | Фермент, ответственный за катализирование добавления нуклеотидных субстратов к ДНК в направлении от 5 'к 3' во время репликации ДНК. Также выполняет корректуру и исправление ошибок. Существует много разных типов ДНК-полимеразы, каждая из которых выполняет разные функции в разных типах клеток. |
| Зажим ДНК | Белок, который предотвращает диссоциацию удлиняющихся ДНК-полимераз от родительской цепи ДНК. |
| Одноцепочечный ДНК-связывающий белок | Связываются с оцДНК и предотвращают повторный отжиг двойной спирали ДНК после того, как ДНК-геликаза раскручивает ее, таким образом поддерживая разделение цепей и облегчая синтез возникающей цепи. |
| Топоизомераза | Освобождает ДНК от ее суперспиральной природы. |
| ДНК-гираза | Снимает напряжение раскручивания ДНК-геликазой; это особый тип топоизомеразы |
| ДНК-лигаза | Повторно отжигает полуконсервативные пряди и соединения Фрагменты Окадзаки отстающей пряди. |
| Primase | Обеспечивает отправную точку РНК (или ДНК) для ДНК-полимеразы, чтобы начать синтез новой цепи ДНК. |
| Теломераза | Удлиняет теломерную ДНК, добавляя повторяющиеся нуклеотидные последовательности к концам эукариотические хромосомы. Это позволяет зародышевым клеткам и стволовым клеткам избежать ограничения Хейфлика на деление клеток.[29] |
Репликационная техника

Машины репликации состоят из факторов, участвующих в репликации ДНК и появляющихся на матричных оцДНК. Механизмы репликации включают примосоторы - ферменты репликации; ДНК-полимераза, ДНК-геликазы, ДНК-зажимы и ДНК-топоизомеразы и белки репликации; например одноцепочечные ДНК-связывающие белки (SSB). В механизмах репликации эти компоненты координируются. У большинства бактерий все факторы, участвующие в репликации ДНК, расположены на вилках репликации, а комплексы остаются на вилках во время репликации ДНК. Эти механизмы репликации называются реплисомы или же Системы ДНК-репликазы. Эти термины являются общими для белков, расположенных на вилках репликации. В эукариотических и некоторых бактериальных клетках реплисомы не образуются.
Поскольку механизмы репликации не перемещаются относительно шаблонных ДНК, таких как фабрики, их называют фабрика репликации.[30] На альтернативной фигуре фабрики ДНК подобны проекторам, а ДНК подобны кинематографическим фильмам, которые постоянно проходят в проекторы. В модели фабрики репликации, после того, как обе ДНК-геликазы для ведущих цепей и отстающих цепей загружены в матрицу ДНК, геликазы перемещаются вдоль ДНК друг в друга. Хеликазы остаются связанными до конца процесса репликации. Питер Мейстер и др. наблюдали непосредственно сайты репликации в бутоньерки путем мониторинга зеленый флуоресцентный белок (GFP) -меченные ДНК-полимеразы α. Они обнаружили репликацию ДНК пар помеченных локусов, симметрично разнесенных от точки начала репликации, и обнаружили, что расстояние между парами заметно уменьшалось со временем.[31] Это открытие предполагает, что механизм репликации ДНК связан с фабриками ДНК. То есть пары фабрик репликации загружаются в источники репликации и фабрики, связанные друг с другом. Кроме того, матричные ДНК перемещаются на фабрики, что приводит к экструзии матричных оцДНК и зарождающихся ДНК. Открытие Майстера - первое прямое свидетельство модели фабрики репликации. Последующие исследования показали, что ДНК-геликазы образуют димеры во многих эукариотических клетках, а механизмы бактериальной репликации остаются в одном внутриядерном месте во время синтеза ДНК.[30]
Фабрики репликации выполняют распутывание сестринских хроматид. Распутывание важно для распределения хроматид по дочерним клеткам после репликации ДНК. Поскольку сестринские хроматиды после репликации ДНК удерживают друг друга Cohesin кольца, это единственный шанс распутывания в репликации ДНК. Установка механизмов репликации в качестве фабрик репликации может повысить эффективность репликации ДНК. Если репликационные вилки свободно перемещаются в хромосомах, сцепление ядер усугубляется и препятствует митотической сегрегации.[31]
Прекращение
Эукариоты инициируют репликацию ДНК в нескольких точках хромосомы, поэтому вилки репликации встречаются и заканчиваются во многих точках хромосомы. Поскольку эукариоты имеют линейные хромосомы, репликация ДНК не может достигать самого конца хромосом. Из-за этой проблемы ДНК теряется в каждом цикле репликации с конца хромосомы. Теломеры являются участками повторяющейся ДНК, близкими к концам, и помогают предотвратить потерю генов из-за этого укорочения. Укорочение теломер - нормальный процесс у соматические клетки. Это укорачивает теломеры хромосомы дочерней ДНК. В результате клетки могут делиться только определенное количество раз, прежде чем потеря ДНК предотвратит дальнейшее деление. (Это известно как Лимит Хейфлика.) Внутри половая клетка линия, передающая ДНК следующему поколению, теломераза удлиняет повторяющиеся последовательности области теломер, чтобы предотвратить деградацию. Теломераза может по ошибке стать активной в соматических клетках, что иногда приводит к рак формирование. Повышенная активность теломеразы - один из признаков рака.
Прекращение требует, чтобы продвижение вилки репликации ДНК было остановлено или заблокировано. Терминация в конкретном локусе, когда она происходит, включает взаимодействие между двумя компонентами: (1) последовательностью сайта терминации в ДНК и (2) белком, который связывается с этой последовательностью, чтобы физически остановить репликацию ДНК. У различных видов бактерий это называется сайт-связывающим белком конца репликации ДНК, или Тер протеин.
Поскольку бактерии имеют кольцевые хромосомы, прекращение репликации происходит, когда две репликационные вилки встречаются на противоположном конце родительской хромосомы. Кишечная палочка регулирует этот процесс за счет использования терминирующих последовательностей, которые при связывании Тус протеин, разрешите прохождение только одного направления вилки репликации. В результате вилки репликации вынуждены всегда встречаться в области терминации хромосомы.[32]
Регулирование

Эукариоты
Внутри эукариот репликация ДНК контролируется в контексте клеточный цикл. По мере того, как клетка растет и делится, она проходит стадии клеточного цикла; Репликация ДНК происходит во время фазы S (фазы синтеза). Прогресс эукариотической клетки по циклу контролируется контрольные точки клеточного цикла. Прохождение через контрольные точки контролируется посредством сложных взаимодействий между различными белками, включая циклины и циклин-зависимые киназы.[33] В отличие от бактерий, эукариотическая ДНК реплицируется в пределах ядра.[34]
Контрольная точка G1 / S (или контрольная точка рестрикции) регулирует, вступают ли эукариотические клетки в процесс репликации ДНК и последующего деления. Клетки, которые не проходят через эту контрольную точку, остаются на стадии G0 и не реплицируют свою ДНК.
После прохождения контрольной точки G1 / S ДНК должна реплицироваться только один раз в каждом клеточном цикле. Когда комплекс Mcm удаляется от источника, пререпликационный комплекс разрушается. Поскольку новый комплекс Mcm не может быть загружен в источнике до тех пор, пока субъединицы предварительной репликации не будут повторно активированы, один источник репликации не может использоваться дважды в одном и том же клеточном цикле.[15]
Активация S-Cdks в ранней S фазе способствует разрушению или ингибированию отдельных компонентов пререпликационного комплекса, предотвращая немедленную повторную сборку. S и M-Cdks продолжают блокировать сборку комплекса до репликации даже после завершения S фазы, гарантируя, что сборка не может произойти снова, пока вся активность Cdk не будет снижена в позднем митозе.[15]
У почкующихся дрожжей ингибирование сборки вызывается Cdk-зависимым фосфорилированием компонентов пререпликационного комплекса. В начале S-фазы фосфорилирование Cdc6 посредством Cdk1 вызывает привязку Cdc6 к SCF убиквитин протеинлигаза, который вызывает протеолитическое разрушение Cdc6. Cdk-зависимое фосфорилирование белков Mcm способствует их экспорту из ядра вместе с Cdt1 во время фазы S, предотвращая загрузку новых комплексов Mcm в источниках в течение одного клеточного цикла. Cdk фосфорилирование комплекса репликации ориджина также ингибирует сборку комплекса до репликации. Индивидуального присутствия любого из этих трех механизмов достаточно для ингибирования сборки пререпликационного комплекса. Однако мутации всех трех белков в одной и той же клетке действительно запускают повторную инициацию во многих источниках репликации в пределах одного клеточного цикла.[15][35]
В клетках животных белок близнецы является ключевым ингибитором сборки пререпликационного комплекса. Геминин связывает Cdt1, предотвращая его связывание с исходным комплексом распознавания. В G1 уровни геминина поддерживаются на низком уровне с помощью APC, который убиквитинирует геминин, чтобы нацелить его на деградацию. Когда геминин разрушается, Cdt1 высвобождается, позволяя ему функционировать в сложной сборке до репликации. В конце G1 APC инактивируется, позволяя геминину накапливаться и связывать Cdt1.[15]
Репликация хлоропластных и митохондриальных геномов происходит независимо от клеточного цикла, в процессе Репликация D-петли.
Фокус репликации
В клетках позвоночных сайты репликации концентрируются в положениях, называемых фокусы репликации.[31] Сайты репликации могут быть обнаружены путем иммуноокрашивания дочерних цепей и ферментов репликации и мониторинга факторов репликации, меченных GFP. С помощью этих методов обнаружено, что в S-фазе деления клетки появляются репликационные очаги различного размера и положения, и их количество на ядро намного меньше, чем количество геномных вилок репликации.
P. Heun et al.,[31](2001) проследили фокусы репликации, меченные GFP, в почкующихся дрожжевых клетках и обнаружили, что точки начала репликации постоянно перемещаются в фазах G1 и S, а динамика значительно снизился в S фазе.[31] Традиционно сайты репликации фиксировали на пространственной структуре хромосом с помощью ядерная матрица или же ламины. Результаты Хойна опровергают традиционные представления о том, что у почкующихся дрожжей нет ламинов, и подтверждают, что источники репликации самостоятельно собираются и образуют очаги репликации.
За счет активации источников репликации, контролируемых пространственно и во времени, регулируется образование фокусов репликации. D. A. Jackson и др. (1998) обнаружили, что соседние источники одновременно активируются в клетках млекопитающих.[31] Пространственное сопоставление сайтов репликации приносит кластеризация вилок репликации. Кластеризация делать спасение застрявших вилок репликации и способствует нормальному продвижению вилок репликации. Прогресс вилок репликации тормозится многими факторами; столкновение с белками или комплексами, прочно связывающимися с ДНК, дефицит dNTP, разрывы на матричных ДНК и т. д. Если репликационные вилки останавливаются, а оставшиеся последовательности из остановившихся вилок не реплицируются, дочерние цепи имеют нереплицированные участки, полученные в результате взлома. Нереплицированные сайты на одной родительской цепи удерживают вместе другую, но не дочерние цепи. Следовательно, образующиеся сестринские хроматиды не могут отделиться друг от друга и не могут делиться на 2 дочерние клетки. Когда срабатывают соседние источники и форк из одного источника останавливается, форк из другого источника получает доступ в направлении, противоположном остановившемуся форку, и дублирует нереплицированные сайты. В качестве другого механизма спасения есть применение неактивные источники репликации что избыточные ориджины не активируются при нормальной репликации ДНК.
Бактерии
Большинство бактерий не проходят четко определенный клеточный цикл, а вместо этого постоянно копируют свою ДНК; во время быстрого роста это может привести к одновременному возникновению нескольких циклов репликации.[36] В Кишечная палочка, наиболее охарактеризованных бактерий, репликация ДНК регулируется с помощью нескольких механизмов, включая: гемиметилирование и секвестирование исходной последовательности, соотношение аденозинтрифосфат (АТФ) к аденозиндифосфат (АДФ), и уровни белка DnaA. Все они контролируют связывание белков-инициаторов с исходными последовательностями.
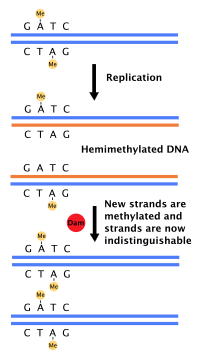
Потому что Кишечная палочка метилаты Последовательности ДНК GATC, синтез ДНК приводит к полуметилированным последовательностям. Эта гемиметилированная ДНК распознается белком SeqA, который связывает и изолирует исходную последовательность; кроме того, DnaA (необходимая для инициации репликации) хуже связывается с гемиметилированной ДНК. В результате вновь реплицированные ориджины не могут немедленно инициировать следующий раунд репликации ДНК.[37]
АТФ накапливается, когда клетка находится в богатой среде, запуская репликацию ДНК, как только клетка достигает определенного размера. АТФ конкурирует с АДФ за связывание с DnaA, и комплекс DnaA-ATP способен инициировать репликацию. Определенное количество белков DnaA также требуется для репликации ДНК - каждый раз, когда копируется источник, количество сайтов связывания для DnaA удваивается, что требует синтеза большего количества DnaA, чтобы обеспечить еще одну инициацию репликации.
У быстрорастущих бактерий, таких как Кишечная палочка, репликация хромосомы занимает больше времени, чем деление клетки. Бактерии решают эту проблему, инициируя новый раунд репликации до того, как предыдущий был завершен.[38] Новый раунд репликации сформирует хромосому клетки, которая рождается через два поколения после делящейся клетки. Этот механизм создает перекрывающиеся циклы репликации.
Проблемы с репликацией ДНК
Эта секция нуждается в расширении. Вы можете помочь добавляя к этому. (Май 2020 г.) |
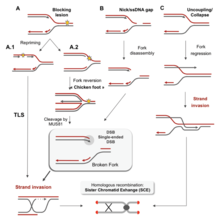
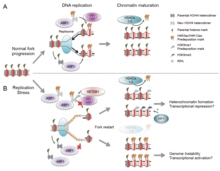
Есть много событий, которые способствуют стрессу репликации, в том числе:[39]
- Неправильное включение рибонуклеотидов
- Необычный Структуры ДНК
- Конфликты между репликацией и транскрипцией
- Недостаточность основных факторов репликации
- Общие хрупкие сайты
- Сверхэкспрессия или конститутивная активация онкогены
- Хроматин недоступность
Полимеразной цепной реакции
Исследователи обычно копируют ДНК in vitro с использованием полимеразной цепной реакции (ПЦР). ПЦР использует пару грунтовки для охвата целевой области в матричной ДНК, а затем полимеризует партнерские цепи в каждом направлении от этих праймеров, используя термостабильный ДНК-полимераза. Повторение этого процесса через несколько циклов усиливает целевой участок ДНК. В начале каждого цикла смесь матрицы и праймеров нагревают, разделяя вновь синтезированную молекулу и матрицу. Затем, когда смесь остывает, оба они становятся матрицами для отжига новых праймеров, и полимераза выходит из них. В результате количество копий целевой области удваивается каждый раунд, экспоненциально возрастает.[40]
Смотрите также
- Жизнь
- Клетка (биология)
- Деление клеток
- Ген
- Экспрессия гена
- Эпигенетика
- Геном
- Автопоэзис
- Расщепление хромосом
- Устройство хранения данных
- Самовоспроизведение
- ДНК Хатимодзи
Примечания
- ^ В энергетика этого процесса также может помочь объяснить направленность синтеза - если бы ДНК синтезировалась в направлении от 3 'к 5', энергия для процесса исходила бы от 5 'конца растущей цепи, а не от свободных нуклеотидов. Проблема в том, что если бы высокоэнергетические трифосфаты находились на растущей нити, а не на свободных нуклеотидах, проверка путем удаления несовпадающего концевого нуклеотида была бы проблематичной: после добавления нуклеотида трифосфат теряется, а один фосфат остается на каркас между новым нуклеотидом и остальной цепью. Если бы добавленные нуклеотиды не соответствовали друг другу, удаление привело бы к тому, что цепь ДНК оканчивалась бы монофосфатом на конце «растущей цепи», а не высокоэнергетическим трифосфатом. Таким образом, прядь застревает и больше не может расти. На самом деле высокоэнергетические трифосфаты, гидролизуемые на каждой стадии, происходят из свободных нуклеотидов, а не из полимеризованной цепи, поэтому этой проблемы не существует.
Рекомендации
- ^ Life, Microb (25 мая 2020 г.). «Репликация ДНК | почему мы должны изучать репликацию ДНК?». Microb Life. Получено 2020-05-29.
- ^ Молитесь Л.А. «Полуконсервативная репликация ДНК; Мезельсон и Шталь».
- ^ Несовершенная репликация ДНК приводит к мутации. Берг Дж. М., Тимочко Дж. Л., Страйер Л., Кларк Н. Д. (2002). «Глава 27: Репликация, рекомбинация и восстановление ДНК». Биохимия. W.H. Фримен и компания. ISBN 0-7167-3051-0. Архивировано из оригинал на 2020-03-26. Получено 2019-08-09.
- ^ а б Лодиш Х., Берк А., Зипурский С.Л. и др. (2000). «Репликация, ремонт и рекомбинация ДНК». Молекулярная клеточная биология (4-е изд.). WH Freeman. ISBN 0-7167-3136-3.
- ^ а б Берг Дж. М., Тимочко Дж. Л., Страйер Л., Кларк Н. Д. (2002). «Глава 27, Раздел 4: Репликация обеих цепей ДНК быстро происходит с определенных начальных участков». Биохимия. W.H. Фримен и компания. ISBN 0-7167-3051-0. Архивировано из оригинал на 2020-03-26. Получено 2019-08-09.
- ^ Альбертс Б. и др. (2002). Молекулярная биология клетки (4-е изд.). Наука о гирляндах. С. 238–240. ISBN 0-8153-3218-1.
- ^ Эллисон Л.А. (2007). Фундаментальная молекулярная биология. Блэквелл Паблишинг. п. 112. ISBN 978-1-4051-0379-4.
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л., Кларк Н. Д. (2002). Биохимия. W.H. Фримен и компания. ISBN 0-7167-3051-0. Глава 27, Раздел 2: ДНК-полимеразы требуют шаблона и праймера
- ^ а б Маккаллох С.Д., Кункель Т.А. (январь 2008 г.). «Верность синтеза ДНК эукариотическими полимеразами репликативного и транслезионного синтеза». Клеточные исследования. 18 (1): 148–61. Дои:10.1038 / кр.2008.4. ЧВК 3639319. PMID 18166979.
- ^ Маккарти Д., Миннер С., Бернштейн Н., Бернштейн С. (октябрь 1976 г.). «Скорость удлинения ДНК и распределение точек роста фага Т4 дикого типа и янтарного мутанта с задержкой ДНК». Журнал молекулярной биологии. 106 (4): 963–81. Дои:10.1016/0022-2836(76)90346-6. PMID 789903.
- ^ Дрейк JW (1970) Молекулярные основы мутации. Холден-Дэй, Сан-Франциско ISBN 0816224501 ISBN 978-0816224500
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки. Наука о гирляндах. ISBN 0-8153-3218-1. Глава 5: Механизмы репликации ДНК
- ^ Вайгель С., Шмидт А., Рюкерт Б., Лурц Р., Мессер В. (ноябрь 1997 г.). «Связывание белка DnaA с отдельными боксами DnaA в ориджине репликации Escherichia coli, oriC». Журнал EMBO. 16 (21): 6574–83. Дои:10.1093 / emboj / 16.21.6574. ЧВК 1170261. PMID 9351837.
- ^ Лодиш Х, Берк А., Зипурски Л.С., Мацудаира П., Балтимор Д., Дарнелл Дж. (2000). Молекулярная клеточная биология. В. Х. Фриман и компания. ISBN 0-7167-3136-3.12.1. Общие черты хромосомной репликации: три общие черты происхождения репликации
- ^ а б c d е ж грамм час я Морган Д.О. (2007). Клеточный цикл: принципы контроля. Лондон: New Science Press. С. 64–75. ISBN 978-0-19-920610-0. OCLC 70173205.
- ^ Дональдсон А.Д., Рагураман М.К., Фридман К.Л., Кросс FR, Брюер Б.Дж., Фангман В.Л. (август 1998 г.). «CLB5-зависимая активация источников поздней репликации в S. cerevisiae». Молекулярная клетка. 2 (2): 173–82. Дои:10.1016 / с1097-2765 (00) 80127-6. PMID 9734354.
- ^ Аравинд Л., Лейпе Д.Д., Кунин Е.В. (сентябрь 1998 г.). «Топрим - консервативный каталитический домен в топоизомеразах типа IA и II, примазах типа DnaG, нуклеазах семейства OLD и белках RecR». Исследования нуклеиновых кислот. 26 (18): 4205–13. Дои:10.1093 / nar / 26.18.4205. ЧВК 147817. PMID 9722641.
- ^ Фрик Д. Н., Ричардсон СС (июль 2001 г.). «ДНК-примазы». Ежегодный обзор биохимии. 70: 39–80. Дои:10.1146 / annurev.biochem.70.1.39. PMID 11395402. S2CID 33197061.
- ^ Барри ER, Bell SD (декабрь 2006 г.). «Репликация ДНК в архее». Обзоры микробиологии и молекулярной биологии. 70 (4): 876–87. Дои:10.1128 / MMBR.00029-06. ЧВК 1698513. PMID 17158702.
- ^ Стиллман Б. (июль 2015 г.). «Пересмотр ДНК-полимераз на вилке репликации у эукариот». Молекулярная клетка. 59 (2): 139–41. Дои:10.1016 / j.molcel.2015.07.004. ЧВК 4636199. PMID 26186286.
- ^ Росси М.Л. (февраль 2009 г.). Выявление путей удаления праймера во время созревания эукариотического фрагмента Окадзаки (Кандидатская диссертация). Школа медицины и стоматологии Рочестерского университета. HDL:1802/6537.
- ^ Хуберман Дж. А., Риггс А. Д. (март 1968 г.). «О механизме репликации ДНК в хромосомах млекопитающих». Журнал молекулярной биологии. 32 (2): 327–41. Дои:10.1016/0022-2836(68)90013-2. PMID 5689363.
- ^ Гао Й, Цуй Й, Фокс Т., Лин С., Ван Х, де Вал Н и др. (Февраль 2019). «Строения и принципы работы реплисомы». Наука. 363 (6429): 835. Дои:10.1126 / science.aav7003. ЧВК 6681829. PMID 30679383.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки. Наука о гирляндах. ISBN 0-8153-3218-1. Механизмы репликации ДНК: топоизомеразы ДНК предотвращают спутывание ДНК во время репликации
- ^ Рис Р.Дж., Максвелл А. (26 сентября 2008 г.). «ДНК-гираза: структура и функции». Критические обзоры в биохимии и молекулярной биологии. 26 (3–4): 335–75. Дои:10.3109/10409239109114072. PMID 1657531.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки. Наука о гирляндах. ISBN 0-8153-3218-1. Механизмы репликации ДНК: специальные белки помогают раскрыть двойную спираль ДНК перед вилкой репликации
- ^ Выкуп М., Деннехи Б., Тайлер Дж. К. (22 января 2010 г.). «Сопровождение гистонов во время репликации и восстановления ДНК». Клетка. 140 (2): 183–195. Дои:10.1016 / j.cell.2010.01.004. ЧВК 3433953. PMID 20141833.
- ^ Гриффитс AJ, Wessler SR, Lewontin RC, Carroll SB (2008). Введение в генетический анализ. В. Х. Фриман и компания. ISBN 978-0-7167-6887-6.[Глава 7: ДНК: структура и репликация. стр. 283–290]
- ^ "Будет ли лимит Хейфлика удерживать нас от вечной жизни?". Как это работает. 2009-05-11. Получено 20 января, 2015.
- ^ а б Джеймс Д. Уотсон и др. (2008), «Молекулярная биология гена», Pearson Education: 237
- ^ а б c d е ж Питер Мейстер, Анджела Таддеи1, Сьюзан М. Гассер (июнь 2006 г.), «На фабрике репликации и из нее», Клетка 125 (7): 1233–1235
- ^ Браун Т.А. (2002). Геномы. Издательство BIOS Scientific. ISBN 1-85996-228-9.13.2.3. Прекращение репликации
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки. Наука о гирляндах. ISBN 0-8153-3218-1. Внутриклеточный контроль событий клеточного цикла: S-фазные комплексы циклин-Cdk (S-Cdks) инициируют репликацию ДНК один раз за цикл
- ^ Браун Т.А. (2002). "13". Геномы (2-е изд.). Оксфорд: Wiley-Liss.
- ^ Nguyen VQ, Co C, Li JJ (июнь 2001 г.). «Циклин-зависимые киназы предотвращают повторную репликацию ДНК с помощью множества механизмов». Природа. 411 (6841): 1068–73. Bibcode:2001Натура.411.1068N. Дои:10.1038/35082600. PMID 11429609. S2CID 4393812.
- ^ Тобиасон Д.М., Зайферт Х.С. (июнь 2006 г.). «Облигатный патоген человека, Neisseria gonorrhoeae, полиплоидный». PLOS Биология. 4 (6): e185. Дои:10.1371 / journal.pbio.0040185. ЧВК 1470461. PMID 16719561.
- ^ Слейтер С., Уолд С., Лу М., Бой Э, Скарстад К., Клекнер Н. (сентябрь 1995 г.). «Белок E. coli SeqA связывает oriC в двух различных метил-модулированных реакциях, соответствующих его роли в инициации репликации ДНК и секвестрации ориджина». Клетка. 82 (6): 927–36. Дои:10.1016/0092-8674(95)90272-4. PMID 7553853. S2CID 14652024.
- ^ Купер С., Хельмштеттер СЕ (февраль 1968 г.). «Репликация хромосом и цикл деления Escherichia coli B / r». Журнал молекулярной биологии. 31 (3): 519–40. Дои:10.1016/0022-2836(68)90425-7. PMID 4866337.
- ^ Земан М.К., Цимприч К.А. (январь 2014 г.). «Причины и последствия репликационного стресса». Природа клеточной биологии. 16 (1): 2–9. Дои:10.1038 / ncb2897. ЧВК 4354890. PMID 24366029.
- ^ Сайки Р.К., Гельфанд Д.Х., Стоффель С., Шарф С.Дж., Хигучи Р., Хорн Г.Т. и др. (Январь 1988 г.). «Праймер-направленная ферментативная амплификация ДНК с помощью термостабильной ДНК-полимеразы». Наука. 239 (4839): 487–91. Bibcode:1988Научный ... 239..487С. Дои:10.1126 / science.239.4839.487. PMID 2448875.