Ривароксабан - Rivaroxaban
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Xarelto, другие |
| Другие имена | ЗАЛ 59-7939 |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a611049 |
| Данные лицензии |
|
| Беременность категория | |
| Маршруты администрация | Устно |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | 80–100%; Cmax = 2–4 часа (10 мг перорально)[4] |
| Метаболизм | CYP3A4, CYP2J2 и CYP-независимые механизмы[4] |
| Устранение период полураспада | 5–9 часов у здоровых людей в возрасте от 20 до 45 лет[4][5] |
| Экскреция | 2/3 метаболизируется в печени и 1/3 исключено без изменений[4] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Лиганд PDB | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.210.589 |
| Химические и физические данные | |
| Формула | C19ЧАС18ClN3О5S |
| Молярная масса | 435.88 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Ривароксабан, продается под торговой маркой Xarelto среди прочего, это антикоагулянтные препараты (разжижитель крови) используется для лечения и профилактики сгустки крови.[6] В частности, он используется для лечения глубокие венозные тромбы и легочная эмболия и предотвратить образование тромбов в мерцательная аритмия и после операции на бедре или колене.[6] Принято устно.[6]
Общие побочные эффекты включают кровотечение.[6] Другие серьезные побочные эффекты могут включать: гематома позвоночника и анафилаксия.[6] Неясно, используется ли в беременность и кормление грудью безопасно.[1] В сравнении с варфарин у него меньше взаимодействие с другими лекарствами.[7] Он работает, блокируя активность белка свертывания крови. фактор Ха.[6]
Ривароксабан был запатентован в 2007 году и одобрен для медицинского применения в США в 2011 году.[8] В США он не будет доступен в качестве дженерик до 2024 г.[9][10] В 2017 году это было 109-е место среди наиболее часто назначаемых лекарств в Соединенных Штатах, было выписано более шести миллионов рецептов.[11][12]
Медицинское использование
У пациентов с неклапанными мерцательная аритмия, он оказывается столь же эффективным, как варфарин в предотвращении ишемические инсульты и эмболические события.[13][14] Ривароксабан связан с более низкой частотой серьезных и фатальных кровотечений, чем варфарин, хотя ривароксабан связан с более высокой частотой кровотечений в желудочно-кишечный тракт.[15]
В июле 2012 г. Национальный институт здравоохранения и клинического совершенства рекомендуется ривароксабан для профилактики и лечения Венозная тромбоэмболия.[16]
Противопоказания
Из-за трудностей, связанных с лечением кровотечений, прием ривароксабана следует прекратить, по крайней мере, за 24 часа до операции, а затем возобновить прием, как только потребуется. гемостаз Установлено.[17]
В рекомендациях по дозировке не рекомендуется назначать ривароксабан с лекарствами, которые, как известно, обладают сильной комбинацией. CYP3A4 /Р-гликопротеин ингибиторы, потому что это приводит к значительно более высоким концентрациям ривароксабана в плазме.[2][18]
Побочные эффекты
Самый серьезный побочный эффект - это кровотечение, в том числе тяжелые внутреннее кровотечение.[19][20][21] Ривароксабан связан с более низкой частотой серьезных и смертельных кровотечений, чем варфарин, но связан с более высокой частотой кровотечений в желудочно-кишечный тракт.[15] Хотя в настоящее время доступен реверсивный агент ривароксабана (Андексанет альфа /AndexXa); его безопасность и эффективность не так хорошо изучены, как препараты, отменяющие действие более старого антикоагулянта, варфарина (витамин К и концентрат протромбинового комплекса ), что означает, что с серьезным кровотечением справиться труднее.[требуется медицинская цитата ]
По состоянию на 2015 год[Обновить], постмаркетинговые оценки показали токсичность для печени, и необходимы дальнейшие исследования для количественной оценки этого риска.[22][23] Лекарство противопоказано людям со значительным заболеванием печени и терминальной стадией заболевания почек, у которых препарат не испытывался.
Ривароксабан имеет предупреждение в рамке чтобы дать понять, что люди, принимающие лекарство, не должны прекращать его, прежде чем поговорить со своим врачом, потому что преждевременное прекращение может увеличить риск инсульта.[2]
В 2015 году на ривароксабан приходилось наибольшее количество зарегистрированных случаев серьезных травм среди лекарств, которые регулярно контролировались в Системе сообщений о побочных эффектах (AERS) FDA.[24]
Реверсивный агент
В октябре 2014 г. Portola Pharmaceuticals завершены клинические испытания фазы I и II для андексанет альфа в качестве антидота для ингибиторов фактора Ха с небольшими побочными эффектами и приступил к исследованиям фазы III.[25][26] Ожидается, что Andexanet alfa будет одобрен в 2016 году.[27] Andexanet alfa был одобрен Управлением по контролю за продуктами и лекарствами США в мае 2018 года под торговой маркой AndexXa.[28][29]
Механизм действия
Ривароксабан подавляет как свободные Фактор Ха и фактор Ха, связанный в протромбиназный комплекс.[30] Это очень селективный прямой ингибитор фактора Ха с быстрым началом действия. Ингибирование фактора Ха прерывает внутренние и внешние пути каскад свертывания крови, подавляя оба тромбин образование и развитие тромбов. Ривароксабан не ингибирует тромбин (активированный фактор II) и не влияет на тромбоциты были продемонстрированы.[4] Это позволяет предсказуемо антикоагулянт корректировка дозы и рутинный мониторинг коагуляции;[4] диетические ограничения не нужны.[27]
Нефракционированный гепарин (UFH), низкомолекулярный гепарин (LMWH) и фондапаринукс также подавляют активность фактора Ха, косвенно, путем связывания с циркулирующими антитромбин (AT III) и должны вводиться инъекционно, тогда как перорально активные варфарин, фенпрокумон, и аценокумарол находятся антагонисты витамина К (VKA), снижая ряд факторов свертывания, в том числе Фактор X.[31]
Ривароксабан предсказуемо фармакокинетика у широкого спектра пациентов (возраст, пол, вес, раса) и имеет квартиру доза реакция в восьмикратном диапазоне доз (5–40 мг).[32] Устный биодоступность уменьшается при приеме более высоких доз и увеличивается при приеме во время еды.[2]
Химия
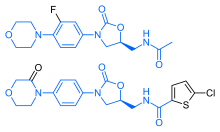
Ривароксабан обладает поразительным структурный сходство с антибиотиком линезолид: оба препарата имеют одно и то же оксазолидинон -производная основная структура. Соответственно, ривароксабан был изучен на предмет возможных антимикробных эффектов и возможности митохондриальная токсичность, что является известным осложнением длительного приема линезолида. Исследования показали, что ни ривароксабан, ни его метаболиты не обладают антибиотическим действием против Грамположительные бактерии. Что касается митохондриальной токсичности, in vitro исследования, опубликованные до 2008 г., показали, что риск невелик.[33]
История
Ривароксабан был первоначально разработан Байер. В США его продает Янссен Фармацевтика (часть Джонсон и Джонсон ). Это первый доступный активный прямой ингибитор фактора Ха который принимают внутрь.
Общество и культура
Экономика
По словам ученых, использование ривароксабана вместо варфарина обходится в 70 раз дороже. Экспресс Скрипты Холдинг Co, крупнейшего менеджера по льготам для аптек США.[27] По состоянию на 2016 год, Bayer утверждал, что препарат был лицензирован в 130 странах и что более 23 миллионов пациентов прошли курс лечения.[34]
Одобрение
В сентябре 2008 г. Министерство здравоохранения Канады выдано разрешение на продажу ривароксабана для предотвращения Венозная тромбоэмболия (ВТЭ) у людей, прошедших полную замена бедра или всего замена колена хирургия.[35]
В том же месяце Европейская комиссия также выдано разрешение на продажу ривароксабана для предотвращения венозной тромбоэмболии у взрослых, которым проводится плановая замена тазобедренного и коленного суставов.[36][3]
1 июля 2011 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA США) одобрило ривароксабан для профилактики глубокие венозные тромбы (ТГВ), что может привести к легочная эмболия (PE) у взрослых, перенесших операцию по замене тазобедренного и коленного суставов.[37]
4 ноября 2011 г. FDA одобренный ривароксабан для профилактики инсульта у людей с неклапанными мерцательная аритмия.[38]
Судебный иск
25 марта 2019 года в США было урегулировано более 25000 судебных исков по поводу ривароксабана на 775 миллионов долларов, которые должны быть выплачены пострадавшим. Истцы обвинили производителей лекарств в том, что они не предупредили о риске кровотечения, утверждая, что их травмы можно было бы предотвратить, если бы врачам и пациентам была предоставлена надлежащая информация.[39]
Исследование
Исследователи из Институт клинических исследований Дьюка были обвинены в сокрытии клинических данных, используемых для оценки ривароксабана.[40] Герцог тестировал ривароксабан в клиническом исследовании, известном как ROCKET AF.[41] Клиническое испытание, опубликованное в 2011 году в Медицинском журнале Новой Англии.[42] и во главе с Роберт Калифф, затем комиссар FDA,[43][42] обнаружили, что ривароксабан более эффективен, чем варфарин, в снижении вероятности ишемического инсульта у пациентов с фибрилляцией предсердий.[42] Достоверность исследования была поставлена под сомнение в 2014 году, когда фармацевтические спонсоры Байер и Джонсон и Джонсон показал, что Приборы для мониторинга крови INRatio использованные не работали должным образом,[40][41] Последующий анализ команды Duke, опубликованный в феврале 2016 года, показал, что это не оказало значительного влияния на эффективность и безопасность исследования.[44]
Отмечена недостаточная представленность расовых меньшинств в клинических испытаниях. По сравнению с варфарином эффективность и безопасность оказались одинаковыми для разных расовых подгрупп.[42]
Рекомендации
- ^ а б c «Применение ривароксабана во время беременности». Drugs.com. Получено 3 марта 2019.
- ^ а б c d «Ксарелто-ривароксабан в таблетках, Ксарелто-ривароксабан в таблетках с пленочным покрытием, Ксарелто-ривароксабан в виде таблеток с пленочным покрытием». DailyMed. Получено 13 ноября 2020.
- ^ а б «Ксарелто ЕПАР». Европейское агентство по лекарствам (EMA). Получено 13 ноября 2020.
- ^ а б c d е ж «Xarelto: Краткое описание характеристик продукта». Байер Шеринг Фарма АГ. 2008 г.. Получено 2009-02-11.
- ^ Абдулсаттар Й, Бхамбри Р., Ногид А (май 2009 г.). «Ривароксабан (ксарелто) для профилактики тромбоэмболических заболеваний: взгляд изнутри на пероральный прямой ингибитор фактора ха». P&T. 34 (5): 238–44. ЧВК 2697099. PMID 19561868.
- ^ а б c d е ж «Монография по ривароксабану для профессионалов». Drugs.com. Американское общество фармацевтов систем здравоохранения. Получено 3 марта 2019.
- ^ Кисер К (2017). Пероральная антикоагулянтная терапия: случаи и клиническая взаимосвязь. Springer. п. 11. ISBN 9783319546438.
- ^ «Доступность универсального Xarelto». Drugs.com. Получено 9 мая 2017.
- ^ «Оранжевая книга: одобренные лекарственные препараты с оценками терапевтической эквивалентности». www.accessdata.fda.gov. Получено 2019-04-24.
- ^ «Bayer, J&J Win, постановление, защищающее патент на лекарство Xarelto». 2019-04-22. Получено 2019-04-24.
- ^ «ТОП-300 2020». ClinCalc. Получено 11 апреля 2020.
- ^ «Ривароксабан - Статистика употребления наркотиков». ClinCalc. Получено 11 апреля 2020.
- ^ Ловенштерн А., Аль-Хатиб С.М., Шаран Л., Чаттерджи Р., Аллен ЛаПойнт Н.М., Шах Б. и др. (Декабрь 2018 г.). «Вмешательства для предотвращения тромбоэмболических событий у пациентов с фибрилляцией предсердий: систематический обзор». Анналы внутренней медицины. 169 (11): 774–787. Дои:10.7326 / M18-1523. ЧВК 6825839. PMID 30383133.
- ^ Гомес-Оутес А., Терлейра-Фернандес А.И., Кальво-Рохас Г., Суарес-Геа М.Л., Варгас-Кастрильон Э. (2013). «Дабигатран, ривароксабан или апиксабан в сравнении с варфарином у пациентов с неклапанной фибрилляцией предсердий: систематический обзор и метаанализ подгрупп». Тромбоз. 2013: 640723. Дои:10.1155/2013/640723. ЧВК 3885278. PMID 24455237.
- ^ а б Brown DG, Wilkerson EC, Love WE (март 2015 г.). «Обзор традиционных и новых пероральных антикоагулянтов и антитромбоцитов для дерматологов и дерматологических хирургов». Журнал Американской академии дерматологии. 72 (3): 524–34. Дои:10.1016 / j.jaad.2014.10.027. PMID 25486915.
- ^ «Обзор | Ривароксабан для лечения тромбоза глубоких вен и профилактики рецидивов тромбоза глубоких вен и тромбоэмболии легочной артерии | Рекомендации | NICE». www.nice.org.uk. Получено 1 января 2020.
- ^ Сункара Т., Офори Э., Зарубин В., Кауги М.Э., Гадупути В., Редди М. (2016). «Периоперационное управление пероральными антикоагулянтами прямого действия (DOAC): системный обзор». Статистика служб здравоохранения. 9 (Дополнение 1): 25–36. Дои:10.4137 / HSI.S40701. ЧВК 5156547. PMID 28008269.
- ^ Муек В., Кубица Д., Бека М. (сентябрь 2013 г.). «Совместное применение ривароксабана с лекарствами, которые имеют общие пути выведения: фармакокинетические эффекты у здоровых людей». Британский журнал клинической фармакологии. 76 (3): 455–66. Дои:10.1111 / bcp.12075. ЧВК 3769672. PMID 23305158.
- ^ «Руководство по лекарствам - Ксарелто» (PDF). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 1 сентября 2014.
- ^ «Побочные эффекты Xarelto». WebMD. Получено 1 сентября 2014.
- ^ «Центр побочных эффектов Ксарелто». RxList. Получено 1 сентября 2014.
- ^ Raschi E, Poluzzi E, Koci A, Salvo F, Pariente A, Biselli M и др. (Август 2015 г.). «Повреждение печени новыми пероральными антикоагулянтами: оценка постмаркетинговых отчетов в системе отчетов о побочных эффектах Управления по контролю за продуктами и лекарствами США». Британский журнал клинической фармакологии. 80 (2): 285–93. Дои:10.1111 / bcp.12611. ЧВК 4541976. PMID 25689417.
- ^ Russmann S, Niedrig DF, Budmiger M, Schmidt C, Stieger B, Hürlimann S, Kullak-Ublick GA (август 2014 г.). «Ривароксабан, постмаркетинговый риск повреждения печени» (PDF). Журнал гепатологии. 61 (2): 293–300. Дои:10.1016 / j.jhep.2014.03.026. PMID 24681117.
- ^ Шредер К. «ISMP оценивает Xarelto как самый опасный препарат в США». DrugNews. DrugNews. Получено 10 августа 2016.
- ^ Шредер К. «Возможное противоядие может помочь пациентам, разжижающим кровь, в случае кровотечения». DrugNews. Получено 20 августа 2015.
- ^ Мо Й, Ям Ф.К. (февраль 2015 г.). «Последние достижения в разработке специфических антидотов для пероральных антикоагулянтов, специфичных для мишени». Фармакотерапия. 35 (2): 198–207. Дои:10.1002 / phar.1532. PMID 25644580. S2CID 22593448.
- ^ а б c Беркрот Б. (23 декабря 2015 г.). «Новый антидот, разжижающий кровь, чтобы помочь врачам отказаться от варфарина». Рейтер.
- ^ «Ускоренное утверждение для AndexXa» (PDF). FDA. Получено 1 августа 2018.
- ^ «FDA США одобряет Andexxa® компании Portola Pharmaceuticals, первый и единственный антидот для отмены ингибиторов фактора Ха». Portola Pharmaceuticals Inc. Комната новостей GlobeNewswire. Получено 1 августа 2018.
- ^ Рёриг С., Штрауб А., Польманн Дж., Лампе Т., Пернерсторфер Дж., Шлеммер К. Х. и др. (Сентябрь 2005 г.). «Открытие нового антитромботического агента 5-хлор-N - ({(5S) -2-оксо-3- [4- (3-оксоморфолин-4-ил) фенил] -1,3-оксазолидин-5-ил}] метил) тиофен-2-карбоксамид (BAY 59-7939): пероральный прямой ингибитор фактора Ха ». Журнал медицинской химии. 48 (19): 5900–8. Дои:10.1021 / jm050101d. PMID 16161994.
- ^ Turpie AG (январь 2008 г.). «Новые пероральные антикоагулянты при фибрилляции предсердий». Европейский журнал сердца. 29 (2): 155–65. Дои:10.1093 / eurheartj / ehm575. PMID 18096568.
- ^ Эрикссон Б.И., Боррис Л.К., Даль О.Е., Хаас С., Хьюисман М.В., Каккар А.К. и др. (Ноябрь 2006 г.). «Пероральный прямой ингибитор фактора Ха, ривароксабан (BAY 59-7939), принимаемый один раз в день, для тромбопрофилактики после полной замены тазобедренного сустава». Тираж. 114 (22): 2374–81. Дои:10.1161 / CIRCULATIONAHA.106.642074. PMID 17116766.
- ^ Европейское агентство по лекарственным средствам (2008 г.). «Отчет об оценке ТЭЦ для Xarelto (EMEA / 543519/2008)» (PDF). Получено 2009-06-11.[постоянная мертвая ссылка ]
- ^ "Байер комментирует статью в Британском медицинском журнале (BMJ) о Xarelto" (PDF). Коммуникации, отношения с государственными органами и корпоративный бренд Bayer AG 29 сентября 2016.
- ^ «Байер Xarelto одобрен в Канаде» (Пресс-релиз). Байер. 2008-09-16. Получено 2010-01-31.
- ^ «Новый антикоагулянт Bayer Xarelto теперь также одобрен в ЕС» (Пресс-релиз). Байер. 2008-02-10. Получено 2010-01-31.
- ^ «FDA одобряет Ксарелто® (таблетки ривароксабана) для предотвращения тромбоза глубоких вен у пациентов, перенесших операцию по замене коленного или тазобедренного сустава» (Пресс-релиз). Янссен Фармацевтика. 2011-07-01. Архивировано из оригинал на 2011-11-05. Получено 2011-07-01.
- ^ «FDA одобряет Xarelto для предотвращения инсульта у людей с обычным типом нарушения сердечного ритма». Ассоциация США по пищевым продуктам и лекарствам. 4 ноября 2011 г.. Получено 27 апреля 2016.
- ^ «Bayer, Johnson & Johnson урегулировала более 25 000 судебных исков против препарата Xarelto, разжижающего кровь, на сумму 775 миллионов долларов». Washingtonpost.com. Получено 7 апреля 2019.
- ^ а б Томас К. (1 марта 2016 г.). «В документе утверждается, что производители лекарств обманули ведущий медицинский журнал». Нью-Йорк Таймс. Получено 3 мая 2016.
- ^ а б Патель В. «Клинические испытания Duke под пристальным вниманием по делу о наркотиках». Хроника. Издательство Duke Student.
- ^ а б c d Пател М.Р., Махаффи К.В., Гарг Дж., Пан Дж., Зингер Д.Э., Хаке В. и др. (Сентябрь 2011 г.). «Ривароксабан в сравнении с варфарином при неклапанной фибрилляции предсердий». Медицинский журнал Новой Англии. 365 (10): 883–91. Дои:10.1056 / NEJMoa1009638. ЧВК 3860773. PMID 21830957.
- ^ «Познакомьтесь с Робертом М. Калиффом, доктором медицины, комиссаром по продовольствию и лекарствам». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 3 мая 2016.
- ^ Пател М.Р., Хеллкамп А.С., Фокс К.А. (февраль 2016 г.). «Мониторинг варфарина в месте оказания медицинской помощи в испытании ROCKET AF» (PDF). Медицинский журнал Новой Англии. 374 (8): 785–8. Дои:10.1056 / NEJMc1515842. PMID 26839968.
внешняя ссылка
- «Ривароксабан». Портал информации о наркотиках. Национальная медицинская библиотека США.
