Калнексин - Calnexin
Калнексин (CNX) это 67 кДа интегральный белок (который проявляется по-разному как полоса 90 кДа, 80 кДа или 75 кДа при вестерн-блоттинге в зависимости от источника антитела) эндоплазматический ретикулум (ER). Он состоит из большого (50 кДа) N-концевой кальций -привязка просвет домен, один трансмембранная спираль и короткое (90 остатки ), кислый цитоплазматический хвост.[5]
Функция
Кальнексин - это сопровождающий, характеризуется оказанием помощи сворачивание белка и контроль качества, гарантирующий, что только правильно сложенные и собранные белки продвигаются дальше по секреторный путь. Он специально действует для удержания развернутых или несобранных N-связанных гликопротеины в ER.[6]
Калнексин связывает только N-гликопротеины которые имеют GlcNAc2Man9Glc1 олигосахариды.[7] Эти моноглюкозилированные олигосахариды возникают в результате обрезки двух остатков глюкозы последовательным действием двух глюкозидазы, I и II. Глюкозидаза II может также удалять третий и последний остаток глюкозы. Если гликопротеин не свернут должным образом, фермент, называемый UGGT (для UDP-глюкозы: гликопротеин-глюкозилтрансфераза) добавит остаток глюкозы обратно к олигосахариду, таким образом восстанавливая способность гликопротеина связываться с калнексином.[8] Неправильно сложенная цепь гликопротеина, таким образом, задерживается в ER и экспрессия EDEM / Htm1p [9][10][11] что в конечном итоге приговаривает неэффективный гликопротеин к деградация удалив один из девяти манноза остатки. Лектин маннозы Yos-9 (OS-9 у человека) маркирует и сортирует неправильно свернутые гликопротеины для деградации. Yos-9 распознает остатки маннозы, открытые после удаления α-маннозидазой внешней маннозы из неправильно свернутых гликопротеинов.[12]
Калнексин связывается с ферментом сворачивания белка ERp57[13] катализировать образование гликопротеин-специфической дисульфидной связи, а также действует как шаперон для сворачивания MHC класс I α-цепь в мембране ЭР. Когда вновь синтезированные α-цепи MHC класса I попадают в эндоплазматический ретикулум, калнексин связывается с ними, сохраняя их в частично свернутом состоянии.[14]
После того как β2-микроглобулин связывается с комплексом загрузки пептидов (PLC) MHC класса I, кальретикулин и ERp57 берут на себя работу по шаперонированию белка MHC класса I, в то время как тапасин связывает комплекс с транспортер, связанный с процессингом антигена (ТАП) комплекс. Эта ассоциация подготавливает MHC класса I к связыванию антигена для презентации на поверхности клетки.
Длительная ассоциация калнексина с мутантным неправильно свернутым PMP22, как известно, вызывает Болезнь Шарко-Мари-Зуба [15] приводит к секвестрации, деградации и неспособности PMP22 передавать трафик на Шванновская ячейка поверхность для миелинизация. После повторных циклов связывания калнексина мутант PMP22 модифицируется с помощью убиквитин для деградации протеасома а также путь извлечения Гольджи к ER для возврата любых неправильно свернутых PMP22, которые вышли из ER в аппарат Гольджи.[16]
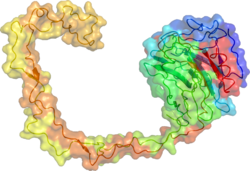
Рентгеновская кристаллическая структура кальнексина выявила глобулярный лектиновый домен и протянувшееся длинное гидрофобное плечо.[17]
Кофакторы
АТФ и ионы кальция являются кофакторами, участвующими в связывании субстрата калнексина.[18]
Рекомендации
- ^ а б c ENSG00000127022 GRCh38: Ensembl release 89: ENSG00000283777, ENSG00000127022 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000020368 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Вада I, Риндресс D, Кэмерон PH, Ou WJ, Доэрти JJ 2nd, Louvard D, Bell AW, Dignard D, Thomas DY, Bergeron JJ (1991). «SSR альфа и связанный с ним калнексин являются основными связывающими кальций белками мембраны эндоплазматического ретикулума». J Biol Chem. 226 (29): 19599–610. PMID 1918067.
- ^ Оу WJ, Кэмерон PH, Томас Д.Й., Бержерон JJ (1993). «Ассоциация интермедиатов сворачивания гликопротеинов». Природа. 364 (644): 771–6. Дои:10.1038 / 364771a0. PMID 8102790. S2CID 4340769.
- ^ Хаммонд C, Браакман I, Хелениус A (1984). «Роль распознавания N-связанных олигосахаридов, тримминга глюкозы и калнексина в сворачивании гликопротеина и контроле качества». Proc Natl Acad Sci USA. 91 (3): 913–7. Дои:10.1073 / пнас.91.3.913. ЧВК 521423. PMID 8302866.
- ^ Gañán S, Cazzulo JJ, Parodi AJ (1991). «Основная часть N-гликопротеинов временно глюкозилируется в эндоплазматическом ретикулуме». Биохимия. 30 (12): 3098–104. Дои:10.1021 / bi00226a017. PMID 1826090.
- ^ Джейкоб К.А., Бодмер Д., Спириг Ю., Баттиг П., Марсиль А., Дигнар Д., Бержерон Д. Дж., Томас Д. Ю., Эби М. (2001). «Htm1p, маннозидазоподобный белок, участвует в деградации гликопротеина в дрожжах». EMBO Rep. 2 (5): 423–30. Дои:10.1093 / embo-reports / kve089. ЧВК 1083883. PMID 11375935.
- ^ Хосокава Н., Вада И., Хасэгава К., Ёрихузи Т., Тремблей Л.О., Херскович А., Нагата К. (2001). «Новый ER альфа-маннозидазоподобный белок ускоряет ER-ассоциированную деградацию». EMBO Rep. 2 (5): 415–2. Дои:10.1093 / embo-reports / kve084. ЧВК 1083879. PMID 11375934.
- ^ Ли А.Х., Ивакоши Н.Н., Глимчер Л.Х. (2003). «XBP-1 регулирует подмножество генов шаперонов эндоплазматического ретикулума в ответе на развернутый белок». Mol Cell Biol. 23 (21): 5448–59. Дои:10.1128 / mcb.23.21.7448-7459.2003. ЧВК 207643. PMID 14559994.
- ^ Куан Э.М., Камия Д., Деник В., Вайбезан Дж., Като К., Вайсман Дж. С. (2008). «Определение сигнала деструкции гликанов для деградации, связанной с эндоплазматическим ретикулумом». Mol Cell. 32 (6): 870–7. Дои:10.1016 / j.molcel.2008.11.017. ЧВК 2873636. PMID 19111666.
- ^ Запун А., Дарби Нью-Джерси, Тессье, округ Колумбия, Михалак М., Бержерон Дж. Дж., Томас Д. Ю. (1998). «Усиленный катализ сворачивания рибонуклеазы В за счет взаимодействия калнексина или кальретикулина с ERp57». J Biol Chem. 273 (211): 6009–12. Дои:10.1074 / jbc.273.11.6009. PMID 9497314.
- ^ Бержерон Дж. Дж., Бреннер МБ, Томас Д. Ю., Уильямс Д. Б. (1994). «Кальнексин: мембраносвязанный шаперон эндоплазматического ретикулума». Тенденции Biochem Sci. 19 (3): 124–8. Дои:10.1016/0968-0004(94)90205-4. PMID 8203019.
- ^ Диксон К.М., Бержерон Дж. Дж., Шамес И., Колби Дж., Нгуен Д. Т., Чевет Е., Томас Д. Ю., Снайпс Г. Дж. (2002). «Ассоциация калнексина с мутантным периферическим миелиновым белком-22 ex vivo: основа для болезней ER». Proc Natl Acad Sci USA. 99 (15): 9852–7. Дои:10.1073 / pnas.152621799. ЧВК 125041. PMID 12119418.
- ^ Хара Т., Хашимото Ю., Акузава Т., Хираи Р., Кобаяши Н., Сато К. (2014). «Rer1 и калнексин регулируют удержание в эндоплазматическом ретикулуме мутанта периферического миелинового белка 22, который вызывает болезнь Шарко-Мари-Тута типа 1A». Научный представитель. 4: 1–11. Дои:10.1038 / srep06992. ЧВК 4227013. PMID 25385046.
- ^ Шраг Дж. Д., Бержерон Дж. Дж., Ли Й, Борисова С., Хан М., Томас Д. Ю., Сиглер М. (2001). «Структура калнексина, шаперона ER, участвующего в контроле качества сворачивания белка». Mol Cell. 8 (3): 633–44. Дои:10.1016 / с1097-2765 (01) 00318-5. PMID 11583625.
- ^ Ou WJ, Бержерон JJ, Ли Y, Кан CY, Томас DY (1995). «Конформационные изменения, индуцированные в просветном домене эндоплазматического ретикулума калнексина под действием Mg-ATP и Ca2 +». J Biol Chem. 270 (30): 18051–9. Дои:10.1074 / jbc.270.30.18051. PMID 7629114.
внешняя ссылка
- Калнексин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
дальнейшее чтение
- Benyair R, Ron E, Lederkremer GZ (2011). Контроль качества, удержания и деградации протеина в эндоплазматическом ретикулуме. Международный обзор клеточной и молекулярной биологии. 292. С. 197–280. Дои:10.1016 / B978-0-12-386033-0.00005-0. ISBN 9780123860330. PMID 22078962.
- Del Bem LE (февраль 2011 г.). «Эволюционная история генов кальретикулина и кальнексина у зеленых растений». Genetica. 139 (2): 225–9. Дои:10.1007 / s10709-010-9544-у. PMID 21222018. S2CID 9228786.
- Клейзен Б., Браакман И. (август 2004 г.). «Фолдинг белков и контроль качества в эндоплазматическом ретикулуме». Текущее мнение в области клеточной биологии. 16 (4): 343–9. Дои:10.1016 / j.ceb.2004.06.012. HDL:1874/5106. PMID 15261665.
- Расмуссен Х. Х., ван Дамм Дж., Пуйпе М., Гессер Б., Селис Дж. Э., Вандекеркхов Дж. (Декабрь 1992 г.). «Микропоследовательности 145 белков, записанные в базе данных двумерных гелевых белков нормальных эпидермальных кератиноцитов человека». Электрофорез. 13 (12): 960–9. Дои:10.1002 / elps.11501301199. PMID 1286667. S2CID 41855774.
- Галвин К., Кришна С., Пончел Ф., Фролих М., Каммингс Д.Э., Карлсон Р., Вандс Дж. Р., Иссельбахер К.Дж., Пиллай С., Озтюрк М. (сентябрь 1992 г.). «Главный антигенсвязывающий белок класса I комплекса гистосовместимости p88 является продуктом гена калнексина». Труды Национальной академии наук Соединенных Штатов Америки. 89 (18): 8452–6. Дои:10.1073 / пнас.89.18.8452. ЧВК 49938. PMID 1326756.
- Пинд С., Риордан-младший, Уильямс Д. Б. (апрель 1994 г.). «Участие шаперона эндоплазматического ретикулума калнексина (p88, IP90) в биогенезе регулятора трансмембранной проводимости при муковисцидозе». Журнал биологической химии. 269 (17): 12784–8. PMID 7513695.
- Оноре Б., Расмуссен Х. Х., Селис А., Лефферс Х., Мадсен П., Селис Дж. Э. (1992). «Молекулярные шапероны HSP28, GRP78, эндоплазмин и калнексин демонстрируют поразительно разные уровни в покоящихся кератиноцитах по сравнению с их пролиферирующими нормальными и трансформированными аналогами: клонирование кДНК и экспрессия кальнексина». Электрофорез. 15 (3–4): 482–90. Дои:10.1002 / elps.1150150166. PMID 8055875. S2CID 22393279.
- Tjoelker LW, Seyfried CE, Eddy RL, Byers MG, Shows TB, Calderon J, Schreiber RB, Gray PW (март 1994). «Клонирование кДНК калнексина человека, мыши и крысы: идентификация потенциальных кальций-связывающих мотивов и локализация гена в хромосоме 5 человека». Биохимия. 33 (11): 3229–36. Дои:10.1021 / bi00177a013. PMID 8136357.
- Лентер М., Вествебер Д. (апрель 1994 г.). «Цепи интегрина бета 1 и альфа 6 связываются с шапероном калнексином до сборки интегрина». Журнал биологической химии. 269 (16): 12263–8. PMID 8163531.
- Раджагопалан С., Сюй Ю., Бреннер МБ (январь 1994 г.). «Удержание несобранных компонентов интегральных мембранных белков калнексином». Наука. 263 (5145): 387–90. Дои:10.1126 / science.8278814. PMID 8278814.
- Дэвид В., Ф. Хохстенбах, С. Раджагопалан, М. Б. Бреннер (май 1993 г.). «Взаимодействие с вновь синтезированными и удерживаемыми белками в эндоплазматическом ретикулуме предполагает наличие шаперонной функции для человеческого интегрального мембранного белка IP90 (калнексин)». Журнал биологической химии. 268 (13): 9585–92. PMID 8486646.
- Белловино Д., Моримото Т., Тосетти Ф., Гаэтани С. (январь 1996 г.). «Связывающий ретинол белок и транстиретин секретируются в виде комплекса, образованного в эндоплазматическом ретикулуме в клетках гепатокарциномы человека HepG2». Экспериментальные исследования клеток. 222 (1): 77–83. Дои:10.1006 / excr.1996.0010. PMID 8549676.
- Оттекен А, Мосс Б. (январь 1996 г.). «Кальретикулин взаимодействует с недавно синтезированным гликопротеином оболочки вируса иммунодефицита человека 1 типа, что свидетельствует о его шаперонной функции, аналогичной функции калнексина».. Журнал биологической химии. 271 (1): 97–103. Дои:10.1074 / jbc.271.1.97. PMID 8550632.
- Devergne O, Hummel M, Koeppen H, Le Beau MM, Nathanson EC, Kieff E, Birkenbach M (февраль 1996 г.). «Новый родственный интерлейкину-12 белок p40, индуцированный латентной инфекцией вируса Эпштейна-Барра в B-лимфоцитах». Журнал вирусологии. 70 (2): 1143–53. Дои:10.1128 / JVI.70.2.1143-1153.1996. ЧВК 189923. PMID 8551575.
- Андерссон Б., Вентланд М.А., Рикафренте Ю.Ю., Лю В., Гиббс Р.А. (апрель 1996 г.). «Метод« двойного адаптера »для улучшения конструкции библиотеки дробовиков». Аналитическая биохимия. 236 (1): 107–13. Дои:10.1006 / abio.1996.0138. PMID 8619474.
- ван Леувен Дж. Э., Кирс К. П. (апрель 1996 г.). «Калнексин связывается исключительно с отдельными CD3-дельта и альфа-белками рецептора Т-клеточного антигена (TCR), содержащими не полностью обрезанные гликаны, которые не собраны в многосубъединичные комплексы TCR». Журнал биологической химии. 271 (16): 9660–5. Дои:10.1074 / jbc.271.16.9660. PMID 8621641.
- Оливер Дж. Д., Греско Р. К., Мюклер М., High S (июнь 1996 г.). «Переносчик глюкозы glut 1 взаимодействует с калнексином и кальретикулином». Журнал биологической химии. 271 (23): 13691–6. Дои:10.1074 / jbc.271.23.13691. PMID 8662691.
- Ли И, Бержерон Дж.Дж., Ло Л., Оу В.Дж., Томас Д.Й., Кан CY (сентябрь 1996 г.). «Влияние неэффективного расщепления сигнальной последовательности gp 120 ВИЧ-1 на ее ассоциацию с калнексином, фолдинг и внутриклеточный транспорт». Труды Национальной академии наук Соединенных Штатов Америки. 93 (18): 9606–11. Дои:10.1073 / пнас.93.18.9606. ЧВК 38475. PMID 8790377.
- Тромбетта Е.С., Саймонс Дж. Ф., Хелениус А. (ноябрь 1996 г.). «Глюкозидаза II эндоплазматического ретикулума состоит из каталитической субъединицы, сохраненной от дрожжей до млекопитающих, и прочно связанной некаталитической субъединицы, содержащей HDEL». Журнал биологической химии. 271 (44): 27509–16. Дои:10.1074 / jbc.271.44.27509. PMID 8910335.
- Тату У, Хелениус А (февраль 1997 г.). «Взаимодействие между вновь синтезированными гликопротеинами, калнексином и сетью резидентных шаперонов в эндоплазматическом ретикулуме». Журнал клеточной биологии. 136 (3): 555–65. Дои:10.1083 / jcb.136.3.555. ЧВК 2134297. PMID 9024687.
- Wiest DL, Bhandoola A, Punt J, Kreibich G, McKean D, Singer A (март 1997 г.). «Неполное удержание эндоплазматического ретикулума (ЭР) в незрелых тимоцитах, выявленное поверхностной экспрессией« резидентных в ЭР »молекулярных шаперонов». Труды Национальной академии наук Соединенных Штатов Америки. 94 (5): 1884–9. Дои:10.1073 / пнас.94.5.1884. ЧВК 20012. PMID 9050874.
- Ю. В., Андерссон Б., Уорли К. С., Музни Д. М., Дин Й., Лю В., Рикафренте Д. Ю., Вентланд М. А., Леннон Г., Гиббс Р. А. (апрель 1997 г.). «Крупномасштабное конкатенационное секвенирование кДНК». Геномные исследования. 7 (4): 353–8. Дои:10.1101 / гр. 7.4.353. ЧВК 139146. PMID 9110174.