AB5 токсин - AB5 toxin - Wikipedia
| Энтеротоксин (субъединица B OB-складки) | |
|---|---|
| Идентификаторы | |
| Символ | Энтеротоксин |
| ИнтерПро | IPR008992 |
| SCOP2 | 2bos / Объем / СУПФАМ |
AB5 токсины шестикомпонентные белок комплексы, секретируемые некоторыми патогенный бактерии известно, что вызывает такие заболевания человека, как холера, дизентерия, и гемолитико-уремический синдром. Один компонент известен как субъединица A, а остальные пять компонентов - субъединицы B. Все эти токсины имеют схожую структуру и механизм проникновения в клетки-мишени. Субъединица B отвечает за связывание с рецепторы чтобы открыть путь для А-субъединицы, чтобы войти в клетку. Затем субъединица A может использовать свои каталитический механизм, чтобы взять на себя обычные функции клетки-хозяина.[1][2]
Семьи



Существует четыре основных семейства токсина AB5. Для этих семей характерны последовательность их A (каталитической) субъединицы, а также их каталитической способности.[4]
Холерный токсин
Это семейство также известно как Ct или Ctx, и оно также включает термолабильный энтеротоксин, известный как LT.[5] Многие приписывают открытие токсина холеры доктору Самбху Натх Де. Он проводил свои исследования в Калькутте (ныне Калькутта ), сделав свое открытие в 1959 году, хотя сначала оно было очищено Роберт Кох в 1883 году. Токсин холеры состоит из белкового комплекса, который секретируется бактериями. Холерный вибрион.[6] Некоторые симптомы этого токсина включают хронический и широко распространенный водянистый понос и обезвоживание, которое в некоторых случаях приводит к смерти.
Токсин коклюша
Это семейство также известно как Ptx и содержит токсин, отвечающий за захлебывающийся кашель. Токсин коклюша выделяется грамотрицательная бактерия, Bordetella pertussis. Коклюш очень заразен, и, несмотря на вакцинацию, число случаев заболевания в США медленно растет.[7] Симптомы включают: приступообразный кашель с коклюшем и даже рвотой.[8] Бактерия Bordetella pertussis был впервые идентифицирован как причина коклюша и изолирован Жюль Борде и Октав Гэнгоу во Франции в 1900 году.[9] Токсин имеет тот же механизм, что и холерный токсин.[5]
ArtAB токсин Salmonella enterica имеет компоненты, аналогичные компонентам двух разных семейств: ArtA (Q404H4) субъединица гомологична коклюшному токсину А, тогда как ArtB (Q404H3) субъединица гомологична subB, а также белкам, обнаруженным в других Сальмонелла штаммы. Согласно правилу категоризации по A, это токсин семейства Ptx.[10][4]
Шига токсин
Токсин шига, также известный как Stx, представляет собой токсин, который вырабатывается стержнем в форме Шигелла дизентерия и кишечная палочка (СТЭК). Еда и напитки, загрязненные этими бактериями, являются источником инфекции и способом распространения этого токсина.[11] Симптомы включают боль в животе, а также водянистую диарею. Для тяжелых опасных для жизни случаев характерны: геморрагический колит (HC).[12] Открытие токсина шига приписывают доктору Киёси Сига в 1898 г.
Субтилаза цитотоксин
Это семейство также известно как SubAB.[4] и был обнаружен в 1990-х годах.[13] Производится штаммами СТЭК, не имеющими место сглаживания энтероцитов (ЛИ),[14] и, как известно, вызывает гемолитико-уремический синдром (ГУС). Он называется цитотоксином субтилазы, потому что его последовательность субъединицы А подобна последовательности субтилазоподобной сериновая протеаза в бацилла сибирской язвы. Некоторые симптомы, вызванные этим токсином, включают снижение тромбоцит посчитать в крови или тромбоцитопения, увеличение лейкоцит считать или лейкоцитоз, и почечный повреждение клеток.[15]
Субъединица цитотоксина А субтилазы (subA, Q6EZC2) - протеаза, расщепляющая связывающий белок иммуноглобулина (BiP), что приводит к эндоплазматический ретикулум стресс и гибель клеток. Субъединицы B (subB, Q6EZC3) связываются с N-гликолилнейраминовая кислота (Neu5Gc) гликаны на клетках с высоким сродством.[16] Просто subB достаточно, чтобы вызвать вакуолизацию клеток веро.[17] Neu5GC не производится человеком, а попадает в слизистую оболочку кишечника человека из пищевых источников, таких как красное мясо и молочные продукты, которые также часто являются источниками инфекций STEC.[18]
Структура
Полный токсиновый комплекс AB5 содержит шесть белковых единиц. Пять единиц аналогичны или идентичны по структуре и составляют субъединицу B. Последняя белковая единица уникальна и известна как субъединица A.


Подразделение
Субъединица A токсина AB5 является частью, ответственной за катализ конкретных мишеней. Для семейства токсинов шига субъединица A содержит Трипсин -чувствительная область, которая при расщеплении выделяет два фрагментированных домена. Этот регион еще не подтвержден для других семейств токсинов AB5.[2] В общем, два домена субъединицы A, названные A1 и A2, связаны между собой дисульфидная связь. Домен A1 (приблизительно 22 кДа в токсине холеры или термолабильных энтеротоксинах) является частью токсина, ответственной за его токсические эффекты. Домен A2 (приблизительно 5 кДа в токсине холеры или термолабильном энтеротоксине) обеспечивает нековалентный связь с B-субъединицей через центральную пору B-субъединицы.[5] Цепь A1 холерного токсина катализирует перенос АДФ-рибоза из Никотинамид аденин динуклеотид (NAD) в аргинин или другой гуанидин соединения за счет использования Факторы АДФ-рибозилирования (АРФ). В отсутствие аргинина или простых гуанидиносоединений токсин опосредован НАД + нуклеозидаза (NADase) активность протекает с использованием воды в качестве нуклеофил.[19]
Субъединица B
Субъединицы B образуют пятичленное или пентамерное кольцо, в которое входит и удерживается один конец субъединицы A. Это кольцо субъединицы B также способно связываться с рецептор, обычно гликопротеин или гликолипид,[5] на поверхности клетки-хозяина.[20] Без субъединиц B субъединица A не имеет возможности присоединиться к клетке или проникнуть в нее и, следовательно, не имеет возможности оказывать свое токсическое действие. Токсин холеры, токсин шига и токсин SubAB все имеют субъединицы B, которые состоят из пяти идентичных белковых компонентов, что означает, что их субъединицы B являются гомопентамерами. Токсин коклюша отличается тем, что его пентамерное кольцо состоит из четырех различных белковых компонентов, где один из компонентов повторяется с образованием гетеропентамера.[5]
Механизмы
Токсин холеры, токсин коклюша и токсин шига имеют свои цели в цитозоль ячейки. После того, как их субъединица B связывается с рецепторами на поверхности клетки, токсин окутывается клеткой и транспортируется внутрь либо через клатрин-зависимый эндоцитоз или же клатриннезависимый эндоцитоз.[21]
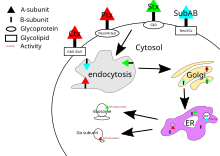
Для токсина холеры основным гликолипид рецептор холерного токсина ганглиозид GM1.[20] После эндоцитоза в аппарат Гольджи, токсин перенаправляется в эндоплазматический ретикулум.[5] Чтобы субъединица A достигла своей цели, дисульфидная связь между доменами A1 и A2 должна быть разорвана. Эта поломка катализируется протеин дисульфид-изомераза[22] то есть в эндоплазматическом ретикулуме. После разделения домен A1 разворачивается и перенаправляется обратно в цитозоль, где он снова складывается.[5] и катализирует АДФ-рибозилирование определенных G протеин альфа-субъединицы. При этом последующие эффекты G-белка путь передачи сигнала нарушен[4] путем активации аденилатциклаза.[20] Это вызывает более высокую концентрацию лагерь в клетке, что нарушает регуляцию механизмов транспорта ионов.[5]
Токсин коклюша не имеет определенного рецептора и связывается с сиалилированный гликопротеины.[13] После эндоцитоза механизм действия токсина коклюша такой же, как у токсина холеры.
Основным рецептором токсина шига является глоботриаозилцерамид или Gb3.[23] Токсин шига также попадает в аппарат Гольджи, а затем направляется в эндоплазматический ретикулум, где PDI расщепляет дисульфидную связь. Субъединица А токсина шига затем возвращается в цитозоль и подавляет синтез эукариотического белка с помощью РНК N-гликозидаза Мероприятия[4] путем расщепления определенной основы аденина на 28S рибосомная РНК[5] что в конечном итоге приведет к гибели клеток.
Мишень SubAB находится в эндоплазматическом ретикулуме клетки и попадает в клетку через клатрин-опосредованный эндоцитоз.[20] Рецептор гликана для SubAB обычно заканчивается α2-3-связанным N-гликолилнейраминовая кислота (Neu5Gc).[13] SubAB имеет субъединицу A, где она действует как сериновая протеаза и расщепляет Bip / GRP78, эндоплазматический ретикулум сопровождающий.[4] Расщепление этого шаперона вызывает клеточный стресс из-за ингибирования белка,[14] и, как следствие, гибель клетки.[5]
Медицинское использование
Лечение рака
Субъединицы B токсинов AB5 обладают сродством к связыванию гликан которые, похоже, обладают некоторыми типами опухолей, что делает их легкой мишенью. Один из примеров - это StxB который специально связывается с CD77 (Gb3), который показывает экспрессию на поверхности раковых клеток, таких как толстая кишка, поджелудочная железа, грудь и многие другие. Как только StxB нацелен на злокачественную клетку, он доставляет субъединицу A токсина, которая в конечном итоге убивает злокачественную клетку.[5]
Еще один метод заключается в использовании препаратов, вызывающих стресс ER, которые были протестированы на мышах и показали положительные синергические реакции. Это достигается за счет слияния фактор роста эпидермиса (EGF) с субъединицей A SubAB. В этом случае раковые клетки, которые экспрессируют рецепторы EGF, будут испытывать токсичность SubAB.[24]
Вакцина
Другое применение токсинов AB5 - использование членов семейства LT в качестве адъюванты. Это позволяет токсину стимулировать иммунологические реакции, такие как IgG2a, IgA, и Чт17 бороться например с желудочным Helicobacter pylori инфекция, когда вакцина дано.[25][26]
Помимо того, что некоторые из этих токсинов AB5 используются для создания вакцин для предотвращения бактериальной инфекции, они также исследуются, чтобы работать как сопрягать для предотвращения вирусных инфекций. Например, системная иммунизация вместе с совместной интраназальной доставкой конъюгированной вакцины вирус-холерный токсин вызвала вирус-специфический ответ антител и показала некоторую степень защиты верхних дыхательных путей от Сендайский вирус.[27]
Последние области исследований
Новые достижения в биотехнологических экспериментальных методах, такие как использование Бесселева балка самолет световая микроскопия и FRET сенсорные молекулы могут лучше демонстрировать динамические структуры щелевой переход бляшки. Для этих экспериментов можно использовать различные типы токсинов AB5, чтобы вызвать быстрое образование tCDR в клетках кишечной палочки. Затем ответ можно записать с помощью лагерь флуктуации концентрации в клетках, связанных щелевым соединением, с использованием сенсорных конструкций на основе FRET. Исследования показывают, что CDR могут быть связаны с быстрой перестройкой липидов и белков в коннексин каналы в пластинах щелевого соединения. Это также может помочь нам понять сигнальный каскад, который следует за потерей клетками K + при воздействии бактериальной инфекции.[28][29]
Было замечено, что токсин SubAB демонстрирует специфичность к связывающему белку, BiP. Эта характеристика была использована для изучения роли самого клеточного BiP, наряду с деградацией, связанной с эндоплазматическим ретикулумом, при стрессе. HeLa клетки.[5]
Смотрите также
Рекомендации
- ^ Le Nours, J .; Paton, A.W .; Byres, E .; Troy, S .; Herdman, B.P .; Johnson, M.D .; Paton, J.C .; Rossjohn, J .; Беддо, Т. (6 августа 2013 г.). «Структурная основа сборки Subtilase Cytotoxin SubAB». Журнал биологической химии. 288 (38): 27505–27516. Дои:10.1074 / jbc.M113.462622. ЧВК 3779744. PMID 23921389.
- ^ а б Миддлбрук, JL; Дорланд, РБ (сентябрь 1984 г.). «Бактериальные токсины: клеточные механизмы действия». Микробиологические обзоры. 48 (3): 199–221. ЧВК 373009. PMID 6436655.
- ^ Locht, C; Антуан, Р. (1995). «Предлагаемый механизм ADP-рибозилирования, катализируемого субъединицей S1 токсина коклюша». Биохимия. 77 (5): 333–40. Дои:10.1016/0300-9084(96)88143-0. PMID 8527486.
- ^ а б c d е ж Wang, H; Патон, JC; Хердман, ВР; Роджерс, Т.Дж.; Беддо, Т; Патон, А.В. (март 2013 г.). «Субъединица B токсина AB5, продуцируемого Salmonella enterica serovar Typhi, активирует хемокины, цитокины и молекулы адгезии в линиях клеток макрофагов, эпителия толстой кишки и эндотелиальных клеток микрососудов мозга человека». Инфекция и иммунитет. 81 (3): 673–83. Дои:10.1128 / IAI.01043-12. ЧВК 3584882. PMID 23250951.
- ^ а б c d е ж грамм час я j k л Беддо, Трэвис; Paton, Adrienne W .; Ле Нур, Жером; Россджон, Джейми; Патон, Джеймс С. (июль 2010 г.). «Структура, биологические функции и применение токсинов AB5». Тенденции в биохимических науках. 35 (7): 411–418. Дои:10.1016 / j.tibs.2010.02.003. ЧВК 2929601. PMID 20202851.
- ^ Бхарати, К. Гангулы, Н. К. (2011). «Холерный токсин: парадигма многофункционального белка». Индийский журнал медицинских исследований. 133 (2): 179–187. ЧВК 3089049. PMID 21415492.
- ^ Millen, S. H .; Schneider, O.D .; Miller, W. E .; Monaco, J. J .; Вайс, А.А. (2013). «Пентамер коклюшного токсина B опосредует межклеточный перенос мембранных белков и липидов». PLoS ONE. 8 (9): e72885. Bibcode:2013PLoSO ... 872885M. Дои:10.1371 / journal.pone.0072885. ЧВК 3760862. PMID 24019885.
- ^ Карбонетти, Н. Х. (2010). «Токсин коклюша и токсин аденилатциклазы: ключевые факторы вирулентности Bordetella pertussis и инструменты клеточной биологии». Будущая микробиология. 5 (3): 455–469. Дои:10.2217 / fmb.09.133. ЧВК 2851156. PMID 20210554.
- ^ Guiso N. 2009.Bordetella pertussis и коклюшные вакцины. Clin. Заразить. Дис. 49:1565–1569
- ^ "1.C.72 Семейство токсинов коклюша (PTX)". TCDB. Получено 21 марта 2019.
- ^ Faruque, S.M .; Чоудхури, Нью-Йорк; Хан, Р; Hasan, M. R .; Нахар, Дж; Islam, M. J .; Ямасаки, S; Ghosh, A.N .; Наир, Г. Б .; Мешок, Д. А. (2003). «Бактериофаг, специфичный для Shigella dysenteriae типа 1, из природных вод в Бангладеш». Прикладная и экологическая микробиология. 69 (12): 7028–7031. Дои:10.1128 / AEM.69.12.7028-7031.2003. ЧВК 310026. PMID 14660345.
- ^ Бейтин, Л; Мико, А; Краузе, G; Прайс, К; Haby, S; Стидж, К; Альбрехт, Н. (2007). «Идентификация патогенных для человека штаммов Escherichia coli, продуцирующих токсин шига из пищи, путем сочетания серотипирования и молекулярного типирования генов токсина шига». Прикладная и экологическая микробиология. 73 (15): 4769–75. Дои:10.1128 / AEM.00873-07. ЧВК 1951031. PMID 17557838.
- ^ а б c Патон, AW; Патон, JC (1 февраля 2010 г.). "Цитотоксин субтилазы Escherichia coli". Токсины. 2 (2): 215–228. Дои:10.3390 / токсины2020215. ЧВК 2943149. PMID 20871837.
- ^ а б Michelacci, V .; Tozzoli, R .; Caprioli, A .; Martínez, R .; Scheutz, F .; Grande, L .; Sánchez, S .; Morabito, S .; Аллербергер, Ф. (2013). «Новый островок патогенности, несущий аллельный вариант цитотоксина Subtilase, распространен среди продуцентов токсина шига человеческого и овечьего происхождения». Клиническая микробиология и инфекции. 19 (3): E149 – E156. Дои:10.1111/1469-0691.12122. PMID 23331629.
- ^ Ван, Хуэй; Патон, Джеймс С .; Патон, Эдриенн В. (октябрь 2007 г.). «Патологические изменения у мышей, вызванные субтилазным цитотоксином, новым мощным токсином AB, который нацелен на эндоплазматический ретикулум». Журнал инфекционных болезней. 196 (7): 1093–1101. Дои:10.1086/521364. PMID 17763334.
- ^ Патон, AW; Патон, JC (1 февраля 2010 г.). "Цитотоксин субтилазы Escherichia coli". Токсины. 2 (2): 215–228. Дои:10.3390 / токсины2020215. ЧВК 2943149. PMID 20871837.
- ^ Моринага, N; Яхиро, К; Мацуура, G; Ватанабэ, М. Nomura, F; Мосс, Дж; Нода, М. (январь 2007 г.). «Две различные цитотоксические активности цитотоксина субтилазы, продуцируемого шига-токсигенной Escherichia coli». Инфекция и иммунитет. 75 (1): 488–96. Дои:10.1128 / IAI.01336-06. ЧВК 1828409. PMID 17101670.
- ^ Byres, E; Патон, AW; Патон, JC; Löfling, JC; Smith, DF; Wilce, MC; Talbot, UM; Чонг, округ Колумбия; Yu, H; Хуанг, S; Чен, X; Варки, НМ; Варки, А; Rossjohn, J; Беддо, Т. (4 декабря 2008 г.). «Включение нечеловеческого гликана опосредует восприимчивость человека к бактериальному токсину». Природа. 456 (7222): 648–52. Bibcode:2008Натура.456..648Б. Дои:10.1038 / природа07428. ЧВК 2723748. PMID 18971931.
- ^ Гуткинд, отредактированный Тореном Финкелем, Дж. Сильвио (2003). Передача сигналов и болезни человека. Хобокен, Нью-Джерси: Джон Уайли и сыновья. ISBN 0471448370.CS1 maint: дополнительный текст: список авторов (связь)
- ^ а б c d Ленсер В., Сасловски Д. (2005). «Плотный трафик бактериальных токсинов субъединицы AB5». Biochim Biophys Acta. 1746 (3): 314–21. Дои:10.1016 / j.bbamcr.2005.07.007. PMID 16153723.
- ^ Смит, Ричард Д .; Уиллетт, Роуз; Кудлык, Татьяна; Покровская, Ирина; Paton, Adrienne W .; Патон, Джеймс С .; Лупашин, Владимир В. (октябрь 2009 г.). «Комплекс COG, Rab6 и COPI определяют новый ретроградный путь торговли людьми Гольджи, который используется токсином SubAB». Трафик. 10 (10): 1502–1517. Дои:10.1111 / j.1600-0854.2009.00965.x. ЧВК 2756830. PMID 19678899.
- ^ Тетер, Кен (10 декабря 2013 г.). «Нестабильность токсина и ее роль в транслокации токсина из эндоплазматического ретикулума в цитозоль». Биомолекулы. 3 (4): 997–1029. Дои:10.3390 / biom3040997. ЧВК 4030972. PMID 24970201. (PDI)
- ^ Торп, К. М. (1 мая 2004 г.). «Токсин шига - вызывает инфекцию Escherichia coli». Клинические инфекционные болезни. 38 (9): 1298–1303. Дои:10.1086/383473. PMID 15127344.
- ^ Бэкер, JM; Кривошеин, А.В. Hamby, CV; Пиццония, Дж; Гилберт, KS; Ray, YS; Марка, H; Патон, AW; Патон, JC; Бэкер, М.В. (ноябрь 2009 г.). «Цитотоксин, нацеленный на шаперон, и лекарство, вызывающее стресс в эндоплазматическом ретикулуме, действуют синергетически, убивая раковые клетки». Неоплазия. 11 (11): 1165–73. Дои:10.1593 / neo.09878. ЧВК 2767218. PMID 19881952.
- ^ Norton, E.B .; Lawson, L.B .; Mahdi, Z .; Freytag, L.C .; Клементс, Дж. Д. (23 апреля 2012 г.). «Субъединица A термолабильного энтеротоксина Escherichia coli действует как адъювант слизистой оболочки и способствует ответам IgG2a, IgA и Th17 на вакцинные антигены». Инфекция и иммунитет. 80 (7): 2426–2435. Дои:10.1128 / IAI.00181-12. ЧВК 3416479. PMID 22526674.
- ^ Weltzin, R; Гай, Б; Томас В.Д., младший; Giannasca, PJ; Monath, TP (май 2000 г.). «Парентеральная адъювантная активность термолабильного токсина Escherichia coli и его субъединицы B для иммунизации мышей против инфекции Helicobacter pylori желудка». Инфекция и иммунитет. 68 (5): 2775–82. Дои:10.1128 / iai.68.5.2775-2782.2000. ЧВК 97487. PMID 10768972.
- ^ Лян, XP; Ламм, Мэн; Недруд, Дж. Г. (1 сентября 1988 г.). «Пероральное введение конъюгата холерный токсин-вирус Сендай усиливает иммунитет кишечника и респираторный иммунитет против вируса Сендай». Журнал иммунологии. 141 (5): 1495–501. PMID 2842395.
- ^ Маджуль, IV; Gao, L; Betzig, E; Onichtchouk, D; Буткевич, Э; Козлов, Я; Букаускас, Ф; Беннетт, М.В.; Липпинкотт-Шварц, Дж; Дуден, Р. (29 октября 2013 г.). «Быстрые структурные ответы мембранных доменов щелевых соединений на токсины AB5». Труды Национальной академии наук Соединенных Штатов Америки. 110 (44): E4125–33. Bibcode:2013ПНАС..110Е4125М. Дои:10.1073 / pnas.1315850110. ЧВК 3816413. PMID 24133139.
- ^ Börner, S; Schwede, F; Шлипп, А; Бериша, Ф; Калебиро, Д; Lohse, MJ; Николаев, В.О. (апр 2011). «Измерения FRET внутриклеточных концентраций цАМФ и проницаемости аналога цАМФ в интактных клетках». Протоколы природы. 6 (4): 427–38. Дои:10.1038 / нпрот.2010.198. PMID 21412271.
внешняя ссылка
- Бактериальные токсины AB5
- Хелд, Пол. «Введение в технологию флуоресцентного резонансного переноса энергии (FRET) и ее применение в биологических науках». BioTek Instruments, Inc.

