Наследственная спастическая параплегия - Hereditary spastic paraplegia
| Наследственная спастическая параплегия | |
|---|---|
| Специальность | Неврология |
Наследственная спастическая параплегия (HSP) - группа наследственных заболеваний, основной особенностью которых является прогрессирующее нарушение походки. Заболевание проявляется прогрессирующей жесткостью (спастичность ) и сокращение в нижних конечностях.[1] HSP также известен как наследственный спастический парапарез, семейная спастическая параплегия, болезнь французского поселения, болезнь Стрампелла или болезнь Стрампелла-Лоррена. Симптомы являются результатом дисфункции длительного аксоны в спинной мозг. Пораженные клетки являются первичными двигательные нейроны; следовательно, болезнь - это верхний двигательный нейрон болезнь.[2] HSP не является формой церебральный паралич даже если физически он может выглядеть и вести себя так же, как спастическая диплегия. Происхождение HSP отличается от церебрального паралича. Несмотря на это, некоторые из тех же препаратов против спастичности, используемых при спастический церебральный паралич иногда используются для лечения симптомов HSP.
HSP вызывается дефектами транспорта белков, структурных белков, белков, поддерживающих клетку, липидов и других веществ через клетку. Поражаются длинные нервные волокна (аксоны), потому что большие расстояния делают нервные клетки особенно чувствительными к дефектам упомянутых механизмов.[3][4]
Заболевание впервые было описано в 1880 году немецким неврологом. Адольф Струмпелл.[5] Более подробно он был описан в 1888 году французским врачом Морисом Лорреном.[6] Благодаря их вкладу в описание болезни, во франкоязычных странах ее до сих пор называют болезнью Штрюмпеля-Лоррена. Период, термин наследственная спастическая параплегия был придуман Анита Хардинг в 1983 г.[7]
Признаки и симптомы
Симптомы зависят от типа унаследованного HSP. Основная особенность заболевания - прогрессирующая. спастичность в нижних конечностях из-за пирамидный тракт дисфункция. Это также приводит к оживленным рефлексам, подошвенным разгибателям, мышечной слабости и различным нарушениям мочевого пузыря. Кроме того, к основным симптомам HSP также относятся аномальная походка и трудности при ходьбе, снижение чувствительности к вибрации в лодыжках и парестезия.[8]Люди с HSP могут испытывать крайнюю усталость, связанную с центральной нервной системой и нервно-мышечными расстройствами, которые могут приводить к инвалидности.[9][10][11] Первоначальные симптомы обычно включают трудности с равновесием, ушибание пальца ноги или спотыкание. Симптомы HSP могут появиться в любом возрасте, от младенчества до старше 60 лет. Если симптомы появляются в подростковом возрасте или позже, то спастическое нарушение походки обычно прогрессирует в течение многих лет. Со временем могут потребоваться трости, ходунки и инвалидные коляски, хотя некоторым людям не требуются вспомогательные приспособления.[12] Инвалидность описывается как более быстрое прогрессирование у взрослых форм.[13]
В частности, у пациентов с аутосомно-доминантной чистой формой HSP обнаруживаются нормальные движения лица и глазного яблока. Несмотря на то что рывок челюсти может быть оживленным у пожилых людей, нет нарушений речи или затруднения глотания. Мышечный тонус и сила верхних конечностей в норме. В нижних конечностях мышечный тонус повышен в подколенных сухожилиях, четырехглавой мышце и лодыжках. Слабость наиболее заметна на подвздошно-поясничная, передняя большеберцовая мышца, и в меньшей степени подколенное сухожилие мышцы.[13]При сложной форме расстройства присутствуют дополнительные симптомы. К ним относятся: периферийные невропатия, амиотрофия, атаксия, Интеллектуальная недееспособность, ихтиоз, эпилепсия, оптика невропатия, слабоумие, глухота, или проблемы с речью, глотанием или дыханием.[14]
Анита Хардинг[7] классифицировал HSP в чистом и сложном виде. Pure HSP представляет спастичность в нижних конечностях, связанных с нейрогенное нарушение мочевого пузыря а также отсутствие вибро чувствительности (паллигипестезия ). С другой стороны, HSP классифицируется как комплексный, когда спастичность нижних конечностей сочетается с любыми дополнительными неврологическими симптомами.
Эта классификация является субъективной, и у пациентов со сложными HSP иногда диагностируется мозжечковая атаксия со спастичностью, умственной отсталостью (со спастичностью) или лейкодистрофия.[7] Некоторые из перечисленных ниже генов были описаны ранее при других заболеваниях, кроме HSP. Таким образом, некоторые ключевые гены перекрываются с другими группами болезней.
Возраст начала
В прошлом HSP классифицировали как раннее начало в раннем детстве или более позднее начало в зрелом возрасте. Возраст начала имеет две максимальные отметки в возрасте 2 лет и около 40 лет.[15] Новые результаты показывают, что более раннее начало ведет к более длительной продолжительности заболевания без потери возможности передвигаться или необходимости использования инвалидной коляски.[15] Это также было описано ранее, что более поздние формы проявления развиваются быстрее.[13]
Причина
HSP - это группа генетических нарушений. Это следует за общим наследование правила и могут быть унаследованы в аутосомно-доминантный, аутосомно-рецессивный или же Х-сцепленный рецессивный манера. Участвующий способ наследования имеет прямое влияние на шансы унаследовать заболевание. Было описано более 70 генотипов, и более 50 генетических локусов были связаны с этим заболеванием.[16] Было идентифицировано десять генов с аутосомно-доминантным наследованием. На один из них, SPG4, приходится ~ 50% всех генетически решенных случаев, или примерно 25% всех случаев HSP.[15] Известно, что двенадцать генов наследуются по аутосомно-рецессивному типу. В совокупности на эту последнюю группу приходится ~ 1/3 случаев.[нужна цитата ]
Большинство измененных генов имеют известную функцию, но для некоторых функция еще не идентифицирована. Все они перечислены в списке генов ниже, включая способ наследования. Некоторые примеры спастин (SPG4) и параплегин (SPG7) обе являются АТФазами AAA.[17]
Генотипы
Обозначены гены САУ (Ген спастической походки). Расположение генов в формате: хромосома - плечо (короткое или п: long или q) - номер полосы. Эти обозначения предназначены только для генов человека. Расположение может (и, вероятно, будет) варьироваться у других организмов. Несмотря на количество генов, которые, как известно, вовлечены в это состояние, ~ 40% случаев еще не идентифицированы.[18] В таблице ниже САУ? используется для обозначения гена, который был связан с HSP, но еще не получил официального обозначения гена HSP.
| Генотип | OMIM | Символ гена | Генный локус | Наследование | Возраст начала | Другие названия и характеристики |
|---|---|---|---|---|---|---|
| SPG1 | 303350 | L1CAM | Xq28 | Х-сцепленный рецессивный | Рано | Синдром MASA |
| SPG2 | 312920 | PLP1 | Xq22.2 | Х-сцепленный рецессивный | Переменная | Болезнь Пелицея-Мерцбахера |
| SPG3A | 182600 | ATL1 | 14q22.1 | Аутосомно-доминантный | Рано | Болезнь Штрампелла (эта Wiki) |
| SPG4 | 182601 | СПАСТ | 2п22.3 | Аутосомно-доминантный | Переменная | |
| СПГ5А | 270800 | CYP7B1 | 8q12.3 | Аутосомно-рецессивный | Переменная | |
| SPG6 | 600363 | NIPA1 | 15q11.2 | Аутосомно-доминантный | Переменная | |
| SPG7 | 607259 | SPG7 | 16q24.3 | Аутосомно-доминантный | Переменная | |
| SPG8 | 603563 | KIAA0196 | 8q24.13 | Аутосомно-доминантный | Взрослый | |
| SPG9A | 601162 | ALDH18A1 | 10q24.1 | Аутосомно-доминантный | Подростковый | Катаракта с двигательной нейронопатией, низким ростом и аномалиями скелета |
| СПГ9Б | 616586 | ALDH18A1 | 10q24.1 | Аутосомно-рецессивный | Рано | |
| SPG10 | 604187 | KIF5A | 12q13.3 | Аутосомно-доминантный | Рано | |
| SPG11 | 604360 | SPG11 | 15q21.1 | Аутосомно-рецессивный | Переменная | |
| SPG12 | 604805 | RTN2 | 19q13.32 | Аутосомно-доминантный | Рано | |
| SPG13 | 605280 | HSP60 | 2q33.1 | Аутосомно-доминантный | Переменная | |
| SPG14 | 605229 | ? | 3q27 – q28 | Аутосомно-рецессивный | Взрослый | |
| SPG15 | 270700 | ZFYVE26 | 14q24.1 | Аутосомно-рецессивный | Рано | |
| SPG16 | 300266 | ? | Xq11.2 | Х-сцепленный рецессивный | Рано | |
| SPG17 | 270685 | BSCL2 | 11q12.3 | Аутосомно-доминантный | Подростковый | |
| SPG18 | 611225 | ERLIN2 | 8p11.23 | Аутосомно-рецессивный | Рано | |
| SPG19 | 607152 | ? | 9q | Аутосомно-доминантный | Начало у взрослых | |
| SPG20 | 275900 | SPG20 | 13q13.3 | Аутосомно-рецессивный | Раннее начало | Синдром Тройера |
| SPG21 | 248900 | ACP33 | 15q22.31 | Аутосомно-рецессивный | Раннее начало | МАСТ-синдром |
| SPG22 | 300523 | SLC16A2 | Xq13.2 | Х-сцепленный рецессивный | Раннее начало | Синдром Аллана-Херндона-Дадли |
| SPG23 | 270750 | РИПК5 | 1q32.1 | Аутосомно-рецессивный | Раннее начало | Синдром Лизона |
| SPG24 | 607584 | ? | 13q14 | Аутосомно-рецессивный | Раннее начало | |
| SPG25 | 608220 | ? | 6q23 – q24.1 | Аутосомно-рецессивный | Взрослый | |
| SPG26 | 609195 | B4GALNT1 | 12q13.3 | Аутосомно-рецессивный | Раннее начало | |
| SPG27 | 609041 | ? | 10q22.1 – q24.1 | Аутосомно-рецессивный | Переменная | |
| SPG28 | 609340 | DDHD1 | 14q22.1 | Аутосомно-рецессивный | Раннее начало | |
| SPG29 | 609727 | ? | 1п31.1 – п21.1 | Аутосомно-доминантный | Подростковый | |
| SPG30 | 610357 | KIF1A | 2q37.3 | Аутосомно-рецессивный | Подростковый | |
| SPG31 | 610250 | REEP1 | 2п11.2 | Аутосомно-доминантный | Раннее начало | |
| SPG32 | 611252 | ? | 14q12 – q21 | Аутосомно-рецессивный | Детство | |
| SPG33 | 610244 | ZFYVE27 | 10q24.2 | Аутосомно-доминантный | Взрослый | |
| SPG34 | 300750 | ? | Xq24 – q25 | Х-сцепленный рецессивный | Подростковый / Взрослый | |
| SPG35 | 612319 | FA2H | 16q23.1 | Аутосомно-рецессивный | Детство | |
| SPG36 | 613096 | ? | 12q23 – q24 | Аутосомно-доминантный | Подростковый / Взрослый | |
| SPG37 | 611945 | ? | 8p21.1 – q13.3 | Аутосомно-доминантный | Переменная | |
| SPG38 | 612335 | ? | 4p16 – p15 | Аутосомно-доминантный | Подростковый / Взрослый | |
| SPG39 | 612020 | PNPLA6 | 19p13.2 | Аутосомно-рецессивный | Детство | |
| SPG41 | 613364 | ? | 11п14.1 – п11.2 | Аутосомно-доминантный | Подростковый возраст | |
| SPG42 | 612539 | SLC33A1 | 3q25.31 | Аутосомно-доминантный | Переменная | |
| SPG43 | 615043 | C19orf12 | 19q12 | Аутосомно-рецессивный | Детство | |
| SPG44 | 613206 | GJC2 | 1q42.13 | Аутосомно-рецессивный | Детство / юность | |
| SPG45 | 613162 | NT5C2 | 10q24.32 – q24.33 | Аутосомно-рецессивный | Младенчество | |
| SPG46 | 614409 | GBA2 | 9п13.3 | Аутосомно-рецессивный | Переменная | |
| SPG47 | 614066 | AP4B1 | 1п13.2 | Аутосомно-рецессивный | Детство | |
| SPG48 | 613647 | AP5Z1 | 7p22.1 | Аутосомно-рецессивный | 6-е десятилетие | |
| SPG49 | 615041 | TECPR2 | 14q32.31 | Аутосомно-рецессивный | Младенчество | |
| SPG50 | 612936 | AP4M1 | 7q22.1 | Аутосомно-рецессивный | Младенчество | |
| SPG51 | 613744 | AP4E1 | 15q21.2 | Аутосомно-рецессивный | Младенчество | |
| SPG52 | 614067 | AP4S1 | 14q12 | Аутосомно-рецессивный | Младенчество | |
| SPG53 | 614898 | VPS37A | 8p22 | Аутосомно-рецессивный | Детство | |
| SPG54 | 615033 | DDHD2 | 8p11.23 | Аутосомно-рецессивный | Детство | |
| SPG55 | 615035 | C12orf65 | 12q24.31 | Аутосомно-рецессивный | Детство | |
| SPG56 | 615030 | CYP2U1 | 4q25 | Аутосомно-рецессивный | Детство | |
| SPG57 | 615658 | TFG | 3q12.2 | Аутосомно-рецессивный | Рано | |
| SPG58 | 611302 | KIF1C | 17p13.2 | Аутосомно-рецессивный | В течение первых двух десятилетий | Спастическая атаксия 2 |
| SPG59 | 603158 | USP8 | 15q21.2 | ?Аутосомно-рецессивный | Детство | |
| SPG60 | 612167 | WDR48 | 3p22.2 | ?Аутосомно-рецессивный | Младенчество | |
| SPG61 | 615685 | ARL6IP1 | 16п12.3 | Аутосомно-рецессивный | Младенчество | |
| SPG62 | 615681 | ERLIN1 | 10q24.31 | Аутосомно-рецессивный | Детство | |
| SPG63 | 615686 | AMPD2 | 1п13.3 | Аутосомно-рецессивный | Младенчество | |
| SPG64 | 615683 | ENTPD1 | 10q24.1 | Аутосомно-рецессивный | Детство | |
| SPG66 | 610009 | ARSI | 5q32 | ? Аутосомно-доминантный | Младенчество | |
| SPG67 | 615802 | PGAP1 | 2q33.1 | Аутосомно-рецессивный | Младенчество | |
| SPG68 | 609541 | KLC2 | 11q13.1 | Аутосомно-рецессивный | Детство | Синдром SPOAN |
| SPG69 | 609275 | RAB3GAP2 | 1q41 | Аутосомно-рецессивный | Младенчество | Синдром Марцольфа, Микросиндром Варбурга |
| SPG70 | 156560 | МАРС | 12q13 | ? Аутосомно-доминантный | Младенчество | |
| SPG71 | 615635 | ZFR | 5п13.3 | ?Аутосомно-рецессивный | Детство | |
| SPG72 | 615625 | REEP2 | 5q31 | Аутосомно-рецессивный; аутосомно-доминантный | Младенчество | |
| SPG73 | 616282 | CPT1C | 19q13.33 | Аутосомно-доминантный | Взрослый | |
| SPG74 | 616451 | IBA57 | 1q42.13 | Аутосомно-рецессивный | Детство | |
| SPG75 | 616680 | МАГ | 19q13.12 | Аутосомно-рецессивный | Детство | |
| SPG76 | 616907 | CAPN1 | 11q13 | Аутосомно-рецессивный | Взрослый | |
| SPG77 | 617046 | FARS2 | 6п25 | Аутосомно-рецессивный | Детство | |
| SPG78 | 617225 | ATP13A2 | 1п36 | Аутосомно-рецессивный | Взрослый | Синдром Куфора – Ракеба |
| SPG79 | 615491 | УЧЛ1 | 4п13 | Аутосомно-рецессивный | Детство | |
| HSNSP | 256840 | CCT5 | 5п15.2 | Аутосомно-рецессивный | Детство | Наследственная сенсорная нейропатия со спастической параплегией |
| САУ? | SERAC1 | 6q25.3 | Несовершеннолетний | Синдром MEGDEL | ||
| САУ? | 605739 | KY | 3q22.2 | Аутосомно-рецессивный | Младенчество | |
| САУ? | PLA2G6 | 22q13.1 | Аутосомно-рецессивный | Детство | ||
| САУ? | ATAD3A | 1п36.33 | Аутосомно-доминантный | Детство | Синдром Хареля-Юна | |
| САУ? | KCNA2 | 1п13.3 | Аутосомно-доминантный | Детство | ||
| САУ? | Гранулин | 17q21.31 | ||||
| САУ? | POLR3A | 10q22.3 | Аутосомно-рецессивный |
Патофизиология
Основным признаком HSP является зависимая от длины дегенерация аксонов.[19] К ним относятся скрещенные и неперечеркнутые кортикоспинальные тракты к ногам и fasciculus gracilis. В спиноцеребеллярный тракт участвует в меньшей степени. Тела нейрональных клеток дегенерирующих аксонов сохранены, и нет никаких доказательств первичного демиелинизация.[16] В некоторых случаях наблюдается выпадение клеток переднего рога спинного мозга. Ганглии задних корешков, задние корешки и периферические нервы напрямую не затрагиваются.[нужна цитата ]
HSP влияет на несколько путей в двигательных нейронах. Многие гены были идентифицированы и связаны с HSP. Остается проблема точно определить ключевых игроков в каждом из затронутых путей, в основном потому, что многие гены выполняют несколько функций и участвуют более чем в одном пути (рисунок).
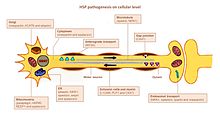
Аксонный поиск пути
Поиск пути важен для роста аксона в нужное место (например, в другую нервную клетку или мышцу). Важным для этого механизма является ген L1CAM, гликопротеин клеточной поверхности суперсемейства иммуноглобулинов. Мутации, ведущие к потере функции в L1CAM, также обнаруживаются при других Х-сцепленных синдромах. Все эти расстройства демонстрируют поражение кортикоспинального тракта (отличительный признак HSP). L1CAM участвует в наборе взаимодействий, связывая другие молекулы L1CAM, а также молекулы адгезии внеклеточных клеток, интегрины и протеогликаны или внутриклеточные белки, такие как анкирины.[нужна цитата ]
Дефект поиска пути возникает из-за ассоциации L1CAM с нейропилин-1. Нейропилин-1 взаимодействует с белками плексин-А с образованием Семафорин-3А рецепторный комплекс. Затем семафорин-a3A высвобождается в вентральном отделе спинного мозга, чтобы отвести кортикоспинальные нейроны от срединного соединения спинного мозга / костного мозга. Если L1CAM не работает правильно из-за мутации, кортиокоспинальные нейроны не направляются в правильное положение, и возникает нарушение.[3]
Липидный обмен
Аксоны в центральной и периферической нервной системе покрыты изоляцией, слоем миелина, для увеличения скорости распространения потенциала действия. Аномальная миелинизация в ЦНС обнаруживается при некоторых формах HSP HSP.[20] Несколько генов были связаны с мальформацией миелина, а именно PLP1, GFC2 и FA2H.[3] Мутации изменяют состав, толщину и целостность миелина.[нужна цитата ]
Эндоплазматический ретикулум (ЭР) является главной органеллой для синтеза липидов. Мутации в генах, кодирующих белки, которые играют роль в формировании морфологии ER и метаболизма липидов, были связаны с HSP. Мутации в ATL1, BSCL2 и ERLIN2 изменяют структуру ER, особенно трубчатую сеть и образование трехсторонних соединений в канальцах ER. Многие мутировавшие гены связаны с аномальным метаболизмом липидов. Чаще всего действует на арахидоновую кислоту (CYP2U1 ) и холестерин (CYP7B1 ) метаболизм, активность фосфолипазы (DDHD1 и DDHD2), образование ганглиозидов (Б4ГАЛНТ-1 ) и баланс между углеводным и жировым обменом (SLV33A1).[3][21][20]
Эндосомный трафик
Нейроны поглощают вещества из окружающей среды путем эндоцитоза. Эндоцитарные везикулы сливаются с эндосомами, чтобы высвободить их содержимое. Транспортировка эндосом осуществляется тремя основными компартментами: Гольджи в / из эндосом; плазматическая мембрана в / из ранних эндосом (через рециклинг эндосом) и поздних эндосом в лизосомы. Как сообщается в HSP, дисфункция эндосомного транспорта может иметь серьезные последствия для мотонейронов с длинными аксонами. Мутации в AP4B1 и KIAA0415 связаны с нарушением образования везикул и мембранного транспорта, включая избирательное поглощение белков везикулами. Оба гена кодируют белки, которые взаимодействуют с несколькими другими белками и нарушают секреторные и эндоцитарные пути.[20]
Митохондриальная функция
Дисфункции митохондрий связаны с неврологическими нарушениями развития и дегенеративными нарушениями. Только несколько генов HSP кодируют митохондриальные белки. Два митохондриальных резидентных белка мутировали в HSP: параплегин и шаперонин 60. Параплегин представляет собой металлопротеиназу m-AAA внутренней митохондриальной мембраны. Он участвует в сборке рибосом и контроле качества белка. Нарушение активности шаперонина 60 приводит к нарушению контроля качества митохондрий. Два гена DDHD1 и CYP2U1 показали изменение митохондриальной архитектуры в фибробластах пациентов. Эти гены кодируют ферменты, участвующие в метаболизме жирных кислот.[нужна цитата ]
Диагностика
Первоначальный диагноз СЧЛ зависит от семейного анамнеза, наличия или отсутствия дополнительных признаков и исключения других негенетических причин спастичности, причем последние особенно важны в единичных случаях.[7]
Церебральный и спинной МРТ это важная процедура, выполняемая для исключения других частых неврологических состояний, таких как рассеянный склероз, но также для выявления связанных аномалий, таких как мозжечок или мозолистое тело атрофия, а также белое вещество аномалии. Дифференциальная диагностика HSP следует также исключить спастическая диплегия который проявляет почти идентичные повседневные эффекты и даже лечится аналогичными лекарствами, такими как баклофен и ортопедическая хирургия; время от времени эти два состояния могут выглядеть и ощущаться настолько похожими, что единственный воспринимается различие может заключаться в наследственной природе HSP и явно ненаследственной природе спастической диплегии (однако, в отличие от спастической диплегии и других форм спастический церебральный паралич, HSP нельзя надежно лечить селективная дорсальная ризотомия ).
Окончательное подтверждение диагноза HSP может быть получено только путем проведения генетические тесты нацелены на известные генетические мутации.
Классификация
Наследственные спастические параплегии можно классифицировать на основе симптомов; режим наследования; возраст пациента в начале заболевания; пораженные гены; и задействованные биохимические пути.
Уход
Неизвестно ни одно конкретное лечение, которое могло бы предотвратить, замедлить или обратить вспять HSP. Доступные методы лечения в основном состоят из симптоматического лечения и улучшения физического и эмоционального благополучия. Терапия, предлагаемая пациентам с HSP, включает:
- Баклофен - произвольный миорелаксант для расслабления мышц и снижения тонуса. Это можно вводить перорально или интратекально. (Исследования в HSP [22][23][24])
- Тизанидин - для лечения ночного или прерывистого судороги (доступны исследования [25][26])
- Диазепам и клоназепам - для уменьшения интенсивности спазмов
- Оксибутинин хлорид - непроизвольный миорелаксант и спазмолитик, используемый для уменьшения спастичности мочевого пузыря у пациентов с проблемами контроля над мочевым пузырем
- Толтеродин тартрат - непроизвольный миорелаксант и спазмолитик, используемый для уменьшения спастичности мочевого пузыря у пациентов с проблемами контроля над мочевым пузырем
- Система Cro - для уменьшения мышечной гиперактивности (существующие исследования спастичности [27][28][29])
- Ботулинический токсин - для уменьшения мышечной гиперактивности (существующие исследования для пациентов с HSP[30][31])
- Антидепрессанты (например, селективные ингибиторы обратного захвата серотонина, трициклические антидепрессанты и ингибиторы моноаминоксидазы) - для пациентов, страдающих клинической депрессией
- Физиотерапия - восстановить и сохранить способность двигаться; для снижения мышечного тонуса; для поддержания или улучшения диапазона движений и подвижности; для увеличения силы и координации; для предотвращения таких осложнений, как замороженные суставы, контрактуры или пролежни.
Прогноз
Хотя HSP является прогрессирующим заболеванием, прогноз для людей с HSP сильно различается. В первую очередь это поражает ноги, хотя у некоторых людей может быть поражение верхней части тела. В одних случаях это приводит к серьезной инвалидности, в то время как в других - меньше, и они совместимы с продуктивной и полноценной жизнью. Большинство людей с HSP имеют нормальное продолжительность жизни.[14]
Эпидемиология
По оценкам, во всем мире распространенность всех наследственных спастических параплегий составляет от 2 до 6 на 100 000 человек.[32] А норвежский язык исследование более 2,5 миллионов человек, опубликованное в марте 2009 года, показало, что показатель распространенности HSP составляет 7,4 на 100 000 населения - более высокий показатель, но в том же диапазоне, что и в предыдущих исследованиях. Никаких различий в частоте, связанных с полом, обнаружено не было, средний возраст начала заболевания составлял 24 года.[33] в Соединенные Штаты, Наследственная спастическая параплегия занесена в список «редких заболеваний» Управлением по редким заболеваниям (ORD) Национальные институты здоровья Это означает, что этим расстройством страдают менее 200 000 человек среди населения США.[32]
Рекомендации
- ^ Финк, Джон К. (2003-08-01). «Наследственные спастические параплегии: девять генов и их количество». Архив неврологии. 60 (8): 1045–1049. Дои:10.1001 / archneur.60.8.1045. ISSN 0003-9942. PMID 12925358.
- ^ Депьен, Кристель; Стеванин, Джованни; Брайс, Алексис; Дурр, Александра (01.12.2007). «Наследственные спастические параплегии: обновленная информация». Текущее мнение в неврологии. 20 (6): 674–680. Дои:10.1097 / WCO.0b013e3282f190ba. ISSN 1350-7540. PMID 17992088. S2CID 35343501.
- ^ а б c d Блэкстоун, Крейг (21 июля 2012 г.). «Клеточные пути наследственной спастической параплегии». Ежегодный обзор нейробиологии. 35 (1): 25–47. Дои:10.1146 / annurev-neuro-062111-150400. ЧВК 5584684. PMID 22540978.
- ^ Де Маттеис, Мария Антониетта; Луини, Альберто (2011-09-08). «Менделирующие расстройства мембранного трафика». Медицинский журнал Новой Англии. 365 (10): 927–938. Дои:10.1056 / NEJMra0910494. ISSN 1533-4406. PMID 21899453. S2CID 14772080.
- ^ Faber I, Pereira ER, Martinez AR, França M Jr, Teive HA (ноябрь 2013 г.). «Наследственная спастическая параплегия с 1880 по 2017 год: исторический обзор». Arquivos de Neuro-Psiquiatria. Бразильская академия неврологии. 75 (11): 813–818. Дои:10.1590 / 0004-282X20170160. PMID 29236826.
- ^ Лоррен, Морис. Contribution à l'étude de la paraplégie spasmodique familiale: travail de la Clinique des maladies du système nerveux à la Salpêtrière. Г. Штайнхейль, 1898 г.
- ^ а б c d Хардинг, AE (1983). «Классификация наследственных атаксий и параплегий». Ланцет. Нью-Йорк: Ланцет. 1 (8334): 1151–5. Дои:10.1016 / с0140-6736 (83) 92879-9. PMID 6133167. S2CID 6780732.
- ^ МакЭндрю CR, Хармс П. (2003). «Парестезии во время комбинированной спинальной эпидуральной анестезии с введением иглы через иглу по сравнению с однократным спинальным введением при плановом кесаревом сечении». Анестезия и интенсивная терапия. 31 (5): 514–517. Дои:10.1177 / 0310057X0303100504. PMID 14601273.
- ^ Fjermestad, Krister W .; Kanavin, Øivind J .; Næss, Eva E .; Hoxmark, Lise B .; Хуммельволл, Грете (13.07.2016). «Обследование здоровья взрослых с наследственным спастическим парапарезом по сравнению с контрольной группой населения». Журнал редких заболеваний Orphanet. 11 (1): 98. Дои:10.1186 / s13023-016-0469-0. ISSN 1750-1172. ЧВК 4944497. PMID 27412159.
- ^ Чаудхури, Абхиджит; Бехан, Питер О. (2004-03-20). «Утомляемость при неврологических расстройствах». Ланцет. 363 (9413): 978–988. Дои:10.1016 / S0140-6736 (04) 15794-2. ISSN 1474-547X. PMID 15043967. S2CID 40500803.
- ^ «Наследственная спастическая параплегия». nhs.uk. 2017-10-18. Получено 2018-01-28.
- ^ Финк Дж. К. (2003). «Наследственные спастические параплегии». Архив неврологии. 60 (8): 1045–1049. Дои:10.1001 / archneur.60.8.1045. PMID 12925358.
- ^ а б c Хардинг А.Е. (1981). «Наследственная« чистая »спастическая параплегия: клинико-генетическое исследование 22 семей». Журнал неврологии, нейрохирургии и психиатрии. 44 (10): 871–883. Дои:10.1136 / jnnp.44.10.871. ЧВК 491171. PMID 7310405.
- ^ а б Депьенн С., Стеванин Г., Брайс А., Дурр А. (2007). «Наследственная спастическая параплегия: обновление». Текущее мнение в неврологии. 20 (6): 674–680. Дои:10.1097 / WCO.0b013e3282f190ba. PMID 17992088. S2CID 35343501.
- ^ а б c Шюле, Ребекка; Витхофф, Сара; Мартус, Петр; Karle, Kathrin N .; Отто, Сюзанна; Клебе, Стефан; Климпе, Свен; Галленмюллер, Констанце; Курцвелли, Делия (2016-04-01). «Наследственная спастическая параплегия: клинико-генетические уроки 608 пациентов». Анналы неврологии. 79 (4): 646–658. Дои:10.1002 / ana.24611. ISSN 1531-8249. PMID 26856398. S2CID 10558032.
- ^ а б Schüle R, Schöls L (2011) Генетика наследственных спастических параплегий. Семин Нейрол 31 (5): 484-493
- ^ Wang YG, Shen L (2009) АТФазы AAA и наследственная спастическая параплегия. Чжунхуа И Сюэ И Чуань Сюэ За Чжи 26 (3): 298-301
- ^ Helbig KL, Hedrich UB, Shinde DN, Krey I, Teichmann AC, Hentschel J, Schubert J, Chamberlin AC, Huether R, Lu HM4, Alcaraz WA, Tang S, Jungbluth C, Dugan SL, Vainionpää L, Karle KN, Synofzik M , Schöls L, Schüle R, Lehesjoki AE, Helbig I, Lerche H, Lemke JR (2016) Повторяющаяся мутация в KCNA2 как новая причина наследственной спастической параплегии и атаксии. Энн Нейрол 80 (4)
- ^ Wharton SB, McDermott CJ, Gierson AJ, Wood JD, Gelsthorpe C, Ince PG, Shaw PJ (2003) Клеточная и молекулярная патология двигательной системы при наследственном спастическом парапарезе из-за мутации гена спастина. J Neuropathol Exp Neurol 62: 1166–1177
- ^ а б c Норо, А., Дион, П.А. & Rouleau, G.A., 2014. Молекулярные аспекты наследственной спастической параплегии. Experimental Cell Research, 325 (1), стр.18–26.
- ^ Lo Giudice, T. et al., 2014. Наследственная спастическая параплегия: клинико-генетические характеристики и развивающиеся молекулярные механизмы. Экспериментальная неврология, 261, стр. 518–539.
- ^ Маргетис К., Корфиас С., Бутос Н., Гацонис С., Фемистоклеус М., Сиатуни А. и др. Интратекальная терапия баклофеном для симптоматического лечения наследственной спастической параплегии. Клиническая неврология и нейрохирургия. 2014; 123: 142-5.
- ^ Heetla HW, Halbertsma JP, Dekker R, Staal MJ, van Laar T. Улучшение походки у пациента с наследственной спастической параплегией после непрерывной интратекальной тестовой инфузии баклофена и последующей имплантации помпы: отчет о болезни. Архивы физической медицины и реабилитации. 2015; 96 (6): 1166-9.
- ^ Klebe S, Stolze H, Kopper F, Lorenz D, Wenzelburger R, Deuschl G и др. Объективная оценка походки после интратекального введения баклофена при наследственной спастической параплегии. Журнал неврологии. 2005; 252 (8): 991-3.
- ^ Knutsson E, Mårtensson A, Gransberg L. Антипаретические и антиспастические эффекты, вызванные тизанидином у пациентов со спастическим парезом. Журнал неврологических наук. 1982; 53 (2): 187-204.
- ^ Bes A, Eyssette M, Pierrot-Deseilligny E, Rohmer F, Warter JM. Многоцентровое двойное слепое исследование тизанидина, нового антиспастического средства, при спастичности, связанной с гемиплегией. Текущие медицинские исследования и мнения. 1988; 10 (10): 709-18.
- ^ Celletti C, Camerota F. Предварительные данные о влиянии фокальной мышечной вибрации на спастичность из-за церебрального паралича у небольшой выборки итальянских детей. Clin Ter. 162 (5): 125-8. 2011 г.
- ^ Caliandro P, Celletti C, Padua L, Minciotti I, Russo G, Granata G, La Torre G, Granieri E, Camerota F. Фокусная мышечная вибрация при лечении спастичности верхних конечностей: пилотное рандомизированное контролируемое исследование у пациентов с хроническим инсультом. Arch Phys Med Rehabil. 93 (9): 1656-61. 2012 г.
- ^ . Casale R1, Damiani C, Maestri R, Fundarò C, Chimento P, Foti C. Фокусированная вибрация 100 Гц улучшает функцию и снижает спастичность верхних конечностей: контролируемое двойное слепое исследование. Eur J Phys Rehabil Med. 2014 Октябрь; 50 (5): 495-504. 2014 г.
- ^ Hecht MJ, Stolze H, Auf Dem Brinke M, Giess R, Treig T, Winterholler M и др. Инъекции ботулинического нейротоксина типа А уменьшают спастичность при наследственной спастической параплегии легкой и средней степени тяжести - отчет о 19 случаях. Расстройства движения. 2008; 23 (2): 228-33.
- ^ де Ньет М., де Бот С.Т., ван де Варренбург Б.П., Вердестейн В., Геуртс А.С. Функциональные эффекты лечения ботулотоксином типа A и последующее растяжение спастических мышц голени: исследование у пациентов с наследственной спастической параплегией. Журнал восстановительной медицины. 2015; 47 (2): 147-53.
- ^ а б Национальный институт здоровья (2008 г.). «Информационная страница о наследственной спастической параплегии». Архивировано из оригинал на 2014-02-21. Получено 2008-04-30.
- ^ Эриксен, АК; Koht, J; Стрэй-Педерсен, А; Абдельнур, М; Таллаксен, CM (июнь 2009 г.). «Распространенность наследственной атаксии и спастической параплегии на юго-востоке Норвегии: популяционное исследование» (PDF). Мозг. 132 (Pt 6): 1577–88. Дои:10.1093 / мозг / awp056. PMID 19339254.
дальнейшее чтение
- GeneReviews / NCBI / NIH / UW запись о спастической параплегии 3A
- GeneReviews / NCBI / NIH / UW запись об обзоре наследственной спастической параплегии
- Уорнер, Том (январь – февраль 2007 г.). «Наследственная спастическая параплегия» (PDF). Достижения в клинической неврологии и реабилитации. 6 (6): 16–17.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
