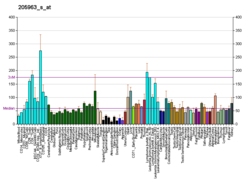
DNAJA3 - DNAJA3
DnaJ гомолог подсемейства А член 3, митохондриальный, также известный как опухолевый имагинальный диск 1 (TID1), представляет собой белок что у людей кодируется DNAJA3 ген на хромосоме 16.[5][6][7] Этот белок принадлежит ДНКJ /Hsp40 семейство белков, которые, как известно, связывают и активируют Hsp70 сопровождающий белки для выполнения фолдинга, деградации и сложной сборки белков.[6][7][8] Как митохондриальный белок, он участвует в поддержании мембранный потенциал и митохондриальная ДНК (мтДНК) целостность, а также клеточные процессы, такие как движение, рост и смерть.[6][7][9][10][11] Кроме того, это связано с широким спектром болезни, включая нейродегенеративные заболевания, воспалительные заболевания, и раки.[7][9][11][12]
Структура
Как член DNAJ /Hsp40 семейства белков DNAJA3 содержит консервативный домен DnaJ, который включает мотив HPD, который взаимодействует с Hsp70 выполнять свои кочаперон функция.[6][7][8][9][10] Домен DnaJ состоит из тетрахелевых областей, содержащих трипептид гистидина, пролина и аспарагиновой кислоты, расположенных между двумя спиралями. Кроме того, этот белок содержит богатую глицином / фенилаланином (G / F) линкерную область и центральную богатую цистеином область, похожую на цинковый палец Повторим, обе характерны для молекулярных шаперонов DnaJ типа I.[8][9][10] В митохондриальный Нацеливающая последовательность на своем N-конце направляет локализацию белка в митохондриальный матрикс.[8][9][10]
DNAJA3 имеет два альтернативно сращенный формы: длинный изоформа 43 кДа и короткая изоформа 40 кДа.[6][7][9][12] Длинная изоформа содержит дополнительно 33 остатка на своем С-конце по сравнению с короткой изоформой, и предполагается, что эта область препятствует регулированию мембранного потенциала длинной изоформой.[7]
Функция
DNAJA3 является членом семейства белков DNAJ / Hsp40, который стимулирует АТФазную активность шаперонов Hsp70 и играет важную роль в сворачивание белка, деградация, и мультипротеиновый комплекс сборка.[6][7][8] DNAJA3 локализует в митохондрии, где он взаимодействует с митохондриальным шапероном Hsp70 (mtHsp70 ) для проведения шаперонной системы.[6][7] Этот белок имеет решающее значение для поддержания однородного распределения потенциала митохондриальной мембраны и целостности мтДНК. DNAJA3 гомогенизирует мембранный потенциал посредством регуляции агрегации комплекса I, хотя механизм поддержания мтДНК остается неизвестным.[7] Эти функции затем позволяют DNAJA3 опосредовать деление митохондрий через DRP1 и, соответственно, клеточные процессы, такие как клетка движение, рост, распространение, дифференциация, старение, и апоптоз.[6][7][9][10][11] Однако, хотя обе изоформы DNAJA3 участвуют в выживании клеток, они также влияют на два противоположных результата. Проапоптотическая длинная изоформа вызывает апоптоз, стимулируя цитохром C выпуск и каспаза активация в митохондриях, тогда как антиапоптотическая короткая изоформа предотвращает высвобождение цитохрома С и, таким образом, апоптоз.[7][11] В нервно-мышечные соединения, только короткие кластеры изоформ рецепторы ацетилхолина для эффективного синаптическая передача.[7] Две изоформы также различаются по своей специфической митохондриальной локализации, что может частично объяснять их различные функции.[7][11]
До локализации в митохондриях DNAJA3 временно удерживается в цитозоле, где также может взаимодействовать с цитозольный белки и, возможно, функционируют транспорт эти белки.[8][11]
Клиническое значение
Этот белок вовлечен в несколько видов рака, в том числе рак кожи, рак молочной железы, и колоректальный рак.[12] Это ключевой игрок в подавлении опухолей благодаря взаимодействию с онкогенный белки, в том числе ErbB2 и p53 белок-супрессор опухолей.[6][8] В условиях гипоксии DNAJA3 может прямо влиять на сборку или модификацию комплекса p53 или косвенно убиквитинилировать p53 через убиквитинлигазы подобно MDM2. Более того, как p53, так и DNAJA3 должны присутствовать в митохондриях, чтобы вызвать апоптоз в клетке.[8] При плоскоклеточном раке головы и шеи (HNSCC ) рака, DNAJA3 подавляет пролиферацию клеток, рост, не зависящий от закрепления, подвижность клеток и клеточную инвазию, ослабляя EGFR и ниже по сигнальному пути, AKT.[12] Таким образом, лечение, стимулирующее экспрессию и функцию DNAJA3, может в значительной степени способствовать устранению опухолей.[8]
Кроме того, DNAJA3 участвует в нейродегенеративных заболеваниях, таких как болезнь Паркинсона в силу своей ключевой роли в сопровождении митохондриальных белков и опосредовании морфологии митохондрий в сочетании с mtHsp70.[7][9] Еще одна болезнь, псориаз, это хронический воспалительный кожное заболевание, которое возникает из-за отсутствия активности DNAJA3, которое затем приводит к активации MK5, повысился фосфорилирование из HSP27, повысился актин цитоскелет организация и гипертолщина кожи.[11]
Взаимодействия
Было показано, что DNAJA3 взаимодействовать с:
Рекомендации
- ^ а б c ENSG00000103423 GRCh38: Ensembl release 89: ENSG00000276726, ENSG00000103423 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000004069 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Шиллинг Б., Де-Медина Т., Сайкен Дж., Видал М., Мунгер К. (август 1998 г.). «Новый белок DnaJ человека, hTid-1, гомолог белка-супрессора опухоли Tid56 дрозофилы, может взаимодействовать с онкопротеином E7 вируса папилломы человека типа 16». Вирусология. 247 (1): 74–85. Дои:10.1006 / viro.1998.9220. PMID 9683573.
- ^ а б c d е ж грамм час я «Ген Entrez: ДНКJA3, гомолог DnaJ (Hsp40), подсемейство A, член 3».
- ^ а б c d е ж грамм час я j k л м п о п Ng, AC; Бэрд, SD; Скреатон, РА (апрель 2014 г.). «Важная роль TID1 в поддержании гомогенности мембранного потенциала митохондрий и целостности митохондриальной ДНК». Молекулярная и клеточная биология. 34 (8): 1427–37. Дои:10.1128 / mcb.01021-13. ЧВК 3993590. PMID 24492964.
- ^ а б c d е ж грамм час я Ан, BY; Trinh, DL; Zajchowski, LD; Ли, Б; Elwi, AN; Ким, SW (25 февраля 2010 г.). «Tid1 - новый регулятор митохондриальной транслокации р53 и апоптоза при раке». Онкоген. 29 (8): 1155–66. Дои:10.1038 / onc.2009.413. PMID 19935715.
- ^ а б c d е ж грамм час Elwi, AN; Ли, Б; Meijndert, HC; Браун, JE; Ким, SW (август 2012 г.). «Митохондриальный шаперон DnaJA3 индуцирует Drp1-зависимую фрагментацию митохондрий». Международный журнал биохимии и клеточной биологии. 44 (8): 1366–76. Дои:10.1016 / j.biocel.2012.05.004. PMID 22595283.
- ^ а б c d е ж Trinh, DL; Elwi, AN; Ким, SW (октябрь 2010 г.). «Прямое взаимодействие между белками p53 и Tid1 влияет на локализацию митохондрий p53 и апоптоз». Oncotarget. 1 (6): 396–404. Дои:10.18632 / oncotarget.100902 (неактивно 10.09.2020). ЧВК 3248115. PMID 21311096.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (связь)
- ^ а б c d е ж грамм час Чой, JH; Чой, ДК; Sohn, KC; Квак, СС; Сук, Дж; Lim, JS; Шин, я; Kim, SW; Ли, JH; Джо, Колорадо (27 июля 2012 г.). «Отсутствие человеческого белка DnaJ hTid-1S коррелирует с аберрантной организацией актинового цитоскелета в пораженной псориазом коже». Журнал биологической химии. 287 (31): 25954–63. Дои:10.1074 / jbc.m111.313809. ЧВК 3406679. PMID 22692211.
- ^ а б c d Chen, CY; Chiou, SH; Huang, CY; Ян, ДИ; Lin, SC; Ху, Вайоминг; Чжоу, SH; Лю, CJ; Ло, Дж. Ф. (ноябрь 2009 г.). «Tid1 действует как опухолевый супрессор при плоскоклеточной карциноме головы и шеи». Журнал патологии. 219 (3): 347–55. Дои:10.1002 / path.2604. PMID 19681071. S2CID 23405415.
- ^ а б Саркар С., Поллак Б. П., Лин К. Т., Котенко С. В., Кук Дж. Р., Льюис А., Пестка С. (декабрь 2001 г.). «hTid-1, белок DnaJ человека, модулирует путь передачи сигналов интерферона». J. Biol. Chem. 276 (52): 49034–42. Дои:10.1074 / jbc.M103683200. PMID 11679576.
- ^ Трентин Г.А., Инь Х, Тахир С., Лхотак С., Фарханг-Фаллах Дж., Ли Й., Розакис-Адкок М. (апрель 2001 г.). «Мышиный гомолог гена tid-супрессора опухоли дрозофилы l (2) определяет новый белок, связывающий белок, активирующий Ras GTPase (RasGAP)». J. Biol. Chem. 276 (16): 13087–95. Дои:10.1074 / jbc.M009267200. PMID 11116152.
дальнейшее чтение
- Маруяма К., Сугано С. (1994). «Олиго-кэппинг: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Ген. 138 (1–2): 171–4. Дои:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Судзуки Ю., Ёситомо-Накагава К., Маруяма К. и др. (1997). «Конструирование и характеристика полноразмерной библиотеки кДНК с обогащением по 5'-концу». Ген. 200 (1–2): 149–56. Дои:10.1016 / S0378-1119 (97) 00411-3. PMID 9373149.
- Syken J, De-Medina T, Münger K (1999). «TID1, человеческий гомолог опухолевого супрессора дрозофилы l (2) tid, кодирует два митохондриальных модулятора апоптоза с противоположными функциями». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 96 (15): 8499–504. Bibcode:1999PNAS ... 96.8499S. Дои:10.1073 / пнас.96.15.8499. ЧВК 17545. PMID 10411904.
- Шинохара М, Гасиор С.Л., Епископ Д.К., Шинохара А (2000). «Tid1 / Rdh54 способствует совместной локализации rad51 и dmc1 во время мейотической рекомбинации». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 97 (20): 10814–9. Bibcode:2000PNAS ... 9710814S. Дои:10.1073 / pnas.97.20.10814. ЧВК 27106. PMID 11005857.
- Трентин Г.А., Инь Х, Тахир С. и др. (2001). «Мышиный гомолог гена tid-супрессора опухоли дрозофилы l (2) определяет новый белок, связывающий белок, активирующий Ras GTPase (RasGAP)». J. Biol. Chem. 276 (16): 13087–95. Дои:10.1074 / jbc.M009267200. PMID 11116152.
- Оцука К., Хата М. (2001). «Гомологи HSP40 / DNAJ млекопитающих: клонирование новых кДНК и предложение по их классификации и номенклатуре». Шапероны клеточного стресса. 5 (2): 98–112. Дои:10.1379 / 1466-1268 (2000) 005 <0098: MHDHCO> 2.0.CO; 2. ISSN 1466-1268. ЧВК 312896. PMID 11147971.
- Саркар С., Поллак Б.П., Лин К.Т. и др. (2002). «hTid-1, белок DnaJ человека, модулирует путь передачи сигналов интерферона». J. Biol. Chem. 276 (52): 49034–42. Дои:10.1074 / jbc.M103683200. PMID 11679576.
- Инь X, Розакис-Адкок М (2002). «Геномная организация и экспрессия гена опухолевого имагинального диска человека (TID1)». Ген. 278 (1–2): 201–10. Дои:10.1016 / S0378-1119 (01) 00720-X. PMID 11707338.
- Ченг Х., Ченчарелли С., Шао З. и др. (2002). «Налоговые ассоциации вируса Т-клеточного лейкоза человека 1 типа с молекулярным шаперонным комплексом, содержащим hTid-1 и Hsp70». Curr. Биол. 11 (22): 1771–5. Дои:10.1016 / S0960-9822 (01) 00540-1. PMID 11719219. S2CID 17461974.
- Ченг Х., Ченчарелли С., Тао М. и др. (2002). «HTLV-1 Tax-связанный hTid-1, белок DnaJ человека, является репрессором бета-субъединицы Ikappa B киназы». J. Biol. Chem. 277 (23): 20605–10. Дои:10.1074 / jbc.M201204200. PMID 11927590.
- Ван И, Хан KJ, Пан XW и др. (2002). «Крупномасштабная идентификация антигенов, связанных с гепатоцеллюлярной карциномой человека, с помощью аутоантител». J. Immunol. 169 (2): 1102–9. Дои:10.4049 / jimmunol.169.2.1102. PMID 12097419.
- Сасаки С., Накамура Т., Аракава Х. и др. (2002). «Выделение и характеристика нового гена hRFI, предпочтительно экспрессируемого при раке пищевода». Онкоген. 21 (32): 5024–30. Дои:10.1038 / sj.onc.1205627. PMID 12118383.
- Strausberg RL, Feingold EA, Grouse LH, et al. (2003). «Создание и первоначальный анализ более 15 000 полноразмерных последовательностей кДНК человека и мыши». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 99 (26): 16899–903. Bibcode:2002ПНАС ... 9916899М. Дои:10.1073 / pnas.242603899. ЧВК 139241. PMID 12477932.
- Syken J, Macian F, Agarwal S и др. (2003). «TID1, млекопитающее, гомолог смертельного опухолевого супрессора (2) опухолевых имагинальных дисков дрозофилы, регулирует вызванную активацией гибель клеток в клетках Th2». Онкоген. 22 (30): 4636–41. Дои:10.1038 / sj.onc.1206569. PMID 12879007.
- Родригес М., Ю Икс, Чен Дж, Сунъян Зи (2004). «Специфичность связывания фосфопептида COOH-концевых (BRCT) доменов BRCA1». J. Biol. Chem. 278 (52): 52914–8. Дои:10.1074 / jbc.C300407200. PMID 14578343.
- Ота Т., Сузуки Ю., Нисикава Т. и др. (2004). «Полное секвенирование и характеристика 21 243 полноразмерных кДНК человека». Nat. Genet. 36 (1): 40–5. Дои:10,1038 / ng1285. PMID 14702039.
- Ло Дж. Ф., Хаяши М., Ву-Ким С. и др. (2004). «Tid1, коаперон белка теплового шока 70 и аналог опухолевого супрессора дрозофилы l (2) tid у млекопитающих, имеет решающее значение для раннего эмбрионального развития и выживания клеток». Мол. Клетка. Биол. 24 (6): 2226–36. Дои:10.1128 / MCB.24.6.2226-2236.2004. ЧВК 355836. PMID 14993262.
- Эдвардс К.М., Мюнгер К. (2004). «Истощение физиологических уровней белка TID1 человека делает линии раковых клеток устойчивыми к апоптозу, опосредованному множественными экзогенными стимулами». Онкоген. 23 (52): 8419–31. Дои:10.1038 / sj.onc.1207732. PMID 15156195.
- Колланд Ф., Жак Х, Труплин В. и др. (2004). «Функциональное протеомное картирование сигнального пути человека». Genome Res. 14 (7): 1324–32. Дои:10.1101 / гр. 2334104. ЧВК 442148. PMID 15231748.