Нейрогеномика - Neurogenomics
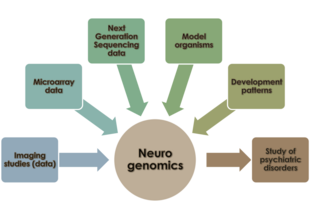
Нейрогеномика это исследование того, как геном организма влияет на развитие и функции его нервной системы.[1] Это поле намерено объединить функциональная геномика и нейробиология чтобы понять нервную систему в целом с геномной точки зрения.
Нервная система позвоночных состоит из двух основных типов клеток: нейроглиальные клетки и нейроны. У людей существуют сотни различных типов нейронов с различными функциями - некоторые из них обрабатывают внешние раздражители; другие вызывают реакцию на раздражители; другие организуются в централизованные структуры (мозг, спинномозговые ганглии ), которые отвечают за познание, восприятие и регуляцию двигательных функций. Нейроны в этих централизованных местах имеют тенденцию организовываться в гигантские сети и активно взаимодействовать друг с другом. До появления массивы выражений и Методики секвенирования ДНК, исследователи стремились понять клеточное поведение нейронов (включая образование синапсов развитие и регионализация нейронов в нервной системе человека) с точки зрения лежащих в основе молекулярной биологии и биохимии, без какого-либо понимания влияния генома нейрона на его развитие и поведение. По мере того как наше понимание генома расширилось, роль сетей взаимодействия генов в поддержании функции и поведения нейронов вызвала интерес к нейробиология исследовательское сообщество. Нейрогеномика позволяет ученым изучать нервную систему организмов в контексте этих основных регуляторных и транскрипционных сетей. Этот подход отличается от нейрогенетика, который подчеркивает роль отдельных генов без контекста сетевого взаимодействия при изучении нервной системы.[2]
Подходы
Появление высокопроизводительной биологии
В 1999 году Cirelli & Tononi[3] впервые сообщили об ассоциации геномного анализа экспрессии генов мозга (с использованием микрочипы ) с поведенческим фенотипом у мышей. С тех пор глобальные данные об экспрессии генов мозга, полученные из микрочипов, были согласованы с различными локусами количественных поведенческих признаков (QTL) и опубликованы в нескольких публикациях.[4][5][6] Однако подходы на основе микрочипов имеют свои собственные проблемы, которые затрудняют анализ - насыщение зонда может привести к очень небольшой измеримой вариации экспрессии генов между генетически уникальными индивидуумами,[7] а наличие однонуклеотидных полиморфизмов (SNP) может привести к артефактам гибридизации.[8][9] Кроме того, микроматрицы могут пропускать многие типы транскриптов (нкРНК, миРНК, и мРНК изоформы ). Зонды также могут иметь видоспецифичную аффинность связывания, которая может затруднить сравнительный анализ.
Примечательно, что связь между поведенческими моделями и высоким пенетрантность Один генные локусы подпадает под компетенцию нейрогенетика исследование, в котором основное внимание уделяется выявлению простой причинной связи между одним геном с высокой пенетрантностью и наблюдаемой функцией / поведением. Однако было показано, что некоторые неврологические заболевания имеют тенденцию к полигенный, находясь под влиянием множества разных гены и регулирующие регионы вместо одного только гена. Таким образом, произошел переход от подходов с использованием одного гена к сетевым подходам к изучению неврологического развития и заболеваний, сдвиг, который во многом был вызван появлением секвенирование следующего поколения методологии.
Подходы к секвенированию следующего поколения
Исследования близнецов показали, что шизофрения,[10] биполярное расстройство,[11] расстройство аутистического спектра (ASD),[12][13] и Синдром дефицита внимания и гиперактивности[14] (СДВГ) очень наследственные, генетически сложные психические расстройства. Однако исследования сцепления в значительной степени не смогли определить причинные варианты таких психических расстройств, в первую очередь из-за их сложной генетической архитектуры. Множественная низкая пенетрантность варианты риска могут быть агрегированы у пораженных людей и семей, а наборы причинных вариантов могут варьироваться в зависимости от семьи. Исследования в этом направлении определили полигенный основа для нескольких психические расстройства.[15] Несколько независимо возникающих de novo мутации у пациентов Болезнь Альцгеймера например, было обнаружено, что они нарушают общий набор функциональных путей, участвующих в передаче сигналов нейронов.[16] Таким образом, поиску понимания причинной биологии психических расстройств в значительной степени способствует способность беспристрастно анализировать полные геномы затронутых и незатронутых людей.[17]
При наличии массово параллельных секвенирование следующего поколения методологии, ученые смогли выйти за рамки захвата экспрессируемых генов на основе зондов. РНК-последовательность, например, выявляет на 25-60% больше экспрессируемых генов, чем микроматрицы. В будущей области нейрогеномики есть надежда, что, понимая геномные профили различных частей мозга, мы сможем улучшить наше понимание того, как взаимодействия между генами и путями влияют на клеточную функцию и развитие. Ожидается, что этот подход сможет идентифицировать вторичные генные сети, которые нарушены при неврологических расстройствах, что впоследствии будет способствовать разработке лекарств для лечения заболеваний мозга.[18] В Инициатива BRAIN запущен в 2013 году, например, стремится "информировать о разработке будущих методов лечения заболеваний головного мозга, включая болезнь Альцгеймера, эпилепсию и черепно-мозговые травмы" .
Исследования ассоциации редких вариантов (RVAS) подчеркнули роль de novo мутации в нескольких врожденный и расстройства с раннего детства, такие как аутизм.[19][20] Некоторые из этих мутаций, разрушающих белок, удалось идентифицировать только с помощью секвенирование всего генома усилия и подтверждены РНК-Seq. Кроме того, эти мутации статистически не обогащают отдельные гены, а скорее демонстрируют закономерности статистического обогащения в группах генов, связанных с сетями, регулирующими неврологическое развитие и поддержание. Такое открытие было бы невозможно с предшествующими геноцентрическими подходами (нейрогенетика, поведенческая неврология ). Нейрогеномика позволяет использовать высокопроизводительный системный подход к пониманию полигенный базис психоневрологический расстройства.[17]
Визуальные исследования и оптическое картирование
Когда аутизм было идентифицировано как отдельное биологическое заболевание в 1980-х годах, исследователи обнаружили, что у аутичных людей наблюдается аномалия роста мозга в мозжечок в первые годы своего развития.[21] Последующие исследования показали, что 90% детей-аутистов имеют больший объем мозга, чем их сверстники, к 2–4 годам, и демонстрируют увеличение содержания белого и серого вещества в головной мозг.[22] Белое и серое вещество в головном мозге связаны с обучением и познанием соответственно, а также с образованием амилоидные бляшки в белом веществе был связан с Болезнь Альцгеймера. Эти результаты подчеркнули влияние структурных различий в мозге на психические расстройства и послужили стимулом для использования технологий визуализации для картирования областей расхождения между здоровым и больным мозгом. Кроме того, хотя не всегда возможно получить биологические образцы из разных областей живого человеческого мозга, нейровизуализация методы предлагают неинвазивные средства понимания биологических основ неврологических расстройств. Есть надежда, что понимание паттернов локализации различных психических заболеваний, в свою очередь, может помочь в исследованиях сетевого анализа в нейрогеномике.
МРТ
Структурная магнитно-резонансная томография (МРТ) можно использовать для определения структурного состава мозга. В частности, в контексте нейрогеномики МРТ сыграла значительную роль в изучении Болезнь Альцгеймера (AD) за последние четыре десятилетия. Первоначально он использовался для исключения других причин слабоумие,[16] но недавние исследования показали наличие характерных изменений у пациентов с БА. В результате МРТ в настоящее время используется в качестве инструмента нейровизуализации, чтобы помочь определить временную и пространственную патофизиологию болезни Альцгеймера, такую как специфические церебральные изменения и амилоидная визуализация.[16]
Простота и неинвазивность МРТ-сканирования послужила стимулом для исследовательских проектов, которые отслеживают развитие и начало психических заболеваний головного мозга. Болезнь Альцгеймера стала ключевым кандидатом в этом топографическом подходе к психиатрическим заболеваниям. Например, МРТ в настоящее время используется для отслеживания функциональных профилей мозга в состоянии покоя и в зависимости от задач у детей с аутосомно-доминантной болезнью Альцгеймера.[23] Эти исследования выявили признаки ранних изменений мозга у лиц из группы риска по БА.[16] Центр передового опыта в области аутизма при Калифорнийском университете в Сан-Диего также проводит МРТ-исследования с детьми в возрасте от 12 до 42 месяцев в надежде охарактеризовать аномалии развития мозга у детей с поведенческими симптомами аутизма.[24]
Дополнительные исследования показали, что существуют определенные закономерности атрофия в головном мозге (в результате нейродегенерация ) при различных неврологических расстройствах и заболеваниях. Эти специфические для болезни паттерны прогрессирования атрофии могут быть идентифицированы с помощью МРТ и обеспечивают контекст клинического фенотипа для нейрогеномных исследований. Временная информация о прогрессировании заболевания, предоставляемая этим подходом, также может потенциально использоваться для интерпретации нарушений на уровне генной сети при психических заболеваниях.[16]
Оптическое отображение
Одной из запретительных черт методологий секвенирования 2-го поколения является верхний предел диапазона генома, доступный для спаривание. Оптическое отображение - это новая методология, используемая для охвата крупномасштабных вариантов, которые обычно не могут быть обнаружены с помощью парных считываний конца. Этот подход был успешно применен для обнаружения варианты конструкции в олигодендроглиома, разновидность рака мозга.[25] Недавняя работа также подчеркнула универсальность оптических карт для улучшения существующих геномных сборок. Хромосомные перестройки, микроделеции, и крупномасштабные транслокации были связаны с нарушениями неврологического и когнитивные функции, например в наследственных невропатия и нейрофиброматоз. Оптическое картирование может значительно улучшить обнаружение вариантов и информировать сетевые модели взаимодействия генов для болезненного состояния при неврологических расстройствах.
Изучение других заболеваний головного мозга
Помимо неврологических расстройств, существуют дополнительные заболевания, которые проявляются в головном мозге и сформировали образцовые сценарии использования изображений мозга в сетевом анализе. В классическом примере визуализирующего геномного анализа исследование 2012 года сравнивало МРТ-сканирование и профили экспрессии генов 104 пациентов с глиомой, чтобы различать результаты лечения и идентифицировать новые целевые геномные пути в Мультиформная глиобластома (ГБМ). Исследователи обнаружили две разные группы пациентов со значительно различающейся организацией белое вещество (инвазивный vs неинвазивный). Последующий анализ данных экспрессии генов показал, что митохондриальная дисфункция является главным каноническим путем в агрессивном фенотипе GBM с низкой смертностью.[26]
Расширение подходов к визуализации мозга к другим заболеваниям может использоваться для исключения других заболеваний при диагностике психических расстройств, но не может использоваться для информирования о наличии или отсутствии психического расстройства.
Модели развития исследований
В людях
Современные подходы к сбору данных об экспрессии генов в человеческом мозге предполагают использование либо микрочипы или же РНК-последовательность. В настоящее время собирать «живую» мозговую ткань редко - только когда лечение связано с операцией на головном мозге, есть шанс, что ткань головного мозга будет собрана во время процедуры. Так обстоит дело с эпилепсией.
В настоящее время данные об экспрессии генов обычно собираются на вскрытии головного мозга, и это часто является препятствием для исследований нейрогеномики на людях.[27][28] После смерти промежуток времени между смертью и моментом сбора данных из посмертного мозга известен как посмертный интервал (PMI). Поскольку после смерти РНК разлагается, свежий мозг оптимален, но не всегда доступен. Это, в свою очередь, может повлиять на различные последующие анализы. При работе с данные omics собраны из посмертного мозга:
- В идеале человеческий мозг должен контролироваться на предмет PMI для данного исследования.[29][30]
- Причина смерти также является важной переменной, которую следует учитывать при сборе образцов человеческого мозга для целей нейрогеномических исследований. Например, образцы мозга людей с клиническими депрессия часто собираются после самоубийства. Определенные условия смерти, такие как передозировка наркотиками или нанесение самому себе огнестрельного оружия, изменяют экспрессию мозга.
- Еще одна проблема, связанная с изучением экспрессии генов в мозге, - это клеточная неоднородность образцов ткани мозга. Объемные образцы головного мозга могут варьироваться по пропорциям конкретных популяций клеток от случая к случаю. Это может повлиять на сигнатуры экспрессии генов и может значительно изменить анализ дифференциальной экспрессии.
- Один из подходов к решению этой проблемы - использовать одноклеточная последовательность РНК. Это будет контролировать определенный тип ячеек. Однако это решение применимо только в тех случаях, когда исследования не относятся к конкретному типу клеток.[31]
Дифференциальная диагностика также остается критическим преаналитическим фактором, влияющим на когортные исследования неврологических расстройств спектра. В частности, это было замечено как проблема хрома при исследованиях болезни Альцгеймера и расстройств аутистического спектра. Кроме того, по мере того, как наше понимание разнообразных симптомов и геномных основ различных нейрогеномных расстройств улучшается, сами диагностические критерии претерпевают изменения и пересмотр.[32]
Модели животных
Текущие исследования в области геномики неврологических расстройств, как правило, используют модели на животных (и соответствующие гомологи генов ), чтобы понять сетевые взаимодействия, лежащие в основе определенного расстройства из-за этических проблем, связанных с извлечением биологических образцов из живого человеческого мозга. И это тоже не без препятствий.
Нейрогеномное исследование модельного организма зависит от наличия полностью секвенированного и аннотированного эталонного генома. Кроме того, профили РНК (miRNA, нкРНК, мРНК ) модельного организма должны быть хорошо каталогизированы, и любые выводы, сделанные на их основе для людей, должны иметь основание в функциональной / последовательности гомология.[33]
Данио
Данио развитие опирается на генные сети, которые хорошо сохраняются среди всех позвоночные.[34] Кроме того, с чрезвычайно хорошо аннотированным набором из 12000 генов и 1000 мутантов раннего развития, которые фактически видны в оптически прозрачных эмбрионах и личинках рыбок данио, рыбки данио предлагают сложную систему для мутагенез и получение изображений развивающихся патологий в реальном времени. Эта модель раннего развития была использована для изучения нервной системы при клеточном разрешении.[35][36] Система моделей рыбок данио уже использовалась для изучения нейрорегенерация[37] и суровый полигенный болезни человека, такие как рак и болезни сердца.[38] Было выделено несколько мутантов рыбок данио с вариациями поведения в ответ на дозу кокаина и алкоголя, которые также могут служить основой для изучения патогенеза поведенческих расстройств.[39][40]
Грызун
Модели на грызунах были выдающимися в изучении заболеваний человека. Эти модели были подробно аннотированы гомологами генов нескольких моногенный расстройства у человека. Нокаут-исследования Использование этих гомологов привело к расширению нашего понимания сетевых взаимодействий генов в тканях человека. Например, FMR1 ген был связан с аутизмом из ряда сетевых исследований.[41][42] Используя нокаут FMR1 в мышах создает модель для Синдром ломкой Х-хромосомы, одно из расстройств в Спектр аутизма.[43]
мышей ксенотрансплантаты особенно полезны для открытия лекарств,[44] и сыграли чрезвычайно важную роль в открытии ранних антипсихотический наркотики. Разработка животных моделей сложных психических заболеваний также улучшилась за последние несколько лет. Модели грызунов продемонстрировали изменения поведенческого фенотипа, напоминающие положительные шизофрения состояние либо после генетических манипуляций, либо после лечения лекарствами, которые нацелены на области мозга, которые, как предполагается, могут влиять на гиперактивность или развитие нервной системы.[45] Возник интерес к выявлению сбоев в сети, вызванных этими лабораторными манипуляциями, и к сбору геномных данных из исследования грызунов внесла значительный вклад в лучшее понимание геномики психических заболеваний.
Первый мозг мыши транскриптом был создан в 2008 году.[46] С тех пор была проделана большая работа по строительству социальный стресс модели мышей для изучения сигнатур экспрессии на уровне метаболических путей различных психических заболеваний. В недавней статье смоделированы признаки посттравматического стрессового расстройства (ПТСР) у мышей и описан весь транскриптом этих мышей.[47] Авторы обнаружили дифференциальную регуляцию многих биологических путей, некоторые из которых связаны с тревожными расстройствами (гиперактивность, реакция страха ), расстройства настроения и нарушение познания. Эти выводы подтверждаются обширными транскриптомный анализ тревожных расстройств, а также изменения уровня экспрессии в биологических путях, связанных с обучением страху и памятью, как полагают, вносят свой вклад в поведенческие проявления этих расстройств.[47] Считается, что функциональное обогащение генов, участвующих в долговременной синаптической потенциации, депрессии и пластичности, играет важную роль в приобретении, консолидации и поддержании травматических воспоминаний, лежащих в основе тревожных расстройств.[47][48]
Экспериментальные мышиные модели психических расстройств
Распространенный подход к использованию модели мышей - экспериментальное лечение беременной мыши с целью воздействия на весь помет. Однако ключевой проблемой в этой области является обработка пометов при статистическом анализе. В большинстве исследований учитывается общее количество произведенного потомства, поскольку это может привести к увеличению статистической мощности. Однако правильным способом является подсчет по количеству пометов и нормализация на основе размера помета. Было обнаружено, что несколько исследований аутизма неправильно проводили статистический анализ, основанный на общем количестве потомков, а не на количестве пометов.[49]
Несколько тревожных расстройств, таких как пост-травматическое стрессовое растройство (ПТСР) включают неоднородный изменения в нескольких различных областях мозга, таких как гиппокамп, миндалина, и прилежащее ядро. Было показано, что клеточное кодирование травматических событий и поведенческие реакции, вызванные такими событиями, заключаются в основном в изменениях сигнальных молекул, связанных с синаптическая передача.
Глобальный профилирование экспрессии генов различных областей генов, участвующих в обработке страха и тревоги, с использованием моделей мышей, привело к идентификации пространственно и временных наборов дифференциально экспрессируемых генов. Анализ путей этих генов показал возможную роль в нейрогенез поведенческие реакции, связанные с тревогой, наряду с другими функциональными и фенотипическими наблюдениями.[47]
Мышиные модели для исследования мозга внесли значительный вклад в разработка лекарств и улучшили наше понимание геномных основ нескольких неврологических заболеваний в последнем поколении. Хлорпромазин, первый антипсихотик препарат (открытый в 1951 г.) был идентифицирован как жизнеспособный вариант лечения после того, как в ходе поведенческого скрининга было показано, что он подавляет реакцию на аверсивные стимулы у крыс.
Вызовы
Моделирование и оценка скрытых симптомов (мысли, вербальное обучение, социальные взаимодействия, когнитивное поведение) остается проблемой при использовании модельных организмов для изучения. психические расстройства со сложной генетической патология. Например, данный генотип + фенотип в мышиной модели должен имитировать геномные основы фенотипа, наблюдаемого у человека.
Это особенно важный вопрос при расстройствах спектра, таких как: аутизм. Аутизм - это расстройство, симптомы которого можно разделить на две категории: (i) дефицит социальных взаимодействий и (ii) повторяющееся поведение и ограниченные интересы. Поскольку мыши, как правило, более социальные существа среди всех членов отряда Rodentia В настоящее время мышей используются в качестве модельных организмов, а мыши обычно используются для максимально точного моделирования психических расстройств человека. В частности, для аутизма в настоящее время существуют следующие обходные пути для имитации поведенческих симптомов человека:
- Для первой диагностической категории нарушенного социального поведения мышей подвергают социальному анализу, предназначенному для представления типичных аутичных социальных дефицитов. Нормальное социальное поведение мышей включает обнюхивание, следование, физический контакт и аллогруминг. Также можно использовать голосовое общение.
- Вторая диагностическая категория может наблюдаться у мышей несколькими способами. Примеры повторяющегося поведения могут включать чрезмерное кружение, уход за собой и чрезмерное копание. Обычно такое поведение проявляется последовательно в течение длительного периода времени (например, самоочищение в течение 10 минут).[50]
- Хотя повторяющееся поведение легко наблюдать, трудно охарактеризовать действительные ограниченные интересы мышей. Одним из аспектов ограниченных интересов аутичных индивидуумов является «настойчивое требование идентичности» - концепция, согласно которой аутичные люди требуют, чтобы их окружение оставалось последовательным. Если эта среда изменится, человек испытает стресс и беспокойство. Сообщается об успехе в подтверждении мышиной модели аутизма путем изменения окружающей среды мыши.[51]
В любом из этих экспериментов «аутичные» мыши имеют «нормального» социализированного партнера, а ученые, наблюдающие за мышами, не знают («слепы») о генотипах мышей.
Экспрессия генов в головном мозге
Профиль экспрессии генов Центральная нервная система (ЦНС) уникален. Восемьдесят процентов всех генов человека экспрессируются в головном мозге; 5000 из этих генов экспрессируются исключительно в ЦНС. Человеческий мозг имеет самый высокий уровень экспрессии генов среди всех исследованных мозгов млекопитающих. Для сравнения, ткани за пределами мозга будут иметь более похожие уровни экспрессии по сравнению с их аналогами у млекопитающих. Одним из источников повышенных уровней экспрессии в головном мозге человека является небелковая кодирующая область генома. Многочисленные исследования показали, что мозг человека имеет более высокий уровень экспрессии в регуляторных областях по сравнению с мозгом других млекопитающих. Также есть заметное обогащение для большего альтернативное сращивание события в мозгу человека.[2]
Пространственные различия
Профили экспрессии генов также различаются в разных областях мозга. А исследование микрочипов показали, что профиль транскриптома кластеров ЦНС вместе на основе региона. Другое исследование охарактеризовало регуляцию экспрессии генов в 10 различных регионах на основе их eQTL сигналы.[52] Причина различных профилей экспрессии связана с функцией, миграция нейронов и клеточная неоднородность региона. Даже три слоя кора головного мозга имеют отчетливые профили экспрессии.[53]
Исследование, проведенное в Гарвардской медицинской школе в 2014 году, позволило выявить линии развития, происходящие от мутаций единичных базовых нейронов. Исследователи секвенировали 36 нейронов коры головного мозга трех нормальных людей и обнаружили, что высокоэкспрессированные гены и гены, связанные с нейронами, были значительно обогащены одиночными нейронами. SNV. Эти SNV, в свою очередь, коррелировали с маркерами транскрипции хроматина из головного мозга плода.[54]
Паттерны развития у человека
Экспрессия генов мозга меняется на разных этапах жизни. Наиболее значимые уровни экспрессии обнаруживаются на раннем этапе развития, а уровень экспрессии генов наиболее высок во время развития плода. Это результат быстрого роста нейронов эмбриона. Нейроны на этом этапе претерпевают нейрональная дифференциация, распространение клеток, миграционные события и дендритные и синаптическое развитие.[55] Паттерны экспрессии генов смещаются ближе к специализированным функциональным профилям во время эмбрионального развития, однако определенные этапы развития все еще продолжаются при родах. Следовательно, профили экспрессии генов двух полушарий мозга при рождении кажутся асимметричными. При рождении профили экспрессии генов кажутся асимметричными между полушария мозга. По мере продолжения развития профили экспрессии генов становятся похожими между полушариями. У здорового взрослого человека профили экспрессии остаются относительно постоянными с конца двадцатых до конца сороковых годов. Начиная с пятидесятых годов, наблюдается значительное снижение экспрессии генов, важных для регулярного функционирования. Несмотря на это, в головном мозге увеличивается разнообразие генов. Это возрастное изменение выражения может быть связано с Содержимое GC. На более поздних стадиях жизни наблюдается увеличение индукции опорных генов с низким содержанием GC, а также усиление репрессии опорных генов с высоким содержанием GC.[53] Другой причиной изменения генного разнообразия является накопление мутаций и повреждения ДНК. Исследования экспрессии генов показывают, что гены, которые накапливают эти возрастные мутации, одинаковы между людьми в стареющей популяции. Гены, которые высоко экспрессируются при развитии, значительно уменьшаются на поздних стадиях жизни, тогда как гены, которые сильно репрессированы в развитии, значительно увеличиваются на поздних стадиях.[54]
Эволюция мозга млекопитающих
Эволюция Homo sapiens поскольку отклонение от общего предка приматов показало заметное увеличение размеров и сложности мозга, особенно в кора головного мозга.[56][57][58][59] В сравнении с приматы, человек кора головного мозга имеет увеличенную площадь поверхности, но незначительно отличается по толщине. Многие крупномасштабные исследования в понимании отличий человеческого мозга от других видов указывают на расширение семейств генов и изменения в альтернативное сращивание нести ответственность за последующее увеличение когнитивных способностей и кооперативного поведения у людей.[60][61] Однако нам еще предстоит определить точные фенотипические последствия всех этих изменений. Одна из трудностей заключается в том, что только приматы развили подразделения в коре головного мозга, что затрудняет моделирование специфических неврологических проблем человека. грызуны.[58][62][63]
Данные последовательности используются для понимания эволюционных генетических изменений, которые привели к развитию ЦНС человека. Тогда мы сможем понять, как неврологические фенотипы различаются между видами. Сравнительная геномика влечет за собой сравнение данных последовательности через филогения чтобы точно определить генотипические изменения, происходящие в определенных линиях, и понять, как эти изменения могли возникнуть. Увеличение высококачественных референсных последовательностей млекопитающих обычно делает Сравнительный анализ лучше по мере увеличения статистическая мощность. Однако увеличение количества видов в филогения рискует добавить ненужный шум, поскольку выравнивание ортологичный последовательности обычно ухудшаются в качестве. Более того, разные классы видов будут иметь значительные различия в фенотипах.[64]
Несмотря на это, сравнительная геномика позволила нам связать генетические изменения, обнаруженные в филогенезе, с конкретными путями. Чтобы определить это, клоны проверяются на функциональные изменения, которые со временем накапливаются. Это часто измеряется как отношение несинонимичные замены к синонимичные замены или отношение dN / dS (иногда сокращенно ω). Когда отношение dN / dS больше 1, это означает положительный выбор. Отношение dN / dS, равное 1, свидетельствует об отсутствии селективных давлений. Отношение dN / dS меньше 1 означает отрицательный выбор. Например, консервативные области генома обычно имеют отношение dN / dS менее 1, поскольку любые изменения этих положений, вероятно, будут пагубными.[65] Из генов, экспрессируемых в человеческом мозге, по оценкам, 342 из них имеют отношение dN / dS больше 1 в человеческой линии по сравнению с другими линиями приматов.[64] Это указывает на положительный отбор по фенотипам мозга по линии человеческого происхождения. Понимание значения положительный выбор это вообще следующий шаг. Например, ASPM, CDK5RAP2 и NIN - это гены, которые положительно отобраны по происхождению от человека и напрямую коррелируют с размером мозга. Это открытие может помочь выяснить, почему человеческий мозг больше, чем мозг других млекопитающих.[65]
Различия экспрессии на сетевом уровне между видами
Считается, что изменения экспрессии генов, являющиеся окончательной реакцией на любые генетические изменения, являются хорошим показателем для понимания фенотипический различия в биологических образцах. Сравнительные исследования выявили ряд различий в транскрипционный контроль между приматы и грызуны. Например, ген CNTNAP2 специально обогащен префронтальная кора. Гомолог мыши CNTNAP2 не экспрессируется в мозге мыши. CNTNAP2 был вовлечен в когнитивные функции языка, а также расстройства нервного развития такие как расстройство аутистического спектра. Это предполагает, что контроль экспрессии играет важную роль в развитии уникальной когнитивной функции человека. Как следствие, в ряде исследований изучались энхансеры, специфичные для мозга. Факторы транскрипции Такие как SOX5 были обнаружены положительно отобранные по линии человеческого происхождения. Исследования экспрессии генов у людей, шимпанзе и макаки резус, определили специфичные для человека сети коэкспрессии и повышение экспрессии генов в коре головного мозга человека по сравнению с приматами.[66]
Расстройства
Нейрогеномные расстройства проявляются в виде неврологические расстройства со сложной генетической архитектурой и неменделирующий -подобный образец наследования.[18] Некоторые примеры этих расстройств включают: Биполярное расстройство и Шизофрения.[15] Несколько генов могут быть вовлечены в проявление заболевания, и мутации при таких нарушениях обычно редки и de novo. Следовательно, становится крайне маловероятным наблюдение одного и того же (потенциально причинного) варианта у двух неродственных людей, страдающих одним и тем же нейрогеномным расстройством.[15] Текущие исследования затронули несколько de novo экзонные вариации и структурные вариации в Расстройство аутистического спектра (ASD), например.[15] В аллельный спектр редких и распространенных вариантов нейрогеномных расстройств, следовательно, требует проведения крупных когортных исследований, чтобы эффективно исключить варианты с низким эффектом и идентифицировать общие пути, часто мутирующие при различных расстройствах, а не конкретные гены и специфические высокая пенетрантность мутации.
Секвенирование всего генома (WGS) и секвенирование всего экзома (WES) использовался в Исследования геномных ассоциаций (GWAS) для характеристики генетических вариантов, связанных с нейрогеномными расстройствами. Однако влияние этих вариантов не всегда можно проверить из-за неменделирующих паттернов наследования, наблюдаемых при некоторых из этих расстройств.[15] Еще одна запретительная особенность сетевого анализа - отсутствие крупномасштабных наборов данных по многим психиатрическим (нейрогеномным) заболеваниям. Поскольку некоторые заболевания, имеющие нейрогеномную основу, имеют тенденцию к полигенный основа, несколько неспецифических, редких и частично пенетрантных de novo мутации у разных пациентов могут вносить вклад в один и тот же наблюдаемый диапазон фенотипов, как в случае с расстройством аутистического спектра и шизофренией.[67] Обширные исследования в алкогольная зависимость (ALC) также подчеркнула необходимость высококачественного геномного профилирования больших наборов образцов.[68][69] во время учебы полигенный, расстройства спектра.
В Проект 1000 геномов была успешной демонстрацией того, как согласованные усилия по получению репрезентативных геномных данных от широкого спектра людей могут привести к выявлению действенных биологических идей для различных болезней.[70] Однако подобная крупномасштабная инициатива в области нейрогеномных расстройств все еще отсутствует.
Моделирование психических расстройств в исследованиях нейрогеномики - вопросы
Один крупный GWAS исследование выявило 13 новых локусов риска для шизофрения.[71] Изучение воздействия этих кандидатов в идеале продемонстрировало бы фенотип шизофрении на животных моделях, который обычно трудно наблюдать из-за его проявления как скрытой личности. Такой подход позволяет определить молекулярное влияние ген-кандидат. В идеале гены-кандидаты должны оказывать неврологическое воздействие, что, в свою очередь, предполагает, что они играют роль в неврологическом расстройстве. Например, в вышеупомянутом исследовании шизофрении GWAS Рипке и его коллеги[71] определили, что все эти гены-кандидаты участвуют в передаче сигналов кальция. В качестве альтернативы можно изучать эти варианты на модельных организмах в контексте нарушенной неврологической функции. Важно отметить, что высокая пенетрантность варианты этих расстройств, как правило, de novo мутации.
Еще одним осложнением при изучении нейрогеномных расстройств является неоднородная природа расстройства. При многих из этих расстройств мутации, наблюдаемые от случая к случаю, не остаются неизменными. При аутизме у пораженного человека может наблюдаться большое количество вредных мутаций в гене X. Другой затронутый человек может не иметь каких-либо значимых мутаций в гене X, но иметь большое количество мутаций в гене Y. Альтернативой является определение того, есть ли ген X и ген Y влияют на один и тот же биохимический путь - тот, который влияет на неврологическую функцию. Сетевой анализ биоинформатики - один из подходов к этой проблеме. Методологии сетевого анализа предоставляют обобщенный системный обзор молекулярного пути.
Последнее осложнение, которое следует учитывать, - это коморбидность нейрогеномных генов. Некоторые расстройства, особенно в более тяжелых частях спектра, имеют тенденцию сочетаться друг с другом. Например, в более тяжелых случаях ASD имеют тенденцию быть связаны с Интеллектуальная недееспособность (Я БЫ). Это поднимает вопрос о том, существуют ли истинные, уникальные гены ASD и уникальные гены ID, или есть только гены, связанные с неврологической функцией, которые могут быть мутированы в аномальный фенотип. Одним смешивающим фактором может быть фактическая диагностическая категория и методы расстройств спектра, поскольку симптомы тяжелых расстройств могут быть схожими. В одном исследовании изучались коморбидные симптомы между группами ID и ASD, и не было обнаружено существенной разницы между симптомами у ID детей, ASD детей с ID и ASD детей без ID. Будущие исследования могут помочь установить более строгую генетическую основу для диагностики этих расстройств.
Сетевой анализ

Основная цель сетевого анализа в нейрогеномике - выявление статистически значимых неслучайных ассоциаций между генами, содержащими варианты риска.[15] Хотя несколько алгоритмов реализации этого подхода уже существуют,[72][73] общие шаги сетевого анализа остаются прежними.
- Аналитический процесс начинается с идентификации биологической сети на основе экспериментальной проверки. Это может быть сеть коэкспрессии генов, или белок-белковое взаимодействие (PPI) сеть. Узлы сети будут сгруппированы.
- Впоследствии создается конкретный список генов с известными ассоциациями с конкретным интересующим фенотипом. Этот список может быть составлен на основе экспериментальных данных, независимо от генетических исследований психических расстройств.[15] Это называется «хит-листом».
- Гены, которые принадлежат списку совпадений, а также биологическая сеть, выбранная на первом этапе, помечаются как таковые.
- Затем следует этап определения вины по ассоциации (GBA). Это означает, что кластеры в биологической сети, которые имеют значительное количество генов из списка совпадений, исследуются дополнительно с использованием инструментов функционального обогащения и запросов к базе данных для выявления путей, в которых участвуют эти высоко оцененные гены кластера.[74]
- Таким образом, исследуются биологические ассоциации высоко оцененных, экспериментально вовлеченных членов кластера, расширяя область поиска за пределы начального списка совпадений, чтобы включить гены-члены дополнительных путей, которые могут иметь значительную связь с начальной рассматриваемой биологической сетью. Это приводит к набору генов-кандидатов.[15]
Основополагающий принцип этого подхода состоит в том, что гены, которые объединяются вместе, также совместно влияют на один и тот же молекулярный путь. Опять же, в идеале они должны быть частью неврологической функции. Затем гены-кандидаты можно использовать для определения приоритетности вариантов для проверки в мокрой лаборатории.
Нейрофармакология
Исторически сложилось так, что из-за поведенческой стимуляции, проявляющейся как симптом нескольких нейрогеномных расстройств, лечение в основном полагалось на антипсихотики или антидепрессанты. Эти классы лекарств подавили бы общие симптомы расстройства, но с сомнительной эффективностью. Самым большим препятствием для нейрофармакогеномных исследований был размер когорт. Учитывая недавно появившиеся данные о секвенировании большой когорты, в последнее время наблюдается стремление расширить терапевтические возможности. Гетерогенный характер неврологических заболеваний является ключевой мотивацией для индивидуализированных медицинских подходов к их лечению. Редко можно встретить отдельные гены-возбудители с высокой пенетрантностью при неврологических заболеваниях. Понятно, что геномные профили варьируются от случая к случаю, и, по логике, методы лечения должны варьироваться от случая к случаю. Еще больше усложняет проблему то, что многие из этих расстройств являются расстройствами спектра. Их генетическая этиология будет варьироваться в пределах этого спектра. Например, тяжелая форма РАС связана с мутациями de novo с высокой пенетрантностью. Более легкие формы РАС обычно связаны со смесью распространенных вариантов.
Ключевым вопросом тогда является перевод этих недавно идентифицированных генетических вариантов (из Копировать вариант номера исследований, секвенирования генов-кандидатов и технологий высокопроизводительного секвенирования) в качестве вмешательства для пациентов с нейрогеномными расстройствами. Один из аспектов будет заключаться в том, поддается ли неврологическое расстройство медицинскому действию (т.е. существует ли простой метаболический путь, на который может воздействовать терапия). Например, частные случаи ASD были связаны с микроделециями на ТМЛХЭ ген. Этот ген кодирует фермент биосинтез карнитина. Добавки для повышения уровня карнитина, по-видимому, облегчают определенные симптомы РАС, но исследование было затруднено из-за многих влияющих факторов. Как упоминалось ранее, использование подхода генной сети поможет определить соответствующие представляющие интерес пути. Многие нейрофармакогеномные подходы сосредоточены на нацеливании на последующие продукты этих путей.[75][76]
Гематоэнцефалический барьер
Исследования на животных моделях нескольких заболеваний головного мозга показали, что гематоэнцефалический барьер (BBB) подвергается модификации на многих уровнях; например, состав поверхностных гликопротеинов может влиять на типы штаммов ВИЧ-1, транспортируемых BBB. BBB оказался ключевым фактором в начале Болезнь Альцгеймера болезнь.[77] Однако чрезвычайно сложно изучить это на людях из-за очевидных ограничений доступа к мозгу и извлечения биологических образцов для секвенирования или морфологического анализа. Мышиные модели ГЭБ и модели болезненных состояний хорошо послужили концептуальной концепцией ГЭБ как регулирующего интерфейса между болезнью и хорошим здоровьем мозга.
Персонализированная нейробиология
Гетерогенный характер неврологических заболеваний является ключевой мотивацией для индивидуализированных медицинских подходов к их лечению.[75] Геномные образцы отдельных пациентов могут использоваться для определения прогностических факторов или для лучшего понимания конкретного прогноза нейрогеномного заболевания и использования этой информации для выбора вариантов лечения.[78] Несмотря на очевидную клиническую полезность этого подхода, его адаптация до сих пор отсутствует.
Существуют различные проблемы, запрещающие применение персонализированной геномики для оценки, диагностики и лечения психических расстройств.
- Во-первых, причинная сетевая биология нескольких расстройств спектра с нейрогеномными основами еще не до конца изучена, несмотря на обширные исследования, проведенные с такими расстройствами, как Аутистический спектр[12][42] и шизофрения.[10] Таким образом, аналитическая обоснованность существующих гипотез относительно этиологии нейрогеномных расстройств до сих пор полностью не установлена и является предметом дискуссий и споров.
- Клиническая валидность генетических вариантов, которые, как было показано, сильно коррелировали с конкретными нейрогеномными расстройствами, часто является серьезной причиной для беспокойства.[78] Интерпретация результатов этих тестов и последующее принятие решения - сложная задача, учитывая полигенную природу многих из этих расстройств. Еще больше усложняя ситуацию, было показано, что превентивное вмешательство при серьезных психических расстройствах не всегда снижает риск этого расстройства.[79] Такое вмешательство может быть недоступно даже для потомков из группы риска зараженных взрослых, что ограничивает «медицинскую применимость» данных.[78]
- Также были высказаны этические соображения относительно защиты личной геномной информации и того, как лучше всего подойти к бремени случайных находок и оценки семейных рисков.
- Родство и кровное родство могут привести к селективному обогащению редких генетических мутаций с низкой пенетрантностью, приписываемых различным симптомам нейрогеномных расстройств. Таким образом, интерпретация семейных генетических мутаций и / или сбоев на сетевом уровне в начале редкого психического расстройства требует тщательного рассмотрения мотивации участников, включенных в исследование.[78]
- Тем не менее, эти проблемы могут быть решены путем эффективного обучения и консультирования, и сбор геномных данных у пациентов с психическими расстройствами не должен быть дисквалифицирован только на этом основании. Сами по себе данные служат динамическим источником здоровья и могут значительно улучшить наше понимание геномной основы некоторых психических расстройств.
Смотрите также
Рекомендации
- ^ Богуски, Марк С .; Джонс, Аллан Р. (2004-05-01). «Нейрогеномика: на стыке нейробиологии и геномных наук». Природа Неврология. 7 (5): 429–433. Дои:10.1038 / nn1232. ISSN 1097-6256. PMID 15114353.
- ^ а б Джайн, Кевал К. (01.01.2013). «Нейрогенетика и нейрогеномика». Применение биотехнологии в неврологии. Humana Press. С. 7–16. Дои:10.1007/978-1-62703-272-8_2. ISBN 9781627032711.
- ^ Чирелли, Кьяра; Тонони, Джулио (1999). «Различия в экспрессии генов во время сна и бодрствования». Анналы медицины. 31 (2): 117–124. Дои:10.3109/07853899908998787. PMID 10344584.
- ^ Мэтьюз, Дуглас Б.; Bhave, Sanjiv V .; Белкнап, Джон К .; Бриттингем, Синтия; Чеслер, Элисса Дж .; Hitzemann, Роберт Дж .; Hoffmann, Paula L .; Лу, Лу; МакВини, Шеннон (01.09.2005). «Сложная генетика взаимодействия алкоголя с функцией и поведением ЦНС». Алкоголизм, Клинические и экспериментальные исследования. 29 (9): 1706–1719. Дои:10.1097 / 01.alc.0000179209.44407.df. ISSN 0145-6008. PMID 16205371.
- ^ Hoffman, Paula L .; Майлз, Майкл; Edenberg, Howard J .; Зоммер, Вольфганг; Табаков Борис; Венер, Жанна М .; Леволь, Джоанн (01.02.2003). «Экспрессия генов в головном мозге: окно на зависимость от этанола, нейроадаптация и предпочтения». Алкоголизм, Клинические и экспериментальные исследования. 27 (2): 155–168. Дои:10.1097 / 01.ALC.0000060101.89334.11. ISSN 0145-6008. PMID 12605065.
- ^ Фаррис, Шон П .; Майлз, Майкл Ф. (01.01.2012). «Этаноловая модуляция генных сетей: последствия для алкоголизма». Нейробиология болезней. 45 (1): 115–121. Дои:10.1016 / j.nbd.2011.04.013. ISSN 1095-953X. ЧВК 3158275. PMID 21536129.
- ^ Пожитков, Алекс Е .; Бубе, Идрисса; Брауэр, Мариус Х .; Благородный, Питер А. (01.03.2010). «Помимо массивов Affymetrix: расширение набора известных изотерм гибридизации и наблюдение за интенсивностями сигналов перед стиркой». Исследования нуклеиновых кислот. 38 (5): e28. Дои:10.1093 / nar / gkp1122. ISSN 0305-1048. ЧВК 2836560. PMID 19969547.
- ^ Уолтер, Николь А. Р .; МакВини, Шеннон К .; Peters, Sandra T .; Белкнап, Джон К .; Hitzemann, Роберт; Бак, Кари Дж. (2007-09-01). «Важность SNP: влияние на обнаружение дифференциального выражения». Методы природы. 4 (9): 679–680. Дои:10.1038 / nmeth0907-679. ISSN 1548-7091. ЧВК 3410665. PMID 17762873.
- ^ Уолтер, Николь А. Р .; Снизу, Дэниел; Ладерас, Тед; Муни, Майкл А .; Даракджян, Присцила; Searles, Роберт П .; Харрингтон, Кристина А .; МакВини, Шеннон К .; Хитземанн, Роберт (01.01.2009). «Высокопроизводительное секвенирование на мышах: сравнение платформ выявляет преобладание загадочных SNP». BMC Genomics. 10: 379. Дои:10.1186/1471-2164-10-379. ISSN 1471-2164. ЧВК 2743714. PMID 19686600.
- ^ а б Салливан П.Ф .; Кендлер К.С.; Нил MC (2003-12-01). «Шизофрения как сложная черта: данные метаанализа исследований близнецов». Архив общей психиатрии. 60 (12): 1187–1192. Дои:10.1001 / archpsyc.60.12.1187. ISSN 0003-990X. PMID 14662550.
- ^ Smoller, Jordan W .; Финн, Кристин Т. (15 ноября 2003 г.). «Семья, близнецы и исследования биполярного расстройства в усыновлении». Американский журнал медицинской генетики, часть C. 123C (1): 48–58. CiteSeerX 10.1.1.456.6790. Дои:10.1002 / ajmg.c.20013. ISSN 1552-4868. PMID 14601036.
- ^ а б Розенберг, Ребекка Э .; Закон, Дж. Кили; Енокян, Гаяне; МакГриди, Джон; Кауфманн, Вальтер Э .; Закон, Пол А. (2009-10-01). «Характеристики и соответствие расстройств аутистического спектра среди 277 пар близнецов». Архивы педиатрии и подростковой медицины. 163 (10): 907–914. Дои:10.1001 / архипедиатрия.2009.98. ISSN 1538-3628. PMID 19805709.
- ^ Фрейзер, Томас У .; Томпсон, Ли; Янгстром, Эрик А .; Закон, Пол; Хардан, Антонио Й .; Eng, Charis; Моррис, Натан (01.08.2014). «Двойное исследование наследственного и общего экологического вклада в аутизм». Журнал аутизма и нарушений развития. 44 (8): 2013–2025. Дои:10.1007 / s10803-014-2081-2. ISSN 1573-3432. ЧВК 4104233. PMID 24604525.
- ^ Бумсма, Доррет; Бусьян, Андреас; Пелтонен, Лина (01.11.2002). «Классические исследования близнецов и не только» (PDF). Природа Обзоры Генетика. 3 (11): 872–882. Дои:10.1038 / nrg932. ISSN 1471-0056. PMID 12415317.
- ^ а б c d е ж грамм час Салливан, Патрик Ф .; Дейли, Марк Дж .; О'Донован, Майкл (01.08.2012). «Генетическая архитектура психических расстройств: возникающая картина и ее последствия». Природа Обзоры Генетика. 13 (8): 537–551. Дои:10.1038 / nrg3240. ISSN 1471-0056. ЧВК 4110909. PMID 22777127.
- ^ а б c d е Johnson, Keith A .; Фокс, Ник С .; Sperling, Reisa A .; Клунк, Уильям Э. (2012-04-01). «Визуализация мозга при болезни Альцгеймера». Перспективы Колд-Спринг-Харбор в медицине. 2 (4): a006213. Дои:10.1101 / cshperspect.a006213. ISSN 2157-1422. ЧВК 3312396. PMID 22474610.
- ^ а б МакКэрролл, Стивен А .; Фэн, Гопин; Хайман, Стивен Э. (2014-06-01). «Геномная нейрогенетика: методология и значение». Природа Неврология. 17 (6): 756–763. Дои:10.1038 / № 3716. ISSN 1546-1726. ЧВК 4912829. PMID 24866041.
- ^ а б "Мнение: настоящее и будущее нейрогеномики | The Scientist Magazine®". Ученый. Получено 2016-02-23.
- ^ Малхотра, Дирадж; Себат, Джонатан (16 марта 2012 г.). "CNVs: предвестники революции редких вариантов в психиатрической генетике". Клетка. 148 (6): 1223–1241. Дои:10.1016 / j.cell.2012.02.039. ISSN 1097-4172. ЧВК 3351385. PMID 22424231.
- ^ Макклеллан, Джон; Кинг, Мэри-Клэр (2010-06-23). «Геномный анализ психических заболеваний: меняющийся ландшафт». JAMA. 303 (24): 2523–2524. Дои:10.1001 / jama.2010.869. ISSN 1538-3598. PMID 20571020.
- ^ Courchesne, E .; Yeung-Courchesne, R .; Press, G.A .; Hesselink, J. R .; Джерниган, Т. Л. (26 мая 1988 г.). «Гипоплазия VI и VII долек мозжечка при аутизме». Медицинский журнал Новой Англии. 318 (21): 1349–1354. Дои:10.1056 / NEJM198805263182102. ISSN 0028-4793. PMID 3367935.
- ^ Courchesne, E .; Karns, C.M .; Davis, H.R .; Ziccardi, R .; Карпер, Р. А .; Tigue, Z. D .; Chisum, H.J .; Моисей, П .; Пирс, К. (24 июля 2001 г.). «Необычные модели роста мозга в раннем возрасте у пациентов с аутизмом: исследование МРТ». Неврология. 57 (2): 245–254. Дои:10.1212 / wnl.57.2.245. ISSN 0028-3878. PMID 11468308.
- ^ Quiroz, Yakeel T .; Шульц, Аарон П .; Чен, Кевей; Protas, Hillary D .; Брикхаус, Майкл; Fleisher, Adam S .; Langbaum, Jessica B .; Тийягура, Прадип; Фэган, Энн М. (2015-08-01). «Визуализация головного мозга и аномалии биомаркеров крови у детей с аутосомно-доминантной болезнью Альцгеймера: кросс-секционное исследование». JAMA Неврология. 72 (8): 912–919. Дои:10.1001 / jamaneurol.2015.1099. ISSN 2168-6157. ЧВК 4625544. PMID 26121081.
- ^ "Центр передового опыта в области аутизма Калифорнийского университета в Сан-Диего". autism-center.ucsd.edu. Получено 2016-02-24.
- ^ Рэй, Мохана; Гольдштейн, Стив; Чжоу, Шигуо; Потамусис, Константинос; Саркар, Дипаян; Ньютон, Майкл А; Эстерберг, Элизабет; Кендзёрски, Кристина; Боглер, Оливер (26.07.2013). «Обнаружение структурных изменений в олигодендроглиоме солидной опухоли с помощью анализа одной молекулы». BMC Genomics. 14 (1): 505. Дои:10.1186/1471-2164-14-505. ЧВК 3727977. PMID 23885787.
- ^ Колен, Ривка Р .; Вангель, Марк; Ван, Цзисинь; Гутман, Дэвид А .; Hwang, Scott N .; Винтермарк, Макс; Джайн, Раджан; Джилван-Николас, Манал; Чен, Джеймс Ю. (01.01.2014). «Визуальное геномное картирование инвазивного фенотипа МРТ позволяет прогнозировать исход болезни и метаболическую дисфункцию: проект группы исследования фенотипа глиомы TCGA». BMC Medical Genomics. 7: 30. Дои:10.1186/1755-8794-7-30. ISSN 1755-8794. ЧВК 4057583. PMID 24889866.
- ^ Липска, Барбара К .; Дип-Собослей, Эми; Вейкерт, Синтия Шеннон; Хайд, Томас М .; Мартин, Екатерина Е .; Герман, Мэри М .; Клейнман, Джоэл Э. (15 сентября 2006 г.). «Критические факторы экспрессии генов в посмертном мозге человека: в центре внимания исследования шизофрении». Биологическая психиатрия. 60 (6): 650–658. Дои:10.1016 / j.biopsych.2006.06.019. PMID 16997002.
- ^ Стэн, Ана Д .; Гхош, Суброто; Гао, Сюэ-Минь; Робертс, Розалинда С.; Льюис-Амезкуа, Келли; Hatanpaa, Kimmo J .; Тамминга, Кэрол А. (2006-12-06). «Посмертная ткань человека: какое значение имеют маркеры качества?». Исследование мозга. 1123 (1): 1–11. Дои:10.1016 / j.brainres.2006.09.025. ЧВК 1995236. PMID 17045977.
- ^ Дурик, Ваня; Банаср, Мунира; Stockmeier, Craig A .; Симен, Артур А .; Newton, Samuel S .; Оверхолзер, Джеймс С.; Jurjus, Джордж Дж .; Дитер, Лиза; Думан, Рональд С. (01.02.2013). «Измененная экспрессия синапсов и генов, связанных с глутаматом, в посмертном гиппокампе пациентов с депрессией». Международный журнал нейропсихофармакологии. 16 (1): 69–82. Дои:10.1017 / S1461145712000016. ISSN 1461-1457. ЧВК 3414647. PMID 22339950.
- ^ Надя, Корина; Маэ, Марисса; Лопес, Хуан Пабло; Вайланкур, Кэтрин; Кручану, Кристиана; Гросс, Джеффри А .; Арновиц, Митчелл; Мехавар, Нагиб; Турецкий, Густаво (01.05.2015). «Влияние посмертного интервала на целостность биомолекул в головном мозге». Журнал невропатологии и экспериментальной неврологии. 74 (5): 459–469. Дои:10.1097 / NEN.0000000000000190. ISSN 0022-3069. PMID 25868148.
- ^ Дарманис, Спирос; Sloan, Steven A .; Чжан, Е; Энге, Мартин; Канеда, Кристина; Шуер, Лоуренс М .; Гепхарт, Мелани Г. Хайден; Баррес, Бен А .; Quake, Стивен Р. (2015-06-09). «Исследование разнообразия транскриптомов человеческого мозга на уровне отдельных клеток». Труды Национальной академии наук. 112 (23): 7285–7290. Дои:10.1073 / pnas.1507125112. ISSN 0027-8424. ЧВК 4466750. PMID 26060301.
- ^ Чикогнола, Клаудиа; Кьяссерини, Давиде; Парнетти, Лусилла (2015-06-29). «Преаналитические смешивающие факторы в анализе биомаркеров спинномозговой жидкости для болезни Альцгеймера: проблема суточных колебаний». Границы неврологии. 6: 143. Дои:10.3389 / fneur.2015.00143. ISSN 1664-2295. ЧВК 4483516. PMID 26175714.
- ^ Ринквиц, Силке; Моррен, Филипп; Беккер, Томас С. (01.02.2011). «Рыбки данио: интегративная система для нейрогеномики и нейробиологии». Прогресс в нейробиологии. 93 (2): 231–243. Дои:10.1016 / j.pneurobio.2010.11.003. ISSN 1873-5118. PMID 21130139.
- ^ Каньестро, Кристиан; Постлетвейт, Джон Х. (15 мая 2007 г.). «Развитие хордовой передне-задней оси без классической передачи сигналов ретиноевой кислоты». Биология развития. 305 (2): 522–538. Дои:10.1016 / j.ydbio.2007.02.032. ISSN 0012-1606. PMID 17397819.
- ^ Таллафус, Александра; Трепман, Алисса; Эйзен, Джудит С. (2009-12-01). «Распределение мРНК DeltaA и белков в нервной системе рыбок данио». Динамика развития. 238 (12): 3226–3236. Дои:10.1002 / dvdy.22136. ISSN 1097-0177. ЧВК 2882441. PMID 19924821.
- ^ Руссек-Блюм, Нива; Гутник, Амос; Набель-Розен, Хелит; Блехман, Жанна; Стаудт, Николь; Дорский, Ричард I .; Хоуарт, Коринн; Левковиц, Гил (01.10.2008). «Размер дофаминергического нейронального кластера определяется во время раннего формирования паттерна переднего мозга». Разработка. 135 (20): 3401–3413. Дои:10.1242 / dev.024232. ISSN 0950-1991. ЧВК 2692842. PMID 18799544.
- ^ Reimer, Michell M .; Соренсен, Инга; Куща, Вероника; Франк, Ребекка Э .; Лю, Чонг; Беккер, Катерина Г .; Беккер, Томас (2008-08-20). «Регенерация двигательных нейронов у взрослых рыбок данио». Журнал неврологии. 28 (34): 8510–8516. Дои:10.1523 / JNEUROSCI.1189-08.2008. ISSN 1529-2401. ЧВК 6671064. PMID 18716209.
- ^ Уайт, Ричард; Роза, Кристин; Зон, Леонард (01.09.2013). «Рак рыбок данио: современное состояние и путь вперед». Обзоры природы Рак. 13 (9): 624–636. Дои:10.1038 / nrc3589. ISSN 1474–175X. ЧВК 6040891. PMID 23969693.
- ^ Darland, T .; Доулинг, Дж. Э. (2001). «Поведенческий скрининг на чувствительность к кокаину у мутагенизированных рыбок данио». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 98 (20): 11691–11696. Дои:10.1073 / пнас.191380698. ЧВК 58791. PMID 11553778.
- ^ ; Локвуд Б., Бьерке С., Кобаяши К. и Го С. «Острое воздействие алкоголя на личинок рыбок данио: генетическая система для крупномасштабного скрининга» Pharmacol. Biochem. Поведение 2004; 77, 647–654
- ^ Буржерон, Томас (01.09.2015). «От генетической архитектуры до синаптической пластичности при расстройствах аутистического спектра». Обзоры природы Неврология. 16 (9): 551–563. Дои:10.1038 / №3992. ISSN 1471-003X. PMID 26289574.
- ^ а б Просто, Марсель Адам; Черкасский, Владимир Л .; Келлер, Тимоти А .; Кана, Раджеш К .; Миншью, Нэнси Дж. (2007-04-01). «Функциональная и анатомическая недостаточность связи коры при аутизме: данные исследования с помощью фМРТ задачи исполнительной функции и морфометрии мозолистого тела». Кора головного мозга. 17 (4): 951–961. Дои:10.1093 / cercor / bhl006. ISSN 1047-3211. ЧВК 4500121. PMID 16772313.
- ^ Oddi, D .; Крузио, В. Э.; D’Amato, F. R .; Пьетропаоло, С. (15.08.2013). «Моногенные мышиные модели социальной дисфункции: последствия для аутизма». Поведенческие исследования мозга. SI: Нейробиология аутизма. 251: 75–84. Дои:10.1016 / j.bbr.2013.01.002. PMID 23327738.
- ^ Гулд, Стивен Э .; Junttila, Melissa R .; де Соваж, Фредерик Дж. (01.05.2015). «Трансляционная ценность мышиных моделей в разработке онкологических препаратов». Природа Медицина. 21 (5): 431–439. Дои:10,1038 / нм.3853. ISSN 1078-8956. PMID 25951530.
- ^ Джонс, Калифорния; Уотсон, DJG; Фон, KCF (2011-10-01). «Животные модели шизофрении». Британский журнал фармакологии. 164 (4): 1162–1194. Дои:10.1111 / j.1476-5381.2011.01386.x. ISSN 0007-1188. ЧВК 3229756. PMID 21449915.
- ^ Мортазави, Али; Уильямс, Брайан А .; МакКью, Кеннет; Шеффер, Лориан; Уолд, Барбара (2008-07-01). «Картирование и количественная оценка транскриптомов млекопитающих с помощью RNA-Seq». Методы природы. 5 (7): 621–628. Дои:10.1038 / nmeth.1226. ISSN 1548-7105. PMID 18516045.
- ^ а б c d Мухие, Сеид; Гаутам, Арти; Мейерхофф, Джеймс; Чакраборти, Набарун; Хаммаме, Раша; Джетт, Марти (2015-02-28). «Профили транскриптома мозга на мышиной модели, имитирующей особенности посттравматического стрессового расстройства». Молекулярный мозг. 8 (1): 14. Дои:10.1186 / s13041-015-0104-3. ЧВК 4359441. PMID 25888136.
- ^ Натт, Дэвид Дж .; Малиция, Андреа Л. (2004-01-01). «Структурные и функциональные изменения мозга при посттравматическом стрессовом расстройстве». Журнал клинической психиатрии. 65 Дополнение 1: 11–17. ISSN 0160-6689. PMID 14728092.
- ^ Лазич, Стэнли Э; Эссиу, Лоран (22 марта 2013 г.). «Улучшение фундаментальной и переводческой науки за счет учета вариаций от помета к помету в моделях животных». BMC Neuroscience. 14: 37. Дои:10.1186/1471-2202-14-37. ISSN 1471-2202. ЧВК 3661356. PMID 23522086.
- ^ Кроули, Жаклин Н. (01.09.2012). «Трансляционные животные модели аутизма и нарушений нервного развития». Диалоги в клинической неврологии. 14 (3): 293–305. ISSN 1294-8322. ЧВК 3513683. PMID 23226954.
- ^ Готэм, Кэтрин; Bishop, Somer L .; Хас, Ванесса; Уэрта, Марисела; Лунд, Сабата; Буя, Андреас; Кригер, Абба; Лорд, Екатерина (01.02.2013). «Изучение взаимосвязи между тревогой и настойчивым требованием сходства при расстройствах аутистического спектра». Исследование аутизма. 6 (1): 33–41. Дои:10.1002 / aur.1263. ISSN 1939-3806. ЧВК 4373663. PMID 23258569.
- ^ Рамасами, Адаикалаван; Трабзуни, Дания; Гуэлфи, Себастьян; Варгезе, Вибин; Смит, Колин; Уокер, Роберт; Де, Тишам; Консорциум по экспрессии мозга в Великобритании; Североамериканский консорциум выражения мозга (01.10.2014). «Генетическая изменчивость в регуляции экспрессии генов в десяти областях человеческого мозга». Природа Неврология. 17 (10): 1418–1428. Дои:10.1038 / №3801. ISSN 1097-6256. ЧВК 4208299. PMID 25174004.
- ^ а б Наумова Оксана Юрьевна; Ли, Мария; Рычков, Сергей Ю.; Власова Наталья В .; Григоренко, Елена Леонидовна (01.01.2013). «Экспрессия генов в человеческом мозге: современное состояние изучения специфичности и пространственно-временной динамики». Развитие ребенка. 84 (1): 76–88. Дои:10.1111 / cdev.12014. ISSN 1467-8624. ЧВК 3557706. PMID 23145569.
- ^ а б Lodato, Michael A .; Вудворт, Молли Б.; Ли, Семин; Evrony, Gilad D .; Mehta, Bhaven K .; Каргер, Амир; Ли, Сухён; Chittenden, Thomas W .; Д'Гама, Алисса М. (02.10.2015). «Соматическая мутация в отдельных нейронах человека отслеживает историю развития и транскрипцию». Наука. 350 (6256): 94–98. Дои:10.1126 / science.aab1785. ISSN 1095-9203. ЧВК 4664477. PMID 26430121.
- ^ Миллер, Джереми А .; Дин, Сун-Линь; Sunkin, Susan M .; Smith, Kimberly A .; Нг, Лидия; Шафер, Аарон; Эбберт, Аманда; Riley, Zackery L .; Ройалл, Джошуа Дж. (10 апреля 2014 г.). «Транскрипционный ландшафт пренатального мозга человека». Природа. 508 (7495): 199–206. Дои:10.1038 / природа13185. ISSN 0028-0836. ЧВК 4105188. PMID 24695229.
- ^ Кэрролл, Шон Б. (апрель 2003 г.). «Генетика и создание Homo sapiens». Природа. 422 (6934): 849–857. Дои:10.1038 / природа01495. PMID 12712196.
- ^ Хилл, Роберт Шон; Уолш, Кристофер А. (01.09.2005). «Молекулярное понимание эволюции человеческого мозга». Природа. 437 (7055): 64–67. Дои:10.1038 / природа04103. ISSN 1476-4687. PMID 16136130.
- ^ а б Ракич, Пасько (01.10.2009). «Эволюция неокортекса: взгляд из биологии развития». Обзоры природы Неврология. 10 (10): 724–735. Дои:10.1038 / nrn2719. ISSN 1471-003X. ЧВК 2913577. PMID 19763105.
- ^ Geschwind, Daniel H .; Ракич, Пасько (30.10.2013). «Корковая эволюция: судите о мозге по его оболочке». Нейрон. 80 (3): 633–647. Дои:10.1016 / j.neuron.2013.10.045. ISSN 1097-4199. ЧВК 3922239. PMID 24183016.
- ^ Calarco, John A .; Син, Йи; Касерес, Марио; Calarco, Joseph P .; Сяо, Синьшу; Пан, Цюнь; Ли, Кристофер; Preuss, Todd M .; Бленкоу, Бенджамин Дж. (2007-11-15). «Глобальный анализ различий в альтернативном сращивании людей и шимпанзе». Гены и развитие. 21 (22): 2963–2975. Дои:10.1101 / gad.1606907. ISSN 0890-9369. ЧВК 2049197. PMID 17978102.
- ^ Чжан, Сяо-Оу; Инь, Цин-Фэй; Ван, Хай-Бин; Чжан, Ян; Чен, Тиан; Чжэн, Пин; Лу, Сюйхуа; Чен, Линь-Лин; Ян Ли (01.01.2014). «Видоспецифический альтернативный сплайсинг приводит к уникальной экспрессии sno-lncRNA». BMC Genomics. 15: 287. Дои:10.1186/1471-2164-15-287. ISSN 1471-2164. ЧВК 4234469. PMID 24734784.
- ^ Сомель, Мехмет; Лю, Силин; Хаитович, Филипп (01.02.2013). «Эволюция человеческого мозга: транскрипты, метаболиты и их регуляторы». Обзоры природы Неврология. 14 (2): 112–127. Дои:10.1038 / номер 3372. ISSN 1471-003X. PMID 23324662.
- ^ Куреши, Ирфан А .; Мелер, Марк Ф. (2012-08-01). «Новые роли некодирующих РНК в эволюции, развитии, пластичности и заболеваниях мозга». Обзоры природы Неврология. 13 (8): 528–541. Дои:10.1038 / номер 3234. ISSN 1471-003X. ЧВК 3478095. PMID 22814587.
- ^ а б Geschwind, Daniel H .; Ракич, Пасько (30.10.2013). "Эволюция коры: судите о мозге по его прикрытию". Нейрон. 80 (3): 633–647. Дои:10.1016 / j.neuron.2013.10.045. ISSN 0896-6273. ЧВК 3922239. PMID 24183016.
- ^ а б Энард, Вольфганг (01.01.2014). «Сравнительная геномика эволюции размеров мозга». Границы нейробиологии человека. 8: 345. Дои:10.3389 / fnhum.2014.00345. ЧВК 4033227. PMID 24904382.
- ^ Ван, Гуан-Чжун; Конопка, Женевьева (01.06.2013). «Расшифровка сигнатур экспрессии генов человека в мозгу». Транскрипция. 4 (3): 102–108. Дои:10.4161 / trns.24885. ISSN 2154-1272. ЧВК 4042582. PMID 23665540.
- ^ Киров, Г .; Pocklington, A.J .; Holmans, P .; Иванов, Д .; Ikeda, M .; Ruderfer, D .; Moran, J .; Chambert, K .; Тончева, Д. (01.02.2012). «Анализ de novo CNV указывает на специфические нарушения постсинаптических сигнальных комплексов в патогенезе шизофрении». Молекулярная психиатрия. 17 (2): 142–153. Дои:10.1038 / mp.2011.154. ISSN 1476-5578. ЧВК 3603134. PMID 22083728.
- ^ Bierut, Laura J .; Агравал, Арпана; Bucholz, Kathleen K .; Доэни, Кимберли Ф .; Лори, Кэти; Пью, Элизабет; Фишер, Шерри; Фокс, Луи; Хауэллс, Уильям (16 марта 2010 г.). «Полногеномное ассоциативное исследование алкогольной зависимости». Труды Национальной академии наук. 107 (11): 5082–5087. Дои:10.1073 / pnas.0911109107. ISSN 0027-8424. ЧВК 2841942. PMID 20202923.
- ^ Джураева, Дилафруз; Treutlein, Jens; Шольц, Хенрике; Франк, Йозеф; Дегенхардт, Франциска; Cichon, Sven; Райдингер, Моника; Маттейзен, Мануэль; Витт, Стефани Х. (01.01.2015). «XRCC5 как ген риска алкогольной зависимости: данные полногеномного анализа на основе набора генов и последующих исследований у дрозофилы и человека». Нейропсихофармакология. 40 (2): 361–371. Дои:10.1038 / npp.2014.178. ISSN 1740-634X. ЧВК 4443948. PMID 25035082.
- ^ Консорциум проекта «1000 геномов» (01.10.2015). «Глобальный справочник генетических вариаций человека». Природа. 526 (7571): 68–74. Дои:10.1038 / природа15393. ISSN 0028-0836. ЧВК 4750478. PMID 26432245.
- ^ а б Рипке, Стефан; О'Душлейн, Колм; Чамбер, Кимберли; Моран, Дженнифер Л .; Kähler, Anna K .; Актерин, Сюзанна; Берген, Сара Э .; Коллинз, Энн Л .; Кроули, Джеймс Дж. (01.10.2013). «Полногеномный ассоциативный анализ выявил 13 новых локусов риска шизофрении». Природа Генетика. 45 (10): 1150–1159. Дои:10.1038 / ng.2742. ISSN 1546-1718. ЧВК 3827979. PMID 23974872.
- ^ Ли, Фил Х .; О'Душлейн, Колм; Томас, Бретт; Перселл, Шон М. (01.07.2012). "INRICH: интервальный анализ обогащения для полногеномных ассоциативных исследований". Биоинформатика. 28 (13): 1797–1799. Дои:10.1093 / биоинформатика / bts191. ISSN 1367-4811. ЧВК 3381960. PMID 22513993.
- ^ Моррис, Эндрю П.; Войт, Бенджамин Ф; Теслович Таня М; Феррейра, Тереза; Segrè, Ayellet V; Штайнторсдоттир, Валгердур; Строубридж, Рона Дж .; Хан, Хасан; Граллерт, Харальд (01.09.2012). «Крупномасштабный ассоциативный анализ дает представление о генетической архитектуре и патофизиологии диабета 2 типа». Природа Генетика. 44 (9): 981–990. Дои:10.1038 / ng.2383. ISSN 1061-4036. ЧВК 3442244. PMID 22885922.
- ^ Гиллис, Джесси; Павлидис, Пол (2012). ""Вина по ассоциации «в генных сетях скорее исключение, чем правило». PLOS вычислительная биология. 8 (3): e1002444. Дои:10.1371 / journal.pcbi.1002444. ЧВК 3315453. PMID 22479173.
- ^ а б МакМахон, Фрэнсис Дж .; Инсел, Томас Р. (07.06.2012). «Фармакогеномика и персонализированная медицина в нейропсихиатрии». Нейрон. 74 (5): 773–776. Дои:10.1016 / j.neuron.2012.05.004. ЧВК 3407812. PMID 22681682.
- ^ Брандлер, Уильям М .; Себат, Джонатан (01.01.2015). «От мутаций De Novo до индивидуальных терапевтических вмешательств при аутизме». Ежегодный обзор медицины. 66 (1): 487–507. Дои:10.1146 / annurev-med-091113-024550. PMID 25587659.
- ^ Бэнкс, Уильям А. (01.10.2010). «Мышиные модели неврологических расстройств: взгляд через гематоэнцефалический барьер». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1802 (10): 881–888. Дои:10.1016 / j.bbadis.2009.10.011. ISSN 0006-3002. ЧВК 2891624. PMID 19879356.
- ^ а б c d Бизекер, Барбара Боулз; Пи, Холли Ландрам (1 августа 2013 г.). «Геномное секвенирование психических расстройств: обещание и вызов». Международный журнал нейропсихофармакологии. 16 (7): 1667–1672. Дои:10.1017 / S146114571300014X. ISSN 1461-1457. ЧВК 3703499. PMID 23575420.
- ^ Банник, Элин М; Schermer, Maartje HN; Янссенс, Сесиль Дж. У. (19 января 2012 г.). «Роль характеристик болезни в этических дебатах по тестированию личного генома». BMC Medical Genomics. 5 (1): 4. Дои:10.1186/1755-8794-5-4. ЧВК 3293088. PMID 22260407.

