Тропонин С типа 1 - Troponin C type 1
Тропонин С, также известен как TN-C или TnC, это белок который находится в тропонин комплекс на актин тонкие нити поперечно-полосатые мышцы (сердечный, быстро сокращающийся скелет или медленно сокращающийся скелет) и отвечает за связывание кальций активировать сокращение мышц.[5][6] Тропонин C кодируется TNNC1 ген в людях[7] как для сердечной, так и для медленной скелетной мышцы.
Структура
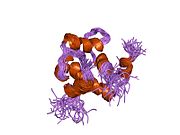
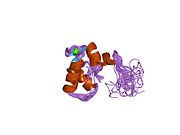
Сердечный тропонин C (cTnC) представляет собой белок из 161 аминокислоты.[8] разделены на две области: нормативная N-концевой домен (cNTnC, остатки 1-86), структурный C-терминал домен (cCTnC, остатки 93-161) и гибкий компоновщик соединяющие два домена (остатки 87-92).[9] Каждый домен содержит два EF-руки, Ca2+-связывающие мотивы спираль-петля-спираль, представленные белками, такими как парвальбумин[10] и кальмодулин.[11] В cCTnC два мотива EF-руки составляют два высокоаффинных Ca2+-участок связывания.[12] которые заняты при всех физиологически значимых концентрациях кальция. Напротив, только вторая EF-рука в cNTnC связывает Ca2+ с низким сродством, тогда как первая EF-рука Ca2+-связь сайта не существует.[13]
В типичном белке EF-hand, таком как кальмодулин, Ca2+ связывание вызывает конформационный переход от закрытого к открытому, обнажая большой гидрофобный участок в открытом состоянии.[14] Точно так же регуляторный домен сердечного тропонина, cNTnC, находится в закрытой конформации в состоянии апо (кальций не связан).[15] На Ca2+ связывания, cNTnC входит в быстрое равновесие между закрытой и открытой формами, однако закрытая форма все еще преобладает.[9][16][17] Структурный домен cCTnC существует как "расплавленная глобула "в состоянии апо,[18] но образует хорошо структурированную открытую конформацию в Ca2+-связанное состояние. Эти структурные различия изменяют относительную стабильность апо- и Ca2+-связанные состояния с учетом расходящегося Ca2+-связь между двумя доменами.
Функция
В сердечной мышце cTnC связывается с сердечным тропонином I (cTnI) и сердечным тропонином T (cTnT), тогда как cTnC связывается с медленным скелетным тропонином I (ssTnI) и тропонином T (ssTnT) в медленно сокращающихся скелетных мышцах.
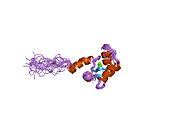
Структурный домен cTnC (cCTnC) прикреплен к тропонинам I и T, образуя так называемое IT-плечо, состоящее из cTnC.93-161, cTnI41-135 и cTnT235-286 (в сердечном комплексе).[19] cCTnC связывается со спиральными cTnI41-60 через свой большой гидрофобный участок, стабилизирующий Ca2+-связанная открытая конформация cCTnC и повышение его сродства к Ca2+ (от Kd = 40 нм до Kd = 3 нМ).[20][21] cTnT235-286 образует спиральную спиральную катушку с cTnI88-135 который связывается с противоположной стороной cCTnC.[19] IT-плечо прикреплено к тропомиозину через соседние сегменты cTnT,[22][23][24] поэтому считается, что он движется вместе с тропомиозином в течение сердечного цикла.[25] В среде с низким содержанием кальция, присутствующей во время диастолы (~ 100 нМ),[26] тропомиозин закрепляется в «заблокированном» положении вдоль тонкого актинового филамента посредством связывания ингибитора тропонина I (cTnI128-147) и С-концевой (cTnI160-209) регионов.[27][28] Это предотвращает образование перекрестных мостиков между актином и миозином и эффективно отключает сокращение мышц.
Поскольку цитоплазматический Са2+ концентрация повышается до ~ 1 мкМ в течение систола,[26] Ca2+ Связывание с регуляторным доменом сердечного тропонина C (cNTnC) является ключевым событием, которое приводит к сокращению мышц. Гидрофобное связывание cNTnC с «переключающей» областью тропонина I, cTnI148-159, стабилизирует Ca2+-связанная открытая конформация cNTnC[29] (увеличивая Ca2+ аффинность связывания cNTnC примерно от Kd = От 5 мкМ до Kd = 0,8 мкМ).[30] Это событие связывания удаляет соседние области ингибирования cTnI из актина и стабилизирует тропомиозин в его «закрытом» положении по умолчанию на тонкой нити,[31] позволяя актин-миозиновому перекрестному соединению и сокращению мышц продолжаться. Сильное взаимодействие актин-миозин может еще больше сдвинуть тонкую нить в «открытое» положение.[32][33]
Физиологическая регуляция чувствительности к кальцию
Чувствительность саркомера к кальцию, то есть концентрация кальция, при которой происходит сокращение мышц, напрямую определяется аффинностью связывания кальция cNTnC. На сегодняшний день неизвестны посттрансляционные модификации cTnC, которые влияют на его аффинность связывания с кальцием. Однако связывание кальция cNTnC - это динамический процесс, на который может влиять конформационное равновесие cNTnC от закрытого до открытого, расположение домена cNTnC или относительная доступность cTnI.148-159, физиологический партнер связывания cNTnC. Закрытое и открытое равновесие cNTnC может быть сдвинуто к открытому состоянию небольшими соединениями. [34](см. раздел ниже, посвященный препаратам, связывающим тропонин). На позиционирование домена cNTnC может влиять фосфорилирование cTnI,[35] из которых наиболее важным сайтом у человека является Ser22 / Ser23.[36][37] Доступность cTnI148-159 зависит от блокированного-закрытого-открытого равновесия тропомиозина на актине, на которое могут влиять любые взаимодействия с участием тонкой нити, включая перекрестное связывание актина и миозина[38] и зависящая от длины активация [39][40](также известный как активация растяжения или закон сердца Фрэнка Старлинга). На все эти процессы могут влиять мутации (см. Ниже раздел о мутациях, вызывающих болезни).
Мутации, вызывающие заболевания
Гипертрофическая кардиомиопатия (ГКМП) - распространенное заболевание (распространенность> 1: 500)[41] характеризуется аномальным утолщением желудочковый мышцы, классически в стенка внутрижелудочковой перегородки. HCM описывается как заболевание саркомер, потому что мутации в сократительных белках саркомера были идентифицированы примерно у половины пациентов с ГКМП. Мутации cTnC, которые были связаны с HCM: A8V, L29Q, A31S, C84Y, D145E.[42][43][44] Во всех случаях мутация была выявлена у одного пациента, поэтому необходимо дополнительное генетическое тестирование, чтобы подтвердить или опровергнуть клиническое значение этих мутаций. С большинством этих мутаций (и с мутациями тонких филаментов, связанных с HCM в целом) наблюдалось повышение сердечной чувствительности к кальцию.[45][46]
Семейная дилатационная кардиомиопатия (ДКМП) - редкая причина систолической сердечной недостаточности (распространенность 1: 5000). С DCM связан более широкий спектр мутаций (включая некоторые несаркомерные белки). Мутации cTnC, связанные с DCM, это Y5H, Q50R, D75Y, M103I, D145E (также связанный с HCM), I148V и G159D.[47][48] Из них Q50R[49] и G159D[50] совместно с заболеванием пораженных членов семьи, что увеличивает уверенность в том, что они являются клинически значимыми мутациями. Биохимические последствия мутаций, связанных с тонкими филаментами DCM, менее хорошо изучены, чем для HCM, хотя есть некоторые предположения, что некоторые из мутаций устраняют кальций-десенсибилизирующий эффект фосфорилирования cTnI по Ser22 / 23.[51] Это может быть связано с тем, что некоторые мутации нарушают точное позиционирование cNTnC для запуска сокращения мышц, когда cTnI не фосфорилирован.[52]
Препараты, связывающие тропонин
Химические соединения могут связываться с тропонином C, чтобы действовать как активаторы тропонина (сенсибилизаторы кальция) или ингибиторы тропонина (десенсибилизаторы кальция). Уже существует несколько активаторов тропонина, которые связываются с быстрым скелетным тропонином С, из которых тирасемтив[53] был протестирован в нескольких клинических испытаниях.[54][55][56] Напротив, не существует известных соединений, которые связываются с высоким сродством с сердечным тропонином С. Сенсибилизатор кальция, левосимендан, предположительно связывается с тропонином C, но было обнаружено только слабое или непоследовательное связывание,[57][58][59] исключающие определение структуры. В отличие от этого, левосимендан ингибирует фосфодиэстеразу 3 типа с наномолярным сродством,[60] так что его биологическая цель противоречива.[61]
Было выявлено, что некоторые соединения связывают cNTnC с низким сродством и действуют как активаторы тропонина: DFBP-O[62] (структурный аналог левосимендана), 4- (4- (2,5-диметилфенил) -1-пиперазинил) -3-пиридинамин (NCI147866),[63] и бепридил.[64] Также было обнаружено, что антагонист кальмодулина, W7, связывается с cNTnC, чтобы действовать как ингибитор тропонина.[65] Все эти соединения связываются с гидрофобным участком в открытой конформации cNTnC, причем активаторы тропонина способствуют взаимодействию с пептидом-переключателем cTnI, а ингибиторы тропонина дестабилизируют взаимодействие.
Ряд соединений также может связываться с cCTnC с низким сродством: EMD 57033,[66] ресвератрол,[67] бепридил,[68] и EGCG.[69] Все эти соединения известны своей неразборчивостью, и биологическое значение этих взаимодействий неизвестно. В частности, неизвестно, как взаимодействие с cCTnC влияет на сродство cNTnC к кальцию.
Теоретически активатор сердечного тропонина может быть полезен для увеличения сократительной способности сердца при лечении систолической сердечной недостаточности, тогда как ингибитор тропонина может использоваться для облегчения расслабления при лечении диастолической сердечной недостаточности. Модуляторы тропонина также могут быть использованы, чтобы обратить вспять влияние мутаций, вызывающих кардиомиопатию, в тонком филаменте.
Заметки
Версия этой статьи 2015 года была обновлена внешним экспертом в соответствии с моделью двойной публикации. Соответствующие академическая экспертная оценка статья была опубликована в Ген и может быть процитирован как: Моника Икс Ли; Питер М. Хванг (25 октября 2015 г.), «Структура и функция сердечного тропонина C (TNNC1): последствия для сердечной недостаточности, кардиомиопатий и препаратов, модулирующих тропонин», Ген, 571 (2): 153–66, Дои:10.1016 / J.GENE.2015.07.074, ISSN 0378-1119, ЧВК 4567495, PMID 26232335, Викиданные Q28607749 |
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000114854 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000091898 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Шрайер Т., Кедес Л., Гальманн Р. (декабрь 1990 г.). «Клонирование, структурный анализ и экспрессия гена медленных сокращающихся скелетных мышц человека / сердечного тропонина C». Журнал биологической химии. 265 (34): 21247–53. PMID 2250022.
- ^ Townsend PJ, Yacoub MH, Barton PJ (июль 1997 г.). «Отнесение гена тропонина С сердечной / медленной скелетной мышцы человека (TNNC1) между D3S3118 и GCT4B10 на коротком плече хромосомы 3 с помощью гибридного анализа соматических клеток». Анналы генетики человека. 61 (Pt 4): 375–7. Дои:10.1046 / j.1469-1809.1997.6140375.x. PMID 9365790. S2CID 2997137.
- ^ «Ген Энтреза: TNNC1 тропонин C типа 1 (медленный)».
- ^ «Тропонин С, медленные скелетные и сердечные мышцы». Атлас кардиоорганических белков (COPaKB) - Информация о белках.
- ^ а б Sia SK, Li MX, Spyracopoulos L, Gagné SM, Liu W, Putkey JA, Sykes BD (июль 1997 г.). «Структура тропонина С сердечной мышцы неожиданно обнаруживает закрытый регуляторный домен». Журнал биологической химии. 272 (29): 18216–21. Дои:10.1074 / jbc.272.29.18216. PMID 9218458.
- ^ Крецингер RH, Нокольдс CE (май 1973 г.). «Кальций-связывающий белок мышц карпа. II. Определение структуры и общее описание». Журнал биологической химии. 248 (9): 3313–26. PMID 4700463.
- ^ Стринадка NC, Джеймс М.Н. (июнь 1989 г.). «Кристаллические структуры кальций-связывающих белков спираль-петля-спираль». Ежегодный обзор биохимии. 58 (1): 951–999. Дои:10.1146 / annurev.bi.58.070189.004511. PMID 2673026.
- ^ Li MX, Saude EJ, Wang X, Pearlstone JR, Smillie LB, Sykes BD (июль 2002 г.). «Кинетические исследования связывания кальция и сердечного тропонина I пептида с сердечным тропонином C человека с использованием ЯМР-спектроскопии». Европейский биофизический журнал. 31 (4): 245–256. Дои:10.1007 / s00249-002-0227-1. PMID 12122471. S2CID 23676865.
- ^ ван Эрд Дж. П., Такахаши К. (май 1975 г.). «Аминокислотная последовательность тампонина-С сердца крупного рогатого скота. Сравнение с тропонином-С скелета кролика». Сообщения о биохимических и биофизических исследованиях. 64 (1): 122–7. Дои:10.1016 / 0006-291x (75) 90227-2. PMID 1170846.
- ^ Гиффорд Дж. Л., Уолш М. П., Фогель Г. Дж. (Июль 2007 г.). «Структуры и свойства связывания ионов металлов Ca2 + -связывающих мотивов EF-руки спираль-петля-спираль». Биохимический журнал. 405 (2): 199–221. Дои:10.1042 / BJ20070255. PMID 17590154. S2CID 11770498.
- ^ Spyracopoulos L, Li MX, Sia SK, Gagné SM, Chandra M, Solaro RJ, Sykes BD (октябрь 1997 г.). «Индуцированный кальцием структурный переход в регуляторном домене сердечного тропонина С человека». Биохимия. 36 (40): 12138–46. Дои:10.1021 / bi971223d. PMID 9315850. S2CID 6509305.
- ^ Эйхмюллер С., Скрынников Н.Р. (август 2005 г.). «Новый эксперимент с амидным протоном R1rho позволяет точно охарактеризовать конформационный обмен в микросекундном масштабе времени». Журнал биомолекулярного ЯМР. 32 (4): 281–293. Дои:10.1007 / s10858-005-0658-y. PMID 16211482. S2CID 44304061.
- ^ Кордина Н.М., Лью С.К., Гелл Д.А., Фаджер П.Г., Маккей Дж. П., Браун Л. Дж. (Март 2013 г.). «Влияние связывания кальция и мутации A8V гипертрофической кардиомиопатии на динамическое равновесие между закрытыми и открытыми конформациями регуляторного N-домена изолированного сердечного тропонина С». Биохимия. 52 (11): 1950–1962. Дои:10.1021 / bi4000172. PMID 23425245.
- ^ Брито Р.М., Круди Г.А., Негеле Дж. К., Путки Дж. А., Rosevear PR (октябрь 1993 г.). «Кальций играет отличительную структурную роль в N- и C-концевых доменах сердечного тропонина C». Журнал биологической химии. 268 (28): 20966–73. PMID 8407932.
- ^ а б Такеда С., Ямасита А., Маеда К., Маеда Y (июль 2003 г.). «Структура основного домена сердечного тропонина человека в Ca (2 +) - насыщенной форме». Природа. 424 (6944): 35–41. Дои:10.1038 / природа01780. PMID 12840750. S2CID 2174019.
- ^ Джонсон Дж. Д., Поттер Дж. Д. (июнь 1978 г.). «Обнаружение двух классов сайтов связывания Ca2 + в тропонине C с круговым дихроизмом и флуоресценцией тирозина». Журнал биологической химии. 253 (11): 3775–7. PMID 649605.
- ^ Джонсон Дж. Д., Коллинз Дж. Х., Робертсон СП, Поттер Дж. Д. (октябрь 1980 г.). «Флуоресцентное исследование связывания Са2 + с Са2 + -специфическими сайтами сердечного тропонина и тропонина С». Журнал биологической химии. 255 (20): 9635–40. PMID 7430090.
- ^ Перлстоун-младший, Смилли Л. «Идентификация второй области связывания на тропонине-Т скелета кролика для альфа-тропомиозина». Письма FEBS. 128 (1): 119–22. Дои:10.1016/0014-5793(81)81095-2. PMID 7274451. S2CID 85355424.
- ^ Джин Дж. П., Чонг С. М. (август 2010 г.). «Локализация двух сайтов связывания тропомиозина тропонина Т». Архивы биохимии и биофизики. 500 (2): 144–150. Дои:10.1016 / j.abb.2010.06.001. ЧВК 2904419. PMID 20529660.
- ^ Танокура М., Оцуки И. (май 1984 г.). «Взаимодействие между химотриптическими субфрагментами тропонина Т, тропомиозином, тропонином I и тропонином С». Журнал биохимии. 95 (5): 1417–21. Дои:10.1093 / oxfordjournals.jbchem.a134749. PMID 6746613.
- ^ Севриева И., Ноулз А.С., Кампуракис Т., Сан Ю.Б. (октябрь 2014 г.). «Регуляторный домен тропонина динамически перемещается во время активации сердечной мышцы». Журнал молекулярной и клеточной кардиологии. 75: 181–7. Дои:10.1016 / j.yjmcc.2014.07.015. ЧВК 4169182. PMID 25101951.
- ^ а б Bers DM (август 2000 г.). «Потоки кальция, участвующие в контроле сокращения сердечных миоцитов». Циркуляционные исследования. 87 (4): 275–81. Дои:10.1161 / 01.res.87.4.275. PMID 10948060.
- ^ Tripet B, Ван Эйк Дж. Э., Ходжес RS (сентябрь 1997 г.). «Картирование второго актин-тропомиозина и второго сайта связывания тропонина С в пределах С-конца тропонина I, и их важность в Са2 + -зависимой регуляции мышечного сокращения». Журнал молекулярной биологии. 271 (5): 728–50. Дои:10.1006 / jmbi.1997.1200. PMID 9299323.
- ^ Ramos CH (июнь 1999 г.). «Картирование субдоменов в C-концевой области тропонина I, участвующих в его связывании с тропонином C и с тонким филаментом». Журнал биологической химии. 274 (26): 18189–95. Дои:10.1074 / jbc.274.26.18189. PMID 10373418.
- ^ Ли М.Х., Спайракопулос Л., Сайкс Б.Д. (июнь 1999 г.). «Связывание сердечного тропонина-I147-163 вызывает структурное открытие сердечного тропонина-С человека». Биохимия. 38 (26): 8289–98. Дои:10.1021 / bi9901679. PMID 10387074.
- ^ Дэвис Дж. П., Норман К., Кобаяши Т., Соларо Р. Дж., Шварц Д. Р., Тикунова С.Б. (май 2007 г.). «Влияние белков тонких и толстых филаментов на связывание кальция и обмен с сердечным тропонином С». Биофизический журнал. 92 (9): 3195–3206. Дои:10.1529 / biophysj.106.095406. ЧВК 1852344. PMID 17293397.
- ^ фон дер Экен Дж., Мюллер М., Леман В., Манштейн Д. Д., Пенчек П. А., Раунсер С. (март 2015 г.). «Структура комплекса F-актин-тропомиозин». Природа. 519 (7541): 114–117. Дои:10.1038 / природа14033. ЧВК 4477711. PMID 25470062.
- ^ Behrmann E, Müller M, Penczek PA, Mannherz HG, Manstein DJ, Raunser S (июль 2012 г.). «Структура комплекса актин-тропомиозин-миозин окоченения». Ячейка. 150 (2): 327–38. Дои:10.1016 / j.cell.2012.05.037. ЧВК 4163373. PMID 22817895.
- ^ фон дер Эккен Дж., Хейсслер С. М., Патан-Чхатбар С., Манштейн Д. Д., Раунсер С. (июнь 2016 г.). «Крио-ЭМ структура цитоплазматического актомиозинового комплекса человека при почти атомном разрешении». Природа. 534 (7609): 724–28. Дои:10.1038 / природа18295. PMID 27324845. S2CID 4472407.
- ^ Хван ПМ, Сайкс Б.Д. (апрель 2015 г.). «Ориентация саркомера на исправление мышечной функции». Обзоры природы. Открытие наркотиков. 14 (5): 313–28. Дои:10.1038 / nrd4554. PMID 25881969. S2CID 21888079.
- ^ Хван П.М., Цай Ф., Пинеда-Санабрия, ЮВ, Корсон, округ Колумбия, Сайкс, Б.Д. (октябрь 2014 г.). «Специфическая для сердца N-концевая область тропонина I позиционирует регуляторный домен тропонина C». Труды Национальной академии наук Соединенных Штатов Америки. 111 (40): 14412–14417. Дои:10.1073 / pnas.1410775111. ЧВК 4210035. PMID 25246568.
- ^ Чжан Дж., Гай MJ, Норман Х.С., Чен Ю.С., Сюй Кью, Донг Х, Гунер Х., Ван С., Кохмото Т., Янг К.Х., Мосс Р.Л., Ге Y (сентябрь 2011 г.). «Нисходящая количественная протеомика определила фосфорилирование сердечного тропонина I как кандидата в биомаркеры хронической сердечной недостаточности». Журнал протеомных исследований. 10 (9): 4054–65. Дои:10.1021 / пр200258м. ЧВК 3170873. PMID 21751783.
- ^ Кобаяши Т., Ян Х, Уокер Л.А., Ван Бримен РБ, Соларо Р.Дж. (январь 2005 г.). «Неравновесный метод изоэлектрического фокусирования для определения состояний фосфорилирования сердечного тропонина I: идентификация Ser-23 и Ser-24 как значимых участков фосфорилирования протеинкиназой C». Журнал молекулярной и клеточной кардиологии. 38 (1): 213–8. Дои:10.1016 / j.yjmcc.2004.10.014. PMID 15623438.
- ^ Рик, округ Колумбия, Ли К.Л., Оуян Ю., Соларо Р.Дж., Донг В.Дж. (сентябрь 2013 г.). «Структурная основа сенсибилизации сердечного тропонина C in situ Ca (2+) за счет положительной обратной связи от миозиновых поперечных мостиков, генерирующих силу». Архивы биохимии и биофизики. 537 (2): 198–209. Дои:10.1016 / j.abb.2013.07.013. ЧВК 3836555. PMID 23896515.
- ^ Wijnker PJ, Sequeira V, Foster DB, Li Y, Dos Remedios CG, Murphy AM, Stienen GJ, van der Velden J (апрель 2014 г.). «Зависимая от длины активация модулируется бисфосфорилированием сердечного тропонина I по Ser23 и Ser24, но не фосфорилированием Thr143». Американский журнал физиологии. Сердце и физиология кровообращения. 306 (8): H1171–81. Дои:10.1152 / ajpheart.00580.2013. ЧВК 3989756. PMID 24585778.
- ^ Wijnker PJ, Sequeira V, Witjas-Paalberends ER, Foster DB, dos Remedios CG, Murphy AM, Stienen GJ, van der Velden J (июль 2014 г.). «Фосфорилирование сайтов протеинкиназы C Ser42 / 44 снижает чувствительность к Ca (2+) и подавляет усиленную зависимую от длины активацию в ответ на протеинкиназу A в кардиомиоцитах человека». Архивы биохимии и биофизики. 554: 11–21. Дои:10.1016 / j.abb.2014.04.017. ЧВК 4121669. PMID 24814372.
- ^ Семзарян К., Инглес Дж., Марон М.С., Марон Б.Дж. (март 2015 г.). «Новые взгляды на распространенность гипертрофической кардиомиопатии». Журнал Американского колледжа кардиологии. 65 (12): 1249–1254. Дои:10.1016 / j.jacc.2015.01.019. PMID 25814232.
- ^ Парватияр М.С., Ландстрем А.П., Фигейредо-Фрейтас К., Поттер Дж. Д., Акерман М. Дж., Пинто Дж. Р. (сентябрь 2012 г.). «Мутация TNNC1-кодируемого сердечного тропонина C, TNNC1-A31S, предрасполагает к гипертрофической кардиомиопатии и фибрилляции желудочков». Журнал биологической химии. 287 (38): 31845–55. Дои:10.1074 / jbc.M112.377713. ЧВК 3442518. PMID 22815480.
- ^ Ландстром А.П., Парватияр М.С., Пинто-младший, Марквардт М.Л., Бос Дж.М., ди-джей-испытатель, Оммен С.Р., Поттер Д.Д., Акерман М.Дж. (август 2008 г.). «Молекулярная и функциональная характеристика новых мутаций восприимчивости к гипертрофической кардиомиопатии в тропонине С, кодируемом TNNC1». Журнал молекулярной и клеточной кардиологии. 45 (2): 281–288. Дои:10.1016 / j.yjmcc.2008.05.003. ЧВК 2627482. PMID 18572189.
- ^ Хоффманн Б., Шмидт-Трауб Х., Перро А, Остерзил К.Дж., Гесснер Р. (июнь 2001 г.). «Первая мутация сердечного тропонина C, L29Q, у пациента с гипертрофической кардиомиопатией». Человеческая мутация. 17 (6): 524. Дои:10.1002 / humu.1143. PMID 11385718. S2CID 28579333.
- ^ Виллотт Р.Х., Гомес А.В., Чанг А.Н., Парватияр М.С., Пинто Дж. Р., Поттер Дж. Д. (май 2010 г.). «Мутации в тропонине, вызывающие HCM, DCM и RCM: что мы можем узнать о функции тонких филаментов?». Журнал молекулярной и клеточной кардиологии. 48 (5): 882–892. Дои:10.1016 / j.yjmcc.2009.10.031. PMID 19914256.
- ^ Чанг А.Н., Парватияр М.С., Поттер Д.Д. (апрель 2008 г.). «Тропонин и кардиомиопатия». Сообщения о биохимических и биофизических исследованиях. 369 (1): 74–81. Дои:10.1016 / j.bbrc.2007.12.081. PMID 18157941.
- ^ Лим СС, Ян Х., Ян М., Ван С.К., Ши Дж., Берг Э.А., Пиментел Д.Р., Гватмей Дж.К., Хаджар Р.Дж., Хельмес М., Костелло К.Э., Хо С., Ляо Р. (май 2008 г.). «Новый мутантный сердечный тропонин C нарушает молекулярные движения, критические для аффинности связывания кальция и сократимости кардиомиоцитов». Биофизический журнал. 94 (9): 3577–89. Дои:10.1529 / biophysj.107.112896. ЧВК 2292379. PMID 18212018.
- ^ Хершбергер Р. Э., Нортон Н., Моралес А., Ли Д., Зигфрид Дж. Д., Гонсалес-Кинтана Дж. (Апрель 2010 г.). «Редкие варианты кодирующей последовательности, идентифицированные в MYBPC3, MYH6, TPM1, TNNC1 и TNNI3 от 312 пациентов с семейной или идиопатической дилатационной кардиомиопатией». Обращение: сердечно-сосудистая генетика. 3 (2): 155–161. Дои:10.1161 / CIRCGENETICS.109.912345. ЧВК 2908892. PMID 20215591.
- ^ van Spaendonck-Zwarts KY, van Tintelen JP, van Veldhuisen DJ, van der Werf R, Jongbloed JD, Paulus WJ, Dooijes D, van den Berg MP (май 2010 г.). «Послеродовая кардиомиопатия как часть семейной дилатационной кардиомиопатии». Тираж. 121 (20): 2169–2175. Дои:10.1161 / CIRCULATIONAHA.109.929646. PMID 20458010.
- ^ Могенсен Дж., Мерфи Р.Т., Шоу Т., Бахл А., Редвуд С., Уоткинс Х., Берк М., Эллиотт П.М., Маккенна В.Дж. (ноябрь 2004 г.). «Тяжелое заболевание экспрессии сердечных мутаций тропонина C и T у пациентов с идиопатической дилатационной кардиомиопатией». Журнал Американского колледжа кардиологии. 44 (10): 2033–2040. Дои:10.1016 / j.jacc.2004.08.027. PMID 15542288.
- ^ Memo M, Leung MC, Ward DG, dos Remedios C, Morimoto S, Zhang L, Ravenscroft G, McNamara E, Nowak KJ, Marston SB, Messer AE (июль 2013 г.). «Семейные мутации при дилатационной кардиомиопатии отделяют фосфорилирование тропонина I от изменений в чувствительности миофибриллы к Ca²». Сердечно-сосудистые исследования. 99 (1): 65–73. Дои:10.1093 / cvr / cvt071. PMID 23539503.
- ^ Хван П.М., Цай Ф., Пинеда-Санабрия, ЮВ, Корсон, округ Колумбия, Сайкс, Б.Д. (октябрь 2014 г.). «Специфическая для сердца N-концевая область тропонина I позиционирует регуляторный домен тропонина C». Труды Национальной академии наук Соединенных Штатов Америки. 111 (40): 14412–14417. Дои:10.1073 / pnas.1410775111. ЧВК 4210035. PMID 25246568.
- ^ Рассел А.Дж., Хартман Дж.Дж., Хинкен А.С., Мучи А.Р., Кавас Р., Дрисколл Л., Годинез Дж., Ли К.Х., Маркес Д., Браун В.Ф., Чен М.М., Кларк Д., Коллиби С.Е., Гарард М., Хансен Р., Цзя З, Лу П.П. , Родригес Х., Сайкали К.Г., Шалецки Дж., Виджаякумар В., Альбертус Д.Л., Клафлин Д.Р., Морганс Д.Д., Морган Б.П., Малик Ф.И. (март 2012 г.). «Активация быстрых тропонинов скелетных мышц как потенциальный терапевтический подход для лечения нервно-мышечных заболеваний». Природа Медицина. 18 (3): 452–455. Дои:10,1038 / нм.2618. ЧВК 3296825. PMID 22344294.
- ^ Шефнер Дж. М., Вольф А. А., Мэн Л. (декабрь 2013 г.). «Взаимосвязь между концентрацией тирасемтива в сыворотке и функциональными результатами у пациентов с БАС». Боковой амиотрофический склероз и лобно-височная дегенерация. 14 (7–8): 582–5. Дои:10.3109/21678421.2013.817587. PMID 23952600. S2CID 25563161.
- ^ Бауэр Т.А., Вольф А.А., Хирш А.Т., Менг Л.Л., Роджерс К., Малик ФИ, Хиатт В.Р. (май 2014 г.). «Эффект тирасемтива, селективного активатора комплекса тропонинов быстрых скелетных мышц, у пациентов с заболеванием периферических артерий». Сосудистая медицина. 19 (4): 297–306. Дои:10.1177 / 1358863X14534516. PMID 24872402. S2CID 25185883.
- ^ Сандерс ДБ, Розенфельд Дж., Димаки М.М., Мэн Л., Малик Ф.И., Эндрюс Дж., Барон Р., Корс А., Дебу А., Феличе К., Харати И., Хейман-Паттерсон Т., Ховард Дж. Ф., Джексон С., Джуэл В., Кац Дж., Ли Дж., Месси Дж., Маквей А., Мозаффар Т., Паснор М., Смолл Джи, Со И, Ван А.К., Вайнберг Д., Вольф А.А. (апрель 2015 г.). «Двойное слепое рандомизированное плацебо-контролируемое исследование для оценки эффективности, безопасности и переносимости однократных доз тирасемтива у пациентов с миастенией гравис с положительной реакцией на рецептор ацетилхолина». Нейротерапия. 12 (2): 455–60. Дои:10.1007 / s13311-015-0345-у. ЧВК 4404445. PMID 25742919.
- ^ Сорса Т., Поллеселло П., Перми П., Дракенберг Т., Килпеляйнен И. (сентябрь 2003 г.). «Взаимодействие левосимендана с сердечным тропонином С в присутствии пептидов сердечного тропонина I.». Журнал молекулярной и клеточной кардиологии. 35 (9): 1055–61. Дои:10.1016 / с0022-2828 (03) 00178-0. PMID 12967628.
- ^ Робертсон И.М., Барышникова О.К., Ли М.Х., Сайкс Б.Д. (июль 2008 г.). «Определение сайта связывания левосимендана и его аналогов в регуляторном комплексе сердечного тропонина C-тропонина I». Биохимия. 47 (28): 7485–95. Дои:10.1021 / bi800438k. ЧВК 2652250. PMID 18570382.
- ^ Kleerekoper Q, Putkey JA (август 1999 г.). «Связывание лекарств с сердечным тропонином С». Журнал биологической химии. 274 (34): 23932–9. Дои:10.1074 / jbc.274.34.23932. PMID 10446160.
- ^ Szilágyi S, Pollesello P, Levijoki J, Kaheinen P, Haikala H, Edes I, Papp Z (февраль 2004 г.). «Действие левосимендана и OR-1896 на изолированные сердца, препараты размером с миоциты и ферменты фосфодиэстеразы морской свинки». Европейский журнал фармакологии. 486 (1): 67–74. Дои:10.1016 / j.ejphar.2003.12.005. PMID 14751410.
- ^ Ørstavik Ø, Manfra O, Andressen KW, Andersen GØ, Skomedal T, Osnes JB, Levy FO, Krobert KA (2015). «Инотропный эффект активного метаболита левосимендана OR-1896 опосредован ингибированием PDE3 в миокарде желудочков крыс». PLOS ONE. 10 (3): e0115547. Дои:10.1371 / journal.pone.0115547. ЧВК 4349697. PMID 25738589.
- ^ Робертсон И.М., Сан Й.Б., Ли М.Х., Сайкс Б.Д. (декабрь 2010 г.). «Структурная и функциональная перспектива механизма действия Ca2 + -сенсибилизаторов, воздействующих на комплекс сердечного тропонина». Журнал молекулярной и клеточной кардиологии. 49 (6): 1031–41. Дои:10.1016 / j.yjmcc.2010.08.019. ЧВК 2975748. PMID 20801130.
- ^ Lindert S, Li MX, Sykes BD, McCammon JA (февраль 2015 г.). «Компьютерный подход к открытию лекарств позволяет обнаружить кальций-сенсибилизатор сердечного тропонина». Химическая биология и дизайн лекарств. 85 (2): 99–106. Дои:10.1111 / cbdd.12381. ЧВК 4456024. PMID 24954187.
- ^ Ван Х, Ли МХ, Сайкс Б.Д. (август 2002 г.). «Структура регуляторного N-домена сердечного тропонина С человека в комплексе с сердечным тропонином человека I147-163 и бепридилом». Журнал биологической химии. 277 (34): 31124–33. Дои:10.1074 / jbc.M203896200. PMID 12060657.
- ^ Олещук М., Робертсон И.М., Ли М.Х., Сайкс Б.Д. (май 2010 г.). «Структура раствора регуляторного домена сердечного тропонина С человека в комплексе с переключающей областью сердечного тропонина I и W7: основа W7 как ингибитора сокращения сердечной мышцы». Журнал молекулярной и клеточной кардиологии. 48 (5): 925–33. Дои:10.1016 / j.yjmcc.2010.01.016. ЧВК 2854253. PMID 20116385.
- ^ Ван Х, Ли М.Х., Спиракопулос Л., Байер Н., Чандра М., Соларо Р.Дж., Сайкс Б.Д. (июль 2001 г.). «Структура C-домена сердечного тропонина C человека в комплексе с Ca2 + -сенсибилизирующим препаратом EMD 57033». Журнал биологической химии. 276 (27): 25456–66. Дои:10.1074 / jbc.M102418200. PMID 11320096.
- ^ Пинеда-Санабрия С.Е., Робертсон И.М., Сайкс Б.Д. (март 2011 г.). «Структура транс-ресвератрола в комплексе с сердечным регуляторным белком тропонином С». Биохимия. 50 (8): 1309–20. Дои:10.1021 / bi101985j. ЧВК 3043152. PMID 21226534.
- ^ Ли Ю., Лав М.Л., Путки Дж. А., Коэн С. (май 2000 г.). «Бепридил открывает регуляторную N-концевую долю сердечного тропонина С». Труды Национальной академии наук Соединенных Штатов Америки. 97 (10): 5140–5. Дои:10.1073 / pnas.090098997. ЧВК 25795. PMID 10792039.
- ^ Робертсон И.М., Ли М.Х., Сайкс Б.Д. (август 2009 г.). «Структура раствора сердечного тропонина С человека в комплексе с полифенолом зеленого чая, (-) - эпигаллокатехин 3-галлат». Журнал биологической химии. 284 (34): 23012–23. Дои:10.1074 / jbc.M109.021352. ЧВК 2755708. PMID 19542563.
внешние ссылки
- Масс-спектрометрическая характеристика человеческого TNNC1 на COPaKB.[1]
- GeneReviews / NIH / NCBI / UW запись об обзоре семейной гипертрофической кардиомиопатии
- Обзор всей структурной информации, доступной в PDB для UniProt: P63316 (Тропонин С, медленные скелетные и сердечные мышцы) в PDBe-KB.
- ^ Zong NC, Li H, Li H, Lam MP, Jimenez RC, Kim CS, Deng N, Kim AK, Choi JH, Zelaya I, Liem D, Meyer D, Odeberg J, Fang C, Lu HJ, Xu T, Weiss J , Дуан Х., Улен М., Йетс Дж. Р., Апвейлер Р., Ге Дж., Хермякоб Х., Пинг П. (октябрь 2013 г.). «Интеграция биологии кардиального протеома и медицины посредством специализированной базы знаний». Циркуляционные исследования. 113 (9): 1043–53. Дои:10.1161 / CIRCRESAHA.113.301151. ЧВК 4076475. PMID 23965338.