Респираторный вирус мыши - Murine respirovirus
| Респираторный вирус мыши | |
|---|---|
| Классификация вирусов | |
| (без рейтинга): | Вирус |
| Область: | Рибовирия |
| Королевство: | Орторнавиры |
| Тип: | Негарнавирикота |
| Учебный класс: | Monjiviricetes |
| Заказ: | Mononegavirales |
| Семья: | Paramyxoviridae |
| Род: | Респировирус |
| Разновидность: | Респираторный вирус мыши |
| Синонимы | |
| |
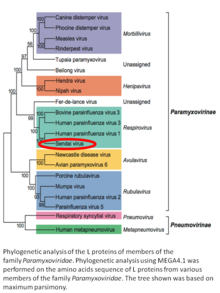
Респираторный вирус мыши, ранее Сендайский вирус (SeV) и ранее также известный как вирус парагриппа мышей типа 1 или гемагглютинирующий вирус Японии (HVJ), представляет собой окутанный, Диаметром 150-200 нм, a отрицательный смысл, одноцепочечный вирус РНК семьи Paramyxoviridae.[2][3] Обычно он поражает грызунов и не является патогенным для человека или домашних животных. Вирус Сендай (SeV) является представителем рода Респировирус.[4][5] Вирус был изолирован в г. Сендай в Япония в начале 1950-х гг. С тех пор он активно используется в исследованиях в качестве модельного возбудителя. Вирус заразен для многих линий раковых клеток (см. Ниже), обладает онколитическими свойствами, продемонстрированными на животных моделях.[6][7] и при естественном раке у животных.[8] Способность SeV сливать эукариотические клетки и образовывать синцитий был использован для производства гибридома ячейки, способные производить моноклональные антитела в большом количестве.[9] Недавние применения векторов на основе SeV включают перепрограммирование соматических клеток в индуцированные плюрипотентные стволовые клетки[10][11] и создание вакцин. Для вакцинации конструкции на основе вируса Сендай могут быть доставлены в форме назальных капель, которые могут быть полезными для индукции иммунный ответ слизистой оболочки. SeV имеет несколько особенностей, которые важны для вектора для успешной вакцины: вирус не интегрируется в геном хозяина, он не подвергается генетической рекомбинации, он реплицируется только в цитоплазме без промежуточных продуктов ДНК или ядерной фазы, и он не вызывает любое заболевание человека или домашних животных. Вирус Сендай используется в качестве основы для разработки вакцины против Микобактерии туберкулеза что вызывает туберкулез, против ВИЧ-1 что вызывает СПИД и против респираторно-синцитиального вируса (RSV)[12] вызывающий респираторную инфекцию у детей. Разработка вакцины против Микобактерии туберкулеза находится в доклинической стадии,[13] против ВИЧ-1 он достиг фазы II клинических испытаний[14][15] а против RSV - в фазе I.[16] Университет Фудань совместно с ID Pharma Co. Ltd. занимается разработкой вакцины для профилактики COVID-19. SeV служит в проекте основным вектором вакцины.[17]
Как возбудитель инфекции
Репликация SeV происходит исключительно в цитоплазме клетки-хозяина. Вирус использует собственную РНК-полимеразу. Один цикл репликации занимает примерно 12–15 часов, при этом одна клетка дает тысячи вирионов.[18]
Восприимчивые животные
Вирус ответственен за высокотрансмиссивную инфекцию дыхательных путей у мышей, хомяков, морских свинок, крыс,[19] а иногда и мартышки,[20] с инфекцией, передаваемой как воздушным, так и прямым контактным путем. Естественное заражение происходит через дыхательные пути. В животноводческих помещениях передача по воздуху может происходить на расстоянии 5–6 футов, а также через системы обработки воздуха. Вирус можно обнаружить в колониях мышей по всему миру,[21] обычно при кормлении молодых взрослых мышей. Исследование, проведенное во Франции, сообщило об антителах к SeV в 17% исследованных колоний мышей.[22] Эпизоотический инфекции мышей обычно связаны с высокой смертностью, в то время как энзоотический Характер заболеваний предполагает, что вирус является латентным и может быть удален в течение года.[3] Сублетальное воздействие SeV может способствовать сохранению стойкого иммунитета к дальнейшим смертельным дозам SeV.[23] Вирус является иммунодепрессивным и может предрасполагать к вторичным бактериальным инфекциям.[24] Нет никаких научных исследований, которые были бы выполнены с использованием современных методов обнаружения, которые идентифицировали бы SeV как инфекционную и вызывающую болезнь человека или домашних животных.[нужна цитата ]


Различная восприимчивость к инфекциям у линий мышей и крыс
У инбредных и аутбредных линий мышей и крыс очень разная восприимчивость к заражению вирусом Сендай. Визуализация инфекции SeV у живых животных демонстрирует это различие.[25] Тестированные мыши 129 / J были примерно в 25000 раз более чувствительными, чем мыши SJL / J.[26] C57BL / 6 мыши обладают высокой устойчивостью к вирусу, а мыши DBA / 2J чувствительны.[27] C57BL / 6 мыши показали небольшую потерю массы тела после введения SeV, которая позже нормализовалась. Только 10% смертность наблюдалась в C57BL / 6 мыши после введения очень высокой вирулентной дозы 1 * 105 TCID50.[28] Было показано, что устойчивость к летальным эффектам вируса Сендай у мышей контролируется генетически и выражается посредством контроля репликации вируса в течение первых 72 часов после заражения.[27] Обработка обоих штаммов экзогенным ИФН до и во время вирусной инфекции привела к увеличению времени выживания у C57BL / 6 мышей, но все животные обеих линий в конечном итоге погибают от болезни, вызванной SeV.[29] Если мышь выживает после заражения SeV, у нее на всю жизнь развивается иммунитет к последующим вирусным инфекциям.[30]
Существуют устойчивые к SeV крысы F344 и чувствительные крысы BN.[31]
Течение инфекции
В дыхательных путях хозяина титр вируса достигает пика через 5–6 дней после инициации инфекции, который снижается до неопределяемого уровня к 14-му дню.[32] Вирус способствует нисходящей респираторной инфекции, которая начинается в носовых проходах, проходит через трахею в легкие и вызывает некроз респираторного эпителия. Некроз мягкий в первые несколько дней заражения, но позже стал тяжелым, достигнув пика примерно на 5 день. К 9-му дню клетки поверхности дыхательных путей регенерируют. Может развиться очаговая интерстициальная пневмония, сопровождающаяся воспалением и поражением легких различной степени. Обычно респираторная система показывает признаки заживления в течение 3 недель после заражения, однако могут возникнуть остаточные поражения, воспаление или постоянное рубцевание. Через 6–8 дней после инициации инфекции появляются сывороточные антитела. Они остаются обнаруживаемыми около 1 года.[нужна цитата ]
Симптомы у животных
- Чихание
- Сгорбленная поза
- Респираторный дистресс
- Порфирин выделения из глаз и / или носа
- Вялость
- Неспособность выжить в выживших детенышах и молодых крысах
- Анорексия
Диагностика и профилактика
SeV вызывает поражения дыхательных путей, обычно связанные с бактериальным воспалением трахеи и легких (трахеит и бронхопневмония, соответственно). Однако поражения ограничены и не указывают исключительно на инфекцию SeV. Таким образом, для обнаружения используются SeV-специфические антигены в нескольких серологический методы, в том числе ELISA, иммунофлуоресценция и анализы гемагглютинации, с особым упором на использование ELISA из-за его высокой чувствительности (в отличие от гемагглютинация анализ) и его достаточно раннее обнаружение (в отличие от иммунофлуоресцентного анализа).[33]
В естественных условиях респираторная инфекция вируса Сендай у мышей протекает остро. Исходя из экстраполяции инфекции лабораторных мышей, присутствие вируса может быть сначала обнаружено в легких через 48-72 часа после заражения. Поскольку вирус реплицируется в дыхательных путях инфицированной мыши, концентрация вируса наиболее быстро растет в течение третьего дня заражения. После этого вирус растет медленнее, но стабильно. Обычно пиковая концентрация вируса приходится на шестой или седьмой день, а к девятому дню следует быстрое снижение. Причиной этого снижения является довольно сильный иммунный ответ, направленный против вируса. Самый длительный период обнаруженного присутствия вируса в легком мыши составляет четырнадцать дней после заражения.[34]
Eaton и другие. советует, что при борьбе со вспышкой SeV дезинфекция лабораторной среды и вакцинация заводчиков, а также уничтожение инфицированных животных и проверка поступающих животных должны очень быстро решить проблему. Импортированные животные должны быть вакцинированы SeV и помещены на карантин, в то время как в лабораторных условиях программы разведения должны быть прекращены, а не размножающихся взрослых особей изолировать на два месяца.[35]
Вирусная иммуносупрессия
Вирус - мощный иммуномодулятор. SeV может действовать в обоих направлениях: он может активировать или подавлять иммунный ответ в зависимости от типа клетки, хозяина и периода времени после инициации инфекции. Вирус может подавлять выработку IFN и пути ответа, а также воспаление путь.[нужна цитата ]
Подавление апоптоза
Ген P вируса Сендай кодирует вложенный набор белков (C ', C, Y1 и Y2), которые в совокупности названы белками C (см. Раздел «Структура генома» ниже). Белки C SeV способны подавлять апоптоз.[36] Антиапоптотическая активность белков C поддерживает инфекцию SeV в клетках-хозяевах.

Ингибирование продукции интерферона и передачи сигнала
Вирус препятствует стимуляции IFN типа 1 производство и последующий апоптоз клеток в ответ на вирусную инфекцию путем ингибирования активации IRF-3.[37][38][39] В этом процессе в основном участвуют два вирусных белка: C и V. SeV может ослаблять механизмы клеточной защиты и позволять себе ускользать от врожденного иммунитета хозяина, ингибируя путь ответа на интерферон в дополнение к ингибированию продукции интерферона.[нужна цитата ]
| белок | привязка с | эффект |
|---|---|---|
| С-протеин | IKKα серин / треонинкиназа | Связывание предотвращает фосфорилирование IRF7 и ингибирует путь, который включает Толл-подобный рецептор (TLR7) и TLR9 -индукция IFN-альфа в плазмацитоиде дендритные клетки.[40] |
| субъединица 2 рецептора интерферона-альфа / бета (IFNAR2) | Связывание ингибирует стимулированное IFN-α фосфорилирование тирозина вышележащих рецептор-ассоциированных киназ. TYK2 и JAK1.[41] | |
| N-концевой домен STAT1 | Связывание подавляет пути передачи сигнала интерферон альфа / бета (IFN-α / β) и IFN-γ[42][43] | |
| C-белок подавляет выработку оксид азота (NO) мышиной макрофаги[44][45] обладающий цитотоксической активностью против вирусов.[46] | ||
| Белок C снижает образование дцРНК, поэтому он сохраняет PKR неактивной для поддержания трансляции белков в клетке-хозяине.[47] | ||
| V-белок | MDA5 | Связывание ингибирует последующую активацию MDA5 промотора IFN.[48][49] |
| RIG-I | Привязка предотвращает передачу сигналов RIG-I в нисходящем направлении к митохондриальный противовирусный сигнальный белок (MAVS) путем нарушения TRIM25-опосредованного убиквитинирования RIG-I.[50] Связывание подавляет индуцибельную NO-синтазу (iNOS) через путь RIG-I / TRIM25 и снижает продукцию оксида азота (NO) в инфицированных макрофагах.[51] | |
| TRIM25 | ||
| V-белок подавляет выработку интерлейкин-1β, препятствуя сборке воспаление NLRP3.[52] |
Анти-IFN активность белка C одинакова для всей семьи Paramyxoviridae, и поэтому, по-видимому, играет важную роль в уклонении от иммунитета к парамиксовирусам.[40] Вирус парагриппа человека типа 1 (HPIV1), который является близким родственником SeV и является (в отличие от SeV) успешным патогеном человека, не экспрессирует V-белки, только C-белки. Таким образом, все необходимые функции, предоставляемые V в SeV, могут быть предоставлены C в HPIV1. Таким образом, C и V имеют эти «перекрывающиеся функции» из-за многогранной природы защиты хозяина, которой можно противостоять во многих местах, и именно то, насколько хорошо и где частично объясняет ограничение хозяина.[53]
Ограничение содержания и безопасность домашних животных
В настоящее время нет научных данных, полученных с использованием современных методов обнаружения, которые позволили бы идентифицировать SeV как возбудителя инфекционных заболеваний человека или домашних животных. Современные методы идентификации патогенных микроорганизмов никогда не выявляли SeV у свиней или других домашних животных, несмотря на выделение других парамиксовирусов.[54][55][56][57][58][59] Следовательно, признано, что инфекция, вызываемая вирусом Сендай, является хозяин ограничивает грызунов, и вирус не вызывает заболеваний у людей[60] или домашние животные, которые являются естественными хозяевами собственных вирусов парагриппа. После экспериментального заражения SeV вирус может реплицироваться и распространяться из верхних и нижних дыхательных путей африканских зеленых мартышек и шимпанзе, но не вызывает никаких заболеваний.[61] Вирус Сендай был использован и продемонстрировал высокий профиль безопасности в клинические испытания с участием обоих взрослых[60] и дети[62] сделать иммунизацию против вирус парагриппа человека тип 1, так как два вируса имеют общие антигенные детерминанты и вызвать генерацию перекрестной реакции нейтрализующие антитела. Исследование, опубликованное в 2011 году, показало, что антитела, нейтрализующие SeV (которые образовывались из-за вирус парагриппа человека инфекция типа 1) может быть обнаружена у 92,5% людей во всем мире со средним значением EC50 титр 60,6 и значения в диапазоне 5,9–11 324.[63] Низкий фон антител против SeV не блокирует способность вакцины на основе SeV стимулировать антиген-специфический Т-клеточный иммунитет.[64]
Исторические проблемы безопасности
В 1952 году Куроя и его коллеги попытались идентифицировать инфекционный агент в образцах тканей человека. Университет Тохоку Больница, Сендай, Япония. Образцы были взяты из легкого новорожденного ребенка, заболевшего пневмонией со смертельным исходом. Первичный изолят из образцов пассировали на мышах, а затем на мышах. зародыш яйца.[65][66] Выделенный инфекционный агент позже был назван вирусом Сендай, который использовался взаимозаменяемо с названием «гемагглютинирующий вирус Японии». Куроя и его коллеги были убеждены, что они изолировали вирус, который является новым этиологическим агентом респираторных инфекций человека. Позже, в 1954 году, Фукуми и его коллеги из Японского национального института здравоохранения предложили альтернативное объяснение происхождения вируса. Было высказано предположение, что мыши, использованные для пассирования вируса, были инфицированы вирусом мыши. Таким образом, вирус мыши был позже перенесен на яйца с зародышем, выделен и окончательно назван вирусом Сендай.[67] Это объяснение Фукуми, указывающее на мышиное, а не на человеческое происхождение вируса, было позже подтверждено многочисленными научными данными. В обзоре хорошо описаны исторические аспекты изоляции вируса Сендай и споры, стоящие за ним.[3] Таким образом, в течение некоторого времени ошибочно предполагалось, что вирус Сендай является возбудителем болезней человека.[68] О неправильном предположении, что вирус был выделен из инфекционного материала человека, до сих пор сообщает Encyclopædia Britannica.[69] и по ATCC в описании истории вирусного изолята Сендай / 52.[70] Также считалось, что вирус может вызывать заболевание не только у людей, но и у свиней, поскольку антитела к вирусу часто обнаруживались в их организмах во время эпидемии свиней в Японии в 1953–1956 годах. Высокая частота серопозитивности к вирусу наблюдалась у свиней в 15 округах Японии.[68] Позднее было найдено объяснение этому широко распространенному обнаружению антител (см. Раздел ниже). Тем не менее, несмотря на неопровержимые доказательства того, что SeV является рестриктивным патогеном для грызунов, в некоторых ветеринарных руководствах [2] листовки по безопасности,Сендайский информационный бюллетень о вирусе - Стэнфорд, экологическое здоровье и безопасность [3][71][72] SeV до сих пор числится в списке вирусов, которые могут вызывать болезни у свиней. Аналогичная информация предоставлена Encyclopædia Britannica.[69] На самом деле множественные изоляты парамиксовирусов у свиней с использованием современных методов секвенирования нуклеиновых кислот никогда не были идентифицированы как SeV.[54][55][56][57][58][59][чрезмерное цитирование ]
Антигенная стабильность и перекрестно-реактивные антитела
Все вирусы в семье Paramyxoviridae находятся антигенно стабильный; поэтому представители семейства, которые являются близкими родственниками и принадлежат к одному роду, скорее всего, имеют общие антигенные детерминанты. Таким образом, парагрипп свиней 1,[56][57] который имеет высокую гомологию последовательности с SeV[56] а также принадлежит к тому же роду Респировирус поскольку СэВ, вероятно, имеет перекрестно-реактивный антитела с Сев. Возможно парагрипп свиней 1 был ответственен за болезнь свиней в Японии в 1953–1956 гг.[68] Однако антигенная перекрестная реактивность между этими двумя представителями в пределах рода Респировирус может объяснить, почему антитела к SeV были обнаружены у больных свиней и почему считалось, что SeV был этиологическим возбудителем болезни свиней. Вирус парагриппа человека тип 1, также общие антигенные детерминанты с SeV и запускает генерацию перекрестно-реактивного нейтрализующие антитела.[60] Этим фактом можно объяснить широкое распространение антител к SeV у людей в 1950-1960-х годах.[68] Недавно опубликованное исследование также показало это широкое распространение. Исследование, опубликованное в 2011 году, показало, что антитела, нейтрализующие SeV (которые образовывались из-за вирус парагриппа человека инфекция типа 1) может быть обнаружена у 92,5% людей во всем мире со средним значением EC50 титр 60,6 и значения в диапазоне 5,9–11 324.[63] Низкий фон антител против SeV не блокирует способность вакцины на основе SeV стимулировать антиген-специфический Т-клеточный иммунитет.[64]
Распространение вируса в дыхательные пути неприродных хозяев
Введение вируса Сендай неприродным хозяевам приводит к выделению вирионов в дыхательные пути. Таким образом, через 10 часов после интраназального введения SeV инфекционные вирионы, несущие чужеродные трансгены, могут быть обнаружены в легких овцы.[73] Более того, SeV воспроизводится до определяемых уровней в верхних и нижних дыхательных путях африканских зеленых мартышек и шимпанзе.[74]
Вызванный вирусами противовирусный иммунитет
SeV может преодолевать противовирусные механизмы у некоторых из своих естественных хозяев (некоторых грызунов), но вирус неэффективен в преодолении этих механизмов у некоторых других организмов, устойчивых к вирусам.[75] Обе врожденный и адаптивный иммунитет способствовать эффективному выздоровлению от инфекции SeV.[23] Используя механизмы, описанные ниже, вирус стимулирует выработку интерфероны и другие цитокины обеспечивающие защиту от вирусов.[нужна цитата ]
SeV стимулирует продукцию и путь трансдукции интерферона
Основным компонентом врожденного противовирусного ответа является: интерфероны I типа (IFN) производство и большинство клеток могут производить IFN типа I, включая IFN-α и -β.[76] Распознавание клеточными молекулами, которые называются рецепторы распознавания образов (PRR) запускающих вирусных элементов, таких как геномная РНК вируса, промежуточная двухцепочечная РНК репликации или вирусные рибонуклеопротеины, способствует продукции IFN и путям ответа. Компоненты вирусного генома и белка могут связывать вариабельные PRR и стимулировать сигнальный путь, который приводит к активации факторов транскрипции, которые перемещаются в ядро и запускают транскрипцию IFN типа I.

Производство интерферона
Благодаря мощным стимулирующим свойствам IFN, раньше рекомбинантный IFN стал доступным для использования в медицине, SeV был выбран среди других вирусов для промышленного крупномасштабного производства IFN. Для этого была использована процедура, включающая обработку инактивированным SeV лейкоцитов периферической крови человека из донорской крови.[77]
Ниже представлена таблица, в которой перечислены известные PRR и факторы регуляции интерферона, которые активируются при заражении SeV.
| Молекулы | Псевдоним | Эффект |
|---|---|---|
| Рецепторы распознавания образов (PRR) | ||
| Toll Like рецепторы | TLR | Инфекция SeV стимулирует экспрессию мРНК TLR1, TLR2, TLR3, и TLR7 в макрофагах. Этот эффект зависит от IFN-альфа / бета, поскольку нейтрализующие антитела против IFN-альфа / бета подавляют стимуляцию транскрипции мРНК.[78] Человек тучная клетка инфекция SeV вызывает противовирусный ответ с активацией экспрессии IFN типа 1 и TLR-3.[79] |
| NLRC5 | Использование эмбриональных клеток почек человека (HEK 293T ) было показано, что SeV может стимулировать производство рецептор распознавания образов NLRC5, который представляет собой цитозольный белок, экспрессируемый в основном в гемопоэтические клетки.[80] | |
| Ген I, индуцируемый ретиноевой кислотой | РИГ-1 | Опосредованная RIG-1-IRF7 индукция IFN-α с помощью SeV требует обоих RIG-I и митохондриальный противовирусный сигнальный белок (MAVS) выражение.[81] MAVS также необходим для индукции SeV Киназа IκB (IKK), IRF3 и IFN-β в клетках человека.[82] Одноцепочечная геномная РНК вируса Сендай, несущая 5'-трифосфаты, активирует продукцию IFN-бета, опосредованную RIG-I.[83] Репликация SeV запускает активацию Путь MAPK / ERK (также известный как путь Ras-Raf-MEK-ERK) в RIG-I -зависимо в дендритные клетки (ДК) И в фибробласты. RIG-I -опосредованная активация этого пути с помощью SeV приводит к IFN типа I производство.[84] Человек тучная клетка инфекция SeV вызывает противовирусный ответ с активацией экспрессии IFN типа 1 и РИГ-1.[79] |
| Антиген, связанный с дифференцировкой меланомы 5 | MDA5 | Было показано, что MDA5 является важным участником противовирусного ответа на SeV и IFN типа I производство.[85] Человек тучная клетка инфекция SeV вызывает противовирусный ответ с активацией экспрессии IFN типа 1 и МДА-5.[79] |
| Факторы регуляции интерферона | ||
| Регуляторный фактор интерферона 3 | IRF-3 | SeV может активировать повсеместно экспрессируемые IRF-3 запустив его посттрансляционный фосфорилирование в клетках человека. IRF-3, активируется фосфорилированием по определенному остатку серина, Ser396.[86] |
| Регуляторный фактор интерферона 7 | IRF-7 | Есть также некоторые свидетельства того, что SeV активирует ИРФ-7.[87] |
Многие разные клетки могут продуцировать интерферон в ответ на SeV.
| Тип ячейки | Эффект |
|---|---|
| Периферическая кровь человека лейкоциты | Вызванные вирусом Сендай лейкоциты периферической крови человека продуцируют интерферон альфа (IFN-α )[88] и интерферон гамма (IFN-γ ).[89][90] Индуцированный SeV IFN-α состоит по меньшей мере из девяти различных подтипов IFN-α: 1a, 2b, 4b, 7a, 8b, 10a, 14c, 17b и 21b. Среди этих подтипов IFN-α1 составляет около 30% от общего IFN-α.[91] Было показано, что HN парамиксовирусов является мощным индуктором IFN типа 1 в мононуклеарных клетках крови человека.[92] |
| Лимфоидные клетки | Заражение SeV клеток Namalwa, происходящих из лимфомы Беркитта человека, временно индуцирует транскрипционную экспрессию множества генов IFN-A.[93] Также было показано, что в этих клетках вирус SeV стимулирует экспрессию IFNα8, IFNα13, IFNβ и IFN типа III (IFN-лямбда, IFNλ): (L28α, IL28β, IL29 ).[94] |
| Моноциты и дендритные клетки | Моноциты[95] и дендритные клетки[96] производить IFN альфа / бета в ответ на стимуляцию SeV. Тем не мение, плазмацитоидные дендритные клетки (pDC), несмотря на невозможность заразиться SeV,[97] производить более высокий уровень IFN-1 в сравнении с моноциты и дендритные клетки, происходящие из моноцитов, в ответ на SeV. Скорее всего, это происходит из-за более высоких уровней конститутивно выраженного IRF-7 в pDC по сравнению с моноцитами и дендритные клетки, полученные из моноцитов.[98] Распознавание SeV pDC происходит через TLR7 активации и требует транспорта продуктов цитозольной репликации вируса в лизосомы в процессе аутофагия. Более того, для pDC было обнаружено, что аутофагия необходима для производства этими клетками IFN-α.[97] Среди обычных ДЦ[99] только два подмножества: CD4+ и CD8α− CD4- «Двойной отрицательный»[100] дендритные клетки производят IFN-α и IFN-β в ответ на инфекцию SeV. Однако все обычные подмножества постоянного тока, включая CD8α+ могут быть инфицированы SeV.[101] SeV может реплицироваться с высокими титрами в человеческих ДК, происходящих из моноцитов.[102] Однако пДК не продуцируют значительное количество вирионов SeV после заражения.[97] УФ-облученный SeV вызывает более низкий уровень продукции IFN-α в pDC по сравнению с живым вирусом.[97] Было продемонстрировано, что SeV может индуцировать продукцию IFN типа III (IFN-lambda).[103] человеком плазмацитоидные дендритные клетки.[104] УФ-инактивированный SeV может индуцировать производство IFN типа I какой-то мышкой дендритные клетки,[105] и некоторыми линиями опухолевых клеток.[106] Однако УФ-инактивированный SeV вызывает более низкие уровни продукции IFN-α в pDC по сравнению с живым вирусом.[97] |
| Фибробласты | Интерферон-бета (IFN-β) производство в человеческом фибробласт клеток также возникает в ответ на лечение SeV.[107] Было показано, что SeV поражает легкие человека. фибробласты MRC-5 и вызывает высвобождение IFN-бета в культуральную среду из этих инфицированных клеток.[75] |
| Тучные клетки | Человек тучная клетка инфекция SeV вызывает экспрессию IFN типа 1.[79] |
| Астроциты | SeV вызывает высокую продукцию IFN-бета в астроцитах мышей.[108] Этот запуск не зависит от экспрессии TLR3, потому что он происходит у мышей с двойным отрицательным TLR3.[108] |
| Селезенка клетки | HN SeV может индуцировать продукцию IFN типа 1 в селезенке мыши.[109] |
Путь ответа на интерферон защищает клетки от инфекции SeV
SeV может стимулировать и / или ингибировать IFN-бета путь ответа в зависимости от типа клетки и хозяина. Если SeV запускает продукцию IFN, продуцируемый IFN дополнительно защищает клетки от следующих раундов инфекции SeV. Описаны многочисленные примеры IFN-бета-защитных клеток от SeV. Предварительная обработка легкого человека фибробласты MRC-5 клетки с IFN-бета подавляют репликацию SeV.[75]
Похожий IFN-бета защита от вируса наблюдалась для некоторых злокачественных клеток человека, которые поддерживают путь ответа IFN. HeLa клетки могут быть инфицированы SeV; однако инкубация этих клеток с IFN-бета вызывает ингибирование репликации SeV.[110] Было установлено, что для этого ингибирования необходимы множественные гены, стимулированные интерфероном (ISG), включая IRF-9, ZNFX1, TRIM69, НПИП, TDRD7, PNPT1 и так далее.[110] Один из этих генов TDRD7 был исследован более подробно. Функциональный белок TDRD7 ингибирует репликацию SeV и других парамиксовирусы, подавление аутофагия, что необходимо для продуктивного заражения этими вирусами.[110]
SeV также запускает экспрессию IFN-индуцированного Ifit2 белок, который участвует в защите мышей от SeV посредством пока неизвестного механизма.[111] Кроме того, SeV запускает экспрессию хемокин, индуцируемый интерфероном-γ белок 10 кДа (CXCL10), который участвует в хемотаксисе, индукции апоптоза, регуляции роста клеток и опосредовании ангиостатических эффектов.[108] Человек тучная клетка инфекция SeV вызывает экспрессию интерферон-стимулированные гены MxA Белок MxA человека: интерферон-индуцированная динаминоподобная GTPase с широкой противовирусной активностью и IFIT3[79] в дополнение к активации экспрессии IFN типа 1, МДА-5, РИГ-1 и TLR-3.
SeV-стимуляция выработки воспалительных цитокинов, инфаммасом и бета-дефенсинов
Цитокины
Вирус Сендай может вызывать образование многих цитокины которые улучшают клеточные иммунные ответы. Некоторые доказательства того, что SeV активирует фактор транскрипции NF-κB[112] и эта активация помогает в защите от инфекции SeV. SeV может стимулировать производство воспалительный белок макрофагов-1α (MIB-1α) и –β (MIB-1β), RANTES (CCL5), фактор некроза опухоли-альфа (TNF-альфа), фактор некроза опухоли-бета (TNF-бета), интерлейкин-6 (ИЛ-6), интерлейкин-8 (ИЛ-8), интерлейкин-1 альфа (IL1A), интерлейкин-1 бета (IL1B), фактор роста тромбоцитов (PDGF-AB) и небольшие концентрации интерлейкин-2 (IL2) и GM-CSF.[90][89][88] Даже плазмиды, которые доставляют F-кодирующий ген SeV к опухолевым клеткам у модельных животных, запускают производство RANTES (CCL5) в инфильтрированном опухолью Т-лимфоциты.[105] SeV индуцирует производство Фактор активации В-клеток моноцитами и некоторыми другими клетками.[113] Инактивированный нагреванием вирус SeV индуцирует выработку цитокинов IL-10 и IL-6 посредством дендритные клетки (ДК).[114] Скорее всего, за эту индукцию ответственен белок F, потому что восстановленные липосомы, содержащие белок F, могут стимулировать выработку IL-6 путем ОКРУГ КОЛУМБИЯ. Продукция IL-6 в ответ на инфекцию SeV ограничена обычные дендритные клетки (ДК ) подмножества, такие как CD4+ и двойной отрицательный (dnDC).[101]
УФ-инактивированный SeV (а также, вероятно, живой вирус) может стимулировать дендритные клетки выделять хемокины и цитокины Такие как интерлейкин-6, интерферон-бета, хемокин (мотив C-C) лиганд 5, и хемокин (мотив C-X-C) лиганд 10. Эти молекулы активируют оба CD8+ Т клетки, а также естественные клетки-киллеры. УФ-инактивированный SeV запускает производство молекула межклеточной адгезии -1 (ICAM-1, CD54), что является гликопротеин который служит лигандом для антиген макрофага-1 (Mac-1) и антиген, связанный с функцией лимфоцитов 1 (LFA-1 (интегрин )). Это индуцированное производство происходит за счет активации NF-κB ниже по течению митохондриальный противовирусный сигнальный путь и RIG-I. Повышенная концентрация ICAM-1 на поверхности клеток увеличивает уязвимость этих клеток к естественные клетки-киллеры.[115] На клетках Намалва было показано, что вирус SeV стимулирует экспрессию многих генов, участвующих в путях иммунной защиты, таких как передача сигналов IFN типа I и типа II, а также передача сигналов цитокинов. Среди десяти наиболее вирус-индуцированных мРНК: IFNα8, IFNα13, IFNβ, IFNλ: (L28α, IL28β, IL29 ), OASL, CXCL10, CXCL11 и HERC5.[94]
Стимуляция инфламмасом помогает защитить от инфекции SeV
Использование эмбриональных клеток почек человека (HEK 293T ) было показано, что SeV может стимулировать производство рецептор распознавания образов NLRC5, который представляет собой цитозольный белок, экспрессируемый в основном в гемопоэтические клетки.[80] Эта продукция активирует криопирин (NALP3) воспаление.[116] Использование человека моноцитарный клеточная линия -1 (ТНП-1) было показано, что SeV может активировать передачу сигнала посредством передача сигналов митохондриального антивирусного сигнального белка (MAVS), которая является ассоциированной с митохондриями адапторной молекулой, которая необходима для оптимального NALP3 -воспаление Мероприятия. Посредством передачи сигналов MAVS SeV стимулирует олигомеризацию NALP3 и запускает NALP3-зависимую активацию каспаза-1[117] что, в свою очередь, стимулирует зависимую от каспазы 1 продукцию интерлейкин -1 бета (IL-1β).[118]
Стимуляция выработки бета-дефенсина
SeV - очень эффективный стимулятор экспрессии человеческого бета-дефенсин-1 (hBD-1). Этот белок является членом семейства белков бета-дефенсина, которые связывают врожденный и адаптивный иммунный ответ на инфекцию патогена.[119] В ответ на инфекцию SeV продукция мРНК и белка hBD-1 увеличивается через 2 часа после воздействия вируса в очищенных плазмоцитоидных дендритных клетках или в PBMC.[120]
Длительный противовирусный иммунитет
После вирусной инфекции у грызунов IFN типа I способствуют клиренсу SeV и ускоряют миграцию и созревание дендритных клеток. Однако вскоре после вирусной инфекции животные эффективно генерируют цитотоксические Т-клетки независимо от передачи сигналов IFN типа I и выводят вирус из своих легких. Более того, даже у животных, которые не реагируют на IFN типа I, вырабатывается длительный анти-SeV иммунитет в форме ответа памяти, который включает образование CD8.+ Т-клетки и нейтрализующие антитела. Эта реакция памяти может защитить животных от дальнейшего заражения смертельной дозой вируса.[23]
Как онколитическое средство
Противоопухолевая терапия на основе вируса Сендай модель[6][7] и животные-компаньоны[8] сообщалось в нескольких научных статьях. Описанные исследования демонстрируют, что вирус Сендай может стать безопасным и эффективным терапевтическим средством против широкого спектра рака человека. Высокая геномная стабильность SeV - очень желательный признак для онколитических вирусов. Маловероятно, что SeV превратится в патогенный штамм или вирус со сниженным онколитическим потенциалом. Цитоплазматическая репликация вируса приводит к отсутствию интеграции и рекомбинации генома хозяина, что делает SeV более безопасным и более привлекательным кандидатом для широко применяемого терапевтического онколиза по сравнению с некоторыми ДНК-вирусами или ретровирусами.[нужна цитата ]
Безопасность для человека
Одним из главных преимуществ вируса Сендай как потенциального онколитического агента является его безопасность. Несмотря на то, что вирус широко распространен в колониях грызунов[3] и десятилетиями использовался в лабораторных исследованиях,[121] никогда не наблюдалось, что он может вызвать заболевание человека. Более того, вирус Сендай использовался в клинические испытания с участием обоих взрослых[60] и дети[62] сделать иммунизацию против вирус парагриппа человека тип 1, так как два вируса имеют общие антигенные детерминанты и вызвать генерацию перекрестной реакции нейтрализующие антитела Введение вируса Сендай в виде капель в нос в дозах от 5 × 105 Инфекционная доза эмбриона 50% (EID50) до 5 × 107 EID50 индуцировал выработку нейтрализующих антител к вирусу человека без каких-либо измеримых побочных эффектов. Результаты этих испытаний представляют собой дополнительное доказательство безопасности вируса Сендай для человека. Разработка Т-клеточных вакцин против СПИДа с использованием векторов вируса Сендай достигла фазы II клинических испытаний. . Оценка безопасности и иммуногенности вводимой интраназально компетентной к репликации вакцины против вируса Сендай с вектором кляп вируса Сендай типа 1 продемонстрировала: индукцию сильных Т-клеточных и антителных ответов в режимах первичной буст-вакцинации.[15][14] Вирус Сендай также используется в качестве основы для вакцины против респираторно-синцитиального вируса (RSV).[12]
Модели рака
Для исследований рака желательно, чтобы онколитический вирус быть непатогенный для экспериментальных животных, но вирус Сендай может вызывать болезнь грызунов, что является проблемой для исследовательских стратегий. Были использованы два подхода, чтобы решить эту проблему и сделать вирус Сендай непатогенным для мышей и крыс. Один из таких подходов заключался в создании набора генетически модифицированных ослабленный вирусные штаммы. Представители этого набора были протестированы на модельных животных, несущих широкий спектр трансплантируемых опухолей человека. Было показано, что они могут вызывать подавление или даже уничтожение фибросаркома,[122][123] нейробластома,[124] гепатоцеллюлярная карцинома,[125] меланома, плоскоклеточный[126] и карциномы простаты.[127] Конструкция SeV подавляет микрометастаз плоскоклеточного рака головы и шеи в модели ортотопической голой мыши.[128] Полное искоренение установленных глиосаркомы в иммунокомпетентный крысы также наблюдались.[129] Были также созданы конструкции SeV с модифицированным сайтом расщепления протеазой в F-белке. Модификация позволила рекомбинантный вирус для специфического заражения раковых клеток, экспрессирующих соответствующие протеазы.[125][122]

Другой подход к тому, чтобы сделать вирус Сендай непатогенным, включал краткосрочную обработку вирионов ультрафиолетовый свет. Такое лечение вызывает потерю способности вируса к репликации. Однако даже этот вирус с недостаточной репликацией может вызывать гибель раковых клеток и стимулировать противоопухолевый иммунитет. Это может вызвать обширные апоптоз человека глиобластома клеток в культуре, и он может эффективно подавлять рост этих клеток у модельных животных.[130] Вирус, обработанный ультрафиолетом, также может убивать клетки рака простаты человека в культуре.[131] запуская их апоптоз и уничтожая опухоли, возникшие из этих клеток, у иммунодефицитных модельных животных.[106] Более того, он может стимулировать регрессию иммуномодулированной опухоли двоеточие[132] и рак почек[133][134] у иммунокомпетентных мышей. Подобные регрессии, вызванные дефицитом репликации вирусом Сендай, наблюдались у животных с трансплантированными меланома опухоли.[135][136]
Естественный рак
Некоторые исследования рака на животных, не являющихся грызунами, были выполнены с использованием немодифицированного вируса Сендай. Таким образом, после внутриопухолевых инъекций вируса полный или же частичная ремиссия из опухоли тучных клеток (мастоцитомы ) наблюдалась у собак, пораженных этим заболеванием.[8] Кратковременная ремиссия после внутривенной инъекции SeV была описана у пациента с острым лейкозом, пролеченного в Центре клинических исследований университетских больниц Кливленда (США) множественными вирусами в 1964 году.[137] Также сообщается[7][138] что московский штамм SeV[139] испытан доктором В. Сениным[140] и его команда в качестве противоракового агента у нескольких десятков пациентов, страдающих различными злокачественными новообразованиями с метастатическим ростом в России в 1990-х годах.[141] Вирус вводили внутрикожно или внутри опухоли, и он вызывал лихорадку менее чем у половины пролеченных пациентов, которая обычно исчезала в течение 24 часов. Иногда введение вируса вызывало воспаление первичной опухоли и метастазы. Клинические исходы были разными. У небольшой части пролеченных пациентов наблюдалась выраженная длительная ремиссия с исчезновением первичных опухолей и метастазов. Иногда после виротерапии ремиссия длилась 5–10 и более лет. В патенте представлены краткие описания медицинских карт пациентов, у которых наблюдается длительная ремиссия.[141] Внутриопухолевое введение УФ-облученного и инактивированного SeV приводило к противоопухолевому эффекту у нескольких пациентов с меланомой с прогрессирующим заболеванием стадии IIIC или IV с метастазами в кожу или лимфу. Полные или частичные ответы наблюдались примерно в половине инъецированных и неинъектированных целевых поражений.[142]
Противораковый механизм
Прямое уничтожение раковых клеток. Злокачественные клетки уязвимы для инфекции SeV.
Вирус Сендай может инфицировать и убивать различные раковые клетки (см. Чувствительные клеточные линии и штаммы вирусов ). Однако некоторые злокачественные клетки устойчивы к инфекции SeV. Есть несколько объяснений такого сопротивления. Не все раковые клетки имеют рецепторы входа в клетки для вируса, и не все раковые клетки экспрессируют сериновые протеазы процессинга вируса. Существуют также другие механизмы, которые могут сделать раковые клетки устойчивыми к онколитическому вирусу. Например, некоторые раковые клетки поддерживают систему ответа на интерферон, которая полностью или частично защищает клетки-хозяева от вирусной инфекции.[143] Следовательно, необходимо было разработать биомаркеры для идентификации опухолей, которые могут погибнуть от онколиза, опосредованного SeV.
Рецепторы входа в клетки вируса Сендай часто сверхэкспрессируются в раковых клетках.
Рецепторы SeV являются потенциальными биомаркеры для оценки уязвимости злокачественных клеток к вирусу. Они представлены гликопротеины и гликолипиды (см. раздел "Рецепторы входа в SeV-клетки "). Экспрессия некоторых молекул, которые могут облегчить проникновение в SeV-клетки (см. Раздел"Рецепторы входа в SeV-клетки ”), Часто ускоряется канцерогенез и / или метастаз разработка. Например, наличие Сиалил-ЛьюисИкс антиген (кластер дифференцировки 15 (CD15)), который является одним из рецепторов входа в SeV-клетки, на внешней клеточной мембране, коррелирует с потенциалом инвазии злокачественных клеток, рецидивом опухоли и общей выживаемостью пациента при чрезвычайно широком диапазоне раковых заболеваний.[144][145] Следовательно, вирус SeV предпочтительно может проникать в такие клетки. Выражение Антиген Vim2 , который является еще одним рецептором входа в SeV-клетки, очень важен для внесосудистый инфильтрационный процесс острого миелоидный лейкоз клетки.[146] GD1a,[147] ганглиозид также служит рецептором SeV и в больших количествах обнаруживается на поверхности стволовые клетки рака груди.[148] Высокая экспрессия на клеточной поверхности другого рецептора SeV - ганглиозид сиалозилпараглобозид / SPG / NeuAcα2-3PG.[149] характеризует лимфоидные лейкозные клетки.[150][151] Среди других рецепторов, представленных ганглиозидами GT1b сильно выражен на наружных мембранах метастазы в мозг клетки, происходящие от очень широкого спектра рака,[152] а GD1a,[147] GT1b[153] и GQ1b[154] может быть обнаружен в глиосаркомах человека. Однако их количество не превышает количества в нормальной лобной коре головного мозга.[155] В рецепторы асиалогликопротеина связывающие вирус Сендай.[156][157] и служат в качестве рецепторов входа в SeV-клетки, высоко экспрессируются в рак печени.[158][159]
| Рецепторы для SeV и их экспрессия при злокачественных новообразованиях | |||
|---|---|---|---|
| Рецептор | Злокачественность / эффект экспрессии рецепторов | Ссылка | Доступность моноклональных АБ |
| Человеческий асиалогликопротеиновый рецептор 1 (ASFR1) | Высокая экспрессия при раке печени и иногда умеренная при глиомах, раке почек, поджелудочной железы, колоректального рака и яичников | [4] | Два варианта [5] |
| Сиалил-ЛьюисИкс Антиген (SLEX / CD15) | Немелкоклеточный рак легкого / усиливает послеоперационный рецидив | [160][161] | Множество вариантов |
| Рак легкого, отдаленные метастазы | [163] | ||
| Колоректальный рак / способствует метастазам в печень, сокращает время безрецидивной выживаемости | [164][165][166] | ||
| Рак желудка / снижает продолжительность жизни пациентов | [167][168] | ||
| Рак груди / снижает продолжительность жизни пациентов | [169][170][171] | ||
| Опухоль простаты / способствует метастазам в кости | [172][173][174] | ||
| Клеточные линии переменного происхождения / высокой экспрессии усиливают адгезию злокачественных клеток к эндотелию сосудов | [175] | ||
| Различные виды рака / высокая экспрессия, связанная с лимфатической инвазией, венозной инвазией, стадией T, стадией N, стадией M, стадией опухоли, рецидивом и общей выживаемостью пациента | Рассмотрение[176] | ||
| Антиген VIM-2 (CD65s) | Острый миелобластный лейкоз | [177][178][179] | |
| GD1a | Стволовые клетки рака груди | [180] | |
| Клетки рака простаты, устойчивые к кастрации | [181] | ||
| GT1b | Метастазы в мозг из карциномы толстой кишки, почек, легких, пищевода, поджелудочной железы и молочной железы | [182] | |
| САУ | Клетки рака простаты, устойчивые к кастрации | [181] | Один вариант |
| Клетки лимфоидной лейкемии | [184][183] | ||
Клеточную экспрессию гликопротеинов можно оценить с помощью различных методов молекулярной биологии, которые включают измерения РНК и белков. Однако клеточная экспрессия ганглиозиды, которые содержат сиаловую кислоту гликосфинголипиды, не могут быть оценены этими методами. Вместо этого его можно измерить с помощью антител против гликанов, и, несмотря на большое количество таких антител в базе данных ресурсов сообщества, они не всегда доступны для каждого ганглиозида.[185] Следовательно, косвенное измерение экспрессии ганглиозидов путем количественной оценки уровней фукозилтрансферазы и гликозилтрансферазы это полное гликан синтез - альтернатива. Есть доказательства того, что экспрессия этих ферментов и продукция ганглиозидов сильно коррелируют.[151] Не менее четырех представителей фукозилтрансферазы и несколько гликозилтрансферазы в том числе сиалилтрансферазы несут ответственность за синтез ганглиозиды которые могут служить рецепторами SeV. Все эти белки часто сверхэкспрессируются в различных опухолях, и уровни их экспрессии коррелируют с метастатическим статусом опухоли и более короткой продолжительностью жизни пациентов. Таким образом, эти ферменты также являются потенциальными биомаркерами SeV-онколитического заразительность
| Синтез ферментов рецепторов входа в SeV-клетки | ||
| Рецептор SeV | Тип фермента | Фермент |
| Сиалил-ЛьюисИкс антиген / (sLeX / CD11s)[186][187][188][189] | Фукозилтрансфераза | FUT3, FUT5, FUT6, FUT7 |
| Гликозилтрансфераза | ST3GAL3, [6] [7] ST3GAL4,[8] [9] ST3GAL6 [10] [11] [12] | |
| Антиген Vim2 / (CD65)[188] | Фукозилтрансфераза | FUT5 |
| GD1a[190][191][151][192] | Гликозилтрансферазы | ST3GAL1,[13] [14] ST3GAL2,[15] [16] ST6GALNAC5 [17] [18] ST6GALNAC6 [19] [20] |
| GD1b,[191] (GT1a, GQ1b и GP1c)[190] | ST6GALNAC6 [21] [22] | |
| GT1b[193] | ST3GAL2,[23] [24] | |
| Сиалозилпараглобозид (САУ).[151] | ST3GAL6, [25] [26] | |
Ферменты протеолитического процессинга вируса Сендай часто сверхэкспрессируются в раковых клетках.
Слитый белок (F) SeV синтезируется как неактивный предшественник и активируется посредством протеолитический расщепление клетки-хозяина сериновые протеазы (см. ниже раздел «Протеолитическое расщепление клеточными протеазами»). Что-нибудь из этого протеазы сверхэкспрессируются в злокачественных новообразованиях. Например, трансмембранная сериновая протеаза 2 (TMPRSS2 ), который является ферментом процессинга F-белка, часто сверхэкспрессируется в рак простаты клетки.[194] Он также сверхэкспрессируется в некоторых клеточных линиях, происходящих из различных злокачественных новообразований. Таким образом, он сильно выражен при карциноме мочевого пузыря,[195] карцинома толстой кишки человека CaCo2[196] и карциномы груди SK-BR-3, MCF7 и Т-47Д.[197] Другая F-протеин-протеаза - это триптаза бета 2 (TPSB2 ). Эта протеаза (с псевдонимом, таким как триптаза-Клара и триптаза тучных клеток) экспрессируется в нормальных клубные клетки и тучные клетки, а также при некоторых видах рака.[198] Особенно высокая выраженность наблюдается у человека. тучная клетка линия HMC-1,[199][200] и в человеке эритролейкоз клеточная линия HEL.[201][199] Плазминоген (PLG ), из которого происходит мини-плазмин, способный расщеплять F-белок, высоко экспрессируется при раке печени.[202] Его экспрессия также увеличивается в широком спектре других злокачественных новообразований.[202] Фактор X (F10) часто проявляется в нормальной печени и при раке печени.[203] Были созданы конструкции SeV с модифицированным сайтом расщепления протеазой. Модификация позволила рекомбинантному вирусу специфически инфицировать раковые клетки, экспрессирующие соответствующие протеазы, которые могут расщеплять модифицированный сайт расщепления протеазой.[122][125]
Дефекты в системе интерферона
Система выработки интерферона и / или ответной реакции в злокачественных клетках часто дает сбой; следовательно, они гораздо более уязвимы для заражения онколитическими вирусами по сравнению с нормальными клетками.[143] Таким образом, клетки, принадлежащие к трем линиям клеток человека, произошли от различных злокачественных новообразований, таких как U937, Намалва, и A549, сохраняют способность инфицироваться SeV даже после лечения IFN типа 1. В этих клетках нарушена система интерферонового ответа, и она не может защитить их от инфекции SeV.[204]
В клетках Намалвы вирус SeV стимулирует экспрессию многих генов, участвующих в путях иммунной защиты, таких как передача сигналов IFN типа I и типа II, а также передача сигналов цитокинов. Среди десяти наиболее вирус-индуцированных мРНК: IFNα8, IFNα13, IFNβ, IFNλ: (L28α, IL28β, IL29 ), OASL, CXCL10, CXCL11 и HERC5.[94] Однако, несмотря на стимуляцию экспрессии этих генов с помощью SeV, клетки Намалва не могут защитить себя от вирусной инфекции.
Способность вируса Сендай подавлять интерфероновый ответ в некоторых раковых клетках
В клетках HeLa SeV (в отличие от Вирус везикулярного стоматита) может противодействовать предварительной обработке IFN-α и поддерживать уровень трансляции вирусного белка, аналогичный таковому в необработанных IFN клетках.[47]
Активация некроптозного пути в злокачественных клетках
Было показано, используя фибросаркома клеточной линии L929, что SeV способен вызывать гибель злокачественных клеток через некроптоз.[205] Этот тип гибели клеток очень иммуногенен, поскольку умирающие некроптозные клетки высвобождают молекулярный паттерн, связанный с повреждениями (DAMPs ) молекулы, которые инициируют адаптивный иммунитет. Некроптозный путь, запускаемый SeV, требует RIG-I активация и присутствие кодируемых SeV белков Y1 и / или Y2.[205]
Вирус, опосредованный слиянием раковых клеток, убивает их быстрее
Организм-хозяин борется с вирусной инфекцией, используя различные стратегии. Одна из таких стратегий - производство нейтрализующие антитела. В ответ на это производство вирусы разработали свои собственные стратегии для распространения инфекции и предотвращения инактивации хозяином, продуцирующим нейтрализующие антитела. Некоторые вирусы, в частности парамиксовирусы, могут производить новые вирусные частицы путем слияния инфицированных и здоровых клеток-хозяев. Этот синтез приводит к образованию большой многоядерной структуры (синцитий ). Сендайский вирус, как представитель Paramyxoviridae, использует эту стратегию для распространения своей инфекции (см. раздел «Направленное слияние клеток» ниже). Вирус может сливать до 50-100 клеток, прилегающих к одной первично инфицированной клетке. Это многоядерное образование, происходящее из нескольких десятков клеток, выживает в течение нескольких дней и впоследствии высвобождает функциональные вирусные частицы.[7]
Было продемонстрировано, что способность вируса разрушать опухолевые клетки возрастает вместе с увеличением способности вируса образовывать большие многоядерные структуры. Перенос генов, ответственных за образование синцития от представителя Paramyxoviridae к представителям Rhabdoviridae или же Herpesviridae делает получателя вирусов более онколитический.[206][207] Более того, онколитический потенциал парамиксовируса может быть усилен мутациями в гене слияния (F). протеаза сайт расщепления, который позволяет F-белку более эффективно обрабатываться клеточными протеазами.[208] Введение гена F SeV в виде плазмиды в опухолевую ткань мышей с помощью электропорации показало, что экспрессия гена F увеличивает Т-клетка инфильтрация опухоли с CD4 + и CD8 + клеток и подавляет рост опухоли.[209] В других подобных экспериментах также было показано, что сами раковые клетки, трансфицированные плазмиды которые кодируют гликопротеины вирусной мембраны с функцией слияния, вызывают коллективную смерть соседних клеток, образующих с ними синцитий. Привлечение сторонних клеток в синцитий приводит к значительной регрессии опухоли.[210][211][212]
Уничтожение злокачественных клеток вирусом, вызвавшее противоопухолевый иммунитет
Вирус вызывает непрямые иммуномодулированный гибель злокачественных клеток с использованием ряда механизмов, которые описаны в опубликованном обзоре.[7] Вирусный фермент нейраминидаза (NA), у которого есть сиалидаза активности, может сделать раковые клетки более заметными для иммунной системы, удаляя сиаловая кислота остатки с поверхности злокачественных клеток.[7] SeV активирует естественные клетки-киллеры (NK), цитотоксические Т-лимфоциты (CTL) и дендритные клетки (ДК). Секреция интерлейкин-6, который запускается вирусом, также подавляет регуляторные Т-клетки.[нужна цитата ]
Стимуляция секреции цитокинов


Интерфероны
Тип I и тип II интерфероны обладают противоопухолевой активностью (см. раздел «Функции» в «Интерферон "статья). Интерфероны могут способствовать выражению главный комплекс гистосовместимости молекулы MHC I и MHC II, и стимулировать иммунопротеасома Мероприятия. Все интерфероны резко увеличивают презентацию MHC I-зависимых антигенов. Интерферон гамма (IFN-гамма) также сильно способствует MHC II-зависимой презентации антигенов.[213] Более высокая экспрессия MHC I приводит к более высокой презентации вирусных и аномальных пептидов из раковых клеток в цитотоксические Т-клетки, в то время как иммунопротеасома более эффективно обрабатывает эти пептиды для загрузки на молекулу MHC I. Таким образом, увеличивается распознавание и уничтожение инфицированных или злокачественных клеток. Более высокая экспрессия MHC II увеличивает презентацию вирусных и раковых пептидов для хелперные Т-клетки; которые выделяют цитокины (например, больше интерферонов, интерлейкины и другие цитокины), которые стимулируют и координируют активность других иммунных клеток.[214][215][216]
Путем понижающего регулирования ангиогенный стимулы, продуцируемые опухолевыми клетками, интерферон также может подавлять ангиогенез[217] Кроме того, они подавляют распространение эндотелиальный клетки. Такое подавление вызывает уменьшение опухоли. васкуляризация и последующее торможение роста. Интерфероны могут напрямую активировать иммунные клетки, в том числе: макрофаги и естественные клетки-киллеры.[214] INF-1 и интерферон гамма (IFN-γ ) продуцирование запускается молекулярными компонентами SeV во многих клетках (см. раздел «Вызванный вирусом противовирусный иммунитет» выше).[88][89][90][107] Было продемонстрировано, что SeV также может индуцировать продукцию IFN типа III (IFN-lambda).[103] человеком плазмацитоидные дендритные клетки.[104]
Не интерфероны
Вирус Сендай может вызывать образование многих цитокины которые улучшают клеточные иммунные ответы против раковых клеток. SeV стимулирует выработку воспалительный белок макрофагов-1α (MIB-1α) и –β (MIB-1β), RANTES (CCL5), фактор некроза опухоли-альфа (TNF-альфа), фактор некроза опухоли-бета (TNF-бета), интерлейкин-6 (ИЛ-6), интерлейкин-8 (ИЛ-8), интерлейкин-1 альфа (IL1A), интерлейкин-1 бета (IL1B), фактор роста тромбоцитов (PDGF-AB) и небольшие концентрации интерлейкин-2 (IL2) и GM-CSF.[90][89][88] Даже плазмиды, которые доставляют F-кодирующий ген SeV к опухолевым клеткам у модельных животных, запускают производство RANTES (CCL5) в инфильтрированном опухолью Т-лимфоциты.[105]
SeV индуцирует производство Фактор активации В-клеток моноцитами и некоторыми другими клетками.[113]
Инактивированный нагреванием вирус SeV индуцирует выработку цитокинов IL-10 и IL-6 посредством дендритные клетки (ДК).[114] Скорее всего, за эту индукцию ответственен белок F, потому что восстановленные липосомы, содержащие белок F, могут стимулировать выработку IL-6 путем ОКРУГ КОЛУМБИЯ. Продукция IL-6 в ответ на инфекцию SeV ограничена обычные дендритные клетки (ДК ) подмножества, такие как CD4+ и двойной отрицательный (dnDC).[101]
УФ-инактивированный SeV (а также, вероятно, живой вирус) может стимулировать дендритные клетки выделять хемокины и цитокины Такие как интерлейкин-6, интерферон-бета, хемокин (мотив C-C) лиганд 5, и хемокин (мотив C-X-C) лиганд 10. Эти молекулы активируют оба CD8+ Т клетки, а также естественные клетки-киллеры и привлечь их к опухоли. Было показано, что в линиях раковых клеток УФ-инактивированный SeV запускает выработку молекула межклеточной адгезии -1 (ICAM-1, CD54), что является гликопротеин который служит лигандом для антиген макрофага-1 (Mac-1) и антиген, связанный с функцией лимфоцитов 1 (LFA-1 (интегрин )). Мак-1 и LFA-1 рецепторы найдены на лейкоциты. Это индуцированное производство происходит за счет активации ядерный фактор-κB ниже по течению митохондриальный противовирусный сигнальный путь и ген I, индуцируемый ретиноевой кислотой. Повышенная концентрация ICAM-1 на поверхности раковых клеток, который запускается SeV, увеличивает уязвимость этих клеток к естественные клетки-киллеры.[115]
Нейраминидаза (NA) удаление сиаловая кислота с поверхности злокачественных клеток стимулирует естественные клетки-киллеры и цитотоксические Т-лимфоциты
Повышенный уровень клеточной мембраны сиалирование связаны с повышенным потенциалом раковых клеток к инвазии и метастазированию, а также с прогрессированием злокачественного новообразования.[218][219][220][221][222][223] Немного сиалирование ингибиторы могут сделать раковые клетки менее злокачественными.[224][225][226]
Одно из возможных объяснений связи между повышенными сиалирование а злокачественный фенотип заключается в том, что сиалирование приводит к образованию толстого слоя покрытия на клеточной мембране, которое маскирует раковые антигены и защищает злокачественные клетки от иммунного надзора. Активность и цитотоксичность NK-клетки подавляется выражением сиаловые кислоты на поверхности опухолевых клеток.[227] Удаление остатков сиаловой кислоты с поверхности опухолевых клеток делает их доступными для NK-клетки и цитотоксические Т-лимфоциты и, следовательно, снижает их потенциал роста. Кроме того, лечение опухолевых клеток сиалидаза улучшает активацию секреции NK-клеток IFN-γ.[227]
Некоторые парамиксовирусы, включая SeV, кодируют и синтезируют нейраминидаза (сиалидаза ), который может удалять остатки сиаловой кислоты с поверхности злокачественных клеток. Гемагглютинин-нейраминидаза (HN) это единственный белок, который вызывает гемагглютинация и обладает нейраминидаза (сиалидаза ) Мероприятия. Нейраминидаза (NA), субъединица белка HN, связывается с сиаловой кислотой и отщепляет ее от поверхности клетки.[228] NA также способствует слиянию клеток, что помогает возникающим вирионам избегать контакта с антителами хозяина и, таким образом, позволяет вирусу распространяться в тканях.
Сиалидаза обработка клеток вызывает потерю сиаловая кислота остатки. Эта потеря значительно увеличивает способность злокачественных клеток активировать цитотоксические Т-лимфоциты.[229] Этот эффект могут вызывать переменные сиалидазы,[229] в том числе NA из Вирус болезни Ньюкасла которые, как было показано, расщепляют 2,3-, 2,6-,[230] и 2,8-связи между остатками сиаловой кислоты.[231] В пробирке, не было существенной разницы между НА от Вирус болезни Ньюкасла, SeV и вирус паротита[232] относительно субстрат специфичность. Эти результаты предполагают, что лечение опухоли вирусом приводит к десиалилирование злокачественных клеток, что способствует усилению противоопухолевого иммунного надзора. Следовательно, способность SeV-сиалидазы (NA) удалять сиаловую кислоту с поверхности злокачественных клеток, скорее всего, помогает обеспечить доступность опухолевых антигенов для распознавания цитотоксические Т-лимфоциты.[нужна цитата ]
Стимуляция естественных киллеров (NK)
Эксперименты с УФ-инактивированным SeV показали, что NK-клетки играют важную роль в опосредованном вирусами ингибировании роста опухоли. Это было показано на мышиной модели рака почки, в которой противоопухолевый эффект SeV подавлялся за счет уменьшения количества NK-клеток путем совместной инъекции специфических антител.[133]
Для активации NK требуется несколько рецепторов, среди которых натуральные белки-киллеры 46 (NKp46) и 44 (НКп44). Исследования показали, что единственным белком парамиксовируса, активирующим NK, является HN.[233] Связывание белка HN с NKp46 и / или NKp44 приводит к лизису клеток, на поверхности которых отображается белок HN или его фрагменты.[234][235] Можно предположить, что активация NK и подавление опухоли с помощью УФ-обработанного SeV[133] вызваны взаимодействием между HN, принадлежащим SeV, и рецепторами NKp46 и / или NKp44, принадлежащими NK-клеткам.
Индукция противоопухолевой цитотоксичности цитотоксических Т-клеток
SeV даже после УФ-инактивации при внутриопухолевом введении может вызвать инфильтрацию опухоли путем дендритные клетки (DC) и CD4 + и CD8 + Т, а также может вызывать усиление противоопухолевой активности этих клеток.[132] Скорее всего, вирусный гемагглютинин-нейраминидаза белок, сильно способствует эффекту (см. "Нейраминидаза (NA) удаление сиаловая кислота с поверхности злокачественных клеток стимулирует естественные клетки-киллеры и цитотоксические Т-лимфоциты " раздел выше).Эта гипотеза основана на двух наблюдениях. Во-первых, функционал гемагглютинин-нейраминидаза белок онколитического Вирус болезни Ньюкасла (NDV), который является родственником SeV, как было показано, усиливает опухолеспецифический цитотоксический ответ CD8 + Т-клетки и повысить активность CD4 + Т-хелперные клетки.[235] Во-вторых, УФ-инактивированный NDV, который не может воспроизводиться, способствует противоопухолевому CTL ответ а также нетронутый NDV, который может воспроизводиться.[235] Поскольку гемагглютинин-нейраминидаза белки вирусов SeV и NDV очень гомологичны, вероятно, что HN белок вируса SeV может активировать как CTL, так и естественные убийцы клеточные ответы. Более вероятный нейраминидаза удаление сиаловая кислота с поверхности злокачественных клеток способствует этому воздействию.[нужна цитата ]
SeV стимуляция дендритных клеток
УФ-инактивированный SeV может вызывать дендритные клетки (DC) для созревания и инфильтрации опухоли,[132] и ex vivo инфицирование ДК рекомбинантным SeV вызывает созревание и активацию ДК в течение 60 минут.[236] Когда вводятся активированные DC, несущие варианты рекомбинантной SeV, выживаемость животных, которым инъецировали злокачественную меланому,[237][238] колоректальный рак,[239] плоскоклеточная карцинома,[240] рак печени, нейробластома и рак простаты[127] значительно улучшен. Было показано, что введение таких ДК перед инъекцией опухолевых клеток предотвращает метастазирование нейробластомы и аденокарциномы простаты в легкие.[241][242]
SeV может реплицироваться с высокими титрами в человеческих ДК, происходящих из моноцитов.[102] При множественности инфицирования 2 примерно 1/3 DC начинают экспрессировать кодируемые белки SeV через 8 часов после заражения. Эта пропорция увеличивается до 2/3 через 24 часа и уменьшается до 1/3 через 48 часов после заражения. SeV демонстрирует высокий цитопатический эффект на ДК; вирус может убить треть DC даже при очень низкой множественности заражения, например 0,5. Наиболее важным наблюдением является то, что инфекция SeV запускает созревание ДК, что проявляется в составе маркеров поверхности клеток ДК. Вирус увеличивает экспрессию молекул класса I и класса II главный комплекс гистосовместимости (MHC) (HLA-A, HLA-B, HLA-C и HLADR ), CD83, а также костимулирующий молекулы CD40 и CD86.[243]
Подавление SeV регуляторных Т-клеток
Эксперименты на животных моделях показали, что даже после УФ-инактивации SeV может блокировать опосредованную Т-клетками регуляторную иммуносупрессию в опухолях. Механизм блокировки связан со стимуляцией инактивированных SeV вирионов интерлейкин 6 (ИЛ-6) секреция зрелыми ДК. Эти эффекты приводят к уничтожению большинства модельных опухолей и подавляют рост остальных.[132] Было показано, что белок F сам по себе может запускать продукцию IL-6 в DC независимым от слияния образом.[105]
Как вектор



SeV был известен исследовательскому сообществу больше с конца 1950-х годов и широко использовался для создания множества вариантов конструкций генной инженерии, включая векторы для доставки транс-генов.[244][121][245] Создание генетических конструкций SeV проще по сравнению с другими вирусами, многие гены SeV имеют сигналы инициации и терминации транскрипции. Следовательно, создание рекомбинантного вируса несложно; чужеродный ген может быть введен в вирусный геном путем замены или добавления гена (ов), экспрессирующего вирусный белок. SeV может включать чужеродный ген или даже несколько генов большого размера. Было продемонстрировано, что ген размером более 3 т.п.н. может быть вставлен и экспрессирован в SeV.[246] Благодаря исключительно цитоплазматической репликации вирус не несет риска генетической интеграции в геномы хозяина, что является проблемой для многих других вирусных векторов. Геном SeV как геномы других несегментированных вирусов с отрицательной цепью РНК[247][248] имеет низкую скорость гомологичной рекомбинации и сравнительно медленно развивается. Существует несколько причин такой стабильности генома: (1) геном не сегментирован, поэтому не может подвергаться генетической реассортации, (2) каждый белок и каждая аминокислота выполняет важную функцию. Следовательно, любая новая генетическая вставка, замена или делеция приведет к снижению или полной потере функции, что, в свою очередь, приведет к тому, что новый вариант вируса станет менее жизнеспособным. (3) Вирус Сендай относится к категории вирусов, которые регулируются «правилом шести».[249] Геном SeV, как и геномы других парамиксовирусов, в основном включает шесть генов, которые кодируют шесть основных белков. Низкая скорость рекомбинации гомологичных РНК в парамиксовирусах, вероятно, является результатом этого необычного геномного требования к полигексамерной длине (6n + 0). Естественная высокая геномная стабильность SeV является положительным признаком его потенциального использования в качестве вектора для вакцины или в качестве онколитического агента. Для любых клинических или промышленных применений важно, чтобы геномные SeV и встроенные чужеродные гены экспрессировались стабильным образом. Благодаря генетической стабильности SeV возможны множественные серийные пассажи вирусной конструкции в культурах клеток или куриных яйцах с эмбрионами без резких геномных изменений.[нужна цитата ]
Обратная генетическая система
Система обратной генетики для спасения вируса Сендай была создана и опубликована в 1995 году.[250] С тех пор был описан ряд доработок и улучшений для представителей Мононегавиралес,[251] Paramyxoviridae в целом,[252][253][254] и, в частности, для вируса Сендай.[255] Вся длина генома вектора SeV, включая трансгены, должна быть кратна шести нуклеотидам (так называемое «правило шести»).[249]
Добавление, удаление и модификация генов
Рекомбинантные варианты SeV были сконструированы путем введения новых генов и / или путем удаления некоторых вирусных генов, таких как F, M и HN, из генома SeV,[239][256][257] Были также созданы конструкции SeV с модифицированным сайтом расщепления протеазой в гибридном белке (F).[122][125][258][259] Белок SeV F относится к типу I мембранный гликопротеин который синтезируется как неактивный предшественник (F0), который должен быть активирован протеолитический расщепление по остатку аргинин-116.[3] После расщепления F0 предшественник дает две дисульфидно-связанные субъединицы F1 и F2.[260] Сайт протеолитического расщепления может быть изменен, поэтому другие протеазы хозяина будут способны обрабатывать F0.[122][125][258][259]
Создана векторная система на основе вируса Сендай, которая может доставлять CRISPR / Cas9 для эффективного редактирования генов.[261]
Неинвазивная визуализация
Набор различных рекомбинантных конструкций SeV, несущих репортерные гены, был создан для неинвазивной визуализации вирусной инфекции у животных. Конструкции позволяют изучать динамику распространения и клиренса SeV.[25][262] Некоторые конструкции были созданы, чтобы доставить зеленый флуоресцентный белок (GFP) в ячейку.[263][264][265][266] Один из них, rSeV-GFP4, коммерчески доступен. Вирус Сендай с зеленым флуоресцентным белком (SeV-GFP4) Некоторые другие конструкции были созданы для доставки красного флуоресцентного белка RFP.[266][267] Кроме того, были созданы конструкции для выражения люцифераза ген.[25][262][268]
Перепрограммирование в ИПСК
Одно из последних применений векторов на основе SeV - перепрограммирование соматических клеток в индуцированные плюрипотентные стволовые клетки.[10][11] Вектор SeV с мутацией, отвечающей за чувствительный к температуре фенотип, был создан для облегчения стирания генома вектора в клеточной линии.[269] Чувствительные к температуре мутанты SeV, кодирующие гены OCT3 / 4, SOX2, KLF4 и c-MYC человека, используются для инфицирования донорских клеток человека, но полученные ИПСК стали свободными от трансгенных генов.[270] Одним из возможных источников донорских клеток являются гемопоэтические стволовые клетки, полученные из пуповинной крови человека, стимулированные цитокинами. Среди этих клеток SeV обеспечивает высокую экспрессию трансгена в субпопуляции клеток CD34 +.[271] Другой источник - человеческий первичный PBMC, в соответствии с техническое примечание TaKaRa Первичные РВМС человека из донорской крови можно напрямую перепрограммировать в ИПСК в течение 21 дня. PBMC производный Т-клетки активирован на 5 дней с анти-CD3 антитело и Ил-2 также может использоваться для этой цели.[272] Кроме того, человеческие фибробласты могут быть использованы для создания ИПСК.[11] Система для такого перепрограммирования коммерчески доступна от ThermoFisher Scientific как CTS ™ CytoTune ™ -iPS 2.1 Sendai Reprogramming Kit, номер по каталогу: A34546.[273] Соответствующее видео, объясняющее процесс создания вектора под названием "Как вирус Сендай перепрограммирует клетки? "доступно в Интернете.
Перенос гена через дыхательные пути
Вектор SeV является одним из наиболее эффективных векторов для переноса генов через дыхательные пути. У его естественных хозяев, таких как мыши, и неприродных хозяев, таких как овцы, опосредованная SeV экспрессия чужеродного гена может быть визуализирована в легких. Эта экспрессия носит временный характер: интенсивна в течение нескольких дней после первого введения SeV, но возвращается к исходным, нулевым значениям к 14 дню. После второго введения экспрессия транс-генов снижается на 60% по сравнению с уровнями, достигнутыми после первая доза.[73]
Для создания вакцины
SeV имеет несколько характеристик, которые важны для вектора для успешной вакцины: вирус не интегрируется в геном хозяина, он не подвергается генетической рекомбинации, он реплицируется только в цитоплазме без промежуточных продуктов ДНК или ядерной фазы. СэВ, как и все другие представители семейства Paramyxoviridae, генетически стабильна и очень медленно развивается. Для вакцинации конструкции на основе вируса могут быть доставлены в форме назальных капель, которые могут быть полезными для индукции иммунный ответ слизистой оболочки. Эта форма вакцинации является более иммуногенной, чем внутримышечная, с учетом уже существующих антител против SeV.[274] Геном вируса имеет большое сходство с вирус парагриппа человека 1 (HPIV-1) и два вируса имеют общие антигенные детерминанты. Исследование, опубликованное в 2011 году, показало, что антитела, нейтрализующие SeV (которые образовывались из-за вирус парагриппа человека инфекция типа 1) может быть обнаружена у 92,5% людей во всем мире со средним значением EC50 титр 60,6 и значения в диапазоне 5,9–11 324.[63] Низкий фон антител против SeV не блокирует способность вакцины на основе SeV стимулировать антиген-специфический Т-клеточный иммунитет.[64]
Вирус парагриппа 1 человека (HPV1)
Аттенуированный SeV дикого типа использовался в клинические испытания с участием обоих взрослых[60] и дети[62] сделать иммунизацию против HPIV-1.Вирусное введение в виде капель в нос в дозах от 5 × 10.5 Инфекционная доза эмбриона 50% (EID50) до 5 × 107 стимулировал производство нейтрализующие антитела к человеческому вирусу без каких-либо измеримых побочных эффектов. Результаты этих испытаний представляют собой доказательство безопасности для людей компетентного в отношении репликации введения вируса Сендай. Антитела к SeV, перекрестно реагирующие с антителами к HPIV-1, присутствуют у большинства людей, однако у большинства людей титр этих антител невысок. Исследование, опубликованное в 2011 году, показало, что антитела, нейтрализующие SeV (которые образовывались из-за HPIV-1 перенесенная инфекция) может быть обнаружена у 92,5% субъектов во всем мире со средним значением EC50 титр 60,6 и значения в диапазоне 5,9–11 324.[63] Низкий фон антител против SeV не блокирует способность вакцины на основе SeV стимулировать антиген-специфический Т-клеточный иммунитет.[64]
Вирус иммунодефицита человека 1 типа (ВИЧ )
Разработка вакцин против СПИДа на основе Т-клеток с использованием векторов вируса Сендай находится в стадии клинических испытаний. Оценка безопасности и иммуногенности вводимой интраназально компетентной к репликации вакцины против вируса Сендай с вектором кляп вируса Сендай типа 1 продемонстрировала: индукцию сильных Т-клеточных и антителных ответов в режимах первичной буст-вакцинации.[275][15][14]
респираторно-синцитиальный вирус (Ортопневмовирус человека )
Вирус Сендай также использовался в качестве основы для вакцины против респираторно-синцитиального вируса (RSV).[12][276] Этот вирус (RSV) является основной причиной инфекции нижних дыхательных путей и посещения больниц в младенчестве и детстве. Было показано, что введение RSV-вакцины на основе SeV защищает хлопковых крыс.[277] и африканские зеленые мартышки от этой вирусной инфекции.[276] Разработка вакцины против RSV находится на стадии I клинических испытаний.
Микобактерии туберкулеза
В настоящее время SeV используется в доклинических исследованиях в качестве основного вектора для вакцины против туберкулез. Слизистая оболочка вакцинация конструкцией SeV генерирует память CD8 Т-клетки иммунитет и способствует защите от Микобактерии туберкулеза в Мышах.[278][13][279]
В качестве векторной основы для COVID-19 вакцина
Для эффективной профилактики инфекций, вызванных SARS-CoV-2, способность вакцины стимулировать иммунитет слизистой оболочки верхних дыхательных путей, включая носовую полость, может иметь большое значение. Такой иммунитет способен усилить противовирусный барьер в верхние дыхательные пути и обеспечить надежную защиту от COVID-19.[280][281] Было продемонстрировано, что интраназально введенный SeV может вызвать сильное иммунитет слизистой оболочки. Таким образом, слизистая оболочка вакцинация SeV генерирует устойчивую продукцию антител IgA и IgG в носовой лимфоидной ткани и в легких хлопковых крыс. Эти антитела способствовали быстрой защите от вируса парагриппа человека 1 типа.[282]
В Китае, Университет Фудань совместно с Pharma Co. Ltd. занимается разработкой вакцины для профилактики COVID-19. SeV служит опорным вектором в проекте. [27]. Исследователи из Университета Фудань имеют значительный опыт работы с векторами SeV; они создали вакцину на основе SeV для профилактики туберкулеза, которая проходит доклинические испытания.[278][13][279] В Китае есть два штамма вируса Сендай, описанные в научных публикациях. Один из них - штамм BB1,[283] которые произошли от Московский штамм вируса[139] и имеет менее 20 несиномных замен по сравнению со штаммом Moscow. Штамм ВВ1 был передан сотрудникам Института биологии им. Контроль и профилактика вирусных заболеваний, Пекин, Китай исследователями Ивановский институт вирусологии, Москва, Россия в 1960-е годы.[284] Другой штамм - штамм Тяньцзинь, выделенный в Китае в 2008 году.[284] Один из этих штаммов был использован для создания конструкции SeV85AB с дефицитом репликации, в которой отсутствует слитый белок (F).[278][13][279] но вставлена последовательность, кодирующая иммунодоминантный антиген Mycobacterium tuberculosis.[285] Безопасность и иммуногенность этой конструкции проверяли на животных моделях.[278][13][279] Эту конструкцию можно легко трансформировать в конструкцию, кодирующую S-белок SARS-CoV-2. В России Государственный научный центр вирусологии и биотехнологии "Вектор" разрабатывает вакцину против COVID-19 с использованием московского штамма вируса Сендай.[139] как векторную основу.
Биология и свойства вируса
Структура вириона

Структура вириона хорошо описана в опубликованном обзоре.[3] Вирус Сендай - это вирус в оболочке: его внешний слой представляет собой липидная оболочка, который содержит гликопротеин гемагглютинин-нейроминидаза (HN)[286] с двумя ферментативными активностями (гемагглютинирующий и нейраминидаза ).[287] Гемагглютинин (ЧАС) служит фактором прикрепления клеток и слитым белком мембраны. Нейраминидаза (NA) это сиалидаза что расщепляет и удаляет сиаловая кислота с поверхности клетки-хозяина. Это расщепление способствует слиянию липидной оболочки вируса с внешней мембраной клетки.
В липидной оболочке вируса находится также гибридный белок (F),[288] который также является гликопротеин что обеспечивает проникновение вируса в клетку-хозяин после вирусного адсорбция. Под липидной мембраной находится матричный белок (M);[289] он образует внутренний слой оболочки вируса и стабилизирует ее структуру. Вирион SeV также содержит ядро нуклеокапсида, которое состоит из геномной РНК, белка нуклеокапсида (НП),[290] фосфопротеины (п),[291] который является важной субъединицей вируса РНК-зависимой РНК-полимеразы (RDRP), и большого белка (L)[292] это каталитическая субъединица этой полимеразы. C-белок, который транслируется из альтернативной рамки считывания Р-кодирующей мРНК, также связан с вирусный капсид.[293] Он присутствует в вирионах SeV в относительно небольших количествах (40 молекул на геном).[294]

Геном
Структура

Геном SeV представляет собой несегментированную РНК с отрицательным смыслом, приблизительно 15.384 n. в длину и содержит некодирующие 3 ’лидерную и 5’ концевую области, которые имеют длину около 50 нуклеотидов.[3][246] Как и другие респираторы семейства Paramyxoviridae, в SeV они работают как цис-действующие элементы, необходимые для репликации. 3’-лидерная последовательность действует как промотор транскрипции. Между этими некодирующими областями расположены шесть генов, которые кодируют белок нуклеокапсида (NP), фосфопротеин (P), матричный белок (M), гибридный белок (F), гемагглютинин-нейраминидазу (HN) и большой белок (L) в этот приказ от конечной остановки 3 '.[3][246] РНК-зависимая РНК-полимераза SeV состоит из большого белка (L) и фосфопротеина (P). В структурный ген Последовательность SeV следующая: 3'-NP-P-M-F-HN-L-5 '. Межгеномные области между этими генами имеют длину три нуклеотида, как и у других респираторов. Дополнительные белки, которые часто называют неструктурными или вспомогательными белками, могут быть получены из гена P с использованием альтернативных рамок считывания.[3][295] МРНК P / C вируса Сендай содержит пять сайтов инициации рибосом между положениями 81 и 201 с 5'-конца. Один из этих сайтов инициируется в открытой рамке считывания P, тогда как четыре других инициируют вложенный набор белков C (C ', C, Y1, Y2).[296][295][297] Эти белки C инициируются в рамке считывания +1 к рамке считывания P в разных сайтах начала трансляции. Сендайский вирус использует рибосомное шунтирование для экспрессии белков Y1 и Y2, которые инициируются в четвертом и пятом стартовых сайтах на мРНК P / C (соответственно).[297] Три дополнительных белка SeV также кодируются мРНК P / C. Два из этих белков V и W являются продуктами Редактирование РНК в кодоне 317 мРНК - остатки G добавляются котранскрипционно (+ один остаток G для V и + два G для W).[294] Третий - Х-белок представлен 95 аминокислотами на С-конце белка Р и независимо инициируется рибосомами.[298] Все эти неструктурные белки выполняют несколько функций, включая организацию синтеза вирусной РНК и помощь вирусу в инфицировании клеток грызунов, избегая врожденного иммунитета хозяина (см. «Механизм вирусного иммуносупрессия в разделе "естественные хосты" выше).[294] Также было обнаружено, что C-белок способствует образованию почкующихся вирусоподобных частиц.[299] и небольшое количество белка C связано с вирусный капсид.[293]
Эволюционная стабильность
Геномы несегментированных вирусов с отрицательной цепью РНК (включая парамиксовирусы) имеют низкую скорость гомологичной рекомбинации и сравнительно медленно развиваются.[247][248] Вероятно, существует множество причин такой геномной стабильности: (1) геномы этих вирусов не сегментированы, поэтому не могут подвергаться генетической реассортации, (2) каждый белок и каждая аминокислота выполняет важную функцию.Следовательно, любая новая генетическая вставка, замена или делеция приведет к снижению или полной потере функции, что, в свою очередь, приведет к тому, что новый вариант вируса станет менее жизнеспособным. (3) Вирус Сендай относится к вирусам, для которых действует «правило шести». Геном SeV, как и геномы других парамиксовирусов, в основном включает шесть генов, которые кодируют шесть основных белков.[249] Низкая скорость рекомбинации гомологичных РНК в парамиксовирусах, вероятно, является результатом этого необычного геномного требования к полигексамерной длине (6n + 0). Естественная высокая геномная стабильность SeV является положительным признаком его потенциального использования в качестве вектора для вакцины или в качестве онколитического агента. Для любых клинических или промышленных применений важно, чтобы геномные SeV и встроенные чужеродные трансгены экспрессировались стабильным образом. Генетическая стабильность позволяет выполнять множество серийных пассажей в клеточных культурах или куриных яйцах с эмбрионами без изменения вирусного генома.[нужна цитата ]
Вирусные белки
| Название и ссылка на UniProt | Псевдоним | Функция | Категория |
|---|---|---|---|
| Нуклеокапсидный белок | НП |  NP-белок внутри вириона SeV | структурные белки |
| Фосфоропротеин | п |  Фосфоропротеин вируса Сендай | |
| Матричный белок | M | Матричный белок образует внутренний слой оболочки вируса и стабилизирует ее структуру.  Томографические и схематические изображения вирионов парамиксовирусов. | |
| Слитый белок | F | Гликопротеин F оболочки способствует слиянию липидной оболочки вируса с внешней мембраной клетки и способствует слиянию клетки-клетки.  Томографические и схематические изображения вирионов парамиксовирусов. | |
| Гемагглютинин нейраминидаза | HN | Гликопротеин оболочки HN участвует в распознавании рецепторов, активности сиалидазы, способствует слиянию липидной оболочки вируса с внешней мембраной клетки, способствует слиянию клеток.  Томографические и схематические изображения вирионов парамиксовирусов. | |
| Большой белок | L |  L-белок внутри вириона SeV | |
| С-протеин | C | Этот белок взаимодействует с IKKα серин / треонинкиназа и предотвращает фосфорилирование IRF7.[37][38][39] С-белок связывает субъединица 2 рецептора интерферона-альфа / бета (IFNAR2 ). Это связывание ингибирует стимулированное IFN-α фосфорилирование тирозина вышележащих рецептор-ассоциированных киназ, TYK2 и JAK1.[41] С-белок подавляет пути передачи сигнала интерферон альфа / бета (IFN-α / β) и IFN-γ путем связывания с N-концевым доменом STAT1.[43] С-протеин подавляет выработку оксид азота (NO) мышиной макрофаги обладающий цитотоксической активностью против вирусов.[44][45] С-белок ингибирует путь, который включает Толл-подобный рецептор (TLR7) и TLR9 -индукция IFN-альфа, который специфичен для плазмацитоидов дендритные клетки.[40] C-белок участвует в почковании SeV и выходе из клеток вирионов. C-белок способствует почкованию за счет взаимодействия с AIP1 / Alix, который является белком-хозяином, который участвует в апоптозе и перемещении через эндосомную мембрану.[300] | неструктурный |
| C'-протеин | C ' | подавление апоптоза, выход из иммунитета хозяина и модуляция формы вирионов[36][39] | |
| Y1-белок | Y1 | ||
| Y2-белок | Y2 | ||
| V-белок | V | Это связывает MDA5 и ингибировать его активацию промотора IFN.[48][49] Это связывает RIG-I и TRIM25. Эта привязка предотвращает передачу сигналов RIG-I в нисходящем направлении к митохондриальный противовирусный сигнальный белок (MAVS) путем нарушения TRIM25-опосредованного убиквитинирования RIG-I.[50] V-протеин подавляет выработку интерлейкин-1β, препятствуя сборке воспаление NLRP3.[52] | |
| W-белок | W | подавление апоптоза, выход из иммунитета хозяина и модуляция формы вирионов[36] | |
| X-белок | Икс |

Протеолитическое расщепление клеточными протеазами
Белок SeV F относится к типу I мембранный гликопротеин который синтезируется как неактивный предшественник (F0), который должен быть активирован протеолитический расщепление по остатку аргинин-116.[3] После расщепления F0 предшественник дает две дисульфидно-связанные субъединицы F1 и F2.[260] Парамиксовирусы используют различные протеазы клетки-хозяина для активации своих F-белков. Вирус Сендай использует активирующие протеазы, которые сериновые эндопептидазы представлен триптазой бета 2- (TPSB2 ),WikiGenes - Совместная публикация (который имеет псевдонимы, такие как триптаза II, триптаза Клара, клубные клетки триптаза, тучные клетки триптаза,[301][302][303][304]) трипсин 1 (PRSS1 ),[305] мини-плазмин (PLG )[306] и трансмембранная сериновая протеаза 2 (TMPRSS2 ).[267] Скорее всего, свертываемость крови фактор X (F10) способен расщеплять и активировать SeV F0.[307][308][309] Возможно, что другие, еще не идентифицированные клеточные протеазы, также могут обрабатывать F0 белок SeV.
Рецепторы входа в SeV-клетки
Штаммы респираторы, авулавирусы, и большинство рубулавирусы, который имеет HN в своих конвертах используйте сиаловые кислоты в качестве рецепторов входа в клетки. SeV, как представитель респираторных вирусов, использует молекулы, содержащие остатки сиаловых кислот, такие как гликопротеины и гликосфинголипиды (ганглиозиды ). SeV также может использовать лектины для записи в ячейку. Три рецептора SeV представлены молекулами, которые кластеры дифференциации.[310] Некоторые рецепторы SeV сверхэкспрессируются в раковых клетках (см. противораковый механизм ).
Структуры некоторых из этих рецепторов доступны для визуализации через SugarBindDB - ресурс опосредованных гликаном взаимодействий между хозяином и патогеном.[325] Другие доступны через базу данных KEGG Glycan,[326] Составная база данных PubChem,[327] и база данных TOXNET (сеть токсикологических данных) Национальной медицинской библиотеки США.[328]



Жизненный цикл
Поскольку SeV представляет собой РНК-вирус с отрицательной цепью, весь жизненный цикл вируса завершается в цитоплазме с использованием его собственной РНК-полимеразы.
Адсорбция и синтез
Вирус Сендай инициирует процесс заражения клеткой-хозяином адсорбция опосредовано признанием конкретных рецептор молекулы.[316] Гемагглютининнейраминидаза (HN) служит белком прикрепления вирусной клетки, который взаимодействует со специфическим рецептором входа в клетку. NH имеет сиалидаза активности, и он способен раскалывать сиаловая кислота остатки клеточного рецептора. Это расщепление запускает процесс слияния вирусный конверт и клеточная мембрана, который способствует взаимодействию NH с вирусным гибридным белком (F).[329] Для выполнения функции слияния белок F должен быть протеолитически активированный из него предшественник неактивной формы F0.[330] Для этой активации требуется F0 расщепление хозяином протеаза перед адсорбцией вируса (см. раздел «протеолитическое расщепление клеточными протеазами»).
Без покрытия
После слияния основная мембрана и вирусный конверт, СэВ по одной модели «непокрытие " с распространение из вирусный конверт белки в плазматическая мембрана хозяина.[331] Согласно другой модели, вирус не высвобождает свои белки оболочки в мембрану хозяина. Мембраны вируса и хозяина сливаются и образуется соединительная структура. Эта соединительная структура служит транспортной «магистралью» для вирусных рибонуклеопротеин (РНП). Таким образом, RNP проходит через соединительную структуру, чтобы достичь внутренней части ячейки.[331] позволяя генетическому материалу SeV проникать в цитоплазму клетки-хозяина.[329][332]
Цитоплазматическая транскрипция и репликация
Оказавшись в цитоплазме, геномная РНК SeV участвует в качестве матрицы в двух различных процессах синтеза РНК, выполняемых РНК-зависимой РНК-полимеразой, которая состоит из белков L и P: (1) транскрипция для генерации мРНК и (2) репликация для получения РНК антигенома с положительным смыслом, которая, в свою очередь, действует как матрица для производства геномов с отрицательной цепью потомства.[333][334] РНК-зависимая РНК-полимераза способствует образованию метилированных кэп-структур мРНК.[335]
Считается, что белок NP выполняет как структурную, так и функциональную роль.[336] Считается, что эта концентрация белка регулирует переключение от транскрипции РНК к репликации РНК. Геномная РНК функционирует как матрица для транскрипции вирусной РНК до тех пор, пока концентрация белка NP не возрастет. По мере накопления белка NP происходит переход от транскрипции к репликации.[337] Белок NP инкапсидирует геномную РНК, образуя спиральный нуклеокапсид, который является матрицей для синтеза РНК вирусной РНК-полимеразой. Белок входит в состав следующих комплексов NP-P (P, фосфопротеин), NP-NP, нуклеокапсид-полимераза и РНК-NP. Все эти комплексы необходимы для репликации вирусной РНК.[336]

Перевод
Два разных набора белков транслируются с вирусных мРНК.[3] Первый набор представлен шестью структурными белками, которые включают нуклеокапсидный белок (NP), фосфопротеин (P), матричный белок (M), гибридный белок (F), нейраминидазу (NA) и большой белок (L).[3] Все эти белки имеют различные функции и включены в вирусный капсид (см. Раздел «Структура вириона» выше). Второй набор представлен семью неструктурными или вспомогательными белками.[3] Эти белки транслируются с полицистронной мРНК гена P.[296][295][297] Эта мРНК кодирует восемь продуктов трансляции, и Р-белок - только один из них. Альтернативные варианты трансляции представлены белками V, W, C, C ’, Y, Y’ и X. Белки C ’, C, Y1, Y2 являются продуктами альтернативной рамки считывания мРНК, они все вместе называются C-белками или C-вложенными белками и имеют общий C-концевой конец.[3][338] Белок X также имеет один и тот же С-конец, и его трансляция также независимо инициируется рибосомами.[298] Белки V и W являются продуктами котранскрипционного редактирования мРНК. Все эти неструктурные белки выполняют множество функций, включая организацию синтеза вирусной РНК и помощь вирусу в инфицировании клеток-хозяев, избегая врожденного иммунитета.[294] (см. выше раздел «Механизм вирусной иммуносупрессии у естественных хозяев»).

Транспортировка вирусных белков к клеточной мембране
После трансляции, при подготовке к процессу почкования, три вирусных липофильных белка NA, F и M мигрируют к мембране клетки-хозяина и связываются с ней.[339]
Образование синцития и прямая передача инфекции от клетки к клетке
Два белка SeV: HA и F после их связывания непосредственно с клеточной мембраной способствуют слиянию клеток, что приводит к образованию больших многоядерных клеток (синцитий). Это образование включает слияние инфицированных клеток с соседними клетками-мишенями и остается важным механизмом прямого распространения вирусных компонентов от клетки к клетке. Таким образом, инфекция SeV в форме генетического материала в частично собранных вирионах может распространяться без какого-либо воздействия нейтрализующих антител хозяина (подробности и ссылки см. В разделе «Направленное слияние клеток (образование синцития)»).
Почкование
Вирус Сендай, как и все другие вирусы оболочки, использует липидный бислой клеточной мембраны хозяина для образования мембраны вирусного капсида. Связывание вирусных белков (M, HN и F) с мембраной клетки-хозяина способствует их взаимодействию с комплексом RNP, который состоит из вирусной геномной РНК, связанной с белками SeV (NP, P и L).[339] Таким образом, все структурные компоненты вируса, включая вирусные гликопротеины и геномный комплекс РНП, собираются вместе. После такой сборки инфекционные вирусные частицы отпочковываются из индивидуально или коллективно инфицированных клеток (синцития). C-белок способствует почкованию за счет взаимодействия с AIP1 / Alix, который является белком-хозяином, который участвует в апоптозе и перемещении через эндосомную мембрану.[300] Частицы инфекционного вируса обычно высвобождаются через 24 часа после заражения (hpi), а пиковые титры появляются между 48 и 72 hpi.[264]
Стойкая инфекция
Вирус Сендай может вызвать стойкую инфекцию в своих клетках-хозяевах. Несколько циклов субкультивирования вируса приводят к созданию новых вариантов вируса с высокой способностью устанавливать стойкую инфекцию. Эти варианты SeV развивают определенные генотипический изменения.[340] Постоянная инфекция также может быть установлена мгновенно в регуляторный фактор интерферона 3 (IRF-3) -сборщики ячеек. IRF-3 является ключевым проапоптотическим белком, который после активации SeV запускает апоптоз. IRF-3 клетки-нокдаун экспрессируют вирусный белок и продуцируют низкие уровни инфекционных вирионов.[341][342] IRF-3 контролирует судьбу инфицированных SeV клеток, запуская апоптоз и предотвращая установление персистенции; поэтому его разрушение позволяет проявить настойчивость.[112] Также сообщалось, что во время репликации инфекции SeV образуются дефектные вирусные геномы (ДВГ).[343] и выборочно защищать субпопуляцию клеток-хозяев от гибели, тем самым способствуя возникновению стойких инфекций.[344][345] В природе энзоотический Характер заболеваний предполагает, что вирус может быть латентным и может быть удален в течение года.
Направленное слияние клеток (образование синцития)
Одной из признанных черт вируса Сендай, присущей членам его рода, является способность вызывать синцития формирование in vivo и in vitro в культурах клеток эукариот.[346] Образование синцития помогает вирусу избегать нейтрализации антител организма-хозяина во время распространения инфекции. Механизм этого процесса достаточно хорошо изучен и очень похож на процесс слияния, используемый вирионом для облегчения проникновения в клетки. Активность связывания рецепторов гемагглютинин -нейраминидаза белок несет полную ответственность за создание тесного взаимодействия между оболочкой вируса и клеточной мембраной.
Однако это белок F (один из многих мембранные слитые белки ), что при локальном обезвоживании[347] и конформационное изменение в связанном белке HN,[348] активно внедряется в клеточную мембрану, что приводит к слиянию оболочки и мембраны с последующим проникновением вириона. Когда белок HN и F продуцируются клеткой и экспрессируются на поверхности, тот же процесс может происходить между соседними клетками, вызывая обширное слияние мембран и приводя к образованию синцития.[349]
Такое поведение SeV использовали Келер и Мильштейн, опубликовавшие в 1975 году статью, описывающую революционный метод производства. моноклональные антитела. При необходимости надежного метода для производства больших количеств специфического антитела, эти два объединили моноклональный В клетка, подвергнутые действию выбранного антигена, и миелома опухолевые клетки для производства гибридомы, способные расти неограниченно долго и вырабатывать значительные количества антитела, специфически нацеленного на выбранный антиген. Хотя с тех пор были найдены более эффективные методы создания таких гибридов, Келер и Мильштейн впервые использовали вирус Сендай для создания своих революционных клеток.[9]
Чувствительные клеточные линии и штаммы вирусов


Сотовые линии
Научные исследования показывают, что следующие клеточные линии в разной степени восприимчивы к инфекции SeV.

Некоторые из этих ячеек (например, ООО МК2,[357] 4647 и HEK 293) не экспрессируют протеазу, которая обрабатывает слитый белок F0 вируса Сендай; следовательно, они производят неинфекционные вирионы.[355]
IFN типа 1 ингибирует продукцию SeV в нормальных респираторных клетках человека,[75] но не в состоянии сделать это в клетках человека, которые происходят из различных злокачественных новообразований, таких как U937, Намалва, и A549.[204]

Вариабельные культуры клеток, полученные из опухолей, обладают разной чувствительностью к SeV, а также могут продуцировать вирус в разных количествах.[351] Есть несколько факторов, которые ответственны за эту изменчивость. Например, наблюдалась обратная корреляция между чувствительностью клеток к инфекции SeV и конститутивными уровнями экспрессии мРНК TLR 3 и TLR 7 в первичных культурах рака простаты.[356] Таким образом, дефектная передача сигналов IFN, активируемая TLR, является одним из этих факторов.
Варианты штамма SeV, адаптированные для роста в разных клетках, обладают разными свойствами. Одно исследование показывает, что вариант SeV адаптирован для роста в ООО-МК2 клетки и вариант SeV, адаптированный для роста в зародыш яйца отличаются двумя аминокислотами по Белок HN. Эта разница приводит к разной нейраминидазе. конформации вокруг сайта связывания рецептора и вариации в нейраминидаза активность между двумя вирусными вариантами.[358] Другое исследование показывает, что варианты SeV, адаптированные для роста в культура клеток 4647 (клетки почек африканской зеленой мартышки) И в НЕК 293 (клетки эмбриональной почки человека) вместо того зародыш куриные яйца, также приобретают мутации в Ген HN и оба варианта SeV утратили онколитическую активность.[355][359]
Штаммы
История
Все штаммы вируса Сендай принадлежат к одному серотип. Происхождение многих штаммов SeV было описано в 1978 году.[68] Некоторые сорта, такие как Ohita[358] и Хамамацу[360] были описаны позже. Штаммы Ohita и Hamanatsu были изолированы от отдельных эпидемий у лабораторных мышей.[361][362] По личной памяти Алисы Геннадьевны Букринской, которая является соавтором множества публикаций, связанных с Сев, вместе с проф. Виктор Михайлович Жданов, начиная с 1961 г.,[363] Московский штамм SeV[139] был получен проф. Виктор Михайлович Жданов из Ивановский институт вирусологии из Японии конца 1950-х или начала 1960-х годов,[363] Сообщается[284] что штамм BB1[283] получен из штамма вируса Москва.[139] Штамм BB1 был передан исследователям Института контроля и профилактики вирусных заболеваний, Пекин, Китай, исследователями Ивановский институт вирусологии, Москва, Россия в 1960-е годы.[284]
Вирулентность
Полевой изолят SeV, который ослабляется через пассажи яйца, менее вирулентен для респираторных клеток мыши.[364] Таким образом, штаммы, выделенные от животных несколько десятилетий назад и прошедшие многократные пассажи в яйцах, менее вирулентны для мышей по сравнению со штаммами, представляющими собой свежие полевые изоляты.
Дефектные мешающие геномы
Дефектные интерферирующие (DI) геномы или дефектные вирусные геномы (DVG) представляют собой продукты вирусной РНК с дефектом репликации, генерируемые во время вирусных инфекций многими типами вирусов, включая SeV.[365][343][345] Одна аминокислотная замена в нуклеопротеине (NP) вызывает повышенную скорость продукции геномов DI в штамме SeV Cantell, который известен своей особенно сильной индукцией интерферона бета (IFN-β) во время вирусной инфекции.[366] Было показано, что DI ответственны за эту сильную индукцию IFN-β.[367]
Происхождение штаммов и идентификатор последовательности
| Название штамма | Источник | Идентификатор последовательности |
| Z (Сендай / 52, или ВР-105, или Фусими) | производное мышиного изолята 50-х (Япония) | AB855655.1 |
| Cantell (VR-907) | производное того же изолята, что и выше | AB855654.1 |
| Эндерс | производное того же изолята, что и выше | * |
| Нагоя | производное того же изолята, что и выше | AB275417.1 AB195968.1 |
| Москва | производное мышиного изолята 50-60s (Япония или Россия) | KP717417.1 |
| BB1 | производное того же мышиного изолята 50-60s, что указано выше (Япония или Россия) | DQ219803.1 |
| Охита | мышиный изолят 70-90-х годов (Япония) | NC_001552.1 |
| Хамамацу | Независимо от Ohita, мышиный изолят 70-90-х годов (Япония) | AB039658 |
* Последовательность штамма Enders доступна из патента США. Модифицированная вакцина против вируса Сендай и вектор визуализации
Сходство последовательностей штаммов
| Название штамма | Z | Могу сказать | Эндерс | Нагоя | Москва | BB1 | Охита | Хамамацу |
| Сендайский вирус | Гомология мегабластов для полного генома SeV (%) | |||||||
| Z | 100 | |||||||
| Могу сказать | 99.3 | 100 | ||||||
| Эндерс | 99.4 | 99.2 | 100 | |||||
| Нагоя | 98.9 | 100 | ||||||
| Москва | 88.1 | 88.6 | 87.9 | 100 | ||||
| BB1 | 88.1 | 99.9 | 100 | |||||
| Охита | 88.9 | 91.2 | 100 | |||||
| Хамамацу | 91.7 | 91.7 | 99.2 | 100 | ||||
| Вирус парагриппа человека 1 | Несмежный мегабласт для полных вирусных геномов (%) seq. ID AF457102.1 | |||||||
| ВПЧ1 (штамм Вашингтон / 1964) | 75.2 | 73.9 | 74.5 | 74.6 | ||||
| Вирус парагриппа свиней 1 | Несмежный мегабласт для полных вирусных геномов (%) seq.ID NC_025402.1 | |||||||
| PPV1 (штамм S206N) | 71.15 | 75.1 | 70.5 | 71 | ||||
Подготовка и титрование вирусов
Вирус Сендай может быть произведен с использованием определенных свободных от патогенов (SPF) зародыш куриные яйца в соответствии с установленным протоколом.[368] Следует проявлять осторожность при адаптации SeV для роста в культуре клеток для онколитических исследований. Одно исследование показало, что вирус Сендай, адаптированный для роста в культуре клеток вместо куриных яиц, теряет онколитическую активность.[355][359]
Титр вируса Сендай можно оценить по серийной конечной точке. 10-кратное разведение вирусосодержащего материала в зародыш куриные яйца. Этот анализ оценивает конечное разведение, которое может вызвать вирусную инфекцию в 50% инокулированных яиц. Этот анализ EID50 используется для количественного определения титра многих вирусов которые можно выращивать в яйцах.[369]Простой метод оценки пятидесяти процентов конечных точек. Измерение титра вируса, полученное в результате этого анализа, выражается как инфекционная доза эмбриона 50% (EID50). Титр SeV также можно оценить с помощью анализ зубного налета в ООО-МК2 клетки[370] и по серийной конечной точке 2-кратное разведение анализ гемагглютинации (HA).[371] Однако тест HA менее надежен, чем тесты EID50 или PFU, потому что он не всегда указывает на наличие жизнеспособного вируса в образце. Мертвый вирус может демонстрировать высокие титры НА.
Наличие штаммов, конструкций, белков и антител
Сендайский вирус преп. для научных исследований можно получить в лаборатории Чарльза Риверса. Полученный вирус доступен в жидкой или лиофилизированной форме аллонтоисной жидкости или очищенной в градиенте сахарозы.[28] Греческая компания Bioinnotech также производит вирус Сендай для научных исследований. [29] Семена вируса Сендай Z доступны в ATCC,[372] Штамм Cantell доступен в ATCC,[373] и из лаборатории Чарльза Риверса,[30] Московский штамм также доступен в АТСС.[374] Конструкция вируса Сендай с зеленым флуоресцентным белком (SeV-GFP4) доступна от ViraTree. [31] Рекомбинантные белки SeV в системе экспрессии E.Coli для научных исследований, включая F (а.о. 26-500), M (а.о. 1-348), V (а.о. 1-384), L (а.о. 1-2228), W (а.о. 1- 318), N (aa 1-524), C (aa 2-215) и белок M (aa 1-348) доступны в форме рекомбинантной ДНК от Creative Biolabs Vaccine. Система для перепрограммирования соматических клеток в индуцированные плюрипотентные стволовые клетки доступен от ThermoFisher Scientific как CTS ™ CytoTune ™ -iPS 2.1 Комплект для перепрограммирования Sendai, номер по каталогу: A34546. Система Sendai Fluorescence Reporter, которая позволяет проверять клетки для выявления тех, которые допускают заражение вирусом Сендай, доступна по адресу ThermoFisher Scientific: Каталожный номер A16519. Поликлональные антитела к вирусу Сендай, полученные от кролика, доступны от Международная корпорация MBL (код pd029) и от Caltag Medsystems (каталожный номер PD029). Поликлональные антитела к вирусу Сендай, полученные из курицы, доступны от Abcam. (каталожный номер ab33988)[375] и из antibodies-online.com (№ ABIN6737444) . Моноклональные антитела (IgG1) к F-белку доступны от Керафаст (каталожный номер EMS015 ) и антитела к белку HN (Ig2A) также доступны от Kerafast. (каталожный номер EMS016). Шесть различных вариантов мышиных моноклональных антител к белку HN с разными флуорофорами доступны от ThermoFisher Scientific под номерами каталогов № 51-6494-82, № 25-6494-82, № 12-6494-82, № 13-6494. -82, № по каталогу 14-6494-82, № по каталогу 53-6494-82. Стандартный тест для обнаружения вируса Сендай - ИФА (иммуноферментный анализ ), однако MFI (мультиплексный флуоресцентный иммуноанализ) более чувствителен.
Рекомендации
- ^ Уокер, Питер (15 июня 2015 г.). "Внедрение в семействе нелатинизированных биномиальных названий видов для всего таксона Rhabdoviridae" (PDF). Международный комитет по таксономии вирусов (ICTV). п. 7. Получено 6 февраля 2019.
- ^ "Paramyxoviridae". UniProt.
- ^ а б c d е ж грамм час я j k л м п Faísca P, Desmecht D (февраль 2007 г.). «Вирус Сендай, парагрипп мышей типа 1: давний патоген, который остается актуальным». Исследования в области ветеринарии. 82 (1): 115–25. Дои:10.1016 / j.rvsc.2006.03.009. PMID 16759680.
- ^ «Таксономия - респировирус». UniProt.
- ^ «Респировирус». ViralZone.
- ^ а б Сага К., Канеда Ю. (2015). «Онколитическая виротерапия рака на основе вируса Сендай: последние достижения». Онколитическая виротерапия. 4: 141–7. Дои:10.2147 / OV.S66419. ЧВК 4918391. PMID 27512677.
- ^ а б c d е ж Матвеева О.В., Кочнева Г.В., Нетесов С.В., Оникиенко С.Б., Чумаков П.М. (апрель 2015 г.). «Механизмы онколиза парамиксовирусом Сендай». Acta Naturae. 7 (2): 6–16. Дои:10.32607/20758251-2015-7-2-6-16. ЧВК 4463408. PMID 26085940.
 Материал был скопирован из этого источника, который доступен по лицензии Creative Commons Attribution License.
Материал был скопирован из этого источника, который доступен по лицензии Creative Commons Attribution License. - ^ а б c Ильинская Г.В., Мухина Е.В., Соболева А.В., Матвеева О.В., Чумаков П.М. (2018). «Онколитическая Сендайская вирусная терапия опухолей тучных клеток собак (пилотное исследование)». Границы ветеринарии. 5: 116. Дои:10.3389 / fvets.2018.00116. ЧВК 5995045. PMID 29915788.
- ^ а б Кёлер Г., Мильштейн С. (август 1975 г.). «Непрерывные культуры слитых клеток, секретирующих антитела с заранее определенной специфичностью». Природа. 256 (5517): 495–7. Bibcode:1975Натура.256..495K. Дои:10.1038 / 256495a0. PMID 1172191. S2CID 4161444.
- ^ а б Фусаки Н., Бан Х, Нишияма А., Саеки К., Хасегава М. (2009). «Эффективная индукция свободных от трансгенов плюрипотентных стволовых клеток человека с использованием вектора на основе вируса Сендай, РНК-вируса, который не интегрируется в геном хозяина». Труды Японской академии. Серия B, Физические и биологические науки. 85 (8): 348–62. Bibcode:2009PJAB ... 85..348F. Дои:10.2183 / pjab.85.348. ЧВК 3621571. PMID 19838014.
- ^ а б c Бан Х, Нишишита Н., Фусаки Н., Табата Т., Саеки К., Шикамура М. и др. (Август 2011 г.). «Эффективное генерирование свободных от трансгенов человеческих плюрипотентных стволовых клеток (ИПСК) с помощью чувствительных к температуре векторов вируса Сендай». Труды Национальной академии наук Соединенных Штатов Америки. 108 (34): 14234–9. Bibcode:2011ПНАС..10814234Б. Дои:10.1073 / pnas.1103509108. ЧВК 3161531. PMID 21821793.
- ^ а б c Рассел CJ, Hurwitz JL (2015-12-09). «Вирус Сендай как основа для вакцин против RSV и других парамиксовирусов человека». Экспертный обзор вакцин. 15 (2): 189–200. Дои:10.1586/14760584.2016.1114418. ЧВК 4957581. PMID 26648515.
- ^ а б c d е Ху З, Цзян В., Гу Л., Цяо Д., Шу Т., Лоури Д. Б. и др. (Декабрь 2019 г.). «Гетерологичная первичная буст-вакцинация против туберкулеза рекомбинантным вирусом Сендай и ДНК-вакцинами». Журнал молекулярной медицины. 97 (12): 1685–1694. Дои:10.1007 / s00109-019-01844-3. PMID 31786669. S2CID 208359634.
- ^ а б c Секи С., Матано Т. (2016). «Разработка вакцины против СПИДа на основе вектора вируса Сендай, вызывающей Т-клеточные ответы». Экспертный обзор вакцин. 15 (1): 119–27. Дои:10.1586/14760584.2016.1105747. PMID 26512881. S2CID 27197590.
- ^ а б c Nyombayire J, Anzala O, Gazzard B, Karita E, Bergin P, Hayes P и др. (Январь 2017 г.). «Первая на людях оценка безопасности и иммуногенности вводимой интраназально репликационно-компетентной вакцины против вируса Сендай с вектором против вируса Сендай типа 1: индукция мощных Т-клеточных или антителных ответов в режимах Prime-Boost». Журнал инфекционных болезней. 215 (1): 95–104. Дои:10.1093 / infdis / jiw500. ЧВК 5225252. PMID 28077588.
- ^ Номер клинического исследования NCT03473002 в ClinicalTrials.gov
- ^ Кэри К. (5 марта 2020 г.). «Растущее количество биофармацевтических препаратов нацелено на COVID-19 по мере распространения вируса». BioWorld.
- ^ Кассано А., Расмуссен С., Вольф FR (январь 2012 г.). «Вирусные болезни». В Suckow MA, Стивенс КА, Уилсон Р.П. (ред.). Лабораторный кролик, морская свинка, хомяк и другие грызуны.. Американский колледж медицины лабораторных животных. Академическая пресса. С. 821–837. ISBN 978-0-12-380920-9.
- ^ Маклахлан Н.Дж., Дубови Э.Д., ред. (2017). «Глава 17 - Paramyxoviridae и Pneumoviridae». Ветеринарная вирусология Феннера (Пятое изд.). Академическая пресса. С. 327–356. Дои:10.1016 / B978-0-12-800946-8.00017-9. ISBN 9780128009468. S2CID 214757272.
- ^ Flecknell PA, Parry R, Needham JR, Ridley RM, Baker HF, Bowes P (апрель 1983 г.). «Респираторное заболевание, связанное с вирусом парагриппа I типа (Сендай) в колонии мартышек (Callithrix jacchus)». Лабораторные животные. 17 (2): 111–3. Дои:10.1258/002367783780959448. PMID 6306336. S2CID 7413539.
- ^ Suckow, Mark A .; Стивенс, Карла А .; Уилсон, Рональд П. (23 января 2012 г.). Лабораторный кролик, морская свинка, хомяк и другие грызуны. ISBN 978-0-12-380920-9.
- ^ Никлас В., Блайх А., Мелер М. (01.01.2012). «Глава 3.2 - Вирусные инфекции лабораторных мышей». В Hedrich HJ (ред.). Лабораторная мышь (Второе изд.). Академическая пресса. С. 427–480. Дои:10.1016 / B978-0-12-382008-2.00019-2. ISBN 9780123820082. ЧВК 7150319.
- ^ а б c López CB, Yount JS, Hermesh T, Moran TM (май 2006 г.). «Инфекция вирусом Сендай вызывает эффективный адаптивный иммунитет независимо от интерферонов I типа». Журнал вирусологии. 80 (9): 4538–45. Дои:10.1128 / JVI.80.9.4538-4545.2006. ЧВК 1472017. PMID 16611914.
- ^ «Сендайский вирус». Болезни подопытных животных.
- ^ а б c d Берк К.В., Мейсон Дж., Сурман С.Л., Джонс Б.Г., Даллоно Э., Гурвиц Дж. Л., Рассел С.Дж. (июль 2011 г.). «Освещение заражения и передачи вируса парагриппа у живых животных показывает тканеспецифическую дихотомию». Патогены PLOS. 7 (7): e1002134. Дои:10.1371 / journal.ppat.1002134. ЧВК 3131265. PMID 21750677.
- ^ Паркер Дж. К., Уайтман, доктор медицины, Рихтер, С. Б. (январь 1978 г.). «Восприимчивость инбредных и беспородных линий мышей к вирусу Сендай и распространенность инфекции у лабораторных грызунов». Инфекция и иммунитет. 19 (1): 123–30. Дои:10.1128 / IAI.19.1.123-130.1978. ЧВК 414057. PMID 203530.
- ^ а б Браунштейн Д.Г., Винклер С. (апрель 1986 г.). «Генетическая устойчивость к летальной пневмонии, вызванной вирусом Сендай: репликация вируса и производство интерферона у мышей C57BL / 6J и DBA / 2J». Лаборатория зоотехники. 36 (2): 126–9. PMID 2422437.
- ^ Саймон А.Ю., Морито К., Торигоэ Д., Асано А., Сасаки Н., Агуи Т. (декабрь 2009 г.). «Мультигенный контроль устойчивости мышей к инфекции вируса Сендай». Инфекция, генетика и эволюция. 9 (6): 1253–9. Дои:10.1016 / j.meegid.2009.08.011. HDL:2115/42554. PMID 19733691.
- ^ Брейдер М.А., Адамс Л.Г., Вомак Д.Е. (декабрь 1987 г.). «Влияние интерферона на естественную устойчивость мышей к пневмонии, вызванной вирусом Сендай». Американский журнал ветеринарных исследований. 48 (12): 1746–50. PMID 2449103.
- ^ Сангстер М., Смит Ф. С., Колекло С., Гурвиц Д. Л. (сентябрь 1995 г.). «Иммунизация детенышей мышей вирусом парагриппа типа 1 защищает от последующего заражения вирусом Сендай». Вирусология. 212 (1): 13–9. Дои:10.1006 / viro.1995.1448. PMID 7676623.
- ^ Stone AE, Giguere S, Castleman WL (ноябрь 2003 г.). «IL-12 снижает тяжесть вызванного вирусом Сендая бронхиолярного воспаления и ремоделирования». Цитокин. 24 (3): 103–13. Дои:10.1016 / j.cyto.2003.07.005. PMID 14581004.
- ^ «Сендайский вирус (SV)». Путеводитель по крысе.
- ^ Крафт В., Мейер Б. (июнь 1986 г.). «Диагностика инфекций мышей в зависимости от используемых методов тестирования». Лаборатория зоотехники. 36 (3): 271–6. PMID 3014210.
- ^ Фокс JG (2007). Мышь в биомедицинских исследованиях, 2-е издание. Берлингтон: Academic Press. С. 281–309. Дои:10.1016 / B978-012369454-6 / 50039-X.
- ^ Итон Г.Дж., Лерро А., Кастер Р.П., Крейн А.Р. (август 1982 г.). «Ликвидация Сендайского пневмонита в колонии обычных мышей». Лаборатория зоотехники. 32 (4): 384–6. PMID 6292576.
- ^ а б c Кояма А.Х., Ирие Х., Като А., Нагай Ю., Адачи А. (апрель 2003 г.). «Размножение вирусов и индукция апоптоза вирусом Сендай: роль белков C». Микробы и инфекции. 5 (5): 373–8. Дои:10.1016 / S1286-4579 (03) 00043-1. PMID 12737992.
- ^ а б Киётани К., Сакагути Т., Като А., Нагай Ю., Йошида Т. (март 2007 г.). «Белок вируса V Paramyxovirus Sendai противодействует очищению от врожденного вируса через активацию IRF-3, но не через интерферон у мышей». Вирусология. 359 (1): 82–91. Дои:10.1016 / j.virol.2006.08.053. PMID 17027894.
- ^ а б Ирие Т., Нагата Н., Игараси Т., Окамото И., Сакагути Т. (май 2010 г.). «Консервативные заряженные аминокислоты в белке С вируса Сендай играют несколько ролей в уклонении от врожденных иммунных ответов». PLOS ONE. 5 (5): e10719. Bibcode:2010PLoSO ... 510719I. Дои:10.1371 / journal.pone.0010719. ЧВК 2873429. PMID 20502666.
- ^ а б c Като А., Охниши Ю., Кохасе М., Сайто С., Таширо М., Нагаи Ю. (апрель 2001 г.). «Y2, наименьший из белков C вируса Сендай, полностью способен как противодействовать противовирусному действию интерферонов, так и ингибировать синтез вирусной РНК». Журнал вирусологии. 75 (8): 3802–10. Дои:10.1128 / JVI.75.8.3802-3810.2001. ЧВК 114871. PMID 11264369.
- ^ а б c Ямагути М., Китагава Ю., Чжоу М., Ито М., Гото Б. (январь 2014 г.). «Антиинтерфероновая активность, присущая белкам парамиксовируса С: ингибирование Toll-подобного рецептора 7/9-зависимой индукции альфа-интерферона». Письма FEBS. 588 (1): 28–34. Дои:10.1016 / j.febslet.2013.11.015. PMID 24269682. S2CID 24831300.
- ^ а б Китагава Ю., Ямагути М., Коно М., Сакаи М., Ито М., Гото Б. (2020). «Белок респировируса C ингибирует активацию киназ, связанных с рецептором интерферона I типа, чтобы блокировать передачу сигналов JAK-STAT». Письма FEBS. 594 (5): 864–877. Дои:10.1002/1873-3468.13670. PMID 31705658. S2CID 207944272.
- ^ Ода К., Матоба Ю., Ирие Т., Кавабата Р., Фукуши М., Сугияма М., Сакагути Т. (ноябрь 2015 г.). «Структурные основы ингибирования активности STAT1 белком Сендайского вируса». Журнал вирусологии. 89 (22): 11487–99. Дои:10.1128 / JVI.01887-15. ЧВК 4645678. PMID 26339056.
- ^ а б Ода К., Ода Т., Матоба Ю., Сато М., Ирие Т., Сакагути Т. (декабрь 2017 г.). «Структурный анализ гетеродимера STAT1: STAT2 выявил механизм опосредованной белком С Сендай блокады передачи сигналов интерферона 1 типа». Журнал биологической химии. 292 (48): 19752–19766. Дои:10.1074 / jbc.m117.786285. ЧВК 5712616. PMID 28978648.
- ^ а б Одхуу Э, Комацу Т., Наики Ю., Коидэ Н., Йокочи Т. (ноябрь 2014 г.). «Белок С вируса Сендай ингибирует индуцированное липополисахаридом производство оксида азота за счет нарушения передачи сигналов интерферона-β». Международная иммунофармакология. 23 (1): 267–72. Дои:10.1016 / j.intimp.2014.09.012. PMID 25242386.
- ^ а б Odkhuu E, Komatsu T, Koide N, Naiki Y, Takeuchi K, Tanaka Y и др. (Октябрь 2018 г.). «Белок вируса С Сендай ограничивает выработку NO в инфицированных макрофагах RAW264.7». Врожденный иммунитет. 24 (7): 430–438. Дои:10.1177/1753425918796619. ЧВК 6830875. PMID 30189760.
- ^ МакМикинг Дж., Се QW, Натан С. (1997). «Оксид азота и функция макрофагов». Ежегодный обзор иммунологии. 15: 323–50. Дои:10.1146 / annurev.immunol.15.1.323. PMID 9143691.
- ^ а б c Такеучи К., Комацу Т., Китагава Ю., Сада К., Гото Б. (октябрь 2008 г.). «Белок C вируса Сендай играет роль в ограничении активации PKR, ограничивая образование внутриклеточной двухцепочечной РНК». Журнал вирусологии. 82 (20): 10102–10. Дои:10.1128 / JVI.00599-08. ЧВК 2566265. PMID 18684815.
- ^ а б Андреева Дж., Чайлдс К.С., Янг Д.Ф., Карлос Т.С., Сток Н., Гудборн С., Рэндалл Р.Э. (декабрь 2004 г.). «Белки V парамиксовирусов связывают IFN-индуцируемую РНК-геликазу, mda-5, и ингибируют ее активацию промотора IFN-бета». Труды Национальной академии наук Соединенных Штатов Америки. 101 (49): 17264–9. Bibcode:2004PNAS..10117264A. Дои:10.1073 / pnas.0407639101. ЧВК 535396. PMID 15563593.
- ^ а б Чайлдс К., Сток Н., Росс С., Андреева Дж., Хилтон Л., Скиннер М. и др. (Март 2007 г.). «mda-5, но не RIG-I, является общей мишенью для белков парамиксовируса V». Вирусология. 359 (1): 190–200. Дои:10.1016 / j.virol.2006.09.023. PMID 17049367.
- ^ а б Санчес-Апарисио М.Т., Фейнман Л.Дж., Гарсия-Састре А., Шоу М.Л. (март 2018 г.). «Белки парамиксовируса V взаимодействуют с регуляторным комплексом RIG-I / TRIM25 и подавляют передачу сигналов RIG-I». Журнал вирусологии. 92 (6). Дои:10.1128 / JVI.01960-17. ЧВК 5827389. PMID 29321315.
- ^ Морита Н., Танака Ю., Одхуу Е., Наики Ю., Комацу Т., Коидэ Н. (февраль 2020 г.). «Белок вируса Сендай V снижает выработку оксида азота путем ингибирования передачи сигналов RIG-I в инфицированных макрофагах RAW264.7». Микробы и инфекции. 22 (8): 322–330. Дои:10.1016 / j.micinf.2020.01.005. PMID 32032681.
- ^ а б Komatsu T, Tanaka Y, Kitagawa Y, Koide N, Naiki Y, Morita N и др. (Октябрь 2018 г.). «Белок вируса Сендай V ингибирует секрецию интерлейкина-1β, предотвращая сборку инфламмасомы NLRP3». Журнал вирусологии. 92 (19): e00842–18. Дои:10.1128 / JVI.00842-18. ЧВК 6146803. PMID 30021903.
- ^ Рочат С., Комада Х., Колаковски Д. (июль 1992 г.). «Потеря экспрессии белка V в вирусе парагриппа человека типа 1 - не недавнее событие». Вирусные исследования. 24 (2): 137–44. Дои:10.1016 / 0168-1702 (92) 90002-кв. PMID 1326826.
- ^ а б Генов И., Павлов Н. (июнь 1972 г.). «Исследование вируса парагриппа типа 1, выделенного от свиней». Zentralblatt für Veterinarmedizin. Рейхе Б. Журнал ветеринарной медицины. Серия B. 19 (6): 437–44. Дои:10.1111 / j.1439-0450.1972.tb00422.x. PMID 4346239.
- ^ а б Janke BH, Paul PS, Landgraf JG, Halbur PG, Huinker CD (сентябрь 2001 г.). «Парамиксовирусная инфекция у свиней с интерстициальной пневмонией и энцефалитом в США». Журнал ветеринарных диагностических исследований. 13 (5): 428–33. Дои:10.1177/104063870101300513. PMID 11580068. S2CID 25384267.
- ^ а б c d Лау С.К., Ву ПК, Ву И, Вонг А.Ю., Вонг Б.Х., Лау С.К. и др. (Октябрь 2013). «Идентификация и характеристика нового парамиксовируса, вируса парагриппа свиней 1, от умерших свиней». Журнал общей вирусологии. 94 (Pt 10): 2184–90. Дои:10.1099 / vir.0.052985-0. PMID 23918408.
- ^ а б c Палински Р.М., Чен З., Хеннингсон Дж. Н., Ланг И., Роуленд Р. Р., Фанг Ю. и др. (Февраль 2016). «Широко распространенное обнаружение и характеристика вируса парагриппа свиней 1 у свиней в США». Журнал общей вирусологии. 97 (2): 281–286. Дои:10.1099 / jgv.0.000343. PMID 26581410.
- ^ а б Цяо Д., Янке Б. Х., Эланкумаран С. (август 2009 г.). «Молекулярная характеристика генов гликопротеинов и филогенетический анализ двух парамиксовирусов свиней, выделенных из США». Гены вирусов. 39 (1): 53–65. Дои:10.1007 / s11262-009-0353-2. PMID 19337823. S2CID 7100230.
- ^ а б Цяо Д., Янке Б. Х., Эланкумаран С. (январь 2010 г.). «Полная последовательность генома и патогенность двух изолятов парагриппа 3 свиней в США». Журнал вирусологии. 84 (2): 686–94. Дои:10.1128 / JVI.00847-09. ЧВК 2798373. PMID 19906928.
- ^ а б c d е Slobod KS, Shenep JL, Luján-Zilbermann J, Allison K, Brown B, Scroggs RA, et al. (Август 2004 г.). «Безопасность и иммуногенность интраназального вируса парагриппа мышей типа 1 (вирус Сендай) у здоровых взрослых людей». Вакцина. 22 (23–24): 3182–6. Дои:10.1016 / j.vaccine.2004.01.053. PMID 15297072.
- ^ Скиадопулос М.Х., Сурман С.Р., Риггс Дж. М., Элкинс В. Р., Сент-Клер М., Нишио М. и др. (Май 2002 г.). «Вирус Сендай, вирус парагриппа мышей типа 1, реплицируется до уровня, аналогичного человеческому PIV1, в верхних и нижних дыхательных путях африканских зеленых мартышек и шимпанзе». Вирусология. 297 (1): 153–60. Дои:10.1006 / viro.2002.1416. PMID 12083845.
- ^ а б c Аддерсон Э., Бранум К., Сили Р.Э., Джонс Б.Г., Сурман С.Л., Пенкерт Р. и др. (Март 2015 г.). «Безопасность и иммуногенность интраназальной вакцины против вируса парагриппа человека типа 1 на основе вируса Сендай для детей от 3 до 6 лет». Клиническая и вакцинная иммунология. 22 (3): 298–303. Дои:10.1128 / CVI.00618-14. ЧВК 4340902. PMID 25552633.
- ^ а б c d Хара Х, Хара Х, Хиронака Т, Иноуэ М., Иида А, Шу Т и др. (Июнь 2011 г.). «Распространенность специфических нейтрализующих антител против вируса Сендай в популяциях из разных географических регионов: значение для разработки вакцины против СПИДа с использованием векторов вируса Сендай». Человеческие вакцины. 7 (6): 639–45. Дои:10.4161 / hv.7.6.15408. PMID 21508675. S2CID 24481304.
- ^ а б c d Мория К., Хориба С., Иноуэ М., Иида А., Хара Х, Шу Т. и др. (Июль 2008 г.). «Индукция антиген-специфических Т-клеток путем вакцинации рекомбинантным вектором вируса Сендай даже в присутствии вектор-специфичных нейтрализующих антител у макак-резусов». Сообщения о биохимических и биофизических исследованиях. 371 (4): 850–4. Дои:10.1016 / j.bbrc.2008.04.156. PMID 18466766.
- ^ Куроя М., Исида Н. (август 1953 г.). «Вирусный пневмонит новорожденных (тип Сендай). II. Выделение нового вируса, обладающего гемагглютининовой активностью». Медицинский бюллетень Иокогамы. 4 (4): 217–33. PMID 13137076.
- ^ Куроя М., Исида Н., Ширатори Т. (июнь 1953 г.). «Вирусный пневмонит новорожденных (тип Сендай). II. Выделение нового вируса». Журнал экспериментальной медицины Тохоку. 58 (1): 62. Дои:10.1620 / tjem.58.62. PMID 13102529.
- ^ Фукуми Х., Нисикава Ф., Китайма Т. (август 1954 г.). «Пневмотропный вирус от мышей, вызывающий гемагглютинацию». Японский журнал медицинских наук и биологии. 7 (4): 345–63. Дои:10.7883 / yoken1952.7.345. PMID 13232830.
- ^ а б c d е Исида Н., Хомма М. (1978). «Сендайский вирус». Достижения в вирусных исследованиях. 23: 349–83. Дои:10.1016 / S0065-3527 (08) 60103-7. ISBN 9780120398232. PMID 219669.
- ^ а б «Сендайский вирус | инфекционный агент». Энциклопедия Британника. Получено 2019-08-26.
- ^ «Вирус Сендай (ATCC VR-105)». ATCC.
- ^ "листовки" (PDF). Получено 4 февраля 2020.
- ^ "Сендайский информационный бюллетень". Стэнфорд, охрана окружающей среды, здоровье и безопасность. Стэндфордский Университет.
- ^ а б Гризенбах У., Маклахлан Г, Оваки Т., Сомертон Л., Шу Т., Бейкер А. и др. (Февраль 2011 г.). «Проверка рекомбинантного вируса Сендай на неприродной модели хозяина». Генная терапия. 18 (2): 182–8. Дои:10.1038 / gt.2010.131. PMID 20962870. S2CID 23293412.
- ^ Скиадопулос М.Х., Сурман С.Р., Риггс Дж. М., Элкинс В. Р., Сент-Клер М., Нишио М. и др. (Май 2002 г.). «Вирус Сендай, вирус парагриппа мышей типа 1, реплицируется до уровня, аналогичного человеческому PIV1, в верхних и нижних дыхательных путях африканских зеленых мартышек и шимпанзе». Вирусология. 297 (1): 153–60. Дои:10.1006 / viro.2002.1416. PMID 12083845.
- ^ а б c d Бусс Т., Чемберс Р.Л., Скроггс Р.А., Портнер А., Такимото Т. (октябрь 2006 г.). «Вирус парагриппа человека типа 1, но не вирус Сендай, реплицируется в респираторных клетках человека, несмотря на лечение IFN». Вирусные исследования. 121 (1): 23–32. Дои:10.1016 / j.virusres.2006.03.012. PMID 16677733.
- ^ Хейлбрук С., Балачандран С., Слуга М.Дж., ДеЛука С., Барбер Г.Н., Лин Р., Хискотт Дж. (Апрель 2000 г.). «Фактор транскрипции IRF-3 опосредует апоптоз, индуцированный вирусом Сендай». Журнал вирусологии. 74 (8): 3781–92. Дои:10.1128 / jvi.74.8.3781-3792.2000. ЧВК 111887. PMID 10729153.
- ^ Кантелл К., Хирвонен С., Кауппинен Х.Л., Мюллюля Г. (1981). «Производство интерферона в лейкоцитах человека от нормальных доноров с использованием вируса Сендай». Методы в энзимологии. 78 (Pt A): 29–38. Дои:10.1016/0076-6879(81)78094-7. ISBN 9780121819781. PMID 6173603.
- ^ Миеттинен М., Саренева Т., Юлкунен И., Матикайнен С. (октябрь 2001 г.). «IFNs активируют экспрессию гена toll-подобного рецептора при вирусных инфекциях». Гены и иммунитет. 2 (6): 349–55. Дои:10.1038 / sj.gene.6363791. PMID 11607792. S2CID 5819381.
- ^ а б c d е Лаппалайнен Дж., Ринтахака Дж., Кованен П.Т., Матикайнен С., Эклунд К.К. (апрель 2013 г.). «Путь распознавания внутриклеточной РНК активирует сильный антивирусный ответ в тучных клетках человека». Клиническая и экспериментальная иммунология. 172 (1): 121–8. Дои:10.1111 / cei.12042. ЧВК 3719938. PMID 23480192.
- ^ а б Neerincx A, Lautz K, Menning M, Kremmer E, Zigrino P, Hösel M и др. (Август 2010 г.). «Роль человеческого нуклеотид-связывающего домена, члена семейства NLRC5, содержащего богатые лейцином повтора, в противовирусных реакциях». Журнал биологической химии. 285 (34): 26223–32. Дои:10.1074 / jbc.M110.109736. ЧВК 2924034. PMID 20538593.
- ^ Сет РБ, Сун Л., Эа СК, Чен З.Д. (сентябрь 2005 г.). «Идентификация и характеристика MAVS, митохондриального антивирусного сигнального белка, который активирует NF-kappaB и IRF 3». Клетка. 122 (5): 669–82. Дои:10.1016 / j.cell.2005.08.012. PMID 16125763. S2CID 11104354.
- ^ Сет РБ, Сун Л., Эа СК, Чен З.Д. (сентябрь 2005 г.). «Идентификация и характеристика MAVS, митохондриального антивирусного сигнального белка, который активирует NF-kappaB и IRF 3». Клетка. 122 (5): 669–82. Дои:10.1016 / j.cell.2005.08.012. PMID 16125763. S2CID 11104354.
- ^ Лейб Д. (2010-03-08). «Факультет 1000 оценок для RIG-I обнаруживает вирусную геномную РНК во время инфицирования вирусом РНК с отрицательной цепью». Дои:10.3410 / f.2412956.2047054. Цитировать журнал требует
| журнал =(помощь) - ^ Mikkelsen SS, Jensen SB, Chiliveru S, Melchjorsen J, Julkunen I., Gaestel M, et al. (Апрель 2009 г.). «Опосредованная RIG-I активация p38 MAPK важна для вирусной индукции интерферона и активации дендритных клеток: зависимость от TRAF2 и TAK1». Журнал биологической химии. 284 (16): 10774–82. Дои:10.1074 / jbc.M807272200. ЧВК 2667765. PMID 19224920.
- ^ Gitlin L, Benoit L, Song C, Cella M, Gilfillan S, Holtzman MJ, Colonna M (январь 2010 г.). «Ген 5, связанный с дифференцировкой меланомы (MDA5), участвует во врожденном иммунном ответе на инфекцию Paramyxoviridae in vivo». Патогены PLOS. 6 (1): e1000734. Дои:10.1371 / journal.ppat.1000734. ЧВК 2809771. PMID 20107606.
- ^ Слуга MJ, Grandvaux N, tenOever BR, Duguay D, Lin R, Hiscott J (март 2003 г.). «Идентификация минимального участка фосфоакцептора, необходимого для активации in vivo регуляторного фактора 3 интерферона в ответ на вирус и двухцепочечную РНК». Журнал биологической химии. 278 (11): 9441–7. Дои:10.1074 / jbc.M209851200. PMID 12524442. S2CID 19096582.
- ^ Барнс Б.Дж., Мур PA, Pitha PM (июнь 2001 г.). «Вирус-специфическая активация нового фактора регуляции интерферона, IRF-5, приводит к индукции различных генов интерферона альфа». Журнал биологической химии. 276 (26): 23382–90. Дои:10.1074 / jbc.M101216200. PMID 11303025. S2CID 26896371.
- ^ а б c d Хуа Дж., Ляо М.Дж., Рашидбайги А. (июль 1996 г.). «Цитокины, индуцированные вирусом Сендай в лейкоцитах периферической крови человека». Журнал биологии лейкоцитов. 60 (1): 125–8. Дои:10.1002 / jlb.60.1.125. PMID 8699116. S2CID 28976518.
- ^ а б c d Костас М.А., Мелла Д., Крискуоло М., Диас А., Финкельман С., Нахмод В.Э., Арцт Е. (декабрь 1993 г.). «Супериндукция митоген-стимулированной продукции гамма-интерферона и других лимфокинов вирусом Сендай». Журнал исследований интерферона. 13 (6): 407–12. Дои:10.1089 / jir.1993.13.407. PMID 8151134.
- ^ а б c d Зидовец С., Мазуран Р. (февраль 1999 г.). «Вирус Сендай индуцирует различные цитокины в лейкоцитах периферической крови человека: различную чувствительность молекул цитокинов к низкому pH». Цитокин. 11 (2): 140–3. Дои:10.1006 / cyto.1998.0411. PMID 10089135.
- ^ Найман Т.А., Тёло Х., Парккинен Дж., Калккинен Н. (январь 1998 г.). «Идентификация девяти подтипов интерферона-альфа, продуцируемых лейкоцитами периферической крови человека, индуцированными вирусом Сендай». Биохимический журнал. 329 (Pt 2) (Pt 2): 295–302. Дои:10.1042 / bj3290295. ЧВК 1219044. PMID 9425112.
- ^ Цзэн Дж., Фурнье П., Ширмахер В. (май 2002 г.). «Индукция интерферона-альфа и связанного с фактором некроза опухоли лиганда, индуцирующего апоптоз, в мононуклеарных клетках крови человека гемагглютинин-нейраминидазой, но не белком F вируса болезни Ньюкасла». Вирусология. 297 (1): 19–30. Дои:10.1006 / viro.2002.1413. PMID 12083832.
- ^ Генин П., Лин Р., Хискотт Дж., Сивас А (2012). «Привлечение гистондеацетилазы 3 к промоторам гена интерферона-А снижает экспрессию интерферона». PLOS ONE. 7 (6): e38336. Bibcode:2012PLoSO ... 738336G. Дои:10.1371 / journal.pone.0038336. ЧВК 3369917. PMID 22685561.
- ^ а б c d Мандхана Р., Хорват С.М. (ноябрь 2018 г.). «Сендайская вирусная инфекция вызывает экспрессию новых РНК в клетках человека». Научные отчеты. 8 (1): 16815. Bibcode:2018НатСР ... 816815М. Дои:10.1038 / s41598-018-35231-8. ЧВК 6235974. PMID 30429577.
- ^ Милон М.С., Фицджеральд-Бокарсли П. (сентябрь 1998 г.). «Рецептор маннозы опосредует индукцию IFN-альфа в дендритных клетках периферической крови с помощью оболочечных РНК и ДНК-вирусов». Журнал иммунологии. 161 (5): 2391–9. PMID 9725235.
- ^ Элоранта М.Л., Сандберг К., Риккарди-Кастаньоли П., Линдаль М., Альм Г.В. (сентябрь 1997 г.). «Производство интерферона-альфа / бета линиями дендритных клеток мышей, стимулированных вирусами и бактериями». Скандинавский журнал иммунологии. 46 (3): 235–41. Дои:10.1046 / j.1365-3083.1997.d01-120.x. PMID 9315110. S2CID 40570647.
- ^ а б c d е Ли Х. К., Лунд Дж. М., Раманатан Б., Мидзусима Н., Ивасаки А. (март 2007 г.). «Зависимое от аутофагии распознавание вирусов плазматическими дендритными клетками». Наука. 315 (5817): 1398–401. Bibcode:2007Научный ... 315.1398Л. Дои:10.1126 / science.1136880. PMID 17272685. S2CID 11549012.
- ^ Izaguirre A, Barnes BJ, Amrute S, Yeow WS, Megjugorac N, Dai J и др. (Декабрь 2003 г.). «Сравнительный анализ экспрессии IRF и IFN-альфа в человеческих плазматических и дендритных клетках, происходящих из моноцитов». Журнал биологии лейкоцитов. 74 (6): 1125–38. Дои:10.1189 / jlb.0603255. PMID 12960254. S2CID 12030752.
- ^ «Обычные дендритные клетки - Последние исследования и новости | Природа». www.nature.com. Получено 4 февраля 2020.
- ^ Vremec D, Pooley J, Hochrein H, Wu L, Shortman K (март 2000 г.). «Экспрессия CD4 и CD8 подтипами дендритных клеток в тимусе и селезенке мышей». Журнал иммунологии. 164 (6): 2978–86. Дои:10.4049 / jimmunol.164.6.2978. PMID 10706685. S2CID 20588521.
- ^ а б c Любер К.А., Кокс Дж., Лаутербах Х., Фанке Б., Зельбах М., Чопп Дж. И др. (Февраль 2010 г.). «Количественная протеомика выявляет специфическое для подмножества вирусное распознавание в дендритных клетках». Иммунитет. 32 (2): 279–89. Дои:10.1016 / j.immuni.2010.01.013. PMID 20171123.
- ^ а б Кинер Р., Флейшманн М., Виганд М.А., Леммерманн Н.А., Швеглер С., Кауфманн С. и др. (Август 2018 г.). «Эффективная доставка Т-клеточных антигенов цитомегаловируса человека с помощью ослабленных векторов вируса Сендай». Журнал вирусологии. 92 (15). Дои:10.1128 / JVI.00569-18. ЧВК 6052310. PMID 29769344.
- ^ а б Доннелли Р.П., Котенко С.В. (август 2010 г.). «Интерферон-лямбда: новое пополнение в старом семействе». Журнал исследований интерферона и цитокинов. 30 (8): 555–64. Дои:10.1089 / jir.2010.0078. ЧВК 2925029. PMID 20712453.
- ^ а б Инь З., Дай Дж., Дэн Дж., Шейх Ф., Наталья М, Ши Т. и др. (Сентябрь 2012 г.). «ИФН типа III продуцируются и стимулируют плазматические дендритные клетки человека». Журнал иммунологии. 189 (6): 2735–45. Дои:10.4049 / jimmunol.1102038. ЧВК 3579503. PMID 22891284.
- ^ а б c d Сузуки Х., Куроока М, Хироаки Й., Фудзиёси Й., Канеда Й. (апрель 2008 г.). «Гликопротеин F вируса Сендай индуцирует выработку ИЛ-6 в дендритных клетках независимым от слияния образом». Письма FEBS. 582 (9): 1325–9. Дои:10.1016 / j.febslet.2008.03.011. PMID 18358837. S2CID 207607018.
- ^ а б Кавагути Y, Миямото Y, Иноуэ Т., Канеда Y (май 2009 г.). «Эффективное искоренение гормонорезистентного рака простаты человека с помощью инактивированной частицы вируса Сендай». Международный журнал рака. 124 (10): 2478–87. Дои:10.1002 / ijc.24234. PMID 19173282. S2CID 33289879.
- ^ а б Лин Х.Й., Дэвис П.Дж., Thacore HR (декабрь 1991 г.). «Производство человеческого интерферона-бета вирусом Сендай и поли (rI) .poly (rC): ингибирование неомицином». Журнал исследований интерферона. 11 (6): 365–9. Дои:10.1089 / jir.1991.11.365. PMID 1666117.
- ^ а б c Райнерт Л.С., Хардер Л., Холм К.К., Иверсен МБ, Хоран К.А., Дагнес-Хансен Ф. и др. (Апрель 2012 г.). «Дефицит TLR3 делает астроциты восприимчивыми к инфекции вируса простого герпеса и способствует развитию инфекции ЦНС у мышей». Журнал клинических исследований. 122 (4): 1368–76. Дои:10.1172 / JCI60893. ЧВК 3314467. PMID 22426207.
- ^ Ито Й, Хосака Й (март 1983 г.). «Компонент (ы) вируса Сендай, который может индуцировать интерферон в клетках селезенки мышей». Инфекция и иммунитет. 39 (3): 1019–23. Дои:10.1128 / IAI.39.3.1019-1023.1983. ЧВК 348058. PMID 6301988.
- ^ а б c d Subramanian G, Kuzmanovic T, Zhang Y, Peter CB, Veleeparambil M, Chakravarti R, et al. (Январь 2018). «Новый механизм противовирусного действия интерферона: индукция аутофагии, необходимая для репликации парамиксовируса, ингибируется геном, стимулированным интерфероном, TDRD7». Патогены PLOS. 14 (1): e1006877. Дои:10.1371 / journal.ppat.1006877. ЧВК 5806901. PMID 29381763.
- ^ Ветцель Дж. Л., Фенстерл В., Сен Г. К. (декабрь 2014 г.). «Ифит2 предотвращает патогенез вируса Сендай у мышей, а интерферон обостряет его». Журнал вирусологии. 88 (23): 13593–601. Дои:10.1128 / JVI.02201-14. ЧВК 4248979. PMID 25231314.
- ^ а б Петерс К., Чаттопадхьяй С., Сен Г.К. (апрель 2008 г.). «Активация IRF-3 вирусной инфекцией Сендай необходима для клеточного апоптоза и предотвращения персистенции». Журнал вирусологии. 82 (7): 3500–8. Дои:10.1128 / JVI.02536-07. ЧВК 2268502. PMID 18216110.
- ^ а б Иттах М., Мичели-Ришар С., Лебон П., Паллье С., Лепахолек С., Мариетт X (2011). «Индукция фактора активации В-клеток вирусной инфекцией - обычное явление, но типы вирусов и механизмы зависят от типа клеток». Журнал врожденного иммунитета. 3 (2): 200–7. Дои:10.1159/000321194. PMID 21051868. S2CID 6699971.
- ^ а б Йоханссон Э., Домейка К., Берг М., Альм Г.В., Fossum C (февраль 2003 г.). «Характеристика дендритных клеток свиней, происходящих из моноцитов, в соответствии с их цитокиновым профилем». Ветеринарная иммунология и иммунопатология. 91 (3–4): 183–97. Дои:10.1016 / s0165-2427 (02) 00310-0. PMID 12586481.
- ^ а б Ли С., Нисикава Т., Канеда Ю. (декабрь 2017 г.). «Инактивированная частица вируса Сендай усиливает экспрессию в раковых клетках молекулы межклеточной адгезии-1 и увеличивает чувствительность естественных клеток-киллеров к раковым клеткам». Наука о раке. 108 (12): 2333–2341. Дои:10.1111 / cas.13408. ЧВК 5715349. PMID 28945328.
- ^ Каннеганти Т.Д., Боди-Малапель М., Амер А., Парк Дж. Х., Уитфилд Дж., Франки Л. и др. (Декабрь 2006 г.). «Критическая роль Cryopyrin / Nalp3 в активации каспазы-1 в ответ на вирусную инфекцию и двухцепочечную РНК». Журнал биологической химии. 281 (48): 36560–8. Дои:10.1074 / jbc.M607594200. PMID 17008311. S2CID 23488241.
- ^ Park S, Juliana C, Hong S, Datta P, Hwang I, Fernandes-Alnemri T. и др. (Октябрь 2013). «Митохондриальный противовирусный белок MAVS связывается с NLRP3 и регулирует его инфламмасомную активность». Журнал иммунологии. 191 (8): 4358–66. Дои:10.4049 / jimmunol.1301170. ЧВК 3848201. PMID 24048902.
- ^ Субраманиан Н., Натараджан К., Клатуорти М.Р., Ван З., Жермен Р.Н. (апрель 2013 г.). «Адаптер MAVS способствует локализации митохондрий NLRP3 и активации инфламмасом». Клетка. 153 (2): 348–61. Дои:10.1016 / j.cell.2013.02.054. ЧВК 3632354. PMID 23582325.
- ^ Райан Л.К., Diamond G (июнь 2017 г.). «Модуляция продукции вирусов человеческого β-дефенсина-1». Вирусы. 9 (6): 153. Дои:10.3390 / v9060153. ЧВК 5490828. PMID 28635669.
- ^ Райан Л.К., Дай Дж., Инь З., Мегджугорак Н., Ульхорн В., Йим С. и др. (Август 2011 г.). «Модуляция человеческого бета-дефенсина-1 (hBD-1) в плазматических дендритных клетках (PDC), моноцитах и эпителиальных клетках вирусом гриппа, вирусом простого герпеса и вирусом Сендай и его возможная роль в врожденном иммунитете». Журнал биологии лейкоцитов. 90 (2): 343–56. Дои:10.1189 / jlb.0209079. ЧВК 3133436. PMID 21551252.
- ^ а б Наканиши М., Оцу М. (октябрь 2012 г.). «Разработка векторов вируса Сендай и их потенциальное применение в генной терапии и регенеративной медицине». Современная генная терапия. 12 (5): 410–6. Дои:10.2174/156652312802762518. ЧВК 3504922. PMID 22920683.
- ^ а б c d е Кино Х., Иноуэ М., Васидзава К., Ямамото Т., Фудзикава С., Токусуми Ю. и др. (Июль 2004 г.). «Создание рекомбинантного вируса Сендай, который избирательно активируется и лизирует опухолевые клетки человека, экспрессирующие матриксные металлопротеиназы». Генная терапия. 11 (14): 1137–45. Дои:10.1038 / sj.gt.3302272. PMID 15085175. S2CID 10376042.
- ^ Кино Х., Иноуэ М. (январь 2008 г.). «Новая терапия рака с использованием генно-инженерного вектора онколитического вируса Сендай». Границы биологических наук. 13 (13): 2327–34. Дои:10.2741/2847. PMID 17981715. S2CID 25851804.
- ^ Тацута К., Танака С., Тадзири Т., Шибата С., Комару А., Уэда Ю. и др. (Февраль 2009 г.). «Полное устранение установленной нейробластомы за счет синергического действия гамма-облучения и ДК, обработанных rSeV, экспрессирующим ген интерферона-бета». Генная терапия. 16 (2): 240–51. Дои:10.1038 / gt.2008.161. PMID 18987675. S2CID 27976395.
- ^ а б c d е Циммерманн М., Армеану-Эбингер С., Боссов С., Лампе Дж., Смирнов И., Шенк А. и др. (2014). «Аттенуированные векторы вируса Сендай с модифицированным протеазным профилем как новый инструмент виротерапии солидных опухолей». PLOS ONE. 9 (3): e90508. Bibcode:2014PLoSO ... 990508Z. Дои:10.1371 / journal.pone.0090508. ЧВК 3944018. PMID 24598703.
- ^ Танака Ю., Араки К., Танака С., Миягава Ю., Судзуки Н., Камиде Д. и др. (Июнь 2019). «Онколитический вирус Сендай, индуцированный опухоль-специфическими иммунными ответами, подавляет« симулированный метастаз »плоскоклеточной карциномы на иммунокомпетентной модели мыши». Голова и шея. 41 (6): 1676–1686. Дои:10.1002 / hed.25642. PMID 30620422. S2CID 58561289.
- ^ а б Ёнемицу Ю., Уэда Ю., Кино Х., Хасегава М. (январь 2008 г.). «Иммуностимулирующая виротерапия с использованием рекомбинантного вируса Сендай в качестве новой схемы лечения рака». Границы биологических наук. 13 (13): 1892–8. Дои:10.2741/2809. PMID 17981677.
- ^ Танака Ю., Араки К., Танака С., Миягава Ю., Судзуки Н., Камиде Д. и др. (Август 2019 г.). «Терапия, направленная на сторожевые лимфатические узлы, онколитическим вирусом Сендай подавляет микрометастаз плоскоклеточного рака головы и шеи на модели ортотопической голой мыши». Молекулярная терапия рака. 18 (8): 1430–1438. Дои:10.1158 / 1535-7163.MCT-18-1372. PMID 31171582. S2CID 174812921.
- ^ Ивадате Ю., Иноуэ М., Саегуса Т., Токусуми Ю., Кино Х., Хасегава М. и др. (Май 2005 г.). «Рекомбинантный вектор вируса Сендай вызывает полную ремиссию установленных опухолей головного мозга за счет эффективного переноса гена интерлейкина-2 у вакцинированных крыс». Клинические исследования рака. 11 (10): 3821–7. Дои:10.1158 / 1078-0432.CCR-04-1485. PMID 15897582. S2CID 37657020.
- ^ Танака М., Шимбо Т., Кикучи Ю., Мацуда М., Канеда Ю. (апрель 2010 г.). «Стерильный альфа-мотив, содержащий домен 9, участвует в передаче сигналов смерти злокачественной глиомы, обработанной инактивированной частицей вируса Сендай (HVJ-E) или интерфероном I типа». Международный журнал рака. 126 (8): 1982–1991. Дои:10.1002 / ijc.24965. PMID 19830690. S2CID 3414189.
- ^ Цянь М., Тан Х.М., Ю Н, Ван Т., Чжан Ц. (апрель 2018 г.). «Инактивированный вирус Сендай индуцирует зависимый от АФК апоптоз и аутофагию в раковых клетках предстательной железы человека». Биомедицинские и экологические науки. 31 (4): 280–289. Дои:10.3967 / bes2018.036. PMID 29773091.
- ^ а б c d Куроока М., Канеда Ю. (январь 2007 г.). «Инактивированные частицы вируса Сендай уничтожают опухоли, вызывая иммунные ответы посредством блокирования регуляторных Т-клеток». Исследования рака. 67 (1): 227–36. Дои:10.1158 / 0008-5472.CAN-06-1615. PMID 17210703.
- ^ а б c Fujihara A, Kurooka M, Miki T, Kaneda Y (январь 2008 г.). «Внутриопухолевое введение инактивированных частиц вируса Сендай вызывает сильную противоопухолевую активность за счет усиления локальной экспрессии CXCL10 и системной активации NK-клеток». Иммунология рака, Иммунотерапия. 57 (1): 73–84. Дои:10.1007 / s00262-007-0351-y. PMID 17602226. S2CID 8779015.
- ^ Нисикава Т., Тунг Л.Й., Канеда Ю. (декабрь 2014 г.). «Системное введение тромбоцитов, содержащих инактивированный вирус Сендай, уничтожает меланому у мышей». Молекулярная терапия. 22 (12): 2046–55. Дои:10.1038 / мт.2014.128. ЧВК 4429689. PMID 25023327.
- ^ Чжан Ц., Юань ВФ, Чжай GQ, Чжу С.Ю., Сюэ Ц.Ф., Чжу Х.Ф., Сюй XM (октябрь 2012 г.). «Инактивированный вирус Сендай подавляет рост меланомы мышей, вызывая иммунные ответы хозяина и подавляя экспрессию β-катенина». Биомедицинские и экологические науки. 25 (5): 509–16. Дои:10.3967/0895-3988.2012.05.003. PMID 23122307.
- ^ Сага К., Тамай К., Ямазаки Т., Канеда И. (февраль 2013 г.). «Системное введение нового иммуностимулирующего псевдовириона подавляет метастатическую меланому в легкие за счет регионального усиления продукции IFN-γ». Клинические исследования рака. 19 (3): 668–79. Дои:10.1158 / 1078-0432.CCR-12-1947. PMID 23251005. S2CID 14105282.
- ^ Уилок Э. Ф., Дингл Дж. Х. (сентябрь 1964 г.). «Наблюдения за повторным введением вирусов пациенту с острым лейкозом. Предварительный отчет». Медицинский журнал Новой Англии. 271 (13): 645–51. Дои:10.1056 / NEJM196409242711302. PMID 14170843.
- ^ Зайнутдинов С.С., Кочнева Г.В., Нетесов С.В., Чумаков П.М., Матвеева О.В. (июль 2019). «Направленная эволюция как инструмент для отбора онколитических РНК-вирусов с желаемыми фенотипами». Онколитическая виротерапия. 8: 9–26. Дои:10.2147 / ов.с176523. ЧВК 6636189. PMID 31372363.
- ^ а б c d е Зайнутдинов С.С., Тикунов А.Ю., Матвеева О.В., Нетесов С.В., Кочнева Г.В. (август 2016). «Полная последовательность генома онколитического штамма вируса Сендай Москва». Анонсы генома. 4 (4). Дои:10.1128 / genomeA.00818-16. ЧВК 4982289. PMID 27516510.
- ^ Лечение запущенных метастатических форм рака онколитическим вирусом Сендай, получено 2019-08-21
- ^ а б [1], «Способ иммунотерапии рака и фармацевтические композиции на основе онколитического непатогенного вируса Сендай», выпущенный 21 ноября 2013 г.
- ^ Киёхара Э, Танемура А., Нисиока М., Ямада М., Танака А., Йокоми А. и др. (Июнь 2020 г.). «Внутриопухолевая инъекция гемагглютинирующего вируса вектора японской оболочки дала противоопухолевый эффект при запущенной меланоме: клиническое исследование фазы I / IIa». Иммунология рака, Иммунотерапия. 69 (6): 1131–1140. Дои:10.1007 / s00262-020-02509-8. PMID 32047956. S2CID 211074332.
- ^ а б Матвеева, Ольга В .; Чумаков, Петр Михайлович (ноябрь 2018 г.). «Дефекты путей интерферона как потенциальные биомаркеры чувствительности к онколитическим вирусам». Обзоры в медицинской вирусологии. 28 (6): e2008. Дои:10.1002 / RMV.2008. ISSN 1099-1654. ЧВК 6906582. PMID 30209859.
- ^ Лян Дж. Х., Лян Ю., Гао В. (май 2016 г.). «Клинико-патологическое и прогностическое значение сверхэкспрессии сиалила Льюиса X у больных раком: метаанализ». ОнкоЦели и терапия. 9: 3113–25. Дои:10.2147 / отт.s102389. ЧВК 4888715. PMID 27307752.
- ^ Бланас А., Сахасрабуде Н.М., Родригес Е., ван Койк Ю., ван Влит С.Дж. (11 мая 2018 г.). «Исправление: фукозилированные антигены при раке: альянс на пути к развитию опухоли, метастазированию и устойчивости к химиотерапии». Границы онкологии. 8: 150. Дои:10.3389 / fonc.2018.00150. ЧВК 5958677. PMID 29795807.
- ^ Ногучи М., Сато Н., Сугимори Х., Мори К., Осими К. (октябрь 2001 г.). «Минорный лиганд Е-селектина, CD65, имеет решающее значение для внесосудистой инфильтрации клеток острого миелоидного лейкоза». Исследование лейкемии. 25 (10): 847–53. Дои:10.1016 / s0145-2126 (01) 00036-4. PMID 11532516.
- ^ а б c «КЕГГ ГЛИКАН: G00111». www.genome.jp. Получено 2019-08-13.
- ^ Лян Й.Дж., Дин Й., Ливери С.Б., Лобатон М., Ханда К., Хакомори С.И. (март 2013 г.). «Профили дифференциальной экспрессии гликосфинголипидов в стволовых клетках рака молочной железы человека по сравнению с раковыми не стволовыми клетками». Труды Национальной академии наук Соединенных Штатов Америки. 110 (13): 4968–73. Bibcode:2013ПНАС..110.4968Л. Дои:10.1073 / pnas.1302825110. ЧВК 3612608. PMID 23479608.
- ^ а б Чемберс М. "ChemIDplus - 71833-57-3 - OWMXULOUTAAVIX-HNZIOFRCSA-N - Сиалозилпараглобозид - Поиск похожих структур, синонимов, формул, ссылок на ресурсы и другой химической информации". chem.nlm.nih.gov. Получено 2019-08-13.
- ^ Окегава Т (2018). «Обнаружение циркулирующих опухолевых клеток в устойчивом к кастрации раке простаты». Гормональная терапия и устойчивость к кастрации рака простаты. Сингапур: Спрингер. С. 299–305. Дои:10.1007/978-981-10-7013-6_30. ISBN 978-981-10-7012-9.
- ^ а б c d Хатано К., Миямото Ю., Нономура Н., Канеда Ю. (октябрь 2011 г.). «Экспрессия ганглиозидов, GD1a и сиалилпараглобозида регулируется NF-κB-зависимым транскрипционным контролем α2,3-сиалилтрансферазы I, II и VI в устойчивых к кастрации раковых клетках простаты человека». Международный журнал рака. 129 (8): 1838–47. Дои:10.1002 / ijc.25860. PMID 21165949. S2CID 7765966.
- ^ Хамасаки Х., Аояги М., Касама Т., Ханда С., Хиракава К., Таки Т. (январь 1999 г.). «GT1b в метастатических опухолях головного мозга человека: GT1b как ганглиозид, связанный с метастазами в мозг». Biochimica et Biophysica Acta. 1437 (1): 93–9. Дои:10.1016 / с 1388-1981 (98) 00003-1. PMID 9931455.
- ^ а б «КЕГГ ГЛИКАН: G00116». www.genome.jp. Получено 2019-08-13.
- ^ а б «КЕГГ ГЛИКАН: G00117». www.genome.jp. Получено 2019-08-13.
- ^ Вукелич З., Каланж-Богнар С., Фроеш М., Биндила Л., Радич Б., Аллен М. и др. (Май 2007 г.). «Ганглиозидный состав, связанный с глиосаркомой человека, сложен и отличается, что подтверждается высокоэффективным масс-спектрометрическим определением и структурной характеристикой». Гликобиология. 17 (5): 504–15. Дои:10.1093 / glycob / cwm012. PMID 17293353.
- ^ а б c d Марквелл М.А., Портнер А., Шварц А.Л. (февраль 1985 г.). «Альтернативный путь заражения вирусом: проникновение через рецептор асиалогликопротеина мутанта вируса Сендай, лишенного своего белка прикрепления». Труды Национальной академии наук Соединенных Штатов Америки. 82 (4): 978–82. Bibcode:1985ПНАС ... 82..978М. Дои:10.1073 / pnas.82.4.978. ЧВК 397176. PMID 2983337.
- ^ а б c Битцер М., Лауэр Ю., Бауманн С., Шпигель М., Грегор М., Нойберт В. Дж. (Июль 1997 г.). «Вирус Сендай эффективно инфицирует клетки через рецептор асиалогликопротеина и требует присутствия расщепленных белков-предшественников F0 для этого альтернативного пути проникновения в клетки». Журнал вирусологии. 71 (7): 5481–6. Дои:10.1128 / JVI.71.7.5481-5486.1997. ЧВК 191789. PMID 9188621.
- ^ «Резюме экспрессии белка ASGR1 - Атлас человеческого белка». www.proteinatlas.org. Получено 2020-01-14.
- ^ «Резюме экспрессии белка ASGR2 - Атлас человеческого белка». www.proteinatlas.org. Получено 2020-01-14.
- ^ «Экспрессия антигена, связанного с Льюисом, и прогноз немелкоклеточного рака легкого на стадии I». Рак легких. 13 (1): 93. Август 1995. Дои:10.1016/0169-5002(95)90215-5. ISSN 0169-5002.
- ^ Ю, Чонг-Джен; Ши, Цзинь-Юань; Ли, Юнг-Чи; Шунь, Чиа-Тонг; Юань, Анг; Ян, Пан-Чыр (январь 2005 г.). «Антигены сиалила Льюиса: связь с белком MUC5AC и корреляция с послеоперационным рецидивом немелкоклеточного рака легкого». Рак легких. 47 (1): 59–67. Дои:10.1016 / j.lungcan.2004.05.018. ISSN 0169-5002. PMID 15603855.
- ^ Стернер, Эрик; Фланаган, Натали; Гилдерслив, Джеффри К. (25 мая 2016 г.). «Перспективы антител против гликан, почерпнутые из разработки базы данных ресурсов сообщества». ACS Химическая биология. 11 (7): 1773–1783. Дои:10.1021 / acschembio.6b00244. ISSN 1554-8929. PMID 27220698. S2CID 17515010.
- ^ Фукуока, Казуя; Нарита, Нобухиро; Сайджо, Нагахиро (май 1998 г.). «Повышенная экспрессия сиалилового антигена Льюисса связана с отдаленными метастазами у пациентов с раком легкого: иммуногистохимическое исследование образцов бронхофиброскопической биопсии». Рак легких. 20 (2): 109–116. Дои:10.1016 / s0169-5002 (98) 00016-6. ISSN 0169-5002. PMID 9711529.
- ^ Накамори, Сёдзи; Камеяма, Масао; Имаока, Шинги; Фурукава, Хироши; Исикава, Осаму; Сасаки, Йо; Изуми, Юки; Иримура, Тацуро (апрель 1997 г.). «Участие углеводного антигена сиалил-Льюисса в метастазировании колоректального рака». Заболевания толстой и прямой кишки. 40 (4): 420–431. Дои:10.1007 / bf02258386. ISSN 0012-3706. PMID 9106690. S2CID 24770173.
- ^ Накагое, Тору; Савай, Терумицу; Цудзи, Такаши; Джибики, Маса-аки; Нанашима, Ацуши; Ямагути, Хироюки; Куросаки, Нобуко; Ясутакэ, Тору; Аябе, Хироёши (13.03.2001). «Циркулирующие сиалил-льюис-х, сиалил-льюис-а и сиалил-Tn антигены у пациентов с колоректальным раком: многомерный анализ факторов прогнозирования уровней сывороточного антигена». Журнал гастроэнтерологии. 36 (3): 166–172. Дои:10.1007 / s005350170124. ISSN 0944-1174. PMID 11291879. S2CID 25161348.
- ^ Ямадера, Масато; Синтоизм, эйдзи; Цуда, Хитоши; Кадзивара, Йошики; Найто, Йошихиса; Хасэ, Кадзуо; Ямамото, Дзюндзи; Уэно, Хидеки (03.11.2017). «Экспрессия Сиалил Льюис на инвазивном фронте как прогностический маркер рецидива в печени на стадии II колоректального рака». Письма об онкологии. 15 (1): 221–228. Дои:10.3892 / ол.2017.7340. ISSN 1792-1074. ЧВК 5769389. PMID 29391881.
- ^ Тринчера, Марко; Ароника, Адель; Далл'Олио, Фабио (23 февраля 2017 г.). «Селектиновые лиганды сиалил-Льюис a и сиалил-льюис x при раке желудочно-кишечного тракта». Биология. 6 (1): 16. Дои:10.3390 / biology6010016. ISSN 2079-7737. ЧВК 5372009. PMID 28241499.
- ^ Накагое, Тору; Фукусима, Киёясу; Савай, Терумицу; Цудзи, Такаши; Джибики, Маса-аки; Нанашима, Ацуши; Танака, Кендзи; Ямагути, Хироюки; Ясутакэ, Тору; Аябе, Хироёши; Арисава, Кокичи (25 января 2002 г.). «Повышенная экспрессия сиалилового антигена Льюиса в качестве прогностического фактора у пациентов с раком желудка 0, I и II стадии». Письма о раке. 175 (2): 213–221. Дои:10.1016 / S0304-3835 (01) 00705-4. ISSN 0304-3835. PMID 11741750.
- ^ Nakagoe, T .; Фукусима, К .; Итоянаги, Н .; Ikuta, Y .; Ока, Т .; Nagayasu, T .; Ayabe, H .; Hara, S .; Ishikawa, H .; Минами, Х. (май 2002 г.). «Экспрессия ABH / Lewis-родственных антигенов как прогностических факторов у пациентов с раком груди». Журнал исследований рака и клинической онкологии. 128 (5): 257–264. Дои:10.1007 / s00432-002-0334-5. ISSN 0171-5216. PMID 12029441. S2CID 24553989.
- ^ Йешке, Удо; Милонас, Иоаннис; Шабани, Наим; Кунерт-Кейл, Кристиана; Шиндльбек, Кристиан; Гербер, Бернд; Фризе, Клаус (май 2005 г.). «Экспрессия сиалил Люиса X, сиалила Льюиса A, E-кадгерина и катепсина-D при раке груди человека: иммуногистохимический анализ при карциноме молочной железы in situ, инвазивных карциномах и их метастазах в лимфатические узлы». Противораковые исследования. 25 (3A): 1615–1622. ISSN 0250-7005. PMID 16033070.
- ^ Carrascal, M.A .; Сильва, М .; Ferreira, J.A .; Azevedo, R .; Ferreira, D .; Silva, A.M.N .; Ligeiro, D .; Santos, L.L .; Sackstein, R .; Видейра, П.А. (Сентябрь 2018 г.). «Функциональный подход к гликопротеомике определяет CD13 как новый лиганд Е-селектина при раке груди». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1862 (9): 2069–2080. Дои:10.1016 / j.bbagen.2018.05.013. ISSN 0304-4165. PMID 29777742.
- ^ Димитрофф, Чарльз Дж .; Лечпаммер, Мирна; Лонг-Вудворд, Дениз; Куток, Джеффри Л. (2004-08-01). «Скатывание человеческих костно-метастатических опухолевых клеток простаты на эндотелий костного мозга человека под действием сдвигового потока опосредуется Е-селектином». Исследования рака. 64 (15): 5261–5269. Дои:10.1158 / 0008-5472.CAN-04-0691. ISSN 0008-5472. PMID 15289332. S2CID 11632075.
- ^ Манкли, Дженнифер (март 2017 г.). «Гликозилирование является глобальной мишенью для контроля андрогенов в клетках рака простаты». Эндокринный рак. 24 (3): R49 – R64. Дои:10.1530 / erc-16-0569. ISSN 1351-0088. PMID 28159857.
- ^ Идикио, Х.А. (ноябрь 1997 г.). «Сиалил-Льюис-X, степень и стадия по Глисону неметастатического рака простаты человека». Журнал гликоконъюгатов. 14 (7): 875–877. Дои:10.1023 / а: 1018502424487. ISSN 0282-0080. PMID 9511995. S2CID 28112794.
- ^ Фудзи, Ясухиса; Ёсида, Масаюки; Чиен, Ли-Юнг; Кихара, Кадзунори; Кагеяма, Юкио; Ясукочи, Юкио; Осима, Хироюки (2000). «Значение углеводного антигена сиалил-Льюис X, сиалил-Льюис А и возможных неизвестных лигандов для адгезии уротелиальных раковых клеток человека к активированному эндотелию». Urologia Internationalis. 64 (3): 129–133. Дои:10.1159/000030512. ISSN 0042-1138. PMID 10859542. S2CID 23332254.
- ^ Лян, Цзинь-Сяо; Лян, Юн; Гао, Вэй (2016). «Клинико-патологическое и прогностическое значение сверхэкспрессии сиалила Льюиса X у больных раком: метаанализ». ОнкоЦели и терапия. 9: 3113–3125. Дои:10.2147 / OTT.S102389. ISSN 1178-6930. ЧВК 4888715. PMID 27307752.
- ^ Macher, Bruce A .; Бекстед, Джей Х. (01.01.1990). «Распределение эпитопов гликоконъюгатов VIM-2 и SSEA-1 среди лейкоцитов человека и лейкозных клеток». Исследование лейкемии. 14 (2): 119–130. Дои:10.1016 / 0145-2126 (90) 90040-Г. ISSN 0145-2126. PMID 1690317.
- ^ Майдик, Отто; Беттельхейм, Питер; Стокингер, Ханнес; Аберер, Вернер; Лишка, Кристоф; Лутц, Дитер; Кнапп, Уолтер (1984). «M2, новый антиген миеломоноцитарной клеточной поверхности и его распределение на лейкозных клетках». Международный журнал рака. 33 (5): 617–623. Дои:10.1002 / ijc.2910330511. ISSN 1097-0215. PMID 6724736. S2CID 20483491.
- ^ Noguchi, M .; Сидел на.; Sugimori, H .; Мори, К .; Осими, К. (октябрь 2001 г.). «Минорный лиганд Е-селектина, CD65, имеет решающее значение для внесосудистой инфильтрации клеток острого миелоидного лейкоза». Исследование лейкемии. 25 (10): 847–853. Дои:10.1016 / s0145-2126 (01) 00036-4. ISSN 0145-2126. PMID 11532516.
- ^ Лян Юй-Джин; Дин, Яо; Левери, Стивен Б .; Лобатон, Марлин; Ханда, Казуко; Хакомори, Сен-итиро (26 марта 2013 г.). «Профили дифференциальной экспрессии гликосфинголипидов в стволовых клетках рака молочной железы человека по сравнению с раковыми не стволовыми клетками». Труды Национальной академии наук Соединенных Штатов Америки. 110 (13): 4968–4973. Дои:10.1073 / pnas.1302825110. ISSN 1091-6490. ЧВК 3612608. PMID 23479608.
- ^ а б Хатано, Кодзи; Миямото, Ясухидэ; Нономура, Норио; Канеда, Ясуфуми (13 апреля 2011 г.). «Экспрессия ганглиозидов, GD1a и сиалилпараглобозида регулируется NF-κB-зависимым транскрипционным контролем α2,3-сиалилтрансферазы I, II и VI в устойчивых к кастрации клетках рака простаты человека». Международный журнал рака. 129 (8): 1838–1847. Дои:10.1002 / ijc.25860. ISSN 0020-7136. PMID 21165949. S2CID 7765966.
- ^ Хамасаки, Хироко; Аояги, Масару; Касама, Такеши; Ханда, Шизуо; Хиракава, Кимиёси; Таки, Такао (1999-01-29). «GT1b в метастатических опухолях головного мозга человека: GT1b как ганглиозид, связанный с метастазами в мозг. Номенклатура ганглиозидов основана на системе Свеннергольма [19] и следует последним рекомендациям [20] 1».. Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1437 (1): 93–99. Дои:10.1016 / S1388-1981 (98) 00003-1. ISSN 1388-1981. PMID 9931455.
- ^ а б Merritt, W. D .; Sztein, M. B .; Taylor, B .; Реаман, Г. Х. (декабрь 1991 г.). «Иммунореактивность лейкозных лимфобластов Т-клеточного и предшественника В-клеток с моноклональными анти-GD3 и анти-GM3 антителами». Лейкемия. 5 (12): 1087–1091. ISSN 0887-6924. PMID 1774957.
- ^ Вестрик, Мэри Элис; Ли, Уильям М. Ф .; Машер, Брюс А. (1983-12-01). «Выделение и характеристика ганглиозидов из клеток хронического миелогенного лейкоза». Исследования рака. 43 (12, часть 1): 5890–5894. ISSN 0008-5472. PMID 6580065.
- ^ Стернер Э., Фланаган Н., Гилдерслив Дж. К. (июль 2016 г.). «Перспективы антител против гликан, почерпнутые из разработки базы данных ресурсов сообщества». ACS Химическая биология. 11 (7): 1773–83. Дои:10.1021 / acschembio.6b00244. ЧВК 4949583. PMID 27220698.
- ^ Бриттен CJ, Bird MI (февраль 1997 г.). «Химическая модификация альфа-3-фукозилтрансферазы; определение аминокислотных остатков, необходимых для активности фермента». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1334 (1): 57–64. Дои:10.1016 / с0304-4165 (96) 00076-1. PMID 9042366.
- ^ де Фрис Т., Кнегтель Р.М., Холмс Э.Х., Машер Б.А. (октябрь 2001 г.). «Фукозилтрансферазы: исследование структуры / функции». Гликобиология. 11 (10): 119R – 128R. Дои:10.1093 / гликоб / 11.10.119r. PMID 11588153.
- ^ а б Шеттерли С., Йост Ф., Уотсон С.Р., Кнегтель Р., Машер Б.А., Холмс Э.Х. (август 2007 г.). «Сайт-специфичное фукозилирование сиалилированных полилактозаминов альфа1,3 / 4-фукозилтрансферазами-V и -VI определяется аминокислотами рядом с N-концом каталитического домена». Журнал биологической химии. 282 (34): 24882–92. Дои:10.1074 / jbc.m702395200. PMID 17604274. S2CID 27689343.
- ^ Тринчера М, Ароника А, Далл'Олио Ф (февраль 2017 г.). «Селектиновые лиганды сиалил-Льюис a и сиалил-льюис x при раке желудочно-кишечного тракта». Биология. 6 (1): 16. Дои:10.3390 / biology6010016. ЧВК 5372009. PMID 28241499.
- ^ а б Нгамукоте С., Янагисава М., Арига Т., Андо С., Ю РК (декабрь 2007 г.). «Изменения в развитии гликосфинголипидов и экспрессия гликогенов в мозге мышей». Журнал нейрохимии. 103 (6): 2327–41. Дои:10.1111 / j.1471-4159.2007.04910.x. PMID 17883393. S2CID 21405747.
- ^ а б Сюй В., Козак CA, Десник Р.Дж. (апрель 1995 г.). «Синтаза уропорфириноген-III: молекулярное клонирование, нуклеотидная последовательность, экспрессия полноразмерной кДНК мыши и ее локализация на хромосоме 7 мыши». Геномика. 26 (3): 556–62. Дои:10.1016 / 0888-7543 (95) 80175-л. PMID 7607680.
- ^ Vandermeersch S, Vanbeselaere J, Delannoy CP, Drolez A, Mysiorek C, Guérardel Y, et al. (Апрель 2015 г.). «Накопление ганглиозида GD1α в клетках рака молочной железы MDA-MB-231, экспрессирующих ST6GalNAc V». Молекулы. 20 (4): 6913–24. Дои:10,3390 / молекул20046913. ЧВК 6272744. PMID 25913930.
- ^ Чандрасекаран Э.В., Сюэ Дж., Ся Дж., Локк Р.Д., Патил С.А., Ниламегам С., Матта К.Л. (ноябрь 2011 г.). «Сиалилтрансфераза млекопитающих ST3Gal-II: ее каталитические свойства обменного сиалилирования позволяют маркировать сиалильные остатки в сиалилированных гликопротеинах муцинового типа и специфических ганглиозидах». Биохимия. 50 (44): 9475–87. Дои:10.1021 / bi200301w. ЧВК 3206213. PMID 21913655.
- ^ «Экспрессия TMPRSS2 при раке - Резюме - Атлас белков человека».
- ^ «карцинома мочевого пузыря RT4». ATCC.[постоянная мертвая ссылка ]
- ^ Идальго И.Дж., Рауб Т.Дж., Борчардт Р.Т. (март 1989 г.). «Характеристика линии клеток карциномы толстой кишки человека (Caco-2) как модельной системы для проницаемости кишечного эпителия». Гастроэнтерология. 96 (3): 736–49. Дои:10.1016/0016-5085(89)90897-4. PMID 2914637.
- ^ "Атлас клеток - TMPRSS2 - Атлас белков человека". www.proteinatlas.org. Получено 2019-08-20.
- ^ «Экспрессия TPSB2 при раке - Резюме - Атлас белков человека». www.proteinatlas.org. Получено 2019-08-20.
- ^ а б "Атлас клеток - TPSB2 - Атлас белков человека". www.proteinatlas.org. Получено 2019-08-20.
- ^ Нильссон Г., Блом Т., Куше-Гуллберг М., Кьеллен Л., Баттерфилд Дж. Х., Сундстрём С. и др. (Май 1994). «Фенотипическая характеристика линии тучных клеток человека HMC-1». Скандинавский журнал иммунологии. 39 (5): 489–98. Дои:10.1111 / j.1365-3083.1994.tb03404.x. PMID 8191224. S2CID 28014083.
- ^ Мартин П., Папаяннопулу Т. (июнь 1982 г.). «Клетки HEL: новая линия клеток эритролейкемии человека со спонтанной и индуцированной экспрессией глобина». Наука. 216 (4551): 1233–5. Bibcode:1982Научный ... 216.1233М. Дои:10.1126 / science.6177045. PMID 6177045.
- ^ а б «Экспрессия PLG при раке - Резюме - Атлас белков человека». www.proteinatlas.org. Получено 2019-08-20.
- ^ «Экспрессия F10 при раке - Резюме - Атлас белков человека». www.proteinatlas.org. Получено 2019-08-30.
- ^ а б c d е Бедсаул JR, Зарицкий Л.А., Zoon KC (ноябрь 2016 г.). «Индукция антивирусных генов и белков, опосредованная интерфероном I типа, не защищает клетки от цитопатических эффектов заражения вирусом Сендай». Журнал исследований интерферона и цитокинов. 36 (11): 652–665. Дои:10.1089 / jir.2016.0051. ЧВК 5105340. PMID 27508859.
- ^ а б Шок С.Н., Чандра Н.В., Сан Й., Ирие Т., Китагава Ю., Гото Б. и др. (Апрель 2017 г.). «Индукция гибели некроптозных клеток посредством вирусной активации пути RIG-I или STING». Гибель клеток и дифференциация. 24 (4): 615–625. Дои:10.1038 / cdd.2016.153. ЧВК 5384020. PMID 28060376.
- ^ Эберт О., Шинозаки К., Курниоти К., Парк М.С., Гарсия-Састре А., Ву С.Л. (май 2004 г.). «Индукция синцитией увеличивает онколитический потенциал вируса везикулярного стоматита в виротерапии рака». Исследования рака. 64 (9): 3265–70. Дои:10.1158 / 0008-5472.CAN-03-3753. PMID 15126368.
- ^ Накамори М., Фу Х, Мэн Ф, Джин А., Тао Л., Баст Р.С., Чжан Х (июль 2003 г.). «Эффективная терапия метастатического рака яичников с помощью онколитического вируса простого герпеса, включающего два механизма слияния мембран». Клинические исследования рака. 9 (7): 2727–33. PMID 12855653.
- ^ Альтомонте Дж., Марозин С., Шмид Р.М., Эберт О. (февраль 2010 г.). «Разработан вирус болезни Ньюкасла как улучшенный онколитический агент против гепатоцеллюлярной карциномы». Молекулярная терапия. 18 (2): 275–84. Дои:10.1038 / мт.2009.231. ЧВК 2839313. PMID 19809404.
- ^ Тай Джа, Чанг Си, Нисикава Т., Канеда Ю. (август 2019 г.). «Иммунотерапия рака с использованием гена Fusion вируса Сендай». Генная терапия рака. 27 (6): 498–508. Дои:10.1038 / s41417-019-0126-6. PMID 31383952. S2CID 199450913.
- ^ Бейтман А., Буллоу Ф., Мерфи С., Эмилиусен Л., Лавиллет Д., Коссет Флорида и др. (Март 2000 г.). «Фузогенные мембранные гликопротеины как новый класс генов для местного и иммуноопосредованного контроля роста опухоли». Исследования рака. 60 (6): 1492–7. PMID 10749110.
- ^ Галанис Э., Бейтман А., Джонсон К., Диаз Р.М., Джеймс С.Д., Вайл Р., Рассел С.Дж. (май 2001 г.). «Использование вирусных гликопротеинов слияния мембран в качестве новых терапевтических трансгенов в глиомах». Генная терапия человека. 12 (7): 811–21. Дои:10.1089/104303401750148766. PMID 11339897.
- ^ Лин EH, Салон C, Brambilla E, Lavillette D, Szecsi J, Cosset FL, Coll JL (апрель 2010 г.). «Фузогенные мембранные гликопротеины вызывают образование и гибель синцитий in vitro и in vivo: потенциальный терапевтический агент для рака легких». Генная терапия рака. 17 (4): 256–65. Дои:10.1038 / cgt.2009.74. PMID 19893593. S2CID 11203950.
- ^ Курсунель М.А., Эсендагли Г. (июнь 2017 г.). «Исправление к« Нерассказанной истории IFN-γ в биологии рака »[Cytokine Growth Factor Rev. 31 (2016) 73-81]». Отзывы о цитокинах и факторах роста. 35: 97. Дои:10.1016 / j.cytogfr.2017.02.002. PMID 28258821.
- ^ а б Икеда Х, Старый ЖЖ, Шрайбер Р. Д. (апрель 2002 г.). «Роль гамма-интерферона в защите от развития опухолей и иммуноредактирования рака». Отзывы о цитокинах и факторах роста. 13 (2): 95–109. Дои:10.1016 / с 1359-6101 (01) 00038-7. PMID 11900986.
- ^ Данн Г.П., Брюс А.Т., Шихан К.С., Шанкаран В., Уппалури Р., Буй Д.Д. и др. (Июль 2005 г.). «Критическая функция интерферонов типа I при иммуноредактировании рака». Иммунология природы. 6 (7): 722–9. Дои:10.1038 / ni1213. PMID 15951814. S2CID 20374688.
- ^ Борден ЕС, Сен Г.К., Узе Г., Сильверман Р.Х., Рансохофф Р.М., Фостер Г.Р., Старк Г.Р. (декабрь 2007 г.). «Интерфероны в возрасте 50 лет: прошлое, настоящее и будущее влияние на биомедицину». Обзоры природы. Открытие наркотиков. 6 (12): 975–90. Дои:10.1038 / nrd2422. ЧВК 7097588. PMID 18049472. S2CID 583709.
- ^ Альбини А, Маркизон С, Дель Гроссо Ф, Бенелли Р., Масиелло Л., Таккетти С. и др. (Апрель 2000 г.). «Ингибирование ангиогенеза и роста сосудистых опухолей интерферон-продуцирующими клетками: подход к генной терапии». Американский журнал патологии. 156 (4): 1381–93. Дои:10.1016 / S0002-9440 (10) 65007-9. ЧВК 1876903. PMID 10751362.
- ^ Pearlstein E, Salk PL, Yogeeswaran G, Karpatkin S (июль 1980 г.). «Корреляция между спонтанным метастатическим потенциалом, активностью по агрегации тромбоцитов экстрактов клеточной поверхности и сиалированием клеточной поверхности в 10 метастатически-вариантных производных линии клеток саркомы почек крыс». Труды Национальной академии наук Соединенных Штатов Америки. 77 (7): 4336–9. Bibcode:1980ПНАС ... 77.4336П. Дои:10.1073 / pnas.77.7.4336. ЧВК 349829. PMID 6933486.
- ^ Йогешваран Г., Салк П.Л. (июнь 1981 г.). «Метастатический потенциал положительно коррелирует с сиалированием клеточной поверхности культивируемых линий опухолевых клеток мыши». Наука. 212 (4502): 1514–6. Bibcode:1981Научный ... 212.1514Y. Дои:10.1126 / science.7233237. PMID 7233237.
- ^ Бенедетто А., Элия Дж., Сала А., Беларделли Ф. (январь 1989 г.). «Гипозиалирование высокомолекулярных мембранных гликопротеинов параллельно с потерей метастатического потенциала в устойчивых к агглютинину ростках пшеницы клетках лейкемии Friend». Международный журнал рака. 43 (1): 126–33. Дои:10.1002 / ijc.2910430124. PMID 2910824. S2CID 24704777.
- ^ Collard JG, Schijven JF, Bikker A, La Riviere G, Bolscher JG, Roos E (июль 1986). «Сиаловая кислота на клеточной поверхности и инвазивный и метастатический потенциал Т-клеточных гибридом». Исследования рака. 46 (7): 3521–7. PMID 3486712.
- ^ Пассанити А., Харт Г. В. (июнь 1988 г.). «Сиалирование клеточной поверхности и метастазирование опухоли. Метастатический потенциал вариантов меланомы B16 коррелирует с их относительным количеством специфических предпоследних структур олигосахаридов». Журнал биологической химии. 263 (16): 7591–603. PMID 3372501.
- ^ Bresalier RS, Rockwell RW, Dahiya R, Duh QY, Kim YS (февраль 1990 г.). «Изменения сиалопротеина клеточной поверхности в линиях клеток метастатического рака толстой кишки мышей, выбранных в животной модели метастазов рака толстой кишки». Исследования рака. 50 (4): 1299–307. PMID 2297775.
- ^ Hsu CC, Lin TW, Chang WW, Wu CY, Lo WH, Wang PH, Tsai YC (февраль 2005 г.). «Соясапонин-I-модифицированное инвазивное поведение рака путем изменения сиаловых кислот на поверхности клеток». Гинекологическая онкология. 96 (2): 415–22. Дои:10.1016 / j.ygyno.2004.10.010. PMID 15661230.
- ^ Чанг У.В., Ю CY, Линь Т.В., Ван ПХ, Цай YC (март 2006 г.). «Соясапонин I снижает экспрессию альфа-2,3-связанной сиаловой кислоты на поверхности клетки и подавляет метастатический потенциал клеток меланомы B16F10». Сообщения о биохимических и биофизических исследованиях. 341 (2): 614–9. Дои:10.1016 / j.bbrc.2005.12.216. PMID 16427612.
- ^ Chiang CH, Wang CH, Chang HC, More SV, Li WS, Hung WC (май 2010 г.). «Новый ингибитор сиалилтрансферазы AL10 подавляет инвазию и метастазирование клеток рака легкого путем ингибирования передачи сигналов, опосредованной интегрином». Журнал клеточной физиологии. 223 (2): 492–9. Дои:10.1002 / jcp.22068. PMID 20112294. S2CID 24218458.
- ^ а б Коэн М., Элькабец М., Перлмуттер М., Поргадор А., Воронов Э., Апте Р.Н., Лихтенштейн Р.Г. (ноябрь 2010 г.). «Сиалирование фибросаркомы, индуцированной 3-метилхолантреном, определяет противоопухолевые иммунные ответы во время иммуноредактирования». Журнал иммунологии. 185 (10): 5869–78. Дои:10.4049 / jimmunol.1001635. PMID 20956342. S2CID 45698975.
- ^ Боссарт К.Н., Фуско Д.Л., Бродер К.С. (2013). «Вход парамиксовируса». Достижения экспериментальной медицины и биологии. 790: 95–127. Дои:10.1007/978-1-4614-7651-1_6. ISBN 978-1-4614-7650-4. PMID 23884588.
- ^ а б Пауэлл Л.Д., Уайтхарт С.В., Харт Г.В. (июль 1987 г.). «Сиаловая кислота на поверхности клетки влияет на распознавание опухолевых клеток в реакции смешанных лимфоцитов». Журнал иммунологии. 139 (1): 262–70. PMID 2953814.
- ^ Тягараджан К., Форте Дж. Г., Таунсенд Р. Р. (январь 1996 г.). «Чистота экзогликозидазы и специфичность связывания: оценка с использованием олигосахаридных субстратов и анионообменной хроматографии с высоким pH с импульсным амперометрическим детектированием». Гликобиология. 6 (1): 83–93. Дои:10,1093 / гликоб / 6.1.83. PMID 8991514.
- ^ Drzeniek R, Gauhe A (февраль 1970 г.). «Различия в субстратной специфичности миксовирусных нейраминидаз». Сообщения о биохимических и биофизических исследованиях. 38 (4): 651–6. Дои:10.1016 / 0006-291x (70) 90630-3. PMID 5443707.
- ^ Бростром М.А., Брюнинг Г., Банковский Р.А. (декабрь 1971 г.). «Сравнение нейраминидаз парамиксовирусов с иммунологически несходными гемагглютининами». Вирусология. 46 (3): 856–65. Дои:10.1016/0042-6822(71)90086-9. PMID 4332979.
- ^ Джарахян М., Ватцл С., Фурнье П., Арнольд А., Джанджи Д., Захеди С. и др. (Август 2009 г.). «Активация естественных клеток-киллеров гемагглютинин-нейраминидазой вируса болезни Ньюкасла». Журнал вирусологии. 83 (16): 8108–21. Дои:10.1128 / JVI.00211-09. ЧВК 2715740. PMID 19515783.
- ^ Арнон Т.И., Лев М., Кац Г., Чернобров Ю., Поргадор А., Мандельбойм О. (сентябрь 2001 г.). «Распознавание вирусных гемагглютининов NKp44, но не NKp30». Европейский журнал иммунологии. 31 (9): 2680–9. Дои:10.1002 / 1521-4141 (200109) 31: 9 <2680 :: AID-IMMU2680> 3.0.CO; 2-A. PMID 11536166.
- ^ а б c Ширмахер В., Хаас С., Бонифер Р., Эртель С. (июль 1997 г.). «Вирусное усиление стимулирующей способности Т-клеток опухолевой вакцины требует связывания с клеточной поверхностью, но не инфекции». Клинические исследования рака. 3 (7): 1135–48. PMID 9815793.
- ^ Харада Й., Йонемицу Й. (июнь 2011 г.). «Резкое улучшение иммунотерапии на основе ДК против различных злокачественных новообразований». Границы биологических наук. 16: 2233–42. Дои:10.2741/3850. PMID 21622173. S2CID 30195748.
- ^ Шибата С., Окано С., Йонемицу Й., Онимару М., Сата С., Нагата-Такешита Х. и др. (Сентябрь 2006 г.). «Индукция эффективного противоопухолевого иммунитета с использованием дендритных клеток, активированных рекомбинантным вирусом Сендай, и его модуляция экзогенным геном IFN-бета». Журнал иммунологии. 177 (6): 3564–76. Дои:10.4049 / jimmunol.177.6.3564. PMID 16951315. S2CID 20134438.
- ^ Окано С., Ёнемицу Ю., Ширабе К., Какеджи Ю., Маэхара Ю., Харада М. и др. (Февраль 2011 г.). «Обеспечение непрерывной передачи сигналов созревания дендритным клеткам с помощью RIG-I-стимулирующего синтеза цитозольной РНК вируса Сендай». Журнал иммунологии. 186 (3): 1828–39. Дои:10.4049 / jimmunol.0901641. PMID 21187441. S2CID 36653582.
- ^ а б Sugiyama M, Kakeji Y, Tsujitani S, Harada Y, Onimaru M, Yoshida K и др. (Март 2011 г.). «Антагонизм генно-инженерных дендритных клеток VEGF необходим для индукции противоопухолевого иммунитета против злокачественного асцита». Молекулярная терапия рака. 10 (3): 540–9. Дои:10.1158 / 1535-7163.MCT-10-0479. PMID 21209070. S2CID 37616710.
- ^ Йонеяма Й., Уэда Й., Акуцу Й., Мацунага А., Шимада Х., Като Т. и др. (Март 2007 г.). «Разработка иммуностимулирующей виротерапии с использованием нетрансмиссивных дендритных клеток, активированных вирусом Сендай». Сообщения о биохимических и биофизических исследованиях. 355 (1): 129–35. Дои:10.1016 / j.bbrc.2007.01.132. PMID 17292867.
- ^ Комару А., Уэда Й, Фуруя А., Танака С., Йошида К., Като Т. и др. (Октябрь 2009 г.). «Устойчивое и зависимое от NK / CD4 + Т-лимфоцитов эффективное предотвращение метастазов в легкие, вызванных дендритными клетками, несущими рекомбинантный вирус Сендай». Журнал иммунологии. 183 (7): 4211–9. Дои:10.4049 / jimmunol.0803845. PMID 19734206. S2CID 39194525.
- ^ Като Т., Уэда Й, Кино Х, Йонеяма Й, Мацунага А., Комару А. и др. (Ноябрь 2010 г.). «Независимый от геликазы путь RIG-I в дендритных клетках, активированных вирусом Сендай, имеет решающее значение для предотвращения метастазов рака предстательной железы AT6.3 в легкие». Неоплазия. 12 (11): 906–14. Дои:10.1593 / neo.10732. ЧВК 2978913. PMID 21076616.
- ^ Хосоя Н., Миура Т., Кавана-Тачикава А., Койбути Т., Сиода Т., Одавара Т. и др. (Март 2008 г.). «Сравнение вируса Сендай и аденовирусных векторов для трансдукции генов ВИЧ-1 в дендритные клетки человека». Журнал медицинской вирусологии. 80 (3): 373–82. Дои:10.1002 / jmv.21052. PMID 18205221. S2CID 31337462.
- ^ Нагай Й (31 января 2014 г.). Сендайский вирусный вектор: преимущества и применение. Нагай, Ёсиюки. Токио. ISBN 9784431545569. OCLC 870271420.
- ^ Парки, C.L. (2017), "Репликационно-компетентные вирусные векторы для доставки вакцины", Человеческие вакцины, Elsevier, стр. 25–63, Дои:10.1016 / b978-0-12-802302-0.00001-7, ISBN 978-0-12-802302-0, получено 2020-09-18
- ^ а б c Сакаи Ю., Киётани К., Фукумура М., Асакава М., Като А., Сиода Т. и др. (Август 1999 г.). «Размещение чужеродных генов в геноме вируса Сендай: размеры вставленных генов и репликация вируса». Письма FEBS. 456 (2): 221–6. Дои:10.1016 / s0014-5793 (99) 00960-6. PMID 10456313. S2CID 1285541.
- ^ а б Chare ER, Gould EA, Holmes EC (октябрь 2003 г.). «Филогенетический анализ показывает низкую скорость гомологичной рекомбинации в вирусах с отрицательной РНК». Журнал общей вирусологии. 84 (Pt 10): 2691–2703. Дои:10.1099 / vir.0.19277-0. PMID 13679603.
- ^ а б Хан Г.З., Воробей М. (август 2011 г.). «Гомологичная рекомбинация вирусов с отрицательной РНК». Вирусы. 3 (8): 1358–73. Дои:10.3390 / v3081358. ЧВК 3185808. PMID 21994784.
- ^ а б c Колакофски Д., Ру Л., Гарсин Д., Руигрок Р. В. (июль 2005 г.). «Редактирование мРНК парамиксовируса,« правило шести »и катастрофа ошибок: гипотеза». Журнал общей вирусологии. 86 (Pt 7): 1869–1877. Дои:10.1099 / vir.0.80986-0. PMID 15958664.
- ^ Гарсин Д., Пелет Т., Калейн П., Ру Л., Курран Дж., Колакофски Д. (декабрь 1995 г.). «Высокорекомбиногенная система для восстановления инфекционного парамиксовируса Сендай из кДНК: создание нового недефектного интерферирующего вируса с функцией обратного копирования». Журнал EMBO. 14 (24): 6087–94. Дои:10.1002 / j.1460-2075.1995.tb00299.x. ЧВК 394733. PMID 8557028.
- ^ Pfaller CK, Cattaneo R, Schnell MJ (май 2015 г.). «Обратная генетика Mononegavirales: как они работают, новые вакцины и новые лекарства от рака». Вирусология. Выпуск 60-летия. 479-480: 331–44. Дои:10.1016 / j.virol.2015.01.029. ЧВК 4557643. PMID 25702088.
- ^ Beaty SM, Park A, Won ST, Hong P, Lyons M, Vigant F и др. (Март 2017 г.). "Системы обратной генетики Paramyxoviridae". мСфера. 2 (2). Дои:10.1128 / мСфера.00376-16. ЧВК 5371697. PMID 28405630.
- ^ Лю Х., Альбина Е., Гиль П., Минет С., де Алмейда Р.С. (сентябрь 2017 г.). «Двухплазмидная система для повышения эффективности спасения парамиксовирусов с помощью обратной генетики: пример спасения вируса ньюкаслской болезни». Вирусология. 509: 42–51. Дои:10.1016 / j.virol.2017.06.003. PMID 28595094.
- ^ Лю Х., де Алмейда Р.С., Гил П., Альбина Э. (ноябрь 2017 г.). «Сравнение эффективности различных систем обратной генетики вируса ньюкаслской болезни». Журнал вирусологических методов. 249: 111–116. Дои:10.1016 / j.jviromet.2017.08.024. PMID 28867302.
- ^ Баджимая С., Хаяси Т., Такимото Т. (2017). «Спасение вируса Сендай от клонированной кДНК». Обратная генетика РНК-вирусов. Методы молекулярной биологии. 1602. С. 103–110. Дои:10.1007/978-1-4939-6964-7_7. ISBN 978-1-4939-6962-3. PMID 28508216.
- ^ Йошизаки М., Хиронака Т., Ивасаки Х., Бан Х., Токусуми Ю., Иида А. и др. (Сентябрь 2006 г.). «Голый вектор вируса Сендай, лишенный всех генов, связанных с оболочкой: пониженная цитопатогенность и иммуногенность». Журнал генной медицины. 8 (9): 1151–9. Дои:10.1002 / jgm.938. PMID 16841365. S2CID 39942120.
- ^ Иноуэ М., Токусуми Ю., Бан Х, Каная Т., Ширакура М., Токусуми Т. и др. (Июнь 2003 г.). «Новый вектор вируса Сендай, лишенный матричного гена, не образует вирусных частиц и демонстрирует широкое распространение от клетки к клетке». Журнал вирусологии. 77 (11): 6419–29. Дои:10.1128 / JVI.77.11.6419-6429.2003. ЧВК 155001. PMID 12743299.
- ^ а б Роулинг Дж., Кано О, Гарсин Д., Колакофски Д., Мелеро Дж. А. (март 2011 г.). «Рекомбинантные вирусы Сендай, экспрессирующие слитые белки с двумя сайтами расщепления фурином, имитируют синцитиальные и независимые от рецептора инфекционные свойства респираторно-синцитиального вируса». Журнал вирусологии. 85 (6): 2771–80. Дои:10.1128 / jvi.02065-10. ЧВК 3067931. PMID 21228237.
- ^ а б Роулинг Дж., Гарсия-Баррено Б., Мелеро Дж. А. (июнь 2008 г.). «Вставка двух сайтов расщепления слитого белка респираторно-синцитиального вируса в слитый белок вируса Сендай приводит к усиленному слиянию клеток и уменьшению зависимости активности от белка прикрепления HN». Журнал вирусологии. 82 (12): 5986–98. Дои:10.1128 / jvi.00078-08. ЧВК 2395136. PMID 18385247.
- ^ а б Портнер А., Скроггс Р.А., Наив К.В. (апрель 1987 г.). «Гликопротеин слияния вируса Сендай: анализ последовательности эпитопа, участвующего в слиянии и нейтрализации вируса». Вирусология. 157 (2): 556–9. Дои:10.1016/0042-6822(87)90301-1. PMID 2435061.
- ^ Park A, Hong P, Won ST, Thibault PA, Vigant F, Oguntuyo KY и др. (2016-08-24). «Вирус Сендай, РНК-вирус без риска геномной интеграции, обеспечивает CRISPR / Cas9 для эффективного редактирования генов». Молекулярная терапия. Методы и клинические разработки. 3: 16057. Дои:10.1038 / mtm.2016.57. ЧВК 4996130. PMID 27606350.
- ^ а б Мостафа Х. Х., Фогель П., Сринивасан А., Рассел С. Дж. (Сентябрь 2016 г.). «Неинвазивная визуализация инфекции вируса Сендай у мышей с фармакологическим иммунодефицитом: NK- и Т-клетки, но не нейтрофилы, способствуют избавлению от вирусов после терапии циклофосфамидом и дексаметазоном». Патогены PLOS. 12 (9): e1005875. Дои:10.1371 / journal.ppat.1005875. ЧВК 5010285. PMID 27589232.
- ^ Агунгпрайоно Д.Р., Ямагути Р., Учида К., Тохья Й., Като А., Нагаи Ю. и др. (Февраль 2000 г.). "Вставка гена зеленого флуоресцентного белка инфекции вируса Сендай у мышей nude: возможность в качестве индикатора инфекции". Журнал ветеринарной медицины. 62 (2): 223–8. Дои:10.1292 / jvms.62.223. PMID 10720198.
- ^ а б c Вилленаве Р., Тузелет О., Таваньянам С., Сарланг С., Паркер Дж., Скибински Г. и др. (Ноябрь 2010 г.). «Цитопатогенез вируса Сендай в высокодифференцированных первичных педиатрических эпителиальных клетках бронхов». Журнал вирусологии. 84 (22): 11718–28. Дои:10.1128 / JVI.00798-10. ЧВК 2977906. PMID 20810726.
- ^ Миядзаки М., Сегава Х., Ямасита Т., Чжу Й., Такидзава К., Хасэгава М., Тайра Х (2010-11-23). «Создание и характеристика флуоресцентного вируса Сендай, несущего ген слитого белка оболочки, слитого с усиленным зеленым флуоресцентным белком». Биология, биотехнология и биохимия. 74 (11): 2293–8. Дои:10.1271 / bbb.100511. PMID 21071846. S2CID 43669142.
- ^ а б Стрэле Л., Марк Дж. Б., Брини А., Хаусманн С., Колакофски Д., Гарцин Д. (ноябрь 2007 г.). «Активация промотора бета-интерферона неестественной инфекцией вируса Сендай требует RIG-I и ингибируется вирусными белками C». Журнал вирусологии. 81 (22): 12227–37. Дои:10.1128 / JVI.01300-07. ЧВК 2169027. PMID 17804509.
- ^ а б c d Абэ М., Тахара М., Сакаи К., Ямагути Х., Кану К., Ширато К. и др. (Ноябрь 2013). «TMPRSS2 - активирующая протеаза для вирусов респираторного парагриппа». Журнал вирусологии. 87 (21): 11930–5. Дои:10.1128 / JVI.01490-13. ЧВК 3807344. PMID 23966399.
- ^ а б Хасан М.К., Като А., Шиода Т., Сакаи Ю., Ю. Д., Нагай Ю. (ноябрь 1997 г.). «Создание инфекционного рекомбинантного вируса Сендай, экспрессирующего ген люциферазы светлячка из 3 'проксимального первого локуса». Журнал общей вирусологии. 78 (Pt 11) (11): 2813–20. Дои:10.1099/0022-1317-78-11-2813. PMID 9367367.
- ^ Ву Дж (22.08.2011). «Факультет 1000 оценок для эффективного создания свободных от трансгенов человеческих индуцированных плюрипотентных стволовых клеток (ИПСК) с помощью чувствительных к температуре векторов вируса Сендай». Дои:10.3410 / f.12913956.14203054. Цитировать журнал требует
| журнал =(помощь) - ^ Fujie Y, Fusaki N, Katayama T, Hamasaki M, Soejima Y, Soga M и др. (2014-12-05). «Новый тип вектора вируса Сендай предоставляет свободные от трансгенов iPS-клетки, полученные из крови шимпанзе». PLOS ONE. 9 (12): e113052. Bibcode:2014PLoSO ... 9k3052F. Дои:10.1371 / journal.pone.0113052. ЧВК 4257541. PMID 25479600.
- ^ Джин Ч., Кусухара К., Йонэмицу Й., Номура А., Окано С., Такешита Х. и др. (Февраль 2003 г.). «Рекомбинантный вирус Сендай обеспечивает высокоэффективный перенос генов в гемопоэтические стволовые клетки пуповинной крови человека». Генная терапия. 10 (3): 272–7. Дои:10.1038 / sj.gt.3301877. PMID 12571635. S2CID 22415369.
- ^ Секи Т., Юаса С., Фукуда К. (март 2012 г.). «Создание индуцированных плюрипотентных стволовых клеток из небольшого количества периферической крови человека с использованием комбинации активированных Т-клеток и вируса Сендай». Протоколы природы. 7 (4): 718–28. Дои:10.1038 / nprot.2012.015. PMID 22422317. S2CID 41397031.
- ^ «Комплект для перепрограммирования CTS CytoTune-iPS 2.1 Sendai - Thermo Fisher Scientific». www.thermofisher.com. Получено 2019-08-13.
- ^ Мория К., Хориба С., Курихара К., Камада Т., Такахара И., Иноуэ М. и др. (Ноябрь 2011 г.). «Интраназальная вакцинация вирусным вектором Сендай более иммуногенна, чем внутримышечная, с уже существующими анти-векторными антителами». Вакцина. 29 (47): 8557–63. Дои:10.1016 / j.vaccine.2011.09.028. PMID 21939708.
- ^ Секи, Саюри; Матано, Тетсуро (2015-10-29). «Разработка вакцины против СПИДа на основе вектора вируса Сендай, вызывающей Т-клеточные реакции». Экспертный обзор вакцин. 15 (1): 119–127. Дои:10.1586/14760584.2016.1105747. ISSN 1476-0584. PMID 26512881. S2CID 27197590.
- ^ а б Джонс Б.Г., Сили Р.Э., Рудрараджу Р., Трейна-Дордж В.Л., Финнейфрок Б., Кук А. и др. (Январь 2012 г.). «Вакцина против RSV на основе вируса Сендай защищает африканских зеленых мартышек от инфекции RSV». Вакцина. 30 (5): 959–68. Дои:10.1016 / j.vaccine.2011.11.046. ЧВК 3256274. PMID 22119594.
- ^ Жан X, Слобод К.С., Джонс Б.Г., Сили Р.Э., Такимото Т., Бойд К. и др. (Май 2015 г.). «Рекомбинантная вакцина против вируса Сендай, экспрессирующая секретируемый, неограниченный слитый белок респираторно-синцитиального вируса, защищает от RSV у хлопковых крыс». Международная иммунология. 27 (5): 229–36. Дои:10.1093 / intimm / dxu107. ЧВК 4406265. PMID 25477211.
- ^ а б c d Ху З, Вонг К.В., Чжао Х.М., Вэнь Х.Л., Цзи П, Ма Х и др. (Май 2017). «Вакцинация слизистых оболочек против вируса Сендай устанавливает иммунитет к резидентным клеткам памяти CD8T в легких и усиливает защиту мышей от туберкулеза с помощью БЦЖ». Молекулярная терапия. 25 (5): 1222–1233. Дои:10.1016 / j.ymthe.2017.02.018. ЧВК 5417795. PMID 28342639.
- ^ а б c d Ху З, Гу Л., Ли КЛ, Шу Т., Лоури ДБ, Фан XY (2018). «Профиль Т-клеточных ответов у мышей, примированных бациллой Кальметта-Герена, усиленных новой противотуберкулезной вакциной с вектором вируса Сендай». Границы иммунологии. 9: 1796. Дои:10.3389 / fimmu.2018.01796. ЧВК 6085409. PMID 30123219.
- ^ Морено-Фиеррос, Летисия; Гарсия-Сильва, Илеана; Росалес-Мендоса, Серхио (26 мая 2020 г.). «Разработка вакцин против SARS-CoV-2: следует ли сосредоточить внимание на иммунитете слизистой оболочки?». Мнение эксперта по биологической терапии. 20 (8): 831–836. Дои:10.1080/14712598.2020.1767062. ISSN 1471-2598. S2CID 218556295.
- ^ Трэвис, Крейг Р. (30 сентября 2020 г.). «Так же просто, как нос на вашем лице: аргумент в пользу назального (слизистого) пути введения вакцины для профилактики заболевания Covid-19». Границы иммунологии. 11: 591897. Дои:10.3389 / fimmu.2020.591897. ISSN 1664-3224. ЧВК 7561361. PMID 33117404.
- ^ Сили, Р .; Jones, B.G .; Surman, S.L .; Гурвиц, Дж. Л. (24 сентября 2010 г.). «Устойчивые IgA- и IgG-продуцирующие антитела, образующие клетки в диффузном NALT и легких хлопковых крыс, вакцинированных вирусом Сендай, связаны с быстрой защитой от вируса парагриппа человека типа 1». Вакцина. 28 (41): 6749–6756. Дои:10.1016 / j.vaccine.2010.07.068. ISSN 1873-2518. ЧВК 2950074. PMID 20682364.
- ^ а б Ян Й, Рен Л, Дон Х, Ву Х (2005-05-01). «108. Полная нуклеотидная последовательность изолята BB1 вируса Сендай и сравнение с другими изолятами». Молекулярная терапия. 11: S44. Дои:10.1016 / j.ymthe.2005.06.469.
- ^ а б c d Ши Л.Й., Ли М., Юань Л.Дж., Ван Ц., Ли Х.М. (2008). «Новый парамиксовирус, штамм Тяньцзинь, выделенный из обыкновенной хлопковой мартышки: характеристика генома и анализ структурной последовательности белка». Архив вирусологии. 153 (9): 1715–23. Дои:10.1007 / s00705-008-0184-9. PMID 18696006. S2CID 6151471.
- ^ Лян И, Ву Х, Чжан Дж, Сяо Л, Ян И, Бай Х и др. (Декабрь 2012 г.). «Иммуногенность и терапевтические эффекты вакцины химерной ДНК Ag85A / B у мышей, инфицированных Mycobacterium tuberculosis». FEMS Иммунология и медицинская микробиология. 66 (3): 419–26. Дои:10.1111 / 1574-695X.12008. PMID 23163873.
- ^ «HN - гемагглютинин-нейраминидаза - вирус Сендай (штамм Z) (SeV) - ген и белок HN». www.uniprot.org. Получено 2019-08-09.
- ^ Шайд А., Чоппин П. В. (февраль 1974 г.). «Идентификация биологической активности гликопротеинов парамиксовируса. Активация слияния клеток, гемолиз и инфекционность протеолитического расщепления неактивного белка-предшественника вируса Сендай». Вирусология. 57 (2): 475–90. Дои:10.1016/0042-6822(74)90187-1. PMID 4361457.
- ^ «F - Предшественник гликопротеина F0 - вирус Сендай (штамм Z) (SeV) - ген и белок F». www.uniprot.org. Получено 2019-08-09.
- ^ «M - матричный белок - вирус Сендай (штамм Ohita) (SeV) - M ген и белок». www.uniprot.org. Получено 2019-08-09.
- ^ «N - нуклеопротеин - вирус Сендай (штамм Z) (SeV) - ген и белок N». www.uniprot.org. Получено 2019-08-09.
- ^ «P / V / C - фосфопротеин - вирус Сендай (штамм Harris) (SeV) - ген и белок P / V / C». www.uniprot.org. Получено 2019-08-09.
- ^ «L - РНК-направленная РНК-полимераза L - вирус Сендай (штамм Enders) (SeV) - ген и белок L». www.uniprot.org. Получено 2019-08-09.
- ^ а б Ямада Х., Хаята С., Омата-Ямада Т., Тайра Х., Мизумото К., Ивасаки К. (1990). «Ассоциация белка С вируса Сендай с нуклеокапсидами». Архив вирусологии. 113 (3–4): 245–53. Дои:10.1007 / bf01316677. PMID 2171459. S2CID 24592567.
- ^ а б c d Гарсин Д., Курран Дж., Ито М., Колакофски Д. (август 2001 г.). «Более длинные и более короткие формы белков вируса С Сендай играют разные роли в модулировании клеточного противовирусного ответа». Журнал вирусологии. 75 (15): 6800–7. Дои:10.1128 / JVI.75.15.6800-6807.2001. ЧВК 114406. PMID 11435558.
- ^ а б c Curran J, Kolakofsky D (январь 1988 г.). «Инициирование рибосомы из кодона ACG в мРНК P / C вируса Сендай». Журнал EMBO. 7 (1): 245–51. Дои:10.1002 / j.1460-2075.1988.tb02806.x. ЧВК 454264. PMID 2834203.
- ^ а б Диллон П.Дж., Гупта К.С. (февраль 1989 г.). «Экспрессия пяти белков мРНК P / C вируса Сендай в инфицированных клетках». Журнал вирусологии. 63 (2): 974–7. Дои:10.1128 / JVI.63.2.974-977.1989. ЧВК 247778. PMID 2536120.
- ^ а б c де Брейн С., Симоне В., Пелет Т., Курран Дж. (январь 2003 г.). «Идентификация цис-действующего элемента, необходимого для шунтирующей инициации трансляции белков Y вируса Сендай». Исследования нуклеиновых кислот. 31 (2): 608–18. Дои:10.1093 / nar / gkg143. ЧВК 140508. PMID 12527769.
- ^ а б Curran J, Kolakofsky D (сентябрь 1988 г.). «Сканирование независимой рибосомной инициации белка X вируса Сендай». Журнал EMBO. 7 (9): 2869–74. Дои:10.1002 / j.1460-2075.1988.tb03143.x. ЧВК 457080. PMID 2846286.
- ^ Ирие Т., Нагата Н., Ёсида Т., Сакагути Т. (февраль 2008 г.). «Рекрутирование Alix / AIP1 на плазматическую мембрану белком С вируса Сендай облегчает почкование вирусоподобных частиц». Вирусология. 371 (1): 108–20. Дои:10.1016 / j.virol.2007.09.020. PMID 18028977.
- ^ а б Сакагути Т., Като А., Сугахара Ф., Симадзу Й., Иноуэ М., Киётани К. и др. (Июль 2005 г.). «AIP1 / Alix является партнером связывания белка C вируса Сендай и способствует размножению вируса». Журнал вирусологии. 79 (14): 8933–41. Дои:10.1128 / JVI.79.14.8933-8941.2005. ЧВК 1168738. PMID 15994787.
- ^ Пэйн В., Кам PC (июль 2004 г.). «Триптаза тучных клеток: обзор ее физиологии и клинического значения». Анестезия. 59 (7): 695–703. Дои:10.1111 / j.1365-2044.2004.03757.x. PMID 15200544. S2CID 7611291.
- ^ Чен Й, Сиота М., Охучи М., Товатари Т., Таширо Дж., Мураками М. и др. (Июнь 2000 г.). «Триптаза тучных клеток из легких свиней вызывает инфекцию пневмотропными вирусами Сендай и гриппа А. Очистка и характеристика». Европейский журнал биохимии. 267 (11): 3189–97. Дои:10.1046 / j.1432-1327.2000.01346.x. PMID 10824103.
- ^ Таширо М., Йокогоши Ю., Тобита К., Сето Дж. Т., Ротт Р., Кидо Х. (декабрь 1992 г.). «Триптаза Clara, протеаза, активирующая вирус Сендай в легких крыс, участвует в пневмопатогенности». Журнал вирусологии. 66 (12): 7211–6. Дои:10.1128 / JVI.66.12.7211-7216.1992. ЧВК 240423. PMID 1331518.
- ^ Кидо Х., Нива Й., Беппу Й., Товатари Т. (1996). «Клеточные протеазы, участвующие в патогенности оболочечных вирусов животных, вируса иммунодефицита человека, вируса гриппа А и вируса Сендай». Достижения в регуляции ферментов. 36: 325–47. Дои:10.1016 / 0065-2571 (95) 00016-X. PMID 8869754.
- ^ Ле TQ, Кавачи М., Ямада Х., Сиота М., Окумура Й., Кидо Х. (апрель 2006 г.). «Идентификация трипсина I как кандидата на вирус гриппа А и протеазу процессинга гликопротеина оболочки вируса Сендай в мозге крысы». Биологическая химия. 387 (4): 467–75. Дои:10.1515 / BC.2006.062. PMID 16606346. S2CID 11969821.
- ^ Мураками М., Товатари Т., Охучи М., Шиота М., Акао М., Окумура Ю. и др. (Май 2001 г.). «Мини-плазмин, обнаруженный в эпителиальных клетках бронхиол, вызывает инфицирование вирусами гриппа А широкого спектра действия и вирусом Сендай». Европейский журнал биохимии. 268 (10): 2847–55. Дои:10.1046 / j.1432-1327.2001.02166.x. PMID 11358500.
- ^ Гото Б., Огасавара Т., Тойода Т., Иносенсио Н.М., Хамагучи М., Нагай И. (декабрь 1990 г.). «Эндопротеаза, гомологичная фактору X свертывания крови, как детерминанта вирусного тропизма у куриного эмбриона». Журнал EMBO. 9 (12): 4189–95. Дои:10.1002 / j.1460-2075.1990.tb07643.x. ЧВК 552195. PMID 2174359.
- ^ Огасавара Т, Гото Б., Сузуки Х, Асака Дж, Симоката К., Ротт Р., Нагай Й (февраль 1992 г.). «Экспрессия фактора X и его значение для определения тропизма парамиксовирусов у куриного эмбриона». Журнал EMBO. 11 (2): 467–72. Дои:10.1002 / j.1460-2075.1992.tb05076.x. ЧВК 556476. PMID 1371460.
- ^ Гото Б., Ямаути Ф., Огасавара Т., Нагаи И. (январь 1992 г.). «Выделение фактора Ха из куриного эмбриона в качестве амниотической эндопротеазы, ответственной за активацию парамиксовируса». Письма FEBS. 296 (3): 274–8. Дои:10.1016 / 0014-5793 (92) 80303-х. PMID 1537403. S2CID 33852517.
- ^ Энгель П., Бумселл Л., Балдерас Р., Бенсуссан А., Гаттей В., Хорейси В. и др. (Ноябрь 2015 г.). «Номенклатура CD 2015: Семинары по антигену дифференцировки лейкоцитов человека как движущая сила в иммунологии». Журнал иммунологии. 195 (10): 4555–63. Дои:10.4049 / jimmunol.1502033. PMID 26546687. S2CID 6117827.
- ^ Стокерт, Р. Дж. (Июль 1995 г.). «Рецептор асиалогликопротеина: взаимосвязь между структурой, функцией и экспрессией». Физиологические обзоры. 75 (3): 591–609. Дои:10.1152 / физрев.1995.75.3.591. ISSN 0031-9333. PMID 7624395.
- ^ Suzuki Y, Suzuki T, Matsumoto M (июнь 1983 г.). «Выделение и характеристика рецепторного сиалогликопротеина гемагглютинирующего вируса Японии (вирус Сендай) из мембраны эритроцитов крупного рогатого скота». Журнал биохимии. 93 (6): 1621–33. Дои:10.1093 / oxfordjournals.jbchem.a134301. PMID 6309760.
- ^ Оку Н., Нодзима С., Иноуэ К. (август 1981 г.). «Исследования взаимодействия вируса Сендай с липосомальными мембранами. Индуцированная вирусом Сендай агглютинация липосом, содержащих гликофорин». Biochimica et Biophysica Acta (BBA) - Биомембраны. 646 (1): 36–42. Дои:10.1016/0005-2736(81)90269-8. PMID 6168285.
- ^ а б Müthing J (сентябрь 1996 г.). «Вирусы гриппа А и Сендай предпочтительно связываются с фукозилированными ганглиозидами с линейными поли-N-ацетилактозаминильными цепями из гранулоцитов человека». Исследование углеводов. 290 (2): 217–24. Дои:10.1016/0008-6215(96)00149-8. PMID 8823909.
- ^ "КЕГГ ГЛИКАН: G00197". www.genome.jp. Получено 2019-08-13.
- ^ а б Вильяр Э., Баррозу И.М. (февраль 2006 г.). «Роль молекул, содержащих сиаловую кислоту, в проникновении парамиксовируса в клетку-хозяин: мини-обзор». Журнал гликоконъюгатов. 23 (1–2): 5–17. Дои:10.1007 / s10719-006-5433-0. PMID 16575518. S2CID 21083897.
- ^ Холмгрен Дж., Свеннергольм Л., Элвинг Х., Фредман П., Страннегард О. (апрель 1980 г.). «Рецептор вируса Сендай: предложенная структура распознавания, основанная на связывании с ганглиозидами, адсорбированными пластиком». Труды Национальной академии наук Соединенных Штатов Америки. 77 (4): 1947–50. Bibcode:1980PNAS ... 77.1947H. Дои:10.1073 / пнас.77.4.1947. ЧВК 348626. PMID 6246515.
- ^ «Коррекция: специфическая функция ганглиозидов в качестве рецепторов клеток-хозяев для вируса Сендай». Труды Национальной академии наук. 79 (3): 951. 1982-02-01. Bibcode:1982PNAS ... 79Q.951.. Дои:10.1073 / pnas.79.3.951.
- ^ а б Suzuki Y, Suzuki T, Matsunaga M, Matsumoto M (апрель 1985 г.). «Ганглиозиды как рецептор парамиксовируса. Структурная потребность сиалоолигосахаридов в рецепторах гемагглютинирующего вируса Японии (вирус Сендай) и вируса болезни Ньюкасла». Журнал биохимии. 97 (4): 1189–99. Дои:10.1093 / oxfordjournals.jbchem.a135164. PMID 2993261.
- ^ а б Сузуки Т., Портнер А., Скроггс Р.А., Утикава М., Кояма Н., Мацуо К. и др. (Май 2001 г.). «Рецепторные особенности респираторных вирусов человека». Журнал вирусологии. 75 (10): 4604–13. Дои:10.1128 / JVI.75.10.4604-4613.2001. ЧВК 114213. PMID 11312330.
- ^ «КЕГГ ГЛИКАН: G00112». www.genome.jp. Получено 2019-08-13.
- ^ «КЕГГ ГЛИКАН: G00122». www.genome.jp. Получено 2019-08-13.
- ^ Умеда М., Нодзима С., Иноуэ К. (февраль 1984 г.). «Активность ганглиозидов эритроцитов человека как рецептора HVJ». Вирусология. 133 (1): 172–82. Дои:10.1016/0042-6822(84)90436-7. PMID 6322427.
- ^ Сузуки Т., Портнер А., Скроггс Р.А., Утикава М., Кояма Н., Мацуо К. и др. (Май 2001 г.). «Рецепторные особенности респираторных вирусов человека». Журнал вирусологии. 75 (10): 4604–13. Дои:10.1128 / jvi.75.10.4604-4613.2001. ЧВК 114213. PMID 11312330.
- ^ Мариетоз Дж., Хатиб К., Кэмпбелл М.П., Пакер Н.Х., Маллен Э., Лизачек Ф. (2014-10-20). "SugarBindDB SugarBindDB: Ресурс патогенных микроорганизмов Лектин-гликановые взаимодействия Лектин-гликановые взаимодействия". Гликонаука: биология и медицина. Springer Japan. С. 275–282. Дои:10.1007/978-4-431-54841-6_28. ISBN 9784431548409.
- ^ "DBGET search - ГЛИКАН". www.genome.jp. Получено 2019-08-15.
- ^ «О PubChem». pubchemdocs.ncbi.nlm.nih.gov. Получено 2019-08-15.
- ^ «ТОКСНЕТ». toxnet.nlm.nih.gov. Получено 2019-08-15.
- ^ а б Чанг А., голландский RE (апрель 2012 г.). «Слияние и проникновение парамиксовирусов: несколько путей к общему концу». Вирусы. 4 (4): 613–36. Дои:10.3390 / v4040613. ЧВК 3347325. PMID 22590688.
- ^ Лэмб Р.А., Ярдецкий Т.С. (август 2007 г.). «Структурные основы вирусной инвазии: уроки парамиксовируса F». Текущее мнение в структурной биологии. 17 (4): 427–36. Дои:10.1016 / j.sbi.2007.08.016. ЧВК 2086805. PMID 17870467.
- ^ а б Хейвуд AM (ноябрь 2010 г.). «Снятие оболочки с неповрежденных вирусов в оболочке». Журнал вирусологии. 84 (21): 10946–55. Дои:10.1128 / JVI.00229-10. ЧВК 2953184. PMID 20668081.
- ^ Ярдецкий Т.С., Лэмб Р.А. (апрель 2014 г.). «Активация слияния мембран парамиксовируса и проникновения вируса». Текущее мнение в вирусологии. 5: 24–33. Дои:10.1016 / j.coviro.2014.01.005. ЧВК 4028362. PMID 24530984.
- ^ Уилан С.П., Барр Дж., Вертц Г. В. (2004). «Транскрипция и репликация несегментированных вирусов РНК с отрицательной цепью». Актуальные темы микробиологии и иммунологии. 283: 61–119. Дои:10.1007/978-3-662-06099-5_3. ISBN 978-3-642-07375-5. PMID 15298168.
- ^ Noton SL, Fearns R (май 2015 г.). «Инициирование и регуляция транскрипции и репликации парамиксовирусов». Вирусология. 479-480: 545–54. Дои:10.1016 / j.virol.2015.01.014. ЧВК 4424093. PMID 25683441.
- ^ Огино Т., Кобаяси М., Ивама М., Мизумото К. (февраль 2005 г.). «Белок РНК-зависимой РНК-полимеразы L вируса Сендай катализирует метилирование кэпа вирус-специфической мРНК». Журнал биологической химии. 280 (6): 4429–35. Дои:10.1074 / jbc.M411167200. PMID 15574411. S2CID 27655763.
- ^ а б Myers TM, Moyer SA (февраль 1997 г.). «Аминоконцевой домен нуклеокапсидного белка вируса Сендай необходим для матричной функции в синтезе вирусной РНК». Журнал вирусологии. 71 (2): 918–24. Дои:10.1128 / JVI.71.2.918-924.1997. ЧВК 191139. PMID 8995608.
- ^ Рю В. (2017). «Другие вирусы с отрицательной цепью РНК». Молекулярная вирусология патогенных вирусов человека. Эльзевир. С. 213–224. Дои:10.1016 / b978-0-12-800838-6.00016-3. ISBN 978-0-12-800838-6. S2CID 88812845.
- ^ Latorre P, Kolakofsky D, Curran J (сентябрь 1998 г.). «Белки Y вируса Сендай инициируются рибосомным шунтом». Молекулярная и клеточная биология. 18 (9): 5021–31. Дои:10.1128 / mcb.18.9.5021. ЧВК 109087. PMID 9710586.
- ^ а б Харрисон М.С., Сакагути Т., Шмитт А.П. (сентябрь 2010 г.). «Сборка и почкование парамиксовируса: строительные частицы, передающие инфекции». Международный журнал биохимии и клеточной биологии. 42 (9): 1416–29. Дои:10.1016 / j.biocel.2010.04.005. ЧВК 2910131. PMID 20398786.
- ^ Ито М., Такеучи Т., Нишио М., Кавано М., Комада Х., Цурудоме М., Ито Y (ноябрь 2004 г.). «Ранняя стадия становления стойкой вирусной инфекции Сендай: нестабильная динамическая фаза, а затем отбор вирусов, которые тесно связаны с клетками, чувствительны к температуре и способны вызывать стойкую инфекцию». Журнал вирусологии. 78 (21): 11939–51. Дои:10.1128 / JVI.78.21.11939-11951.2004. ЧВК 523293. PMID 15479834.
- ^ «Создание линии клеток человека, постоянно зараженной ...» bio-protocol.org. Получено 2020-03-01.
- ^ Chattopadhyay S, Fensterl V, Zhang Y, Veleeparambil M, Yamashita M, Sen GC (январь 2013 г.). «Роль апоптоза, опосредованного регуляторным фактором 3 интерферона в установлении и поддержании стойкой инфекции вирусом Сендай». Журнал вирусологии. 87 (1): 16–24. Дои:10.1128 / JVI.01853-12. ЧВК 3536409. PMID 23077293.
- ^ а б Mercado-López X, Cotter CR, Kim WK, Sun Y, Muñoz L, Tapia K, López CB (ноябрь 2013 г.). «Высокоиммуностимулирующая РНК, полученная из вирусного генома, дефектного по вирусу Сендай». Вакцина. 31 (48): 5713–21. Дои:10.1016 / j.vaccine.2013.09.040. ЧВК 4406099. PMID 24099876.
- ^ Сюй Дж., Сунь И, Ли И, Рутель Дж., Weiss SR, Радж А. и др. (Октябрь 2017 г.). «Вирусные геномы с дефектом репликации используют клеточный механизм выживания для установления устойчивости парамиксовируса». Nature Communications. 8 (1): 799. Bibcode:2017НатКо ... 8..799X. Дои:10.1038 / s41467-017-00909-6. ЧВК 5630589. PMID 28986577.
- ^ а б c Genoyer E, López CB (февраль 2019 г.). «Дефектные вирусные геномы меняют то, как вирус Сендай взаимодействует с механизмами клеточного трафика, что приводит к гетерогенности в производстве вирусных частиц среди инфицированных клеток». Журнал вирусологии. 93 (4). Дои:10.1128 / JVI.01579-18. ЧВК 6364009. PMID 30463965.
- ^ Роулинг Дж., Кано О, Гарсин Д., Колакофски Д., Мелеро Дж. А. (март 2011 г.). «Рекомбинантные вирусы Сендай, экспрессирующие слитые белки с двумя сайтами расщепления фурином, имитируют синцитиальные и независимые от рецептора инфекционные свойства респираторно-синцитиального вируса». Журнал вирусологии. 85 (6): 2771–80. Дои:10.1128 / JVI.02065-10. ЧВК 3067931. PMID 21228237.
- ^ Хукстра Д., Клаппе К., Хофф Х., Нир С. (апрель 1989 г.). «Механизм слияния вируса Сендай: роль гидрофобных взаимодействий и ограничения подвижности белков вирусной мембраны. Действие полиэтиленгликоля». Журнал биологической химии. 264 (12): 6786–92. PMID 2540161.
- ^ Такимото Т., Тейлор Г.Л., Коннарис ХК, Креннелл С.Дж., Портнер А. (декабрь 2002 г.). «Роль белка гемагглютинин-нейраминидаза в механизме слияния парамиксовируса с клеточной мембраной». Журнал вирусологии. 76 (24): 13028–33. Дои:10.1128 / JVI.76.24.13028-13033.2002. ЧВК 136693. PMID 12438628.
- ^ Novick SL, Hoekstra D (октябрь 1988 г.). «Проникновение гликопротеинов вируса Сендай в мембрану на ранних стадиях слияния с липосомами, как определено с помощью гидрофобного фотоаффинного мечения». Труды Национальной академии наук Соединенных Штатов Америки. 85 (20): 7433–7. Bibcode:1988ПНАС ... 85.7433Н. Дои:10.1073 / пнас.85.20.7433. ЧВК 282205. PMID 2845406.
- ^ а б Кескинен П., Нюквист М., Саренева Т., Пирхонен Дж., Мелен К., Юлкунен И. (октябрь 1999 г.). «Нарушение противовирусного ответа в клетках гепатомы человека». Вирусология. 263 (2): 364–75. Дои:10.1006 / viro.1999.9983. PMID 10544109.
- ^ а б c d е ж грамм Шах Н.Р., Сандерленд А., Грдзелишвили В.З. (июнь 2010 г.). «Опосредованная клеточным типом устойчивость вируса везикулярного стоматита и вируса Сендай к рибавирину». PLOS ONE. 5 (6): e11265. Bibcode:2010PLoSO ... 511265S. Дои:10.1371 / journal.pone.0011265. ЧВК 2889835. PMID 20582319.
- ^ Самптер Р., Лоо Ю.М., Фой Э., Ли К., Йонеяма М., Фудзита Т. и др. (Март 2005 г.). «Регулирование внутриклеточной противовирусной защиты и допустимости репликации РНК вируса гепатита С через клеточную РНК-геликазу, RIG-I». Журнал вирусологии. 79 (5): 2689–99. Дои:10.1128 / JVI.79.5.2689-2699.2005. ЧВК 548482. PMID 15708988.
- ^ Лаллеманд С., Бланшар Б., Пальмиери М., Лебон П., Мэй Е., Тови М.Г. (январь 2007 г.). «Вирусы с одноцепочечной РНК инактивируют транскрипционную активность р53, но вызывают NOXA-зависимый апоптоз посредством посттрансляционных модификаций IRF-1, IRF-3 и CREB». Онкоген. 26 (3): 328–38. Дои:10.1038 / sj.onc.1209795. PMID 16832344. S2CID 25830890.
- ^ Баггеле WA, Хорват CM (август 2013 г.). «Профилирование микроРНК инфицированных вирусом Сендай клеток A549 идентифицирует miR-203 как интерферон-индуцируемый регулятор IFIT1 / ISG56». Журнал вирусологии. 87 (16): 9260–70. Дои:10.1128 / JVI.01064-13. ЧВК 3754065. PMID 23785202.
- ^ а б c d е ж грамм Зайнутдинов С.С., Гражданцева А.А., Кочетков Д.В., Чумаков П.М., Нетесов С.В., Матвеева О.В., Кочнева Г.В. (2017-10-01). «Изменение онколитической активности вируса Сендай при адаптации к клеточным культурам». Молекулярная генетика, микробиология и вирусология. 32 (4): 212–217. Дои:10.3103 / S0891416817040115. S2CID 46958676.
- ^ а б c Белова А.А., Сосновцева А.О., Липатова А.В., Нюшко К.М., Волченко Н.Н., Беляков М.М. и др. (2017-01-01). «[Биомаркеры чувствительности рака простаты к вирусу Сендай]». Молекулярная Биология. 51 (1): 94–103. Дои:10.1134 / S0026893317010046. PMID 28251971. S2CID 34514102.
- ^ Чемберс Р., Такимото Т. (июнь 2010 г.). «Торговля нуклеокапсидами вируса Сендай опосредуется внутриклеточными везикулами». PLOS ONE. 5 (6): e10994. Bibcode:2010PLoSO ... 510994C. Дои:10.1371 / journal.pone.0010994. ЧВК 2881874. PMID 20543880.
- ^ а б Itoh M, Wang XL, Suzuki Y, Homma M (сентябрь 1992 г.). «Мутация белка HANA вируса Сендай при прохождении через яйца». Вирусология. 190 (1): 356–64. Дои:10.1016 / 0042-6822 (92) 91222-г. PMID 1326808.
- ^ а б Зайнутдинов С.С., Кочнева Г.В., Нетесов С.В., Чумаков П.М., Матвеева О.В. (2019). «Направленная эволюция как инструмент для отбора онколитических РНК-вирусов с желаемыми фенотипами». Онколитическая виротерапия. 8: 9–26. Дои:10.2147 / OV.S176523. ЧВК 6636189. PMID 31372363.
- ^ Сакагути Т., Киётани К., Сакаки М., Фуджи Ю., Йошида Т. (март 1994 г.). «Полевой изолят вируса Сендай: его высокая вирулентность для мышей и генетическая дивергенция от прототипных штаммов». Архив вирусологии. 135 (1–2): 159–64. Дои:10.1007 / bf01309773. PMID 8198441. S2CID 12180965.
- ^ Ито М., Изегава Ю., Хотта Х, Хомма М. (декабрь 1997 г.). «Выделение авирулентного мутанта вируса Сендай с двумя аминокислотными мутациями из высоковирулентного полевого штамма посредством адаптации к клеткам LLC-MK2». Журнал общей вирусологии. 78 (Pt 12) (12): 3207–15. Дои:10.1099/0022-1317-78-12-3207. PMID 9400971.
- ^ Киётани К., Такао С., Сакагути Т., Ёсида Т. (июль 1990 г.). «Непосредственная защита мышей от летальных инфекций вируса Сендай дикого типа (HVJ) с помощью чувствительного к температуре мутанта HVJpi, обладающего гомологичной мешающей способностью». Вирусология. 177 (1): 65–74. Дои:10.1016/0042-6822(90)90460-9. PMID 2162116.
- ^ а б Жданов В.М., Букринская А.Г. (1961). «Авторадиографические исследования проникновения вируса Сендай в клетки культуры тканей. I. Приготовление вируса Сендай, меченного радиоактивными изотопами». Проблемы вирусологии. 6: 588–93. PMID 14040447.
- ^ Киётани К., Сакагути Т., Фуджи Ю., Йошида Т. (2001). «Ослабление полевого изолята вируса Сендай через пассажи яиц связано с препятствием репликации вирусного генома в респираторных клетках мышей». Архив вирусологии. 146 (5): 893–908. Дои:10.1007 / s007050170123. PMID 11448028. S2CID 21947750.
- ^ Колаковский Д. (август 1976 г.). «Выделение и характеристика DI-РНК вируса Сендай». Клетка. 8 (4): 547–55. Дои:10.1016/0092-8674(76)90223-3. PMID 182384. S2CID 32399729.
- ^ Ёсида А., Кавабата Р., Хонда Т., Сакаи К., Ами Ю., Сакагути Т., Ирие Т. (март 2018 г.). «Единичная аминокислотная замена в нуклеопротеине вируса Сендай парамиксовируса является критическим детерминантом для производства интерферон-бета-индуцирующих геномов с дефектом копирующего типа». Журнал вирусологии. 92 (5). Дои:10.1128 / JVI.02094-17. ЧВК 5809723. PMID 29237838.
- ^ Strahle L, Garcin D, Kolakofsky D (июль 2006 г.). «Дефектно-интерферирующие геномы вируса Сендай и активация бета-интерферона». Вирусология. 351 (1): 101–11. Дои:10.1016 / j.virol.2006.03.022. PMID 16631220.
- ^ Тацумото Н., Ардити М., Ямасита М. (сентябрь 2018 г.). «Распространение сендайского вируса с использованием куриных яиц». Биопротокол. 8 (18). Дои:10.21769 / BioProtoc.3009. ЧВК 6200407. PMID 30370318.
- ^ Паппас К., Мацуока Ю., Суэйн Д.Е., Донис Р.О. (ноябрь 2007 г.). «Разработка и оценка вакцины-кандидата от вируса гриппа H7N2 для обеспечения готовности к пандемии». Клиническая и вакцинная иммунология. 14 (11): 1425–32. Дои:10.1128 / CVI.00174-07. ЧВК 2168170. PMID 17913860.
- ^ Тацумото Н., Мияути Т., Ардити М., Ямасита М. (ноябрь 2018 г.). «Количественная оценка инфекционного вируса Сендай с использованием анализа зубного налета». Биопротокол. 8 (21). Дои:10.21769 / BioProtoc.3068. ЧВК 6289198. PMID 30547053.
- ^ Киллиан ML (2008). «Анализ гемагглютинации вируса птичьего гриппа». Вирус птичьего гриппа. Методы молекулярной биологии. 436. С. 47–52. Дои:10.1007/978-1-59745-279-3_7. ISBN 978-1-58829-939-0. PMID 18370040.
- ^ «Сендайский вирус ATCC ® VR-105 ™». www.atcc.org. Получено 2019-08-14.
- ^ «Сендайский вирус ATCC ® VR-907 ™». www.atcc.org. Получено 2019-08-14.
- ^ «ПТА-121432». www.atcc.org. Получено 2019-08-14.
- ^ Carcamo-Orive I, Hoffman GE, Cundiff P, Beckmann ND, D'Souza SL, Knowles JW и др. (Апрель 2017 г.). «Анализ транскрипционной изменчивости в большой библиотеке ИПСК человека выявляет генетические и негенетические детерминанты гетерогенности». Стволовая клетка. 20 (4): 518–532.e9. Дои:10.1016 / j.stem.2016.11.005. ЧВК 5384872. PMID 28017796.
| Scholia имеет тема профиль для Респираторный вирус мыши. |
